长、短疗程口服抗病毒药预防急性髓系白血病患者乙型肝炎病毒再激活的观察研究
庄 衍,唐 勇,俞夜花,杭海芳,叶为德,刘 隽
上海交通大学医学院附属第九人民医院血液内科,上海 200011
急性髓系白血病(acute myeloid leukemia,AML)是一类异质性造血干祖细胞的恶性克隆性疾病,以蒽环类药物(如柔红霉素和去甲氧柔红霉素等)联合阿糖胞苷为基础的诱导化疗以及缓解后大剂量化疗药物的巩固化疗是AML的主要治疗手段。AML合并HBV感染的患者接受化疗后乙型肝炎病毒(hepatitis B virus,HBV)再激活可以引起不同程度的肝功能损害而影响化疗进程,甚至导致爆发性肝炎而危及生命。因此,积极探究预防AML合并HBV感染的患者HBV病毒再激活的有效策略有其必要性和临床意义。近期研究发现,核苷类抗HBV药物(包括拉米夫定和恩替卡韦等)预防性治疗可以显著降低HBV再激活的风险,但这些研究主要集中于接受免疫化疗的淋巴瘤患者[1-3],在AML合并HBV感染的患者预防性应用核苷类抗HBV药物报道仍较少,此外,有关抗HBV药物使用疗程以及时机仍缺乏系统研究。鉴于此,该研究通过回顾性分析29例AML合并HBV感染并接受至少4个疗程化疗的患者的临床资料,探究核苷类抗HBV药物预防病毒再激活的临床疗效和安全性以及理想疗程。
1 资料和方法
1.1 患者选择
本研究纳入2010年1月—2016年12月期间上海交通大学医学院附属第九人民医院血液内科收治的29例AML合并HBV感染并接受至少4个疗程化疗的患者,其中男性16例,女性13例,年龄20~65岁,中位年龄56岁。具体入选标准如下:① 符合世界卫生组织(World Health Organization,WHO)髓系肿瘤分型2008版AML诊断标准;② 化疗前HBV相关抗原,包括HBV表面抗原(hepatitis B surface antigen,HBsAg)、e抗原和抗体(hepatitis B e antigen and hepatitis B e antibody,HBeAg和HBeAb)以及核心抗体(hepatitis B core antibody,HBcAb)血清学检测结果至少1项阳性;③ 影像学检查无肝硬化及白血病肝脏浸润;④ 血清HBV DNA(hepatitis B virus deoxyribonucleic acid)定量聚合酶链反应(quantitative polymerase chain reaction,PCR)检测到拷贝数小于等于2×104个 / mL;⑤ 肝功能检查丙氨酸氨基转移酶(alanine aminotransferase,A LT)、天冬氨酸氨基转移酶(a s p a r t a t e aminotransferase,AST)及总胆红素均不超过正常值1.5倍;⑥ 排除其他肿瘤性疾病、免疫性疾病、糖尿病和肥胖症。29例患者均接受至少4个疗程诱导和巩固化疗,其中诱导化疗为去甲柔红霉素联合阿糖胞苷(idarubicin+cytarabine,IDA+Ara-c)的IA方案,即去甲氧柔红霉素8~12 mg/(m2·d),第1~3天,阿糖胞苷100 mg/(m2·d),第1~7天,28 d为1个周期;巩固化疗为大剂量阿糖胞苷方案,即阿糖胞苷2~3 g/m2,每12 h 1次,第1、3、5天,28 d为1个周期。
1.2 研究方法
1.2.1 治疗方法和分组
诱导化疗开始时,同步口服恩替卡韦500 mg/ d,同时给予患者支持治疗。根据患者服用抗HBV药物持续时间分为两组:① 长疗程预防(long course prophylaxis,LCP)组,口服抗HBV药物持续至化疗结束后6个月以上;② 短疗程预防(short course prophylaxis,SCP)组,口服抗HBV药物持续至化疗结束后1个月以内;同时,根据患者HBsAg血清学检测结果分为两组:① HBsAg阳性组,是指患者血清HBsAg大于等于0.05 IU/mL;② HBsAg阴性组,是指患者血清HBsAg小于0.05 IU/mL。
1.2.2 观察指标和评价标准
收集入组患者每次化疗周期前后以及化疗结束后随访期的病史询问、常规体格检查、全血细胞计数、凝血功能指标、血清肝肾功能生化指标、血清HBV相关抗原以及HBV-DNA定量(采用荧光定量PCR法,检测下限拷贝数为5.0×102个/mL)等临床资料,系统分析和评估患者HBV再激活率、HBV相关肝炎突发率、HBV原发耐药率以及肝衰竭发生频率。评价标准如下:
(1) HBV再激活:血清HBV DNA水平比基线水平升高10倍或以上,或者缺乏HBV DNA基线者其绝对值拷贝数超过2.0×104个/mL,或者血清HBV DNA从阴性转为阳性者;(2) HBV相关肝炎突发:当ALT 水平上升大于5倍正常值上限;(3) HBV原发耐药:核苷(酸)类似物治疗12周,HBV DNA载量的下降幅度小于1 log10 IU/mL);(4) 肝衰竭:① 有腹水或其他门静脉高压表现,② 肝性脑病(C型),③ 血清总胆红素大于51.3 μmol/L和白蛋白小于30 g/L,④ 凝血酶原活动度小于等于40%。
1.2.3 不良反应观察
观察并记录不良反应:包括类型、频率和严重程度。不良反应参考美国国立癌症研究所不良反应分级标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI-CTCAE) 4.03版,并评定其与药物之间的相关性。其中恩替卡韦最常见药物不良事件为肌酸激酶(creatine kinase,CK)升高。根据CK水平为4个级别:1级为(3~<5)×正常值上限;2级为(5~<7)×正常值上限;3 级为(7~<10)×正常值上限;4 级为大于等于10×正常值上限。
1.3 统计学处理
全部数据采用SPSS 13.0软件分析,计数资料以率和构成比表示,用χ2检验进行组间比较,P<0.05为差异有统计学意义。
2 结 果
2.1 长短疗程预防治疗组患者的一般临床资料
LCP和SCP组患者分别为18和11例,两组患者的中位年龄、性别构成、AML分型、预后分层以及诱导和巩固化疗疗程数,经分析比较,差异无统计学意义(P>0.05,表1))。
2.2 长短疗程预防治疗组患者HBV再激活及其相关事件发生率
LCP组只有1例患者在化疗结束后第3个月出现HBV再激活,再激活率为5.56%(1/18),且未发生HBV相关性肝炎;SCP组有5例患者发生HBV再激活,其中3例发生于化疗结束后第3~5个月,1例出现于化疗第4个疗程,另外1例初始HBV-DNA阴性患者于化疗第4个疗程出现病毒再激活,HBV总体再激活率为45.45%(5/11),此外HBV相关性肝炎发生率为36.36%(4/11)。LCP组患者HBV再激活率以及相关性肝炎突发率均明显低于SCP组患者(P=0.018和P=0.014)。同时,LCP和SCP组患者的HBV原发耐药率分别为11.11%(2/18)和9.09%(1/11),差异无统计学意义(P>0.05)。

表 1 长短疗程预防治疗组患者的基本信息Tab. 1 The characteristics of patients receiving long or short course prophylactic anti-HBV therapy
进一步亚组分析显示,LCP组中HBsAg(+)患者HBV再激活率和相关性肝炎突发率分别为8.33%(1/12)和0%(0/12),而SCP组中1例HBsAg(+)患者于化疗期间发生HBV再激活并伴发肝炎,另外3例于化疗结束后6个月内出现HBV再激活并伴发肝炎,HBV再激活率和相关性肝炎突发率均为66.67%(4/6),明显高于LCP组中HBsAg(+)患者(P=0.022和P=0.005);同时,LCP和SCP组HBsAg(+)患者HBV原发耐药率分别为8.33%(1/12)和16.67%(1/6),差异无统计学意义(P>0.05)。另外,LCP组有1例HBsAg(-)患者发生HBV原发耐药,而SCP组有1例HBsAg(-)患者于化疗第4个疗程出现HBV再激活,但未并发肝炎,继续服药后HBV-DNA再次降至测定值以下。LCP和SCP组HBsAg(-)患者HBV再激活率、肝炎发生率和原发耐药率在LCP组为0%(0/6)、0%(0/6)和16.67%(1/6);在SCP组为20%(1/5)、0%(0/5)和0%(0/5),差异无统计学意义(P>0.05)。上述亚组分析具体数值和统计分析见表2。

表 2 长短疗程预防治疗组患者HBV再激活、肝炎突发和原发耐药发生率比较Tab. 2 Comparison of HBV reactivation, hepatitis and primary resistance in patients receiving long or short course prophylaxis
2.3 长短疗程预防治疗组患者药物不良反应
LCP和SCP组患者1~2级CK升高发生率分别为22.22%(4/18)和27.27%(3/11),差异无统计学意义(P>0.05)。两组患者均未出现3~4级CK升高而导致停药的不良事件。此外,两组患者随访服药期间均未发生恩替卡韦相关3级以上血液学或非血液学毒性反应。整个随访期间均无肝衰竭发生(表3)。两组患者化疗期间不良反应因化疗药物因素干扰未予统计比较。
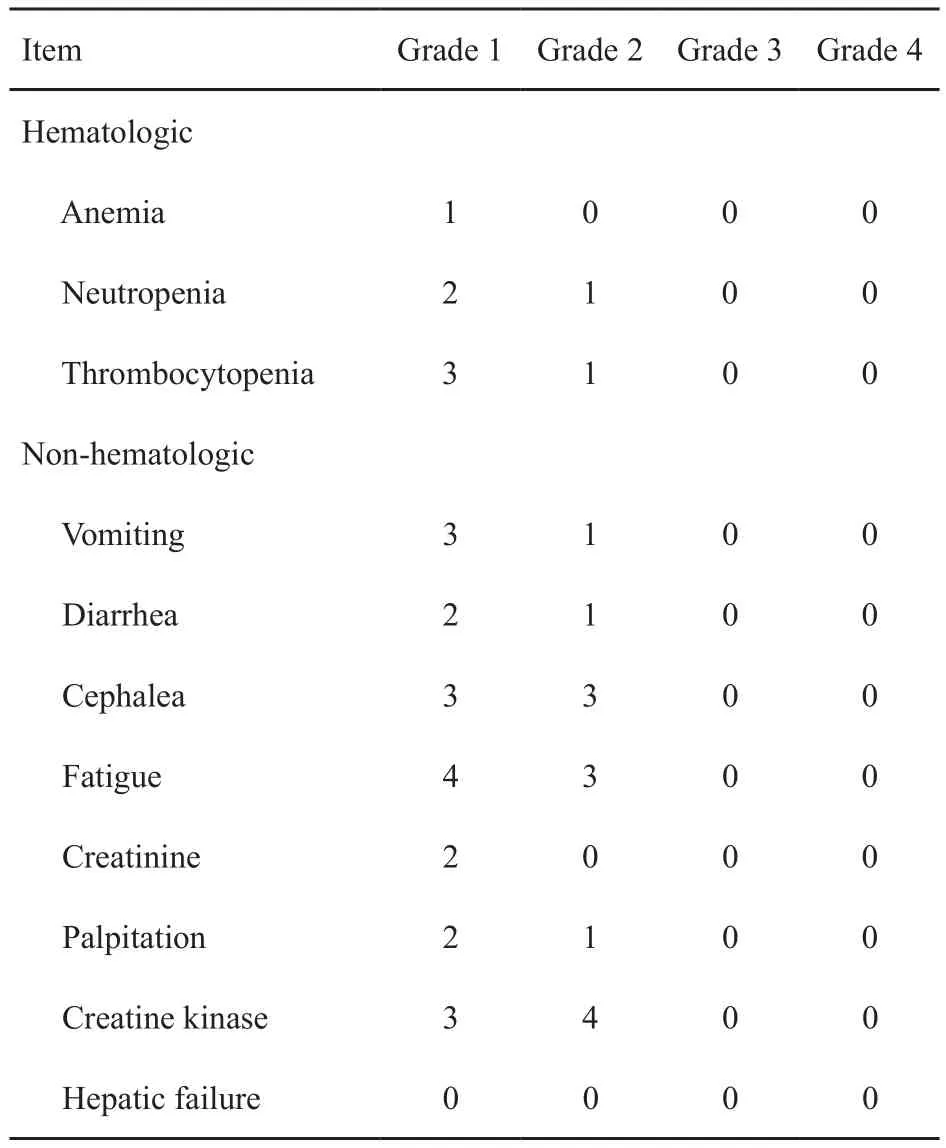
表 3 口服抗HBV药物不良反应Tab. 3 Adverse events of oral anti HBV drugs in 29 AML patients
3 讨 论
目前,血液肿瘤合并HBV感染患者化疗期间以及随访期HBV再激活问题日益受到重视[4],尤其在中国等HBV人群感染率较高地区更是备受关注。临床研究显示,化疗前后和随访期常规监测HBV血清相关抗原和(或)HBV的DNA水平,并给予预防和抢先治疗能够显著降低患者HBV再激活风险,从而使患者临床获益[5]。最近,台湾一项大型回顾性研究显示,AML合并HBV感染患者化疗后病毒再激活概率并不低,建议给予患者核苷类抗HBV预防性治疗[6],其他研究也发现,AML患者HBV再激活并不亚于接受免疫化疗的淋巴瘤患者,同样需要预防性抗病毒治疗[7]。然而,抗HBV预防治疗理想时机、疗程以及抗病毒药物的选择仍不明确而有待进一步研究。
本研究发现,长疗程预防用药组AML患者的HBV再激活率和相关性肝炎突发率均明显低于短疗程预防组患者,提示AML合并HBV感染患者预防性抗病毒治疗至少到化疗结束后6个月以上,虽然样本量较小,但这与国内外报道和临床诊疗指南的结论相似[8-10]。然而必须指出,在长疗程抗HBV用药期间仍有1例患者出现病毒再激活,而且对恩替卡韦出现原发耐药,因此,在抗HBV治疗期间仍有必要密切监测肝功能和血浆病毒负荷,一旦发现病毒复燃必须考虑HBV出现耐药问题,及时检测病毒突变株并调整抗HBV用药。此外,本研究还发现,短疗程预防用药组中HBsAg(+)患者的HBV再激活率和相关性肝炎突发率均明显高于长疗程预防组中HBsAg(+)患者,提示HBsAg(+)高危人群必须接受足疗程的抗HBV预防性治疗;疗程不足可能导致HBV再激活并突发肝炎,这进一步验证AML合并HBsAg(+)患者预防性抗病毒治疗的必要性。而HBsAg(-)患者接受长短疗程抗HBV预防治疗后HBV再激活、肝炎突发和原发耐药发生率无显著差异,说明针对HBsAg(-)患者是否需要足疗程抗病毒治疗有待进一步研究。另外,有1例HBsAg(-)患者于化疗第4个疗程出现HBV再激活,提示接受诱导或巩固化疗后AML患者体内HBV保护性抗体下降而导致病毒再激活。因此,HBsAg(-)患者化疗期间仍有必要监测血浆病毒负荷[11-12]。本研究药物不良反应检测结果显示,长短疗程预防用药组均未发生3级以上CK水平升高或药物毒性反应,提示恩替卡韦作为预防性抗HBV药物具有良好的安全性和耐受性。当然,本研究基于回顾性研究性质和样本量仍有局限性,有进一步完善的空间。
总之,AML合并HBV感染的患者化疗后存在病毒再激活风险。长疗程口服恩替卡韦是降低AML合并HBsAg阳性感染患者化疗后病毒再激活以及病毒相关事件发生率有效而且安全性良好预防治疗方案,值得进一步进行前瞻性研究。
[1] WU C Y, HSIAO L T, CHIOU T J, et al. Lymphocyte/monocyte ratio and cycles of rituximab-containing therapy are risk factors for hepatitis B virus reactivation in patients with diffuse large B-cell lymphoma and resolved hepatitis B[J]. Leuk Lymphoma, 2015, 56 (8): 2357-2364.
[2] TSUTSUMI Y, OGASAVARA R, MIYASHITA N, et al. HBV reactivation in malignant lymphoma patients treated with rituximab and bendamustine[J].Int J Hematol, 2012,95(5): 588-591.
[3] LAURENTI L, AUTORE F, INNOCENTI I, et al. Prevalence,characteristics and management of occult hepatitis B virus infection in patients with chronic lymphocytic leukemia:a single center experience[J]. Leuk Lymphoma, 2015,56(10): 2841-2846.
[4] HSU C, TSOU H H, LIN S J, et al. Chemotherapy-induced hepatitis B reactivation in lymphoma patients with resolved HBV infection: a prospective study[J]. Hepatology, 2014,59(6): 2092-2100.
[5] LAW M F, HO R, CHEUNG C K, et al. Prevention and management of hepatitis B virus reactivation in patients with hematological malignancies treated with anticancer therapy[J]. World J Gastroenterol, 2016, 22 (28): 6484-6500.
[6] CHEN C Y, HUANG S Y, CHENG A, et al. High risk of hepatitis B reactivation among patients with acute myeloid leukemia[J]. PloS One, 2015, 10(5): e0126037.
[7] ISHIGA K, KAWATANI T, SUOU T, et al. Fulminant hepatitis type B after chemotherapy in a serologically negative hepatitis B virus carrier with acute myelogenous leukemia[J]. Int J Hematol, 2001, 73(1): 115-118.
[8] 中国临床肿瘤学会,中华医学会血液学分会,中国医师协会肿瘤医师考核委员会,等. 淋巴瘤免疫化疗乙型肝炎病毒再激活预防和治疗中国专家共识[J]. 中国实用内科杂志,2014, 34(1): 32-39.
[9] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J].中国肝病学杂志,2015, 7(3): 1-18.
[10] 徐 莹,王卫斌,李湛东,等. 2015年美国肝病学会指南更新版:慢性乙型肝炎的治疗摘译[J]. 临床肝胆病杂志, 2016, 32(2): 223-229.
[11] KOO Y X, TAY M, THE Y E, et al. Risk of hepatitis B virus(HBV) reactivation in hepatitis B surface antigen negative/hepatitis B core antibody positive patients receiving rituximabcontaining combination chemotherapy without routine antiviral prophylaxis[J]. Ann Hematol, 2011, 90(10): 1219-1223.
[12] YEO W, CHAN T C, LEUNG N W, et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab[J]. J Clin Oncol, 2009, 27(4): 605-611.

