复发性腹膜后肉瘤的手术治疗探讨
韩 毓,柴宇啸,张 怡,张洪强,王 炳,屈国伦,曲兴龙,王春萌,陈 勇
1. 复旦大学附属肿瘤医院闵行分院肿瘤外科,上海 200240;
2. 复旦大学附属肿瘤医院骨软组织肿瘤外科,复旦大学上海医学院肿瘤学系,上海200032
腹膜后肉瘤是罕见的恶性肿瘤,彻底手术切除是最有效的治疗方法,但腹膜后肉瘤由于体积大,容易累及邻近组织器官,手术时因难以确定其边界,故其术后复发率很高。复发性腹膜后肉瘤临床症状与原发性腹膜后肉瘤相同,多在复查时被发现。目前主要的治疗方法仍是手术切除,资料显示复发性腹膜后肉瘤再次完全切除5年生存率为58.4%[1]。由于解剖关系和层次不如初次手术清楚,多伴有肠黏连及肉瘤与周围组织器官黏连,界限更加不清,要再次彻底切除肿瘤,往往须要联合脏器切除。也易伤及重要的大血管,手术难度加大,出血多。复旦大学附属肿瘤医院闵行分院2007年10月—2016年10月收治了25例复发性腹膜后肉瘤患者。现对该组患者的临床资料进行回顾性分析,对本病复发后的治疗和预后进行讨论。
1 资料和方法
1.1 一般资料
回顾性选取复旦大学附属肿瘤医院闵行分院自2007年10月—2016年10月收治的复发性腹膜后肉瘤患者,共收集了25例,其中,男性14例,女性11例。年龄32~68岁,平均50岁。所有患者均为既往有腹膜后肉瘤手术史,影像学检查为肉瘤复发,均经病理诊断证实。肿瘤最大径定义为影像学上测量的最大值,复发时间是指发现复发距离上次手术的间隔月份。
1.2 检查及治疗方法
临床表现与原发性腹膜后肉瘤基本相同:腹部肿块,邻近脏器压迫症状,腹痛或不适等。部分患者就诊时症状不典型或无症状,为体检复查时发现,均常规行MRI或CT检查。邻近或压迫输尿管的腹膜后肿瘤患者,均行静脉肾盂输尿管造影或输尿管CT检查。
术前所有患者均经复旦大学附属肿瘤医院闵行分院软组织多学科讨论,一致认定首选手术切除。常规备血、肠道准备。术中行联合脏器切除需满足如下条件:① 受累脏器与肿瘤黏连或被肿瘤侵犯无法分离;② 其他脏器无明显受累或局限性受累可一起整块切除;③ 腹腔内无广泛播散。联合脏器切除包括肾、输尿管、胰体尾、脾脏、结肠、小肠及腔静脉等。术后常规护理,根据病理结果及康复情况决定进一步治疗,包括放化疗等。
1.3 统计学处理
用SPSS 22.0统计软件包进行统计学分析,计量资料为±s 表示。总生存时间是指本次治疗后至患者死亡的时间,无复发生存时间是指本次治疗后至再次复发的时间。使用Kaplan-Meier生存分析法及log-rank检验对完整切除组与部分切除或活检组两者进行单因素预后分析,P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
25例患者中复发的腹膜后肿瘤部位、例数见表1。
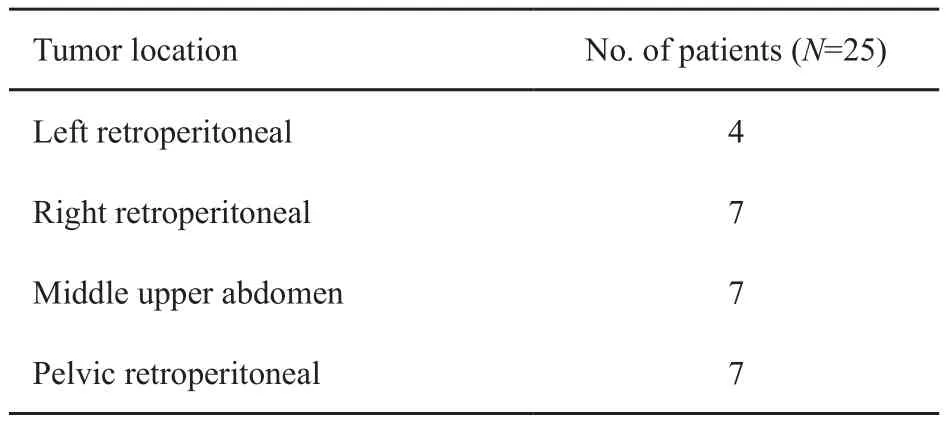
表 1 复发性腹膜后肿瘤部位Tab. 1 The tumor location of the recurrent retroperitoneal sarcoma
复发瘤体直径8~32 cm,平均15 cm。复发距上次手术间隔时间11~58个月,中位复发时间18个月;其中第1次复发18例,复发2次者4例,复发3次者2例,复发7次者1例。
2.2 检查及诊断
临床表现为腹部肿物17例,邻近脏器压迫症状8例,腹痛或不适8例,其他不典型症状6例,就诊时无症状5例。均常规行MRI或CT检查,其中MRI检查15例,CT检查10例。邻近或压迫输尿管的腹膜后肿瘤患者,均行静脉肾盂输尿管造影或输尿管CT检查,其中输尿管造影6例,输尿管CT检查4例。25例患者按其病理分类见表2。
2.3 手术方式及后果
本组手术均采用全麻,MRI或CT检查证实邻近或压迫输尿管的10例患者,均当日术前放置输尿管支架。全组25例完整切除率为64.0%(16/25),部分切除率为24.0%(6/25),未切除活检率为12.0%(3/25)。16例完整切除手术中联合脏器切除8例,占完整切除的50.0%(8/16)。8例联合脏器切除情况见表3。

表 3 复发性腹膜后肿瘤联合脏器情况Tab. 3 Summary of the organs by combined excision
6例部分切除的原因:2例肿瘤侵犯腹主动脉、下腔静脉及肾脏,无法分离。邻近脏器广泛受侵4例,无法行联合脏器切除术;活检3例的原因:腹腔内广泛转移无法切除。全组无手术死亡,出血量为1 600~4 800 mL,平均2 200 mL。大出血3例,其中失血性休克2例,术中纱布填塞2例。术中组织器官损伤3例,分别为输尿管1例,膀胱1例,直肠1例。输尿管及膀胱损伤术中修补,直肠损伤1例术后并发直肠漏,经治疗1.5个月后治愈。
2.4 随访
本组24例获得随访,随访方式包括门诊、电话及书信。完整切除组平均生存时间为(47.00±4.23)个月,5年生存率为56.3%(9/16)。局部切除组失访1例,失访患者按删失处理。实行部分切除或仅作活检者平均生存时间(22.00±6.60)个月,5年生存率为12.5%(1/8)。两者相比,差异有统计学意义(P<0.05,图1)。
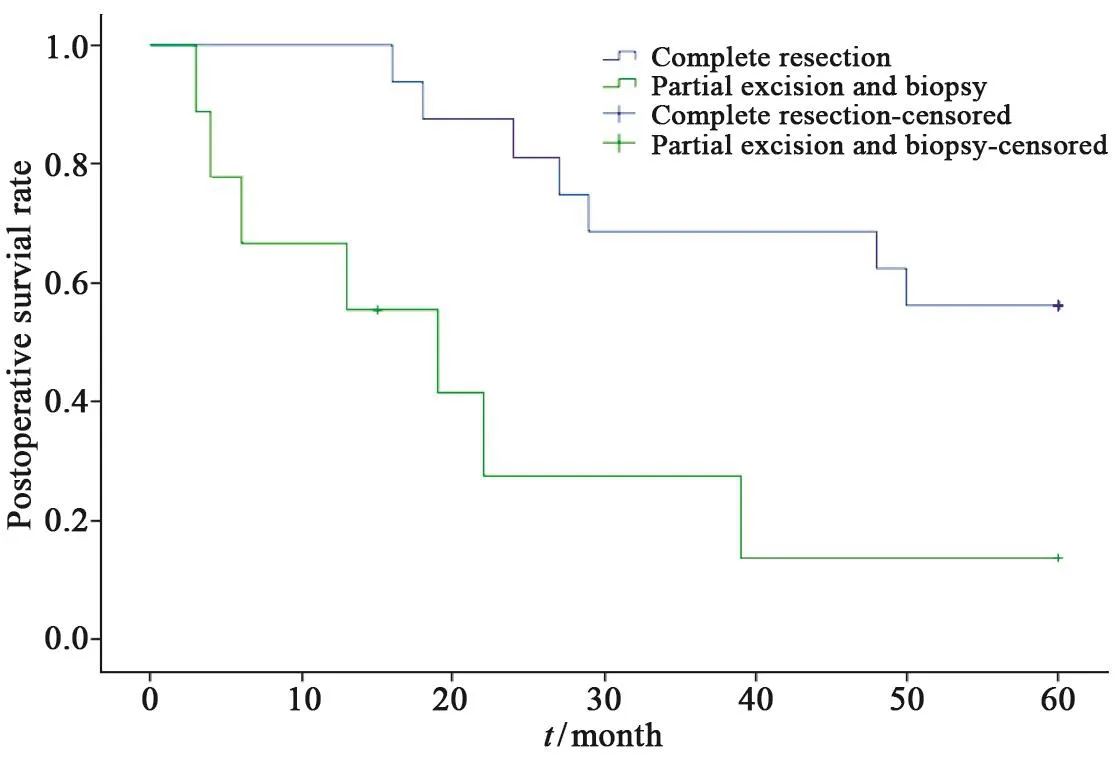
图 1 两组患者的Kaplan-Meier生存分析Fig. 1 The Kaplan-Meier’s survival curve of the patients in the two groups
3 讨 论
复发性腹膜后肉瘤的治疗原则是尽早彻底切除肿瘤和受累的组织和器官,完整切除肿瘤是治疗的关键[2]。但复发性腹膜后肉瘤与周围解剖关系复杂,常累及周围重要组织器官,造成手术切除困难,应特别重视围手术期的准备[3]。术前行全面的CT或MRI检查,充分评估肿瘤大小、部位及可能受累的器官等因素。本组术前行MRI检查15例,CT检查10例,并做肠道准备,根据肿瘤情况准备充足的血源(2 000~4 000 mL),包括红细胞悬液、血浆、冷沉淀及血小板。如肿瘤累及腹腔内重要大血管应准备血管修补、人工血管及血管移植器械,术前开放中心静脉通路。因腹膜后肿瘤常压迫、侵犯输尿管,术前应常规行静脉肾盂造影或输尿管CT检查,了解双侧肾功能情况,为手术可能切除一侧肾脏做好充分的术前准备[4]。为了防止术中损伤输尿管,肿瘤邻近或压迫输尿管的患者,术前应放置输尿管支架,本组10例患者术前放置输尿管支架。手术应根据肿瘤的位置选取适宜的切口,切口应足够大,术野暴露好[5]。经原切口或经腹正中纵切口术野显露好,必要时可加作横切口或胸腹联合切口[6]。再次或多次手术面临腹腔内广泛黏连难题,因此术中应首先小心分离开腹腔内腹壁与肠管、肠管与肠管间的复杂性黏连,防止肠管等脏器损伤,然后再探查腹腔,了解肿瘤是否存在种植转移,从而决定手术如何进行。由于腹膜后肉瘤多体积巨大,血供较丰富,与周围组织脏器关系密切,常导致术野显露困难,解剖不清。手术中探查肿瘤与周围组织器官关系时,必要时可以做部分游离,正确判断肿瘤包膜,游离应紧贴肿瘤包膜进行,以便正确估计肿瘤能否切除及其切除的范围。本组腹膜后肉瘤完整切除率为64.0%(16/25)。复发性腹膜后肿瘤多累及重要腹腔内重要脏器如结肠、小肠、肾脏等。侵犯大血管时,不能将肿瘤从血管表面直接剥离下来,否则术后很快就将复发[7]。腹膜后肉瘤累及腹腔内的重要血管不是手术的禁忌证,必要时行联合受累血管切除并行人工血管重建术。本组完整切除肿瘤手术中联合脏器切除8例,占完整切除的50.0%(8/16)。与肿瘤联合切除的脏器依次为小肠2例、结肠2例、肾1例、部分输尿管1例、受累的下腔静脉和髂外静脉各1例。本组2例静脉受累患者处理方式分别为:受累切除的1例下腔静脉为肾脏下段,切除约5 cm给予人工血管重建;受累切除的髂外静脉1例由于肿瘤压迫无血流通过,已闭塞,未给予重建。切除下腔静脉人工血管重建术患者术后无出血、下肢肿胀等并发症发生。本组6例部分切除的原因:肿瘤因侵犯腹主动脉、下腔静脉及肾脏,无法分离2例;邻近脏器广泛受侵4例。
目前,有些学者强调整体切除,包括无明显肿瘤侵犯的周围脏器,这有利于提高生存率、降低局部复发率,但尚有争议[8]。Ferrario等[9]通过合理的手术设计使复发的腹膜后肉瘤完全切除率达90%,5年存活率达53%。Lehnert等[10]分析1、2和3次复发性腹膜后肉瘤切除术后5年存活率分别为42%、45%和43%,表明完全切除后,其存活率与手术次数差异无统计学意义。本组第1次复发为18例,复发2次者4例,复发3次者2例,复发7次者1例。完整切除5年生存率为56.3%(9/16),提示再次完整切除肿瘤是提高复发性肿瘤患者生存率的重要手段,即使瘤体已侵犯临近脏器,在不影响其脏器功能情况下,若有可能完整切除肿瘤,则应行联合脏器切除[11]。腹膜后肿瘤切除左侧易于右侧,腹腔易于盆腔。盆腔内空间狭窄、脏器多,易损伤膀胱、输尿管、直肠及骶前静脉丛等。在腹膜后肿瘤手术并发症中,最为凶险的莫过于术中大出血,尤其是骶前静脉丛损伤引起的大出血,徙劳无用的缝扎、电凝等方法往往会使出血越来越凶,最后患者休克。我们的经验是出血创面内放置无菌塑料袋,袋内用彼此相连接的大纱布填塞,简易可靠,纱布填塞压迫后术后10 d逐渐拔出,无1例再次出血。本组纱布填塞2例,均为盆腔内恶性神经源性肿瘤。结合本组资料进行数据分析:单因素分析中,病理类型和部分切除影响总生存,切缘和联合脏器切除影响无局部复发生存;多因素分析中,复发时间是独立的预后影响因素。
腹膜后肉瘤术后有较高复发率,原发性腹膜后肿瘤根治性切除后的局部复发率为30%~85%[12]。复发原因为腹膜后肿瘤病理多样且多为恶性,加之腹膜后肿瘤与血管和腹膜后的重要脏器往往关系密切,增加了手术难度,难以达到如同四肢软组织肉瘤一样的真正根治性切除。因此术后随访显得非常重要。2016年腹膜后肉瘤诊断和治疗专家共识提出,患者前3年应每3个月随访2次[13];3年后应每半年随访2次;姑息性治疗患者疾病进展时间的评估建议每6~8周1次。一旦发现复发,只要全身状态允许,肿瘤仅限于局部而无明显转移,都可以再行手术探查切除,甚至多次手术。本组25例复发的腹膜后肿瘤:第1次复发18例,复发2次者4例,复发3次者2例,复发7次者1例。再手术完整切除16例,提示复发后积极再手术可以取得良好疗效。姑息性切除或部分切除的作用目前仍有争论[14],与单纯探查活检相比并不能提高患者生存率。但可以减轻瘤体对脏器的压迫,也可为提高放疗、化疗疗效创造良好条件。虽然大多数腹膜后软组织肉瘤对放疗和化疗不敏感,但仍有部分患者在放疗和化疗后长期生存。近年来,随着基础及临床研究的不断深入,一些颇具临床探索前景的研究结果和治疗模式相继出现,如分子靶向、化疗及免疫治疗等全身治疗方式[15]。
综上所述,完善的影像学检查和充分的术前准备是复发性腹膜后肿瘤手术的前提。手术切除是提高复发性腹膜后肉瘤生存率最有效的方法,联合脏器切除能提高肿瘤完整切除率。由于腹膜后肉瘤术后复发率高,术后需要密切随访。若出现复发,再次手术,仍有可能完整切除肿瘤,获得长期存活。
[1] GIULIANO K, NAGARAJAN N, CANNER J K, et al. Predictors of improved survival for patients with retroperitoneal sarcoma[J]. Surgery, 2016, 160(6): 1628-1635.
[2] 龙子雯, 徐 宇, 刘晓文. 原发性腹膜后肿瘤200例诊治分析[J]. 中国实用外科杂志, 2013, (2): 127-129.
[3] SRIUSSADAPORN S, PAK-ART R, KRITAYAKIRANA K,et al. Experience with surgical treatment of retroperitoneal soft tissue sarcomas at a university hospital in Thailand[J]. J Med Assoc Thai, 2014, 97(6): 598-614.
[4] SONG T, SHEN J, LIANG B L, et al. Retroperitoneal liposarcoma: MR characteristics and pathological correlative analysis[J]. Abdom Imaging, 2007, 32(5): 668-674.
[5] 曲兴龙, 陈福真. 腹膜后肿瘤切除联合重要血管重建12例[J]. 中国癌症杂志, 2008, 18(3): 234-236.
[6] 罗成华, 苗成利. 腹膜后肿瘤的手术治疗策略与新趋势[J]. 中国普外基础与临床杂志, 2016, 23(3): 257-259.
[7] 曲兴龙, 陈新平, 陈福真. 胰十二指肠切除联合血管重建治疗胰头、十二指肠恶性肿瘤[J]. 中国癌症杂志,2006, 16(10): 828-830.
[8] FOWERAKER K L, BURTON K E, MAYNARD S E, et al.High-dose radiotherapy in the management of chordoma and chondrosarcoma of the skull base and cervical spine: part 1-clinical outcomes[J]. Clin Oncol (R Coll Radiol), 2007, 19(7): 509-516.
[9] FERRARIO T, KARAKOUSIS C P. Retroperitoneal sarcomas:grade and survival[J]. Arch Surg, 2003, 138(3): 248-251.
[10] LEHNERT T, CARDONA S, HINZ U, et al. Primary and locally recurrent retroperitoneal soft-tissue sarcoma: Local control and survival[J]. Eur J Surg Oncol, 2009, 35(9):986-993.
[11] 郑树森, 徐 骁. 原发性腹膜后及肠系膜脂肪肉瘤的诊断及外科治疗[J]. 中国实用外科杂志, 2003, 23(9): 540.
[12] AN J Y, HEO J S, NOH J H, et al. Primary malignant retroperitoneal tumors: analysis of a single institutional experience[J]. Eur J Surg Oncol, 2007, 33(3): 376-382.
[13] 中国研究型医院学会腹膜后与盆底疾病专业委员会. 腹膜后脂肪肉瘤诊断和治疗专家共识(2016)[J]. 中国微创外科杂志, 2016, 16(12): 1057-1063.
[14] THONAS D M, O’SULLIVAN B, GRONCHI A. Current concepts and future perspectives in retroperitoneal soft-tissue sarcoma management[J]. Expert Rev Anticancer Ther,2009, 9(3): 1145-1157.
[15] MIAO C, LIU D, ZHANG F, et al. Association of FPGS genetic polymorphisms with primary retroperitoneal liposarcoma[J].Sci Rep, 2015, 5: 9079.

