分化型甲状腺癌被膜及被膜外微小侵犯与复发风险
胡厚洋,梁 军,张 腾,柏庆花,林岩松
1. 青岛大学附属医院肿瘤科,山东 青岛 266003;
2. 中国医学科学院北京协和医院核医学科,北京 100730;
3. 北京大学国际医院肿瘤科,北京 100142
近年来,分化型甲状腺癌(differentiated thyroid cancer,DTC)的发病率逐年上升[1]。外科手术、131I治疗、促甲状腺激素(thyrotropin,TSH)抑制治疗是目前常规的治疗方法[2]。外科手术是DTC综合治疗的基础,术后需对患者进行全面的风险评估,其主要依据为术后病理结果,目的是预测患者的预后及指导后续的131I治疗及TSH抑制治疗[3]。目前最常用的术后评估系统是美国肿瘤协会(American Joint Committee on Cancer,AJCC)提出的TNM分期系统及美国甲状腺协会(American Thyroid Association,ATA)提出的复发危险分层系统。TNM分期被用来预测患者的死亡风险,复发危险分层则用来预测复发风险以及指导131I治疗(低危不常规推荐,中危考虑,高危常规推荐)[3-4]。最新研究显示,甲状腺外微小侵犯(minimal extrathyroid invasion,MEI)对患者的死亡风险没有影响[5-7],第8版TNM分期也完全取消了MEI作为Ⅲ期独立因素对死亡风险的影响[8]。根据希尔(SEER)数据库最新数据显示,DTC患者的5年生存率可达98%,因此,相对于死亡风险,DTC患者的疾病复发/持续存在是临床关注的重点。2015年版ATA指南将DTC的疗效反应分为:满意(excellent response,ER)、不确切(incomplete response,IR)、血清学改变(biochemical incomplete response,BIR)、结构性改变(structural incomplete response,SIR),其中SIR预示着肿瘤的复发/持续存在。本研究采用治疗后的疗效评估系统来分析MEI对疾病复发/持续存在的影响,以期为复发危险分层提供更多临床依据,为后续131I治疗及TSH抑制治疗策略的制定提供更佳的理论基础。
1 资料和方法
1.1 一般资料
2013年1月—2016年1月就诊于北京协和医院核医学科的非远处转移型DTC患者942例,纳入标准:① 甲状腺全切或次全切;② 接受至少1次131I清甲治疗;③ 无影像学及病理证明的远处转移;④ 随访时间大于等于1年。
本研究中943例DTC患者均行甲状腺全切或次全切,根据术前评估行中央区淋巴结清扫及选择性颈侧区清扫。术后于北京协和医院核医学科行131I治疗,首次131I治疗前均进行全面的术后评估,并停服甲状腺激素至TSH大于30 μIU/ mL。中低危患者131I治疗剂量为30 mCi,伴甲状腺外组织(喉、气管、食管、喉返神经、横纹肌等)侵犯的高危患者依据病情给予适当的131I治疗剂量(30~150 mCi),治疗后1周内行全身显像[9]。治疗后3个月行首次治疗后评估,随后每6~12个月进行连续动态评估,并根据血清学指标及复发危险分层对甲状腺激素剂量进行调整[10]。
1.2 疗效反应标准及分组
疗效反应标准依据为2015年ATA指南(表1)。根据外科手术及131I治疗后是否达成SIR进行分组:
① SIR组:所有患者均在131I治疗后再次手术,病理证实为颈部疾病复发或持续存在。
② NSIR:经外科手术及131I治疗后疗效反应为非SIR的患者。
为进一步对比低危与微小侵犯的疗效反应,将患者分为低危组与微小侵犯组两组:
① 低危组:无局部或远处转移(符合全部条件);所有肉眼所见的肿瘤均被手术切除;肿瘤没有侵犯周围组织;肿瘤不是侵袭型亚型,没有血管侵犯;无淋巴结转移;清甲成功后的全身131I显像显示甲状腺床以外没有碘摄取。
② 微小侵犯组:仅有术后病理提示的被膜及被膜外微小侵犯,其他同低危。
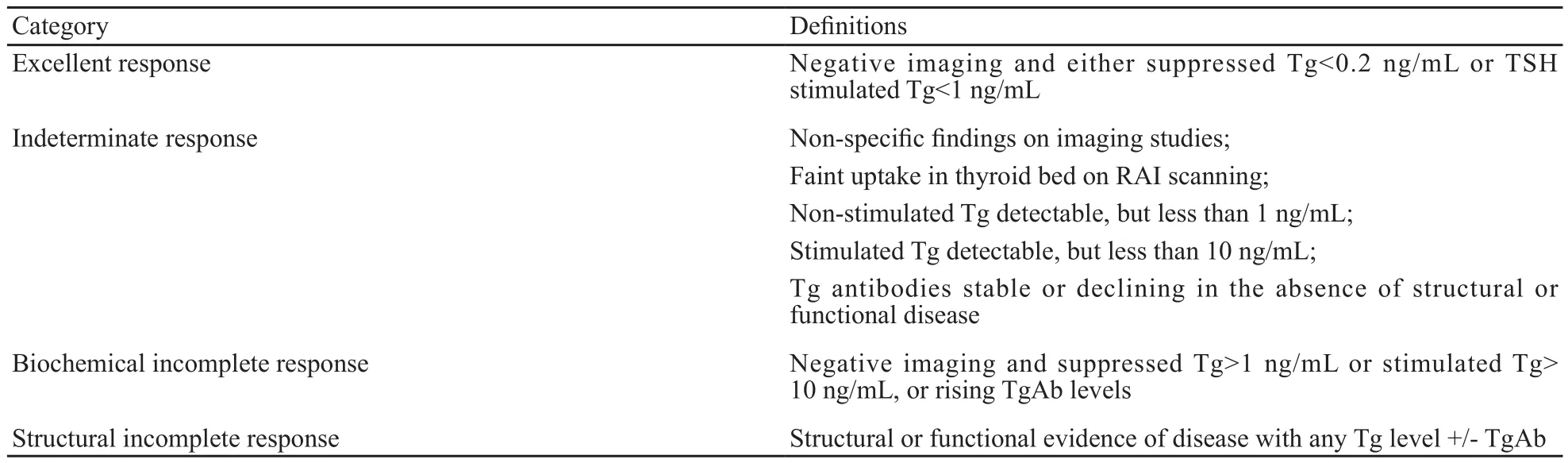
表 1 DTC患者131I治疗后的疗效反应评价标准Tab. 1 Criterion of response to 131I therapy stratification system in DTC patients
1.3 统计学处理
采用SPSS软件MacBook版,两组正态分布的资料采用t检验,二分类资料采用卡方检验,两组有序多分类变量及非正态分布资料采用秩和检验,P<0.05为差异有统计学意义。
2 结 果
2.1 SIR的相关因素
本研究纳入942例非远处转移的DTC患者中,经手术及131I治疗后提示SIR者55例(S1组,5.8%),非SIR者887例(S0组,94.2%)。SIR组在肿瘤大小(P=0.018)、淋巴结分期(P=0.008)及甲状腺外明显侵犯(P=0.008)方面高于NSIR组。两组患者在年龄,性别、多灶性、MEI等方面未见明显差异(表2)。
2.2 影响DTC发展为SIR的多因素分析
纳入因素:性别、肿瘤大小、单双侧、多灶性、淋巴结分期、MEI、甲状腺外明显侵犯。
采用逐步回归法得出进行多因素分析得出结论:肿瘤大小(P=0.007)与甲状腺外明显侵犯(P=0.036)是影响DTC复发/持续存在的主要因素,性别(P=0.972)、单双侧(P=0.916)、多灶性(P=0.344)、淋巴结分期(P=0.151)、MEI(P=0.673)尚不能认为与颈部复发明显相关(表3)。
相关性分析结果显示,MEI与DTC复发/持续存在未见明显相关性(r = -0.026,P=0.425)。
2.3 低危组与微小侵犯组患者一般临床特点及131I治疗后疗效反应差异
本研究中低危组患者39例,微小侵犯组65例,微小侵犯组在女性患者比率(P=0.018)、确诊年龄(P=0.033)方面略高于低危组,在肿瘤大小(P=0.517)、多灶性(P=1.000)、131I剂量(P=1.000)方面差异无统计学意义(表4);低危组患者治疗后SIR率、NSIR率分别为2.6%、97.4%,微小侵犯组患者治疗后SIR率、NSIR率分别为1.5%、98.5%。两组患者的复发率差异无统计学意义(P=0.244,图1)。
为进一步探讨能否将微小侵犯组患者纳入低危组,本研究对比了纳入前后的疗效反应。取消甲状腺被膜及被膜外微小侵犯对复发危险的影响,低危组患者的数量由39增加至104,复发率由2.5%下降为1.9%,最佳治疗反应达成率由79.5%提升为87.5%;相反,中危组患者数量下降,疗效满意率下降(70.4% vs 68.1%),复发率升高(4.7% vs 5.0%,图2)。
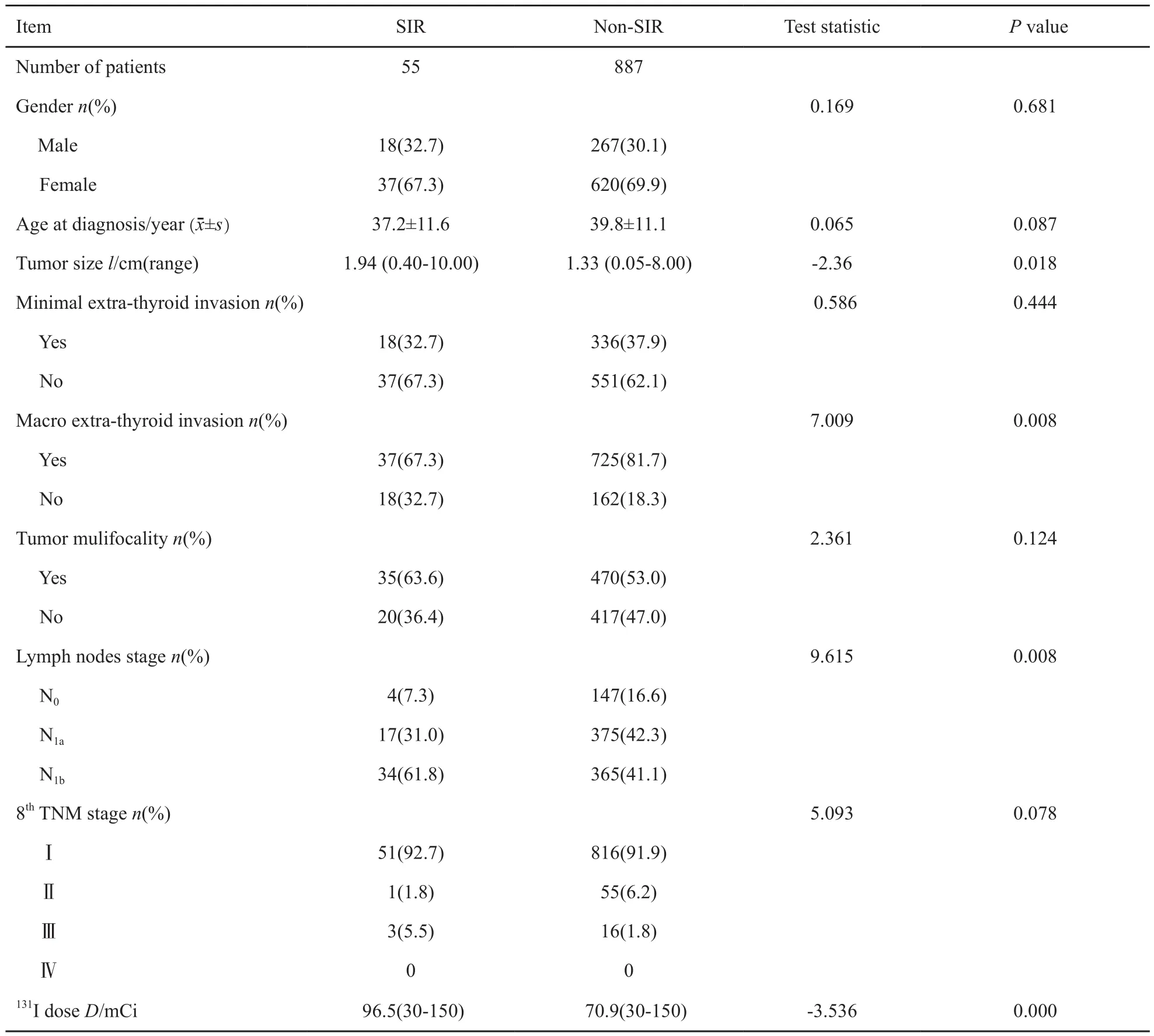
表 2 两组患者临床病理特征与SIR率的关系Tab. 2 Association between clinicopathologic features and SIR rate in two groups
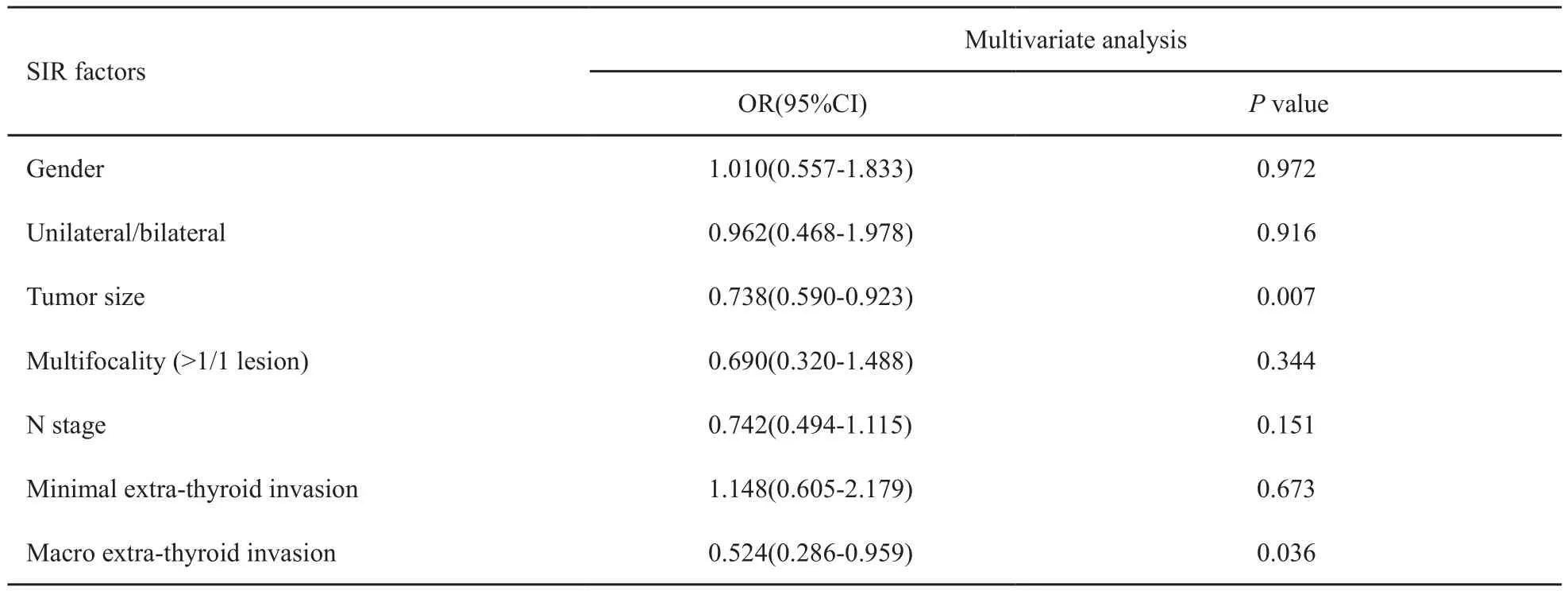
表 3 DTC患者疾病复发/持续存在的多因素分析Tab. 3 Multivariate analysis of SIR according to clinical pathologic factors in DTC patients
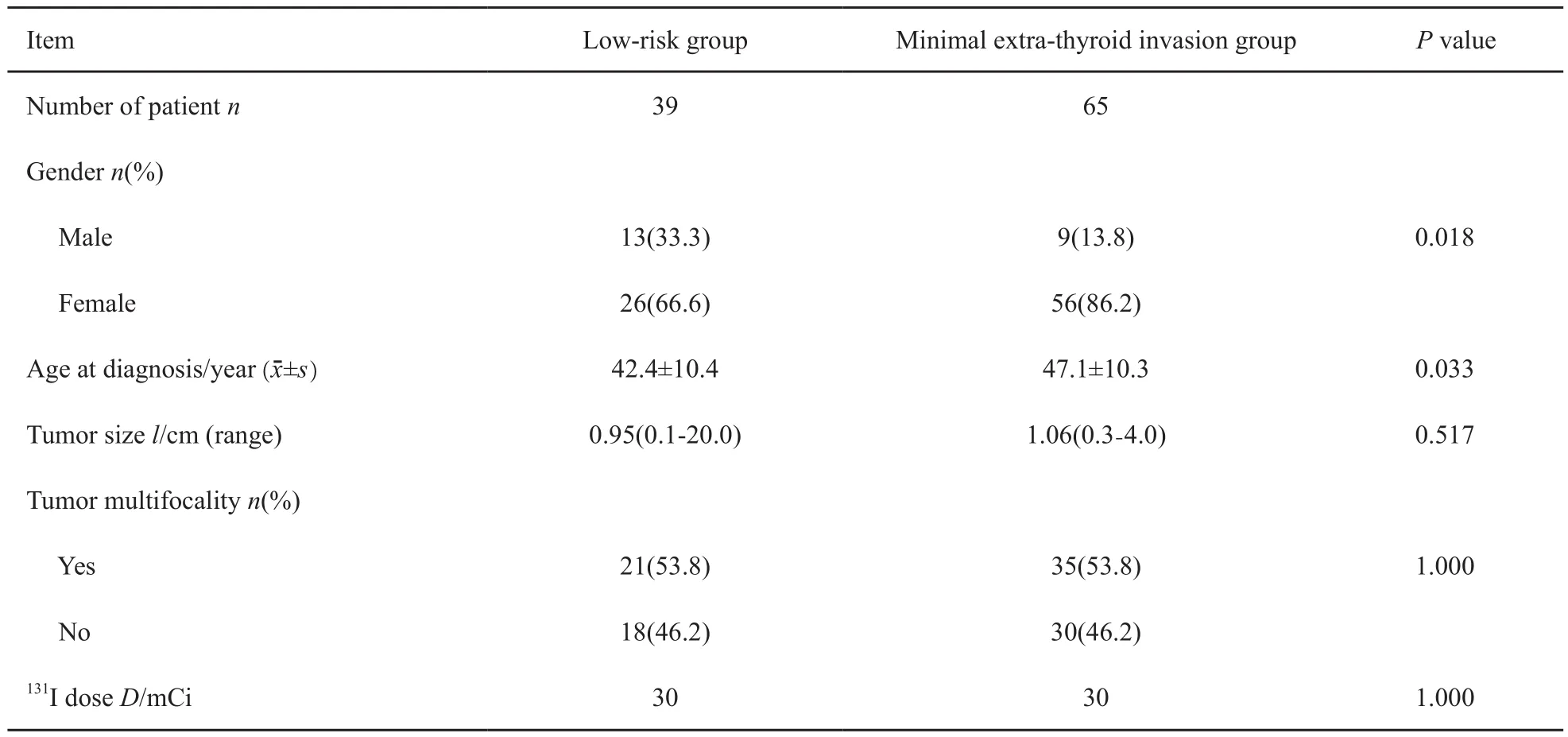
表 4 低危组与微小侵犯组一般临床病理特征比较Tab. 4 Comparison of clinical pathologic features between low-risk group and minimal extra-thyroid invasion group
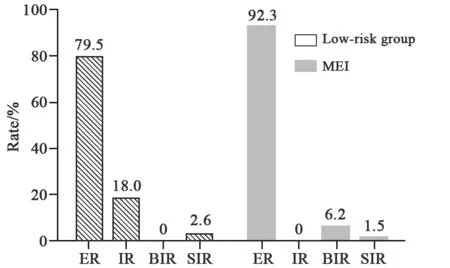
图 1 低危组与微小侵犯组患者的131I治疗疗效Fig. 1 Comparison of response between low-risk group and MEI group
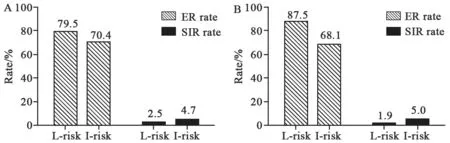
图 2 MEI调整为低危因素前后疗效对比Fig. 2 Comparison of the response before (A) and after (B) classifying MEI into low-risk factors and after
3 讨 论
DTC患者即使经过规范化治疗,包括外科手术、131I治疗和TSH抑制治疗,复发率仍可达20%~30%,因此,对其复发的监测是临床工作的重点[11-12]。在第7版TNM分期中,MEI被作为T3分期的独立影响因素,年龄大于45岁伴MEI患者亦因此被分至更高的分期(Ⅲ期)。有研究报道对仅伴有MEI的DTC患者进行了大样本长期随访,证实了其对患者生存率基本无影响[7,13];其他研究亦显示,MEI不是影响患者死亡的主要因素[14-15],因此,第八版TNM分期完全取消了MEI对死亡风险的影响(归为T1或Ⅰ期)。目前,针对DTC患者进行131I治疗的主要依据为ATA复发风险分层,而MEI在复发危险分层中仍然被作为中危的独立影响因素。因此,有关MEI对疾病复发的影响仍存在争议[16],本研究重点探讨了MEI与非远处转移DTC颈部疾病复发或持续存在的关系。
疗效评估体系是2015年版ATA指南中的亮点,它有助于实时动态评估患者对治疗的反应。研究显示,获得ER患者的10年疾病相关死亡率小于1%,可认为达到“无病生存状态”,SIR代表外科手术及131I治疗后疾病复发或持续存在,其中局部转移者10年死亡率约为10%,远处转移者升至50%[17]。本研究中采用ATA疗效反应对影响DTC复发的危险因素进行评价,发现SIR组与非SIR组的MEI发生率无明显差异,有关SIR的多因素分析亦显示MEI不是影响DTC颈部复发的独立因素,并被进一步MEI与SIR的相关性分析结果(r = -0.026,P=0.425)所证实。这提示,MEI这一特征未对DTC的局部复发产生影响,尚不足以成为DTC患者复发的独立危险因素。
本研究又追踪了不伴有其他中、高危因素仅伴有MEI患者的疗效反应,并与低危组患者进行了一般临床病理特点及疗效反应的对比。微小侵犯组女性比率更高,年龄稍大,女性患者在临床疗效及预后中略优于男性患者,年龄在非远处转移患者中的影响并不显著;两组患者在肿瘤大小、多灶性、131I剂量方面差异并无统计学意义。131I治疗后两年的动态评估中,仅伴微小侵犯组患者ER率高达92.3%,复发率低至1.5%;该组复发率与低危组差异无统计学意义(1.5% vs 2.6%,P=0.244),这再次提示,MEI不足以成为复发的独立影响因素。基于上述的研究结果,我们进一步尝试取消MEI这一特征对复发的影响,重新对患者按复发风险进行分组,发现虽然6.9%的患者因取消MEI这一特征的影响从中危组重新纳入至低危组,低危组患者整体ER率并未因人数的增加而出现明显差异(87.5% vs 79.5%,P=0.056),其复发率稍有下降(1.9% vs 2.5%,P=0.244)。这说明若取消MEI的独立中危因素而将其纳入低危组,低危组患者同样会取得良好的预后,这使得复发危险分层更趋合理,也避免了因MEI对DTC患者过于积极的治疗与随访,本研究亦有望为复发危险分层的修正提供依据。
此外,本研究的多因素分析显示肿瘤直径是影响SIR的独立因素(P=0.007),其他相关研究亦显示,肿瘤直径越大,DTC患者的复发/死亡率越高[18-19]。这提示,在复发风险中,肿瘤直径有可能是比MEI更值得关注的因素。目前,肿瘤直径在复发危险分层中并未提及,有关肿瘤直径与复发风险的关系尚有待进一步研究。
综上,甲状腺被膜及被膜外微小侵犯尚不足以作为DTC颈部复发的影响因素。
[1] SIEGEL R L, MILLER K D, JEMAL A, et al. Cancer statistics[J]. CA Cancer J Clin, 2017, 67(1): 7-30.
[2] 中华医学会核医学分会.131I治疗分化型甲状腺癌指南(2014版)[J]. 中华核医学与分子影像杂志, 2014, 34(4):264-279.
[3] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J]. Thyroid, 2016, 26(1): 1-133.
[4] AMIN M B, EDGE S, GREENE F, et al. 2017 AJCC cancer staging manual[M]. 8thedition, Springer International Publishing, 2016.
[5] CHEREAU N, BUFFET C, TRESALLET C, et al. Does extracapsular extension impact the prognosis of papillary thyroid microcarcinoma?[J]. Ann Surg Oncol, 2014, 21(5):1659-1664.
[6] HOTOMI M, SUGITANI I, TODA K, et al. A novel definition of extrathyroidal invasion for patients with papillary thyroid carcinoma for predicting prognosis[J]. World J Surg, 2012,36(6): 1231-1240.
[7] ITO Y, TOMODA C, URUNO T, et al. Minimal extrathyroid extension does not affect the relapse free survival of patients with papillary thyroid carcinoma measuring 4 cm or less over the age of 45 years[J]. Surg Today, 2006, 36(1): 12-18.
[8] KIM M, KIM W G, OH H S, et al. Comparison of the 7thand 8theditions of the AJCC/UICC TNM staging system for differentiated thyroid cancer[J]. Thyroid, 2017, Jun 21. doi:10. 1089/thy. 2017. 0050.
[9] 张英杰, 梁 军, 杨 柯, 等. 非远处转移性高危分化型甲状腺癌的低剂量碘-131治疗[J]. 中国医学科学院学报,2015, 37(5): 596-601.
[10] DIESSL S, HOLZBERGER B, MADER U, et al. Impact of moderate vs stringent TSH suppression on survival in advanced differentiated thyroid carcinoma[J]. Clin Endocrinol (Oxf), 2012, 76(4): 586-592.
[11] MAZZAFERRI E L, JHIANG S M. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer[J]. Am J Med, 1994, 97(5): 418-428.
[12] YANG X, LIANG J, LI T J, et al. Postoperative stimulated thyroglobulin level and recurrence risk stratification in differentiated thyroid cancer[J]. Chin Med J (Engl), 2015,128(8): 1058-1064.
[13] EROL V, MAKAY O, ICOZ G, et al. Prognostic factors of survival and recurrence pattern in differentiated thyroid cancer: a retrospective study from Western Turkey[J].Endocr Regul, 2014, 48(4): 173-181.
[14] CHO S W, CHOI H S, YEOM G J, et al. Long-term prognosis of differentiated thyroid cancer with lung metastasis in Korea and its prognostic factors[J]. Thyroid, 2014, 24(2): 277-286.
[15] ITO Y, TOMODA C, URUNO T, et al. Prognostic significance of extrathyroid extension of papillary thyroid carcinoma:massive but not minimal extension affects the relapse-free survival[J]. World J Surg, 2006, 30(5): 780-786.
[16] SHIN J H, HA T K, PARK H K, et al. Implication of minimal extrathyroidal extension as a prognostic factor in papillary thyroid carcinoma[J]. Int J Surg, 2013, 11(9): 944-947.
[17] TORLONTANO M, CROCETTI U, AUGELLO G, et al.Comparative evaluation of recombinant human thyrotropinstimulated thyroglobulin levels,131I whole-body scintigraphy,and neck ultrasonography in the follow-up of patients with papillary thyroid microcarcinoma who have not undergone radioiodine therapy[J]. J Clin Endocrinol Metab, 2006,91(1): 60-63.
[18] EROL V, MAKAY O, ICOZ G, et al. Prognostic factors of survival and recurrence pattern in differentiated thyroid cancer: a retrospective study from Western Turkey[J].Endocr Regul, 2014, 48(4): 173-181.
[19] MOON H J, KIM E K, CHUNG W Y, et al. 2011 minimal extrathyroidal extension in patients with papillary thyroid microcarcinoma: is it a real prognostic factor?[J]. Ann Surg Oncol, 18(7): 1916-1923.

