体素内不相干运动扩散加权成像在预测局部进展期直肠癌新辅助放化疗疗效中的初步研究
信 超,孙轶群,毛 健,童 彤,顾雅佳,彭卫军
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
弥散加权成像(diffusion weighted imaging,DWI)是唯一无创观察活体组织内水分子随机运动的方法[1-3]。通过两b值的单指数模型计算出表观扩散系数(apparent diffusion coefficient,ADC)值作为定量参数。DWI对于直肠癌新辅助放化疗疗效预测及评估价值也被国内外学者广泛认可,相关报道较多[4-5]。实际上,由于人体组织结构复杂,水分子的自由运动会受多种因素的影响, 因此不能真实反映人体组织内水分子的扩散状态。有研究提出了体素内不相干运动(intravoxel incoherent motion,IVIM)模型[6-7],即IVIM-MRI依据双指数模型理论基础,在体素水平分离出“扩散”和“灌注”两种因素,计算所获得的ADC值不仅反映水分子的随机扩散运动,还体现了毛细血管网内的微循环灌注情况[8-9],但是在直肠癌疗效预测方面的应用价值尚不明确。因此,本研究旨在探究IVIM预测直肠癌新辅助治疗效果的可行性,从而评估该技术在直肠癌中的应用前景。
1 资料和方法
1.1 临床资料
研究为前瞻性,研究方案通过了复旦大学附属肿瘤医院伦理委员会的批准(批准文号1403132-9),所有患者检查前均签署了知情同意书。收集2012年3月—2013年12月复旦大学附属肿瘤医院符合以下标准的患者。纳入标准:① 经结肠镜活检病理证实为直肠癌,MRI分期为局部进展期T3或T4期直肠癌(任何N分期),所有患者行新辅助放化疗后拟行根治性全直肠系膜切除术;② 年龄18~75岁,性别不限;③ 病灶距肛距离小于等于12 cm;④ 新辅助放化疗前未接受过任何抗肿瘤治疗;⑤ 无远处转移;⑥ 无严重内科疾病。排除标准:① 未完成新辅助放化疗;② 未行根治性全直肠系膜切除术;③ 新辅助放化疗结束到手术的时间间隔大于16周。
1.2 新辅助放化疗方案
治疗前对患者行直肠指检、结肠内镜、胸部和腹部CT、盆腔MRI等检查评估患者状况。新辅助放化疗采用CT模拟定位。采用适形调强放疗计划,直线加速器6 MV光子线常规照射5次/周,照射野包括直肠肿瘤及盆腔淋巴引流区,放射总剂量为50.0~55.0 Gy,1.8~2.0 Gy/次。放疗同期给予同步联合化疗,具体方案为每周第1天奥沙利铂50 mg/m2,每周第1~5天卡培他滨625 mg/m2,每天2次。放疗结束后2周给予卡培他滨联合奥沙利铂方案化疗1个周期,具体方案为第1天奥沙利铂130 mg/ m2,第1~14天卡培他滨1 000 mg/m2,每天2次。新辅助放化疗结束后6~14周行根治性全直肠系膜切除术。
1.3 MRI检查方法
患者均在新辅助放化疗前2~5 d、术前1~4 d行直肠MRI扫描,采用美国GE Signa HorizonHDXT 3.0T MRI扫描仪和8通道相控阵腹部线圈。患者仰卧位,足先进。8通道TORSE体线圈发射并接收信号。扫描参数为T1WI:TE=2 424 ms,TR=230 ms,矩阵(matrix)=384×192,视野(field of view,FOV)=350 mm。T2WI:TE=103 ms,TR=2 880 ms,矩阵=320×224,FOV=260 mm。T2WI薄层FOV序列:TE=110 ms,TR=4 120 ms,矩阵=384×224,FOV=200 mm,层厚=4 mm。T1增强序列(LAVA+增强):TE=1 588 ms,TR=3 464 ms,矩阵=288×256,FOV=330 mm。ZOOM-EPI IVIM序列:b值、50、100、200、400、600、800、1 200 s/mm。TE 87 ms,TR 2 000 ms,采集矩阵128×128,FOV 38 cm×38 cm,层厚5.0 mm,层间隔0.5 mm,激励次数8次。
1.4 图像分析
将扫描全部图像传入美国 GE AW 4.4工作站,采用 GE Cine Tool专用软件进行后处理。工作站采用相应软件包进行处理,得到ADCstandard、D、D*和f参数的伪彩图像。参考b=800 s/mm2的DWI和轴面T2WI观察病变大小、范围和边界,在各参数伪彩图上圈入肿瘤灶面积最大层面及其前后两层为感兴趣区 (region of interest,ROI)。取病变中心实质部分,避开囊变坏死区,选取实质部分较大范围ROI以避免光子效应。为避免误差,由2名放射诊断医师(1名有超过10年的临床经验,另1名有5年以上临床经验)进行勾画及测量。测量并记录标ADCstandard、D、D*和f各参数的值,取两者平均值为最终结果。
1.5 疗效评价
术后依据国际抗癌联盟和美国癌症联合委员会推荐的2010年第7版TNM分期标准[10]判定术后分期,病理完全缓解(pathological complete response,pCR)为手术标本中不存在任何腺癌细胞(ypT0N0),其余为非pCR。将患者根据术后病理结果分为pCR组和非pCR组。
1.6 统计学处理
采用SPSS 17.0软件进行统计学分析。新辅助治疗前、后肿瘤实质区单指数模型ADC值和双指数模型D值、灌注系数D*值、灌注分数f值,采用配对样本t检验进行分析;并比较pCR组和非pCR组新辅助治疗前、后参数差异。组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料
共32例患者纳入研究,其中,男性19例,女性13例;年龄24~75岁,中位年龄56岁。其中,T2患者2例(6.3%),T3期患者25例(78.1%),T4期患者5例(15.6%),N0患者3例(9.4%),N+患者29例(90.6%),直肠系膜筋膜(mesorectal fascia,MRF)未侵犯患者即MRF(-)者24例(75%),MRF(+)患者8例(25%)。12例行根治性全直肠系膜低位前切术,20例行根治性全直肠系膜腹会阴联合切除术。经过新辅助治疗后pCR组11例(34.4%),非pCR组21例(65.7%)。
2.2 IVIM参数变化的变化
IVIM的单指数模型中,治疗前肿瘤平均ADC值[(133.2±21.5)×10-5mm/s]较治疗后[(166.9±21.5)×10-5mm/s]小且差异有统计学意义(P<0.05);双指数模型中,新辅助放化疗前pCR组肿瘤D*值[(4 471±1 271)×10-5mm/ s]低于非pCR组[(5 749±1 722)×10-5mm/s],差异有统计学意义(P<0.05);新辅助放化疗后pCR组肿瘤D值[(97.0±14.6)×10-5mm/s]低于非pCR组[(113.4±22.6)×10-5mm/s],差异有统计学意义(P<0.05),其余新辅助治疗前、后的参数在pCR组和非pCR组之间差异无统计学意义(P>0.05,表1~4)。新辅助化疗前后的ADCstandard、D*、D结果见图1~3。
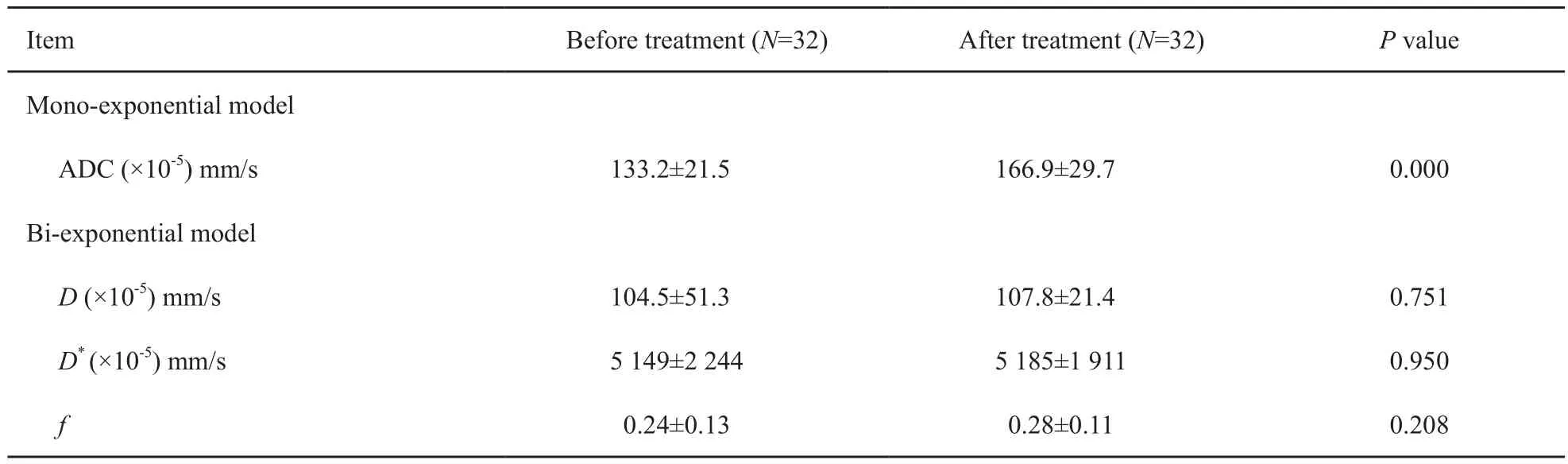
表 1 治疗前、后病变参数对比Tab. 1 Comparison of the parameters of lesion between before and after treatment

表 2 pCR组与非pCR组治疗前参数比较Tab. 2 Comparison of the parameters of lesion between pCR group and non-pCR group before treatment

表 3 pCR组与非pCR组治疗后参数比较Tab. 3 Comparison of the parameters of lesion between pCR group and non-pCR group after treatment

表 4 pCR组与非pCR组治疗前、后参数差值比较Tab. 4 Comparison of the different values between before and after treatment in pCR group and non-pCR group
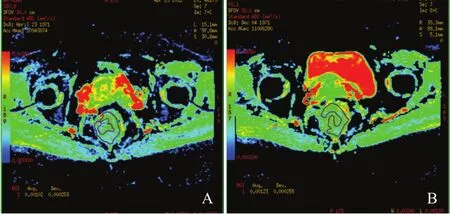
图 1 直肠癌患者新辅助放化疗前后ADCstandard图Fig. 1 The ADCstandard map before and after treatment in patient with rectal cancer

图 2 pCR及非pCR直肠癌患者新辅助放化疗前D*图Fig. 2 The D* map before treatment in patients who got pCR and who got non-pCR

图 3 pCR及非pCR直肠癌患者新辅助放化疗后D图Fig. 3 The D map after treatment in patient who got pCR and who got non-pCR
3 讨 论
新辅助放化疗能显著降低中低位直肠癌局部复发率,而被公认为中低位进展期直肠癌的规范化治疗手段[11]。直肠癌放疗后约有60%的患者出现显著降期,有10%~42%的患者出现pCR,放化疗后分期显著下降或完全缓解的患者预后佳,其据部分复发率及5年生存率均显著低于放疗后无降期者(0.7% vs 2.6%,92.6% vs 73.1%)[12]。直肠癌生物学行为不尽相同,因而对新辅助放化疗反应不同。若能在治疗前预测放化疗疗效,则有望通过选择合理个体化治疗方案来治疗具有不同生物学行为的直肠癌。
DWI是目前检查活体组织中水分子扩散运动的理想方法,可以通过测定ADC值定量反映组织特性[1-3]。单纯的ADC值不能完全准确反映组织内水分子扩散运动,已有研究证实,在复杂而繁密的毛细血管网中,微循环灌注可导致假扩散效应,这就是所谓的体素内不相干运动,即IVIM[13]。常规DWI使用单指数拟合函数得到ADC值,它较大程度上受到成像时所使用的b值的影响,而IVIM DWI时采用足够多的低b值和高b值并使用双指数拟合函数[14]。IVIM双指数模型所得到的4组参数有不同意义:ADCstandard为标准ADC值,与单指数DWI的ADC值相同;D值代表真正水分子扩散系数,即扩散;D*值代表血液在不规则毛细血管网内的流动,即灌注;灌注相关体积分数f值表示对生物组织施加一定时间扩散梯度后,受水分子扩散和灌注过程的双重影响,磁共振信号强度衰减,其中灌注过程所占贡献比例成为灌注相关体积分数,它在一定程度上反映了生物组织内毛细血管的丰富程度,一般认为,f值越大,毛细血管分布越密集[6-7,14]。IVIM可获取更丰富的生物信息,因而可能更准确地对恶性肿瘤放化疗疗效进行预测和监控。因此,本研究欲探讨IVIM的单、双指数模型在预测局部进展期直肠癌新辅助放化疗疗效中的应用价值。
本研究结果显示,单指数模型显示患者治疗后ADCstandard值大于治疗前ADCstandard值,提示经过新辅助放化疗,直肠癌肿瘤细胞出现凋亡现象。治疗后ADCstandard值升高,与治疗后组织间隙增大,细胞内水分子减少,坏死组织内的自由水就会增多有关。这一结果与多数文献报道及理论相符合。但治疗前、后患者双指数模型所有参数差异无统计学意义。pCR组患者治疗前的D*值高于非pCR,即pCR组毛细血管所致的灌注低于非pCR组,有文献报道,肿瘤的灌注情况与其恶性程度相关[15],此组结果可能提示pCR组患者肿瘤恶性程度低。而新辅助放化疗后,pCR组患者D值低于非pCR组(P<0.05),可能与直肠癌经过新辅助治疗pCR组肿瘤退缩而组织纤维化明显有关,因此会导致组织中水分子扩散运动受限。
f值在一定程度上反映生物组织的毛细血管的丰富程度,理论上会与组织微循环灌注成正相关,但就本研究而言,f值并没有符合上述的病理基础,分析其原因,可能与微循环的灌注量与肿瘤内部血管类型、血流量、患者本身的血流量有关[16]。另外,很多学者研究认为D*值变异度高,其尚需进一步研究证实。进一步将直肠癌患者的动态增强磁共振、灌注加权成像共同分析,可能会有更深入的发现[17]。
本研究的局限性:① 患者数较少,尤其pCR组仅12例患者,若绘制受试者工作特征(receiver operating characteristic,ROC)曲线获得截点用以预测pCR和非pCR,其预测力度不够;② 3个层面的ROI分析可能出现偏差,并且不能完整体现肿瘤的特性;③ 随访患者的时间较短,如果通过无病生存期或总生存期来评估肿瘤的侵袭性可能更有说服力,对临床更有价值。今后应扩大样本量及增加随访时间,研究结果更为客观。
综上所述,IVIM-MRI双指数模型可以作为单指数模型的补充,可更加详细补充描述肿瘤信息,在预测局部进展期直肠癌新辅助放化疗疗效具有一定价值。
[1] SCHNAPAUFF D, ZEILE M, NIEDERHAGEN M B, et al.Diffusion-weighted echo-planar, magnetic resonance imaging for the assessment of tumor cellularity in patients with softtissue sarcomas[J]. J Magn Reson Imaging, 2009, 29(6):1355.
[2] MANNELLI L, NOUGARET S, VARGAS H A, et al.Advances in diffusion-weighted imaging[J]. Radiol Clin North Am, 2015, 53(3): 569-581.
[3] CAI P Q, WU Y P, AN X, et al. Simple measurements on diffusion-weighted MR imaging for assessment of complete response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer[J]. Eur Radiol, 2014, 24(11):2962-2970.
[4] GENOVESI D, FILIPPONE A, AUSILICÈFARO G, et al.Diffusion-weighted magnetic resonance for prediction of response after neoadjuvant chemoradiotherapy therapy for locally advanced rectal cancer: preliminary results of a monoinstitutional prospective study[J]. Eur J Surg Oncol,2013, 39(10): 1071-1078.
[5] JUNG S H, HEO S H, KIM J W, et al. Predicting response to neoadjuvant chemoradiation therapy in locally advanced rectal cancer: diffusion-weighted 3 Tesla MR imaging[J]. Magn Reson Imaging, 2012, 35(1): 110-116.
[6] LE BIHAN D, BRETON E, LALLEMAND D, et al. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders[J].Radiology, 1986, 161(2): 401-407.
[7] LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988, 168(2): 497-505.
[8] FEDERAU C, MEULI R, O’BRIEN K, et al. Perfusion measurement in brain gliomas with intravoxel incoherent motion MRI[J]. AJNR Am J Neuroradiol, 2014, 35(2):256-262.
[9] KIM H S, SUH C H, KIM N, et al. Histogram analysis of intravoxel incoherent motion for differentiating recurrent tumor from treatment effect in patients with glioblastoma: initial clinical experience[J]. AJNRAm J Neuroradiol, 2014,35(3): 490-497.
[10] EDGE S B, COMPTON C C. The American Joint Committee on Cancer: the 7thedition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6):1471-1474.
[11] CURVO-SEMEDO L, LAMBREGTS DM, MAAS M, et al. Rectal cancer: assessment of complete response to preoperative combined radiation therapy with chemotherapy--conventional MR volumetry versus diffusion-weighted MR Imaging[J]. Radiology, 2011, 260(3): 734-743.
[12] ZORCOLO L, ROSMAN A S, RESTIVO A, et al. Complete pathologic response after combined modality treatment for rectal cancer and long-term survival: a meta-analysis[J].Ann Surg Oncol, 2012, 19(9): 2822-2832.
[13] CERCUEIL J P, PETIT J M, NOUGARET S, et al. Intravoxel incoherent motion diffusion-weighted imaging in the liver:comparison of mono-, bi-and tri-exponential modelling at 3.0-T[J]. Eur Radiol, 2015, 25(6): 1541-1550.
[14] LE BIHAN D. Intravoxel incoherent motion perfusion MR imaging: a wake-up call[J]. Radiology, 2008, 249(3): 748-752.
[15] TATEISHI U, KUSUMOTO M, NISHIHARA H, et al.Contrast-enhanced dynamic computed tomography for the evaluation of tumor angiogenesis in patients with lung carcinoma[J]. Cancer, 2002, 95(4): 835-842.
[16] PATEL J, SIGMUND E E, RUSINEK H, et al. Diagnosis of cirrhosis with intravoxel incoherent motion diffusion MRI and dynamic contrast-enhanced MRI alone and in combination:preliminary experience[J]. J Magn Reson Imaging, 2010,31 (3): 589-600.
[17] 贾慧茹, 张 翼, 刘 乐, 等. 扩散加权成像单指数和双指数模型评估单侧输尿管梗阻大鼠肾脏扩散及微灌注变化 [J]. 中国医学影像学杂志, 2014, 22(5): 325-328.

