水稻ABA生物合成基因OsNCED3响应干旱胁迫
徐学中 汪 婷 万 旺 李思慧 朱国辉
水稻ABA生物合成基因响应干旱胁迫
徐学中 汪 婷 万 旺 李思慧 朱国辉*
华南农业大学生命科学学院, 广东广州 510642
9-顺-环氧类胡萝卜素双加氧酶(NCED)是植物内源脱落酸(ABA)生物合成的限速酶, 由基因家族编码, 水稻中响应干旱胁迫并以此调节ABA水平的基因尚未见报道。本研究发现在水稻已报道的5个基因中,的表达受干旱胁迫诱导, 复水处理后其表达快速下调, 其表达模式与此过程中内源ABA含量变化趋势一致。的RNAi转基因植株表现为干旱敏感, 且生物量下降; 而过量表达基因增加了水稻的抗旱性。干旱胁迫下过量表达的转基因株系有较高的ABA水平, 同时其抗氧化酶超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性, 以及逆境响应基因脱水素蛋白(Dehydrin)和胚胎发育晚期丰富蛋白(LEA)转录表达均高于野生型。下调表达的转基因株系则呈现相反的变化趋势。因此,是水稻干旱胁迫响应基因, 调节了干旱环境下ABA水平和抗逆性。
基因; 干旱胁迫; 脱落酸; 水稻
干旱胁迫是作物生产的主要限制因素之一, 生殖期的干旱可使作物减产50%以上[1]。干旱对植物生长的危害是多方面的, 植物对干旱胁迫的响应机理也极其复杂, 包括逆境信号识别、信号传导以及在形态、生理和分子水平的适应(通过根系变化、积累渗透保护物、抗氧化物质和活性氧清除剂等)[1-2]。在这个过程中, 大量信号分子(IP3、Ca2+、ABA等)和蛋白质(包括转录因子、蛋白激酶和各种逆境相关蛋白)参与其中, 信号途径交叉互作, 形成了错综复杂的信号传递网络[3]。脱落酸(ABA)作为调节植物生长发育的一种激素, 不仅在植物发育的各个阶段发挥重要的调节作用, 还能介导植物对一些逆境胁迫的生理反应, 比如干旱胁迫导致的气孔关闭, 以增加植物的抗逆性等[3-4]。通过基因工程等手段调节作物ABA水平, 是提高干旱条件下作物产量的有效手段, 有重要的应用前景[1]。
多数高等植物的ABA通过C40间接途径由类胡萝卜素合成, 9-顺-环氧类胡萝卜素双加氧酶(9-- epoxycarotenoid dioxygenase, NCED)催化的反应为ABA合成途径中的限速步骤[5]。水稻NCED由基因家族编码, 包括等5个基因[6]。不同的基因通过调节内源ABA水平, 在不同的生物学过程中发挥作用。Zhu等[7]报道参与水稻籽粒灌浆过程中ABA水平的调控, Hwang等[8]报道在拟南芥中异源表达增加了拟南芥ABA水平, 改变了叶片形态。本研究综合分析水稻基因的组织特异性和干旱逆境下的表达, 同时通过转基因的方法证明在干旱胁迫下调控ABA的生物合成, 以此响应逆境胁迫。
1 材料与方法
1.1 材料与处理
野生型和转基因型水稻品种均为中花11 (L., Zhonghua 11)。于大田种植组织特异性表达材料, 四叶期取野生型水稻叶片、叶鞘和根, 用于基因幼苗期的转录表达分析; 灌浆15 d后取水稻叶片、叶鞘、茎和穗, 用于生殖生长期的转录表达分析。干旱处理材料在光照培养箱中培养至四叶期, 于营养液中加入20% (w/v) PEG-6000模拟干旱胁迫, 分别取处理0、1、2、4 h以及复水0.5、1、2、4 h水稻叶片, 用于干旱胁迫下基因的转录表达分析, 其中干旱处理4 h水稻叶片用于ABA含量、MDA含量、抗氧化酶活性测定和干旱响应基因表达分析。在水稻四叶期以20% PEG连续处理15 d, 取整株材料测定鲜重和干重。土壤干旱胁迫处理时在水稻长至五叶期时停止灌溉, 10 d后复水4 d。以上实验均进行3次生物学重复。
1.2 基因定量表达分析
用RNA Easy Plant Mini Kit (Qiagen)试剂盒提取RNA, 经DNase I处理一次, 去除RNA中的微量DNA, 再以MMLV反转录酶(Promega)将RNA反转录为cDNA。用荧光染料 SYBR Green (Bio-Rad)对各种待测的基因进行定量PCR分析, 所有数据经扩增水稻基因进行均一化处理, 每个基因重复3次。实验中所用的引物见表1。
1.3 转基因株系获得
水稻品种中花11用于转基因植株的构建。为构建过量表达载体, PCR扩增基因全长, 引物为5¢-TCCCGATATGGCGAC GATCACGAC-3¢(d III)和5¢-GAAAGA AACGTGGAGGTGTTCGAT-3¢(H I), 片段酶切后连接于植物表达载体pOX (刘耀光提供, 华南农业大学)。为构建干涉表达载体, PCR扩增基因一段569 bp的片段, 引物为5¢-GA AGTGGTGATCGGCTCGTGCATGAC-3¢(H I)和5¢-TCCCCCCAAGAAACGTG GAGGTGTTCG-3¢(d III), 片段酶切后正向连接于RNAi载体(刘耀光提供, 华南农业大学); 根据载体上I和I酶切位点反向组装片段。构建的过量表达和RNAi干涉载体通过农杆菌侵染的方法转化中花11水稻愈伤, PCR扩增基因筛选T0转化植株, 在含潮霉素的营养液中筛选分离比为3∶1的T1转化植株, 在含潮霉素的营养液中不再分离的T2转化植株用于本实验。

表1 定量PCR分析的引物序列
1.4 生物量、ABA含量、MDA含量、抗氧化酶活性测定与分析
称量擦干根部的整株鲜重, 在100℃烘干8 h后于干燥皿中阴凉, 再分别称取整株、地上部和根干重。ABA含量采用化联免疫法测定[6]。0.2 g水稻材料液氮研磨后溶于1 mL去离子水, 4℃振荡过夜, 离心后其上清液用于测定。采用硫代巴比妥酸比色法测定丙二醛含量[9]。用50 mmol L–1pH 7.0磷酸缓冲液研磨水稻叶片, 离心后上清液可用于酶活性测定[9]。以抑制NBT光化还原50%作为一个SOD酶活力单位(U), 以U g–1FW表示; 以H2O2的分解速率衡量CAT活性, 单位以ΔA240min–1g–1FW表示; POD活性单位以ΔA470min–1g–1FW表示。
2 结果与分析
2.1 水稻OsNCED基因家族组织特异性表达和干旱胁迫反应分析
分别对家族的5个基因转录水平的定量分析表明,主要在水稻叶片中表达;在水稻幼苗期主要在叶鞘表达, 而生殖生长期在茎中表达;和转录丰度整体低于其他3个,在水稻根中有少量表达;主要在水稻穗中表达(图1-A)。
干旱胁迫下水稻叶片ABA水平会快速积累, 以适应环境胁迫。为了解哪个基因对ABA积累起关键作用, 以20% PEG模拟干旱处理水稻幼苗4 h, 然后复水4 h, 分析过程中基因的表达变化。从图1-B可见,基因表达受干旱胁迫诱导, 在处理4 h达到最高, 而复水处理其表达量迅速下调, 复水4 h后达到本底表达水平。其表达模式与此过程中ABA含量变化一致(图1-B, C), 表明是干旱胁迫响应基因, 其转录水平调控了干旱条件下ABA的变化。有意思的是,基因表达模式与基因刚好相反, 其可能原因是基因转录受内源ABA水平的反馈抑制。、和基因表达在此过程中无明显变化(图1-B)。
2.2 水稻OsNCED3转基因株系干旱抗性分析
为了进一步证明是水稻响应干旱胁迫关键基因, 分别构建并获得了基因下调表达和过量表达的转基因株系。下调表达采用RNA干涉(RNAi)的方法, 一段485 bp的基因编码区域作为干涉片段, 通过农杆菌介导的方法转化至水稻中花11 (WT)。过量表达以Ubi作为启动子, 把基因编码框架转化至水稻中花11; 转基因水稻通过潮霉素筛选2代, 获得纯合株系。分别挑选过量表达株系OE-1、OE-5和下调表达株系RNAi-3、RNAi-5作为下一步研究的材料(图2-A)。
干涉株系RNAi-3和RNAi-5中基因表达量分别下调了57.8%和32.9%, 过量表达株系OE-1和OE-5中基因表达量分别增加了3.2倍和9.8倍(图2-A)。从图 2-B可看出, 下调基因表达显著降低了水稻幼苗的干旱抗性。五叶期水稻在自然脱水条件下干旱10 d后, 干涉株系RNAi-3和RNAi-5表现出严重的干旱表型, 整株叶片卷曲枯黄, 而野生型株系仅叶尖和老叶上有干旱胁迫表型。复水处理4 d后, 大部分野生型水稻恢复生长, 而干涉株系仅20%~30%植株得以存活(图2-B, C)。与此相反, 过量表达基因增加了水稻幼苗的干旱抗性。与野生型比较, 过量表达株系OE-1和OE-5在干旱和复水条件下都表现出更好的生长情况(图2-B, C)。这些结果表明直接参与干旱胁迫反应, 其转录水平调控了水稻对干旱胁迫的适应性。
四叶期水稻以20% PEG模拟干旱处理15 d, 与野生型对照相比, 干涉株系RNAi-3和RNAi-5生物量明显较低, PEG处理前后RNAi-3株系干重分别只为野生型的75.8%和75.4%; 过量表达株系OE-1和OE-5生物量与野生型无显著性差异(表2)。与不加PEG处理相比,转基因株系和野生型水稻鲜重、地上部干重及根长均呈下降趋势, 而地下部根的干重则显著增加。同时,过量表达株系根干重增加的比例高于野生型, 而RNAi干涉株系低于野生型(表2), 表明过量表达株系通过增加内源ABA水平, 促进了逆境反应物质可溶性糖等的积累, 因此增加了干物重和逆境胁迫的耐受性; 下调基因的RNAi干涉株系则与此相反。
2.3 水稻OsNCED3转基因株系干旱胁迫下ABA含量和抗氧化酶活性分析
水稻基因表达受干旱胁迫诱导, 且影响水稻的干旱抗性。正常生长条件下,转基因株系与野生型内源ABA水平无明显差异。20% PEG模拟干旱处理水稻幼苗4 h后, 野生型对照和转基因株系ABA水平都显著上调(图3-A)。与野生型相比, 干旱处理后过量表达株系OE-5积累了更多的ABA, 达到301.8 ng g–1FW, 为野生型的1.2倍, 而干涉株系RNAi-3的ABA含量仅为野生型的70% (图 3-A), 这与转基因株系中基因的表达水平正相关。

图1 水稻OsNCED基因家族组织特异性表达和幼苗干旱胁迫响应分析
A:基因组织特性表达; B:基因干旱胁迫响应; C: 干旱胁迫下ABA含量变化。
A: expression patterns ofgenes in different tissues; B: expression patterns ofgenes subjecting to drought stress; C: ABA contents under drought stress.

图2 水稻OsNCED3基因转基因株系抗旱性分析
A: 转基因株系基因表达分析; B:转基因株系抗旱性分析; C:转基因株系干旱处理后存活率。** 差异显著(<0.01)
A: relative expressions ofgene in RNAi and overexpression lines; B: performance of WT control andtransgenic lines after soil drought stress and re-watering; C: survival rate of rice seedlings after rewatering. ** Significantly different (<0.01).
干旱处理后,过量表达株系OE-5丙二醛(MDA)含量的增加低于野生型, 而株系高于野生型(图3-B)。同时,株系提高了水稻的抗氧化酶活性, 干旱胁迫下其SOD、POD和CAT活性均高于野生型对照, 与此相反,株系的POD活性则明显低于野生型(图3-C)。这些结果暗示转基因株系通过内源ABA水平的变化, 调节了抗氧化酶活性, 影响其对干旱胁迫的耐受性。
2.4 水稻OsNCED3转基因株系干旱胁迫下干旱响应基因表达分析
分析了ABA和干旱响应基因在转基因株系中的表达, 包括() (Loc_Os06g03670)、(Loc_Os11g26760、Loc_Os01g50700)和() (Loc_Os01g50910、Loc_Os04g49980、Loc_Os05g46480)。20% PEG模拟干旱处理4 h后, 野生型和转基因株系的干旱响应基因表达量显著上调(图 4)。与野生型对照相比, 过量表达株系OE-5中基因表达水平明显更高, 而干涉株系RNAi-3上调幅度小于野生型(图4), 表明转基因株系通过内源ABA水平的变化, 影响了下游干旱响应基因的表达, 植物细胞脱水保护蛋白Dehydrin和LEA的积累, 在抵御干旱胁迫中发挥着重要作用。
3 讨论
在已研究报道的植物中, 绝大多数NCED均由多基因家族编码, 每个基因都有特异的组织表达或者环境响应模式, 对植物正常生长发育和环境适应性发挥重要调节作用[10]。比如拟南芥有5个基因、、、和[11],基因表达受干旱胁迫诱导, 主要负责逆境条件下ABA的生物合成[12-13];和9参与种子ABA生物合成, 控制种子的发育、休眠与萌发[14];和均具有组织特异性表达, 但其生理功能尚不清楚。水稻亦含有5个基因, 其中在水稻叶片中表达,在叶鞘和茎中表达,在穗中表达(图 1-A)。本研究发现, 在5个基因中, 仅基因表达受干旱胁迫诱导(图1-B), 暗示其可能是逆境条件下ABA的生物合成关键基因。转基因实验进一步证明, 正常水分条件下, 过量表达株系基因表达量是野生型的3~10倍, 而ABA含量无显著提高(图2-A, 图3-A), 可能的解释是基因在一定范围内属于本底表达, 表达量的小幅度上调对NCED酶活性和ABA含量的影响不大。干旱胁迫下, 过量表达的转基因植株显著增加了叶片ABA含量及水稻抗旱性(图2-B, 图3-A); 而下调基因表达的转基因植株在干旱胁迫下积累的ABA水平低于野生型, 表现为干旱敏感(图2-B, 图3-A), 这些数据表明基因调控了干旱条件下ABA含量的变化和水稻抗旱性。
ABA是一种重要的逆境响应激素, 干旱诱导的ABA积累同时也是触发活性氧信号和积累的前提, 微量活性氧产生是植物适应逆境的一种手段, 起到信号分子的作用, 诱导植物抗氧化系统的启动以及逆境响应基因的表达, 而过量产生的活性氧则对植物细胞产生氧化伤害[15]。丙二醛是膜脂过氧化的重要产物之一, 可衡量逆境下膜脂过氧化的程度和伤害程度[16]。抗氧化酶对清除因胁迫产生的过量活性氧、调节活性氧的平衡发挥重要作用[17]。本研究中, 过量表达的转基因株系在干旱环境下其丙二醛含量相对较低, 而抗氧化酶SOD、POD和CAT活性则高于野生型, 对清除干旱胁迫产生的过量活性氧发挥重要作用(图4)。脱水素蛋白(Dehydrin)和胚胎发育晚期丰富蛋白(LEA)是重要的逆境响应蛋白, 其过量积累可显著提高植物抗逆性[18-19]。的过量表达的转基因株系中和的大量表达, 提高了转基因株系的干旱抗性(图5)。

表2 水稻OsNCED3基因转基因株系干旱胁迫下生物量
采用Duncan’s multiple range test方法分析, 同一列不同字母表示显著性差异(<0.05,=5)。
Means followed by different letters differ significantly at< 0.05 according to Duncan’s multiple range test.

图3 水稻OsNCED3基因转基因株系ABA、MDA含量和抗氧化酶活性
A: ABA含量分析; B: MDA含量分析; C: 抗氧化酶活性分析。**差异显著(<0.01)。
A: ABA contents analysis; B: MDA contents analysis; C: Antioxidant enzyme activities analysis.**Significantly different (<0.01).
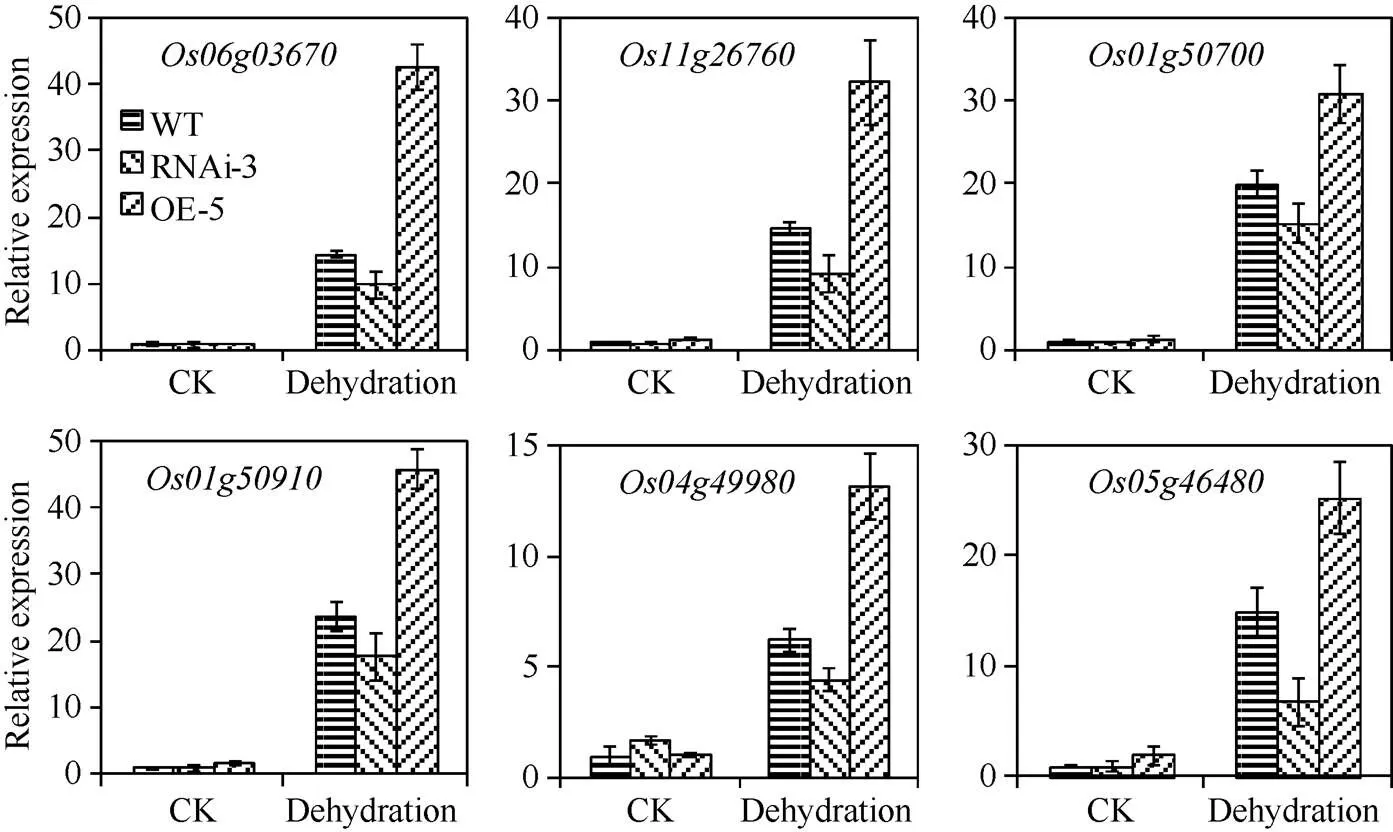
图4 水稻OsNCED3基因转基因株系干旱响应基因表达分析
4 结论
的转录表达受干旱胁迫诱导, 且与内源ABA含量呈一致变化趋势。与野生型对照相比, 过量表达的转基因株系在干旱胁迫下有较高的ABA水平, 抗氧化酶SOD、POD、CAT活性以及逆境响应蛋白基因和的表达升高,水稻抗旱性增强。而抑制表达的转基因植株表现为干旱敏感。因此,是水稻干旱胁迫响应基因, 调节了干旱环境下ABA水平和抗逆性。
[1] Hu H, Xiong L. Genetic engineering and breeding of drought- resistant crops, 2014, 65: 715–741
[2] Zhu J K. Salt and drought stress signal transduction in plants, 2002, 53: 247–273
[3] Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance, 2007, 58: 221–227
[4] Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism, 2005, 56: 165–185
[5] Qin X, Zeevaart J A. The 9--epoxycarotenoid cleavage reaction is the key regulatory step of abscisic acid biosynthesis in water-stressed bean, 1999, 96: 15354–15361
[6] Zhu G, Ye N, Zhang J. Glucose-induced delay of seed germination in rice is mediated by the suppression of ABA catabolism rather than an enhancement of ABA biosynthesis, 2009, 50: 644–651
[7] Zhu G, Ye N, Yang J, Peng X, Zhang J. Regulation of expression of starch synthesis genes by ethylene and ABA in relation to the development of rice inferior and superior spikelets, 2011, 62: 3907–3916
[8] Hwang S, Chen H, Huang W, Chu Y, Shii C, Cheng W. Ectopic expression of ricein Arabidopsis increases ABA level and alters leaf morphology, 2010, 178: 12–22
[9] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. pp 261–263 Li H S. Experimental Principle and Technology of Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000. pp 261–263
[10] Priya R, Siva R. Analysis of phylogenetic and functional diverge in plant nine-epoxycarotenoid dioxygenase gene family, 2015, 128: 519–534
[11] Tan B C, Joseph L M, Deng W T, Liu L, Li Q B, Cline K, Mccarty D R. Molecular characterization of the Arabidopsis 9-epoxycarotenoid dioxygenase gene family, 2003, 35: 44–56
[12] Iuchi S, Kobayashi M, Taji T, Naramoto M, Seki M, Kato T, Tabata S, Kakubari Y, Yamaguchi-Shinozaki K, Shinozaki K. Regulation of drought tolerance by gene manipulation of 9--epoxycarotenoid dioxygenase, a key enzyme in abscisic acid biosynthesis in Arabidopsis., 2001, 27: 325–333
[13] Ruggiero B, Koiwa H, Manabe Y, Quist T M, Inan G, Saccardo F, Joly R J, Hasegawa P M, Bressan R A, Maggio A. Uncoupling the effects of abscisic acid on plant growth and water relations. Analysis of, an abscisic acid-deficient but salt stress-tolerant mutant in Arabidopsis, 2004, 136: 3134–3147
[14] Lefebvre V, North H, Frey A, Sotta B, Seo M, Okamoto M, Nambara E, Marion-Poll A. Functional analysis of Arabidopsisandgenes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy, 2006, 45: 309–319
[15] Hu X, Zhang A, Zhang J, Jiang M. Abscisic acid is a key inducer of hydrogen peroxide production in leaves of maize plants exposed to water stress, 2006, 47: 1484–1495
[16] Esterbauer H, Schaur R J, Zollner H. Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes, 1991, 11: 81–128
[17] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction, 2004, 55: 373–399
[18] Xiang Y, Tang N, Du H, Ye H, Xiong L. Characterization ofas a key player of the basic leucine zipper transcription factor family for conferring abscisic acid sensitivity and salinity and drought tolerance in rice, 2008, 148: 1938–1952
[19] Hundertmark M, Hincha D K. LEA (late embryogenesis abundant) proteins and their encoding genes in, 2008, 9: 1–22
ABA Biosynthesis GeneConfers Drought Stress Tolerance in Rice
XU Xue-Zhong, WANG Ting, WAN Wang, LI Si-Hui, and ZHU Guo-Hui*
College of Life Sciences, South China Agricultural University, Guangzhou 510642, Guangdong, China
NCED (9--epoxycarotenoid dioxygenase), encoded bygene family, is a rate limited enzyme responsible for the ABA biosynthesis in plants. It remains unknown whethergenes are responsible for controlling ABA levels during drought stress in rice. Among the fivegenes, we found thatmRNA level was promptly induced by PEG-mimic drought stress and decreased by re-watering, with a tendency of well consistent with the variation of ABA content. Down-regulating ofgene expression in RNA interference (RNAi)-transgenic plants decreased the total biomass and showed a hypersensitive phenotype subjecting to drought stress, while the overexpression (OE)-transgenic seedlings increased the drought stress tolerance compared with the wild-type (WT). ABA contents in-OE leaves were higher than those in WT, meanwhile,-OE lines also increased the activities of anti-oxidative enzyme including superoxide dismutase (SOD), peroxidase (POD), catalase (CAT), and expressions of stress/drought-related genes, i.e. dehydrin protein, LEA protein under drought stress.-RNAi lines showed an opposite tendency with the-OE plants. We therefore conclude thatgene plays an important role in controlling ABA level and drought stress resistance in rice.
gene; drought stress; abscisic acid;
2016-11-30;
2017-09-10;
2017-10-27.
10.3724/SP.J.1006.2018.00024
通信作者(Corresponding author):朱国辉, E-mail: ghzhu@scau.edu.cn
E-mail: 2214553605@qq.com
本研究由国家自然科学基金项目(31171466, 31570250)和国家重点基础研究发展计划(2012CB114306)资助。
This study was supported by the National Natural Science Foundation of China (31171466) and the National Basic Research Program of China (2012CB114306).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20171027.1757.020.html

