不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系
张海燕 段文学 解备涛 董顺旭 汪宝卿 史春余 张立明
不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系
张海燕1,2段文学2解备涛2董顺旭2汪宝卿2史春余1,*张立明3,*
1山东农业大学农学院, 山东泰安 271018;2山东省农业科学院作物研究所, 山东济南 250100;3山东省农业科学院, 山东济南 250100
在人工控水条件下, 以抗旱品种济薯21和不抗旱品种济紫薯1号为试验材料, 设置全生育期干旱胁迫(DS)、发根分枝期干旱胁迫(DS1)、蔓薯并长期干旱胁迫(DS2)、快速膨大期干旱胁迫(DS3) 4个处理, 全生育期正常灌水(WW)为对照, 研究其对甘薯内源激素及块根产量的影响。结果表明, 与对照相比, 2个品种不同年份的所有干旱胁迫处理的鲜薯和薯干产量均显著下降。其中, DS薯干产量减产幅度最大, 济薯21和济紫薯1号3年平均分别减产44.62%和56.21%; 其次是DS1, 减产32.03%和44.03%; 再次是DS2, 减产30.41%和39.39%; DS3的减产幅度最小, 为13.66%和17.88%。抗旱品种济薯21的减产幅度小于不抗旱品种济紫薯1号。干旱胁迫抑制了甘薯地上部生长及块根的形成和膨大, 两个品种的单株叶片数、蔓长、地上部干重、地下部干重和块根淀粉率, 与对照相比, 各时期均表现为, DS的减少幅度最大, 其次是DS1和DS2, DS3的减少幅度最小。不同时期干旱胁迫均引起叶片和块根中GA、IAA和ZR含量下降, ABA含量上升。地上部干重与叶片GA、IAA和ZR含量呈显著正相关, 与ABA含量呈显著负相关; 地下部干重与块根GA、IAA和ZR含量呈显著正相关, 与ABA含量呈显著负相关。总之, 不同时期干旱胁迫均导致甘薯产量下降, 且胁迫时间越早, 对甘薯内源激素和块根产量的影响越大, 发根分枝期是甘薯对水分最敏感的时期。
甘薯; 干旱胁迫; 内源激素; 产量
甘薯作为耐旱作物, 多数种植在土壤肥力差、养分贫瘠的丘陵旱薄地, 潜在的生产能力得不到充分发挥, 尤其是在半湿润偏旱地区[1-2]。干旱作为限制甘薯产量提高的主要因素, 在不同生育期表现的敏感程度不同[3]。已有研究表明, 干旱胁迫可造成甘薯块根产量不同程度的降低, 前期和中期缺水对甘薯产量影响较大、后期影响较小[4-7]。我国北方地区甘薯栽插适期一般在4月下旬至6月上旬, 正值干旱、少雨季节, 干旱成为影响甘薯发根缓苗和块根形成的主要因素之一, 但是不同时期干旱胁迫对甘薯块根产量影响的生理机制, 研究报道得较少, 且多采用盆栽、室内模拟和年份间降雨量的不同进行生物量和产量的比较研究[5-7]。
干旱条件下, 植物组织水势下降导致不同生育时期的诸多变化, 内源激素的变化是对水分亏缺的信号感知与传递, 各种内源激素以复杂的方式协调作用, 共同形成应对干旱胁迫环境的响应机制[8-10]。前人关于干旱胁迫条件下内源激素的研究多集中于小麦、玉米、棉花、高粱等农作物[11-14], 甘薯方面的研究报道较少, 唯有张明生等[15]研究认为水分胁迫下甘薯各品种叶片IAA、GA3、iPA和ZR含量下降, ABA含量显著增加, 另有研究认为ZR与块根形成有关, ABA与块根的膨大和物质积累有关[16-17]。在甘薯抗旱性机理方面, 前人研究多侧重于细胞膜透性、内源激素和抗氧化酶活性变化等生理生化指标与甘薯品种抗旱性的关系[18-20], 植株形态、生长势和抗脱水能力等与甘薯抗旱适应性的关系[21-22]以及水分胁迫对根系养分吸收、生长发育和干物质积累的影响[23-24], 且多在盆栽或模拟干旱胁迫条件下, 针对同一时期的某种生理响应。干旱胁迫条件下甘薯内源激素与产量的关系, 研究报道较少。内源激素作为调控作物生长发育的物质在干旱条件下起着极其重要的作用[25]。因此, 本试验结合前人的研究[3], 将甘薯大田生长过程划分为发根分枝期(栽插至插后30 d)、蔓薯并长期(插后30~60 d)和块根快速膨大期(插后60 d至收获) 3个时期, 在此基础上, 通过研究不同时期干旱胁迫对甘薯内源激素的影响及其与块根产量的关系, 期望阐明干旱胁迫导致甘薯减产的机理, 为甘薯抗旱高产栽培提供理论依据。
1 材料与方法
1.1 试验设计
在山东省农业科学院试验场防雨旱棚内种植山东省农业科学院作物研究所育成抗旱品种济薯21 (国品鉴甘薯2007001)和不抗旱品种济紫薯1号(国品鉴甘薯2015009)[26], 抗旱池(长6 m, 宽4 m, 深2 m)四周以水泥构建, 底部未封闭。2013年6月10日栽插, 10月9日收获; 2014年6月12日栽插, 10月11日收获; 2015年6月11日栽插, 10月10日收获, 生育期均为122 d。
设全生育期干旱胁迫(DS)、发根分枝期干旱胁迫(DS1)、蔓薯并长期干旱胁迫(DS2)、快速膨大期干旱胁迫(DS3) 4个处理, 全生育期正常灌水为对照(WW)(表1); 采用测墒补灌的方法, 保证抗旱池内土壤水分含量保持在处理的水分含量范围内。随机区组设计, 每处理重复3次。
1.2 农艺性状测定方法
栽后40 d开始田间标记代表性植株5株, 用于叶片数和蔓长的跟踪调查, 每隔20 d调查一次。调查后取样, 每处理选5株, 称量其地上部叶片、叶柄、茎蔓和地下部根系及块根的鲜重, 烘干后称取干重, 块根烘干样品留存用于淀粉率的测定。
收获时进行小区测产, 获得小区产量平均值, 计算鲜薯产量(kg hm–2), 每处理选5块代表性薯块, 切片、烘干, 称重, 计算干率。根据鲜薯产量和干率计算薯干产量(kg hm–2)。采用蒽酮比色法测定淀粉率[27], 按照薯块干物率换算成鲜薯淀粉率。
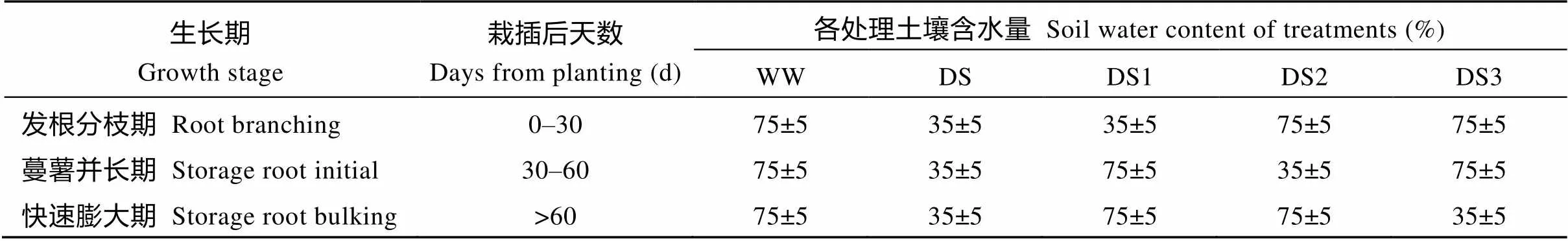
表1 不同时期的土壤相对含水量
WW为正常灌水对照, 其他为干旱胁迫处理, 胁迫时期分别是全生育期(DS)、发根分枝期(DS1)、蔓薯并长期(DS2)和快速膨大期(DS3)。
Well watered was conducted as the control (WW) and four drought treatments were stressed at whole growing period (DS), root branching stage (DS1), storage root initial stage (DS2), and storage root bulking stage (DS3).
1.3 内源激素测定方法
用酶联免疫吸附法(ELISA)测定内源激素(ABA、IAA、ZR、GA)含量, 试剂盒购自中国农业大学, 于田间选取代表性植株, 取顶部第4片展开叶和代表性薯块(四分纵切后, 取薯块中部切成1~2 g的小块), 液氮速冻后, 放入–80℃超低温冰箱保存, 用80%甲醇溶液(含1 mmol L–1二叔丁基对甲苯酚)提取内源激素用于测定。
1.4 数据处理与分析
用Microsoft Excel 2010处理数据及制图, 用DPS v8.01版数据处理系统进行方差分析和差异显著性检验。3年试验结果趋势基本一致, 方差分析结果表明, 各指标及其与年份间的互作不显著(< 0.05), 因此, 均采用3年的平均值进行分析。
2 结果与分析
2.1 不同时期干旱胁迫对甘薯产量和农艺性状的影响
2.1.1 块根产量 由表2可见, 与对照相比, 两个品种不同年份的所有干旱胁迫处理的薯干产量都下降。其中, DS减产幅度最大, 济薯21和济紫薯1号三年平均减产分别为44.62%和56.21%; 其次是DS1, 分别为32.03%和44.03%; 再次是DS2, 分别为30.41%和39.39%; DS3的减产幅度最小, 分别为13.66%和17.88%。干旱胁迫对鲜薯产量的影响与对薯干产量的影响趋势相同, 抗旱品种济薯21的减产幅度小于不抗旱品种济紫薯1号。干旱胁迫时间越早, 持续时间越长, 对块根产量的影响越大。
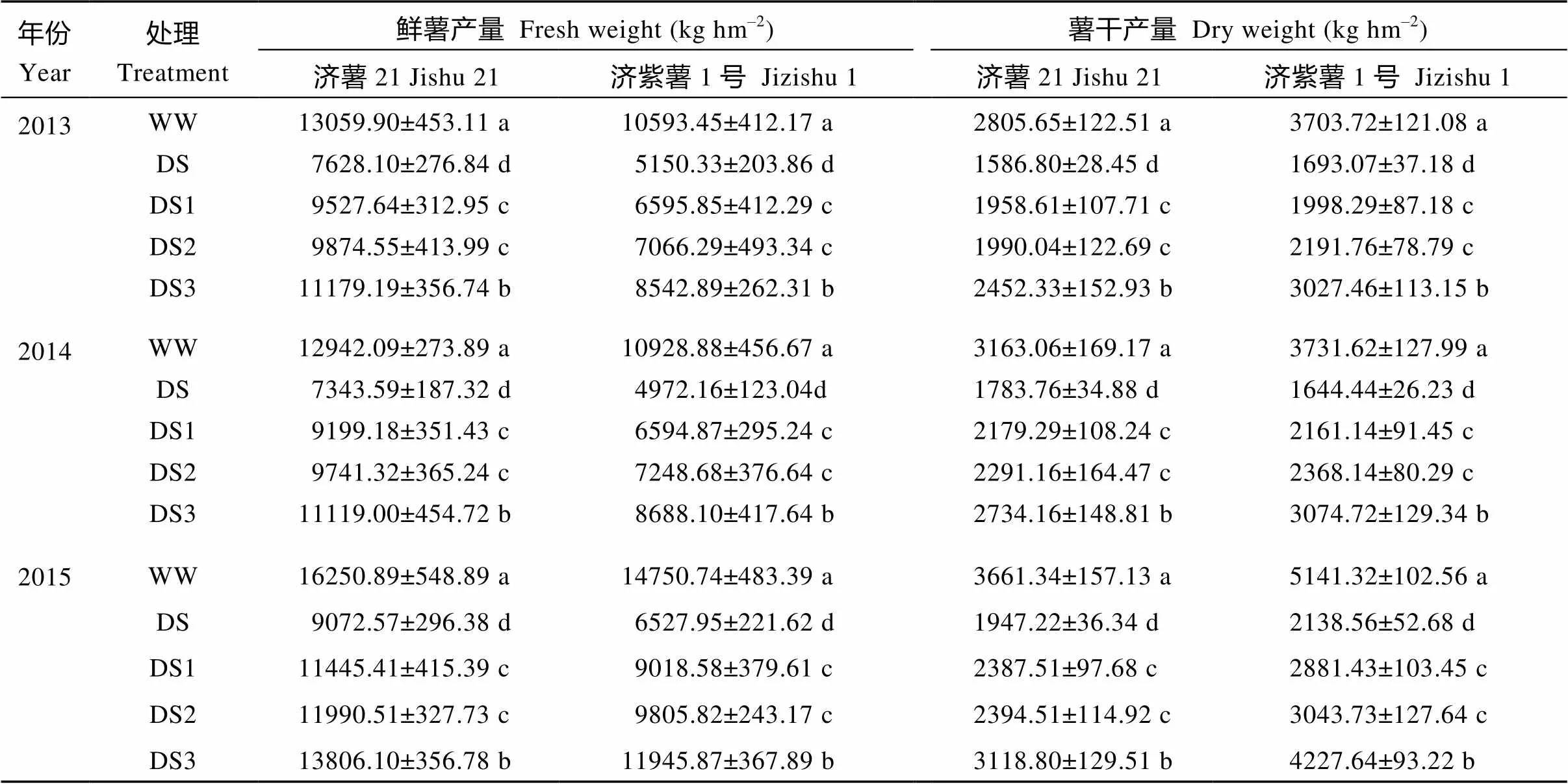
表2 干旱胁迫对甘薯鲜薯和薯干产量的影响
WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。数据为3次重复的平均值±标准差。同一年度, 数据后不同小写字母表示处理间差异达到5%显著水平。
WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Data are shown in mean ± standard deviation of three replicates. Values followed by a different letter within a column are significantly different at the 5% probability level.
2.1.2 单株叶片数 两个品种的单株叶片数, 与对照相比, 各时期均表现为, DS的减少幅度最大, 其次是DS1和DS2, DS3的减少幅度最小, 不抗旱品种济紫薯1号的减少幅度大于抗旱品种济薯21。栽后80~100 d, 抗旱品种济薯21, DS叶片数略有下降, DS1、DS2和DS3的叶片数虽有增长, 但最终数量低于对照; 不抗旱品种济紫薯1号所有干旱胁迫处理的叶片数均有下降, 且以DS的叶片数下降幅度最大, 而对照的叶片数缓慢增长(图1)。说明干旱胁迫抑制了甘薯叶片的生长, 导致生育中后期叶片生长缓慢甚至衰老脱落, 不抗旱品种叶片生长受干旱胁迫的抑制程度高于抗旱品种, 干旱胁迫时间越早, 对甘薯叶片数量的影响越大。
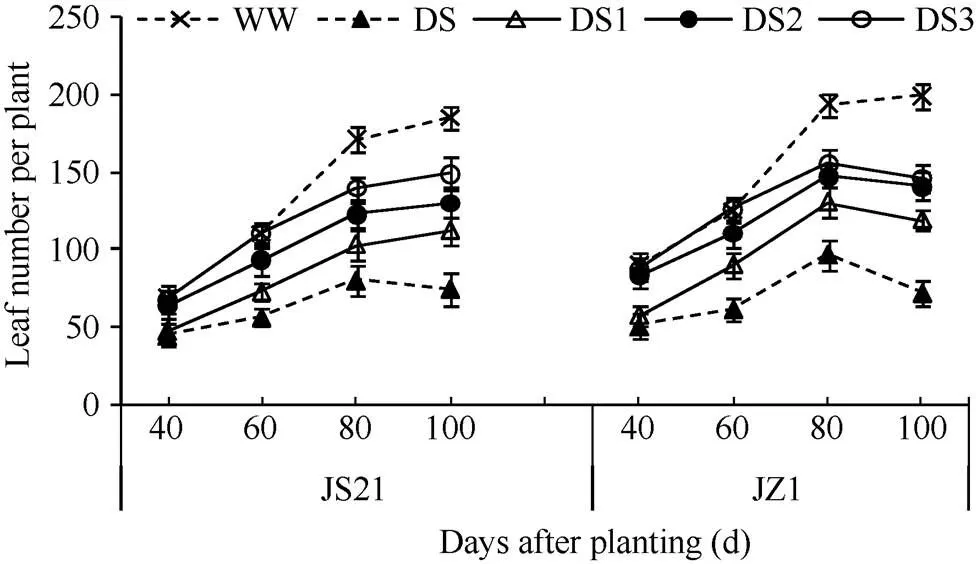
图1 干旱胁迫对甘薯单株叶片数的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
2.1.3 蔓长 栽后30~60 d是茎蔓快速生长的时期, 60 d以后茎蔓生长缓慢, 2个品种的蔓长与对照相比, 各时期均表现为, DS的减少幅度最大, 其次是DS1和DS2, DS3的减少幅度最小(图2)。说明干旱胁迫抑制了茎蔓的伸长生长, 且胁迫时间越早, 对茎蔓生长的影响越大, DS3在前期正常灌水的条件下已完成茎蔓快速生长, 因此后期胁迫对蔓长的影响最小。
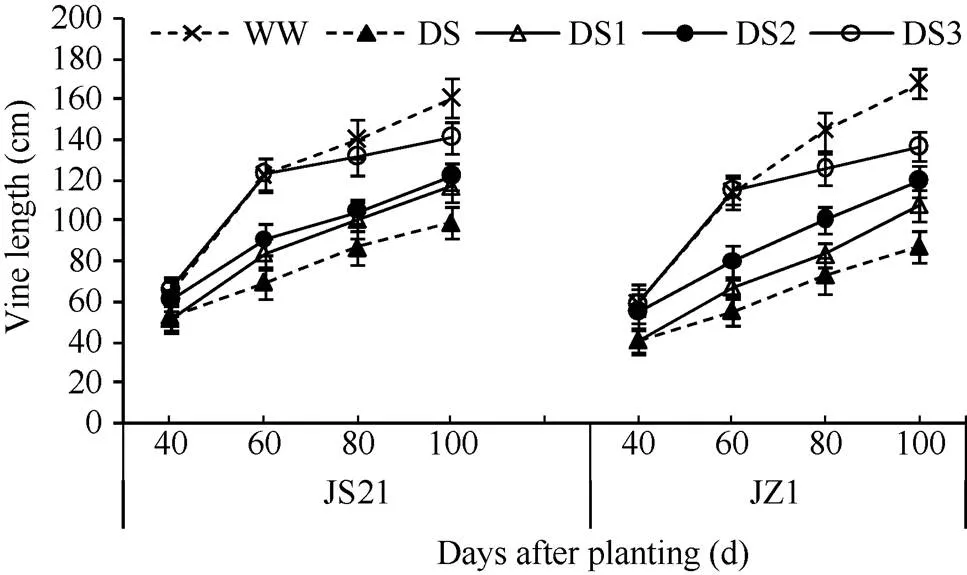
图2 干旱胁迫对甘薯蔓长的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
2.2 不同时期干旱胁迫对甘薯干物质积累和块根淀粉率的影响
2.2.1 地上部干重 全生育期各处理的地上部干重前期均快速增长, 后期缓慢增长。两品种的地上部干重与对照相比, 降低幅度表现为以DS最大, DS1和DS2其次, DS3最小。栽后100 d, 抗旱品种济薯21的DS、DS1、DS2、DS3分别降低58.10%、29.17%、15.96%和8.61%, 不抗旱品种济紫薯1号分别降低73.72%、37.43%、19.10%和9.22% (图3)。不抗旱品种济紫薯1号的DS处理在生育后期地上部干重呈降低的趋势。以上结果表明, 干旱胁迫抑制了甘薯地上部生长, 导致生物量下降, 且干旱胁迫时间越早, 影响越大, 长时间严重干旱还可引起植株早衰。
2.2.2 地下部干重 全生育期各处理的地下部干重均呈增长趋势, 60 d以后快速增长, 两品种的地下部干重与对照相比, 降幅以DS最大, DS1和DS2其次, DS3最小。栽后100 d, 抗旱品种济薯21的DS、DS1、DS2、DS3分别降低54.44%、32.67%、20.82%和8.62%, 不抗旱品种济紫薯1号分别降低63.51%、47.49%、28.22%和12.91% (图4)。以上结果表明, 干旱胁迫抑制了甘薯根系生长和块根膨大, 且胁迫时间越早, 持续时间越长对甘薯地下部生长的影响越大, 甘薯生育中后期是形成块根产量的关键时期, 各处理均呈快速增长的趋势。
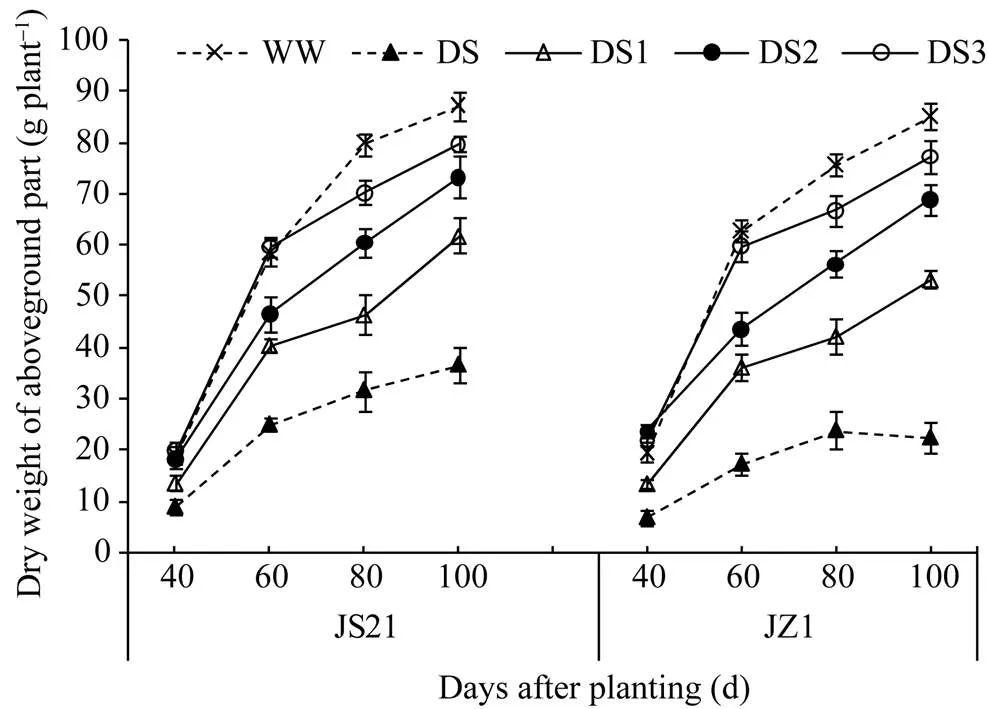
图3 干旱胁迫对甘薯地上部干重的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
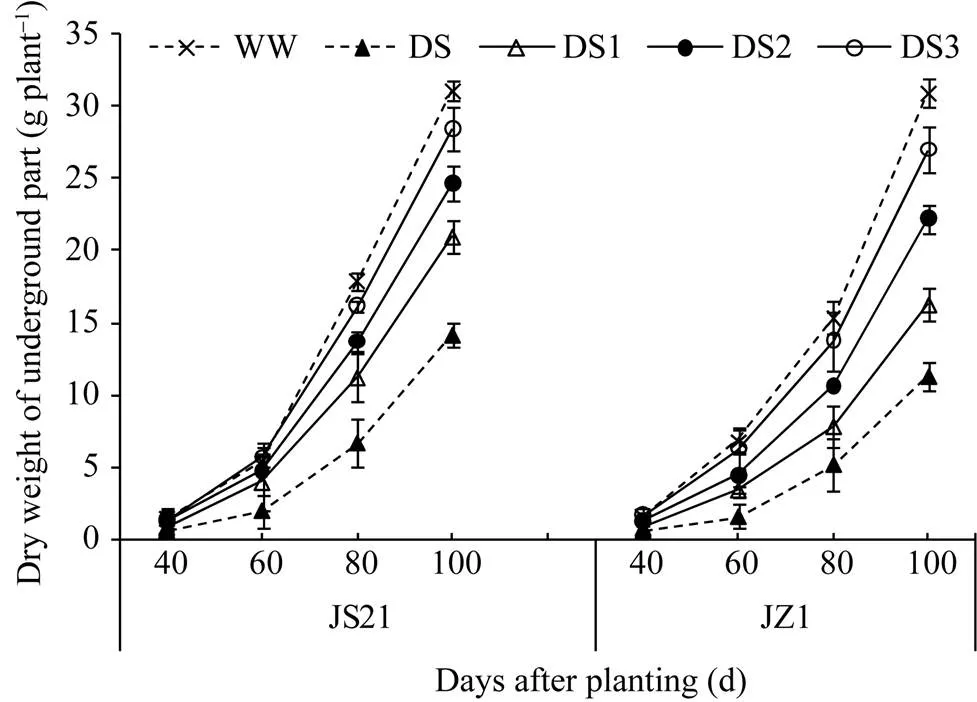
图4 干旱胁迫对甘薯地下部干重的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
2.2.3 块根淀粉率 随着块根膨大, 块根淀粉率呈直线增长。2个品种各时期的块根淀粉率均以对照最高, DS最低。与对照相比, 降幅以DS1最大, DS2其次, DS3最小, 不抗旱品种济紫薯1号大于抗旱品种济薯21 (图5)。说明干旱胁迫影响了块根的淀粉积累, 胁迫时间越早, 影响越大, 且早期胁迫对块根淀粉积累的抑制作用是不可修复的。因此, 在复水后, DS1的淀粉率仍然不能达到或超过DS2和DS3。
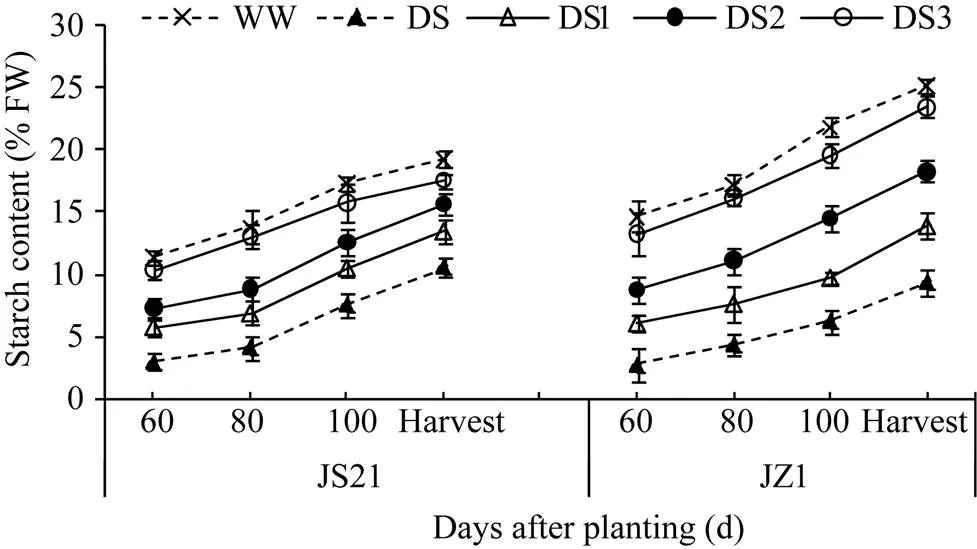
图5 干旱胁迫对甘薯块根淀粉率的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
2.3 干旱胁迫对甘薯内源激素的影响及其与干物质积累的关系
2.3.1 叶片内源激素及地上部干物质积累 由图6可见, 2个品种各处理叶片中GA、IAA、ZR和ABA含量的变化相似。栽植后40~100 d, 对照呈逐渐升高的趋势、且栽植后40~60 d升高速度最快, 而DS呈逐渐下降的趋势, 到块根快速膨大期, DS远低于对照。DS1和DS2的变化与对照相似, 总体上也是呈升高的趋势; 但是, 栽植后40~60 d, DS2呈下降趋势, DS1的升高幅度低于对照。DS3栽植后40~60 d的变化与对照一致, 含量快速上升; 栽植后60~100 d略有下降。与对照相比, 抗旱品种济薯21叶片中GA、IAA、ZR含量下降幅度小于不抗旱品种济紫薯1号(图6)。地上部干重与叶片GA、IAA和ZR含量呈显著正相关(表3)。说明不同时期干旱胁迫都会降低叶片内GA、IAA和ZR含量, 导致地上部干物质积累减少, 干旱胁迫时间越早, 影响越大, 虽然恢复灌水后叶片内GA、IAA和ZR含量也会恢复升高的趋势, 但是升高幅度仍然低于对照。
栽植后40~60 d, 各处理ABA含量均呈逐渐升高的趋势; DS1和DS2分别从栽植后60 d和80 d开始出现下降趋势。不同胁迫处理之间比较, DS最高, 其次是DS1、DS2和DS3, 对照最低(图6)。地上部干重与叶片ABA含量呈显著负相关(表3)。说明不同时期干旱胁迫都会提高叶片内ABA含量, 恢复灌水后一定时间ABA含量会降低, 这有利于维持叶片功能期, 保证持续的光合性能。
2.3.2 块根内源激素及地下部干物质积累 两个品种各处理的块根中GA、IAA、ZR和ABA含量随甘薯生长发育的变化趋势一致。栽后60 d至收获, 对照呈上升趋势, GA和IAA含量在80~100 d快速上升, ZR含量则在100 d至收获快速上升; DS呈缓慢上升, 上升幅度远低于对照; DS1、DS2的变化与对照相似, 总体上也呈升高趋势, 上升幅度低于对照, 高于DS; DS3则在60 d开始胁迫后, 块根GA和IAA的含量略有下降, ZR含量缓慢上升。与对照相比, 抗旱品种济薯21块根中GA、IAA和ZR含量的下降幅度小于不抗旱品种济紫薯1号(图7)。地下部干重与块根中GA、IAA和ZR含量呈显著正相关(表3)。说明不同时期干旱胁迫均会导致块根中GA、IAA和ZR含量下降, 影响干物质积累, 虽然恢复灌水后块根中GA、IAA和ZR含量也会恢复升高的趋势, 但是升高幅度仍然低于对照, 干旱胁迫时间越早, 收获期块根中GA、IAA和ZR含量越低。
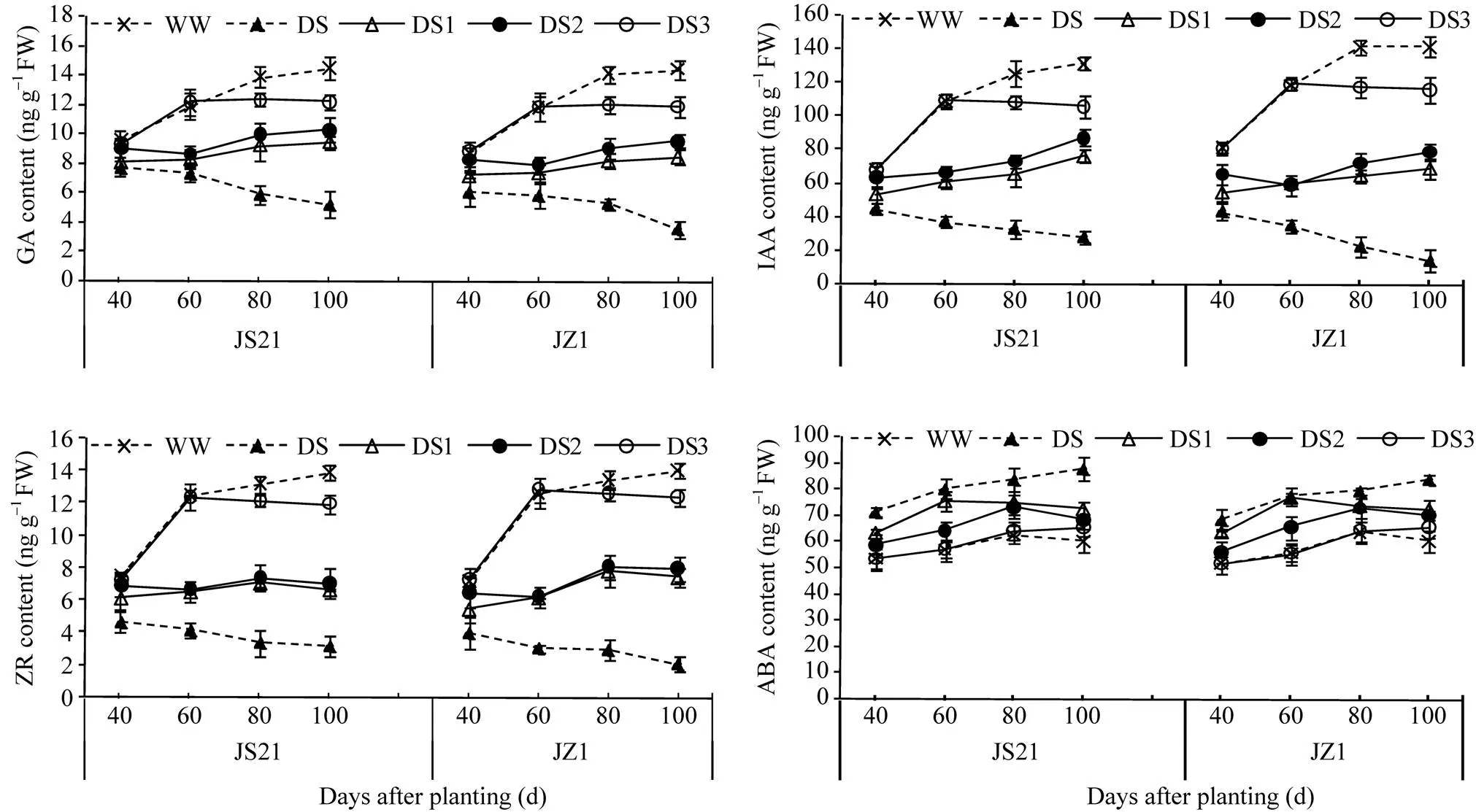
图6 干旱胁迫对甘薯叶片内源激素含量的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
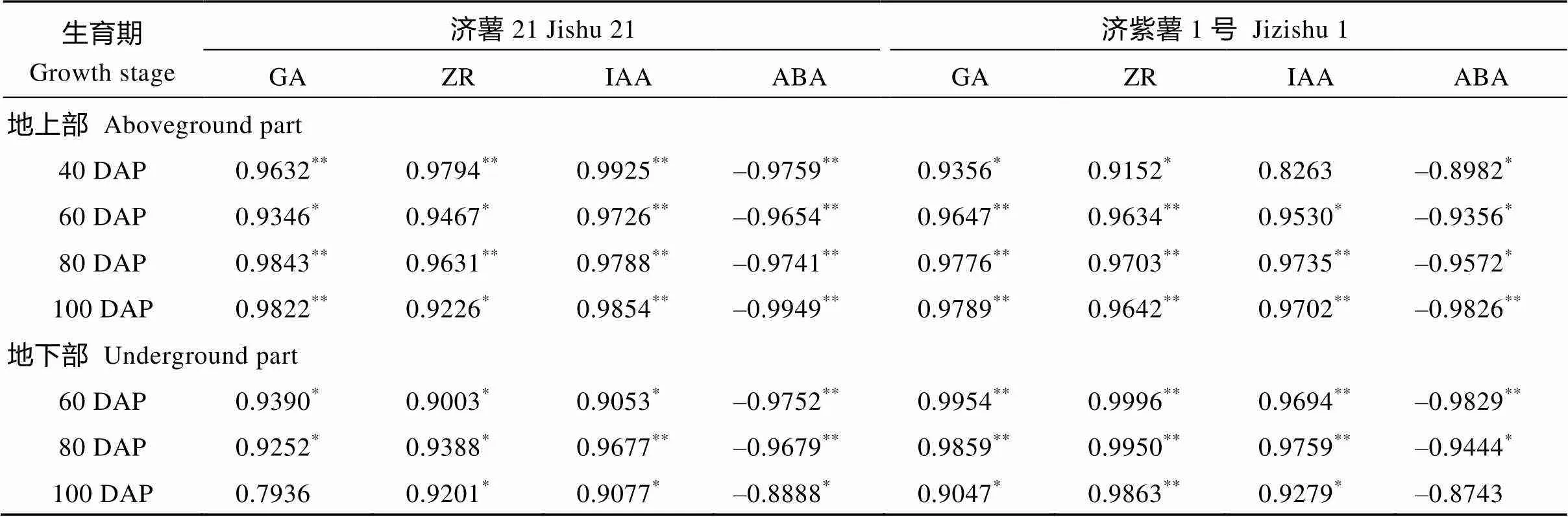
表3 地上部、地下部干重与叶片和块根内源激素含量的相关系数
DAP: 栽植后天数。*和**分别表示在< 0.05和< 0.01水平显著。
DAP: days after planting.*and**indicate significance at< 0.05 and< 0.01, respectively.
对照的ABA含量呈先降后升趋势, 80 d最低; DS1、DS2的变化与对照相似, 100 d最低; DS 和DS3处理则呈逐渐上升趋势, 但DS的上升幅度远大于DS3, 至收获期远高于DS3。地下部干重与块根中ABA含量呈显著负相关(表3)。说明不同时期干旱胁迫都会提高块根中ABA含量, 恢复灌水后一定时间ABA含量会降低, 在所有干旱胁迫处理中, DS3处理块根中ABA含量最低, 说明干旱胁迫对其影响最小, 这有利于保证块根的正常膨大。
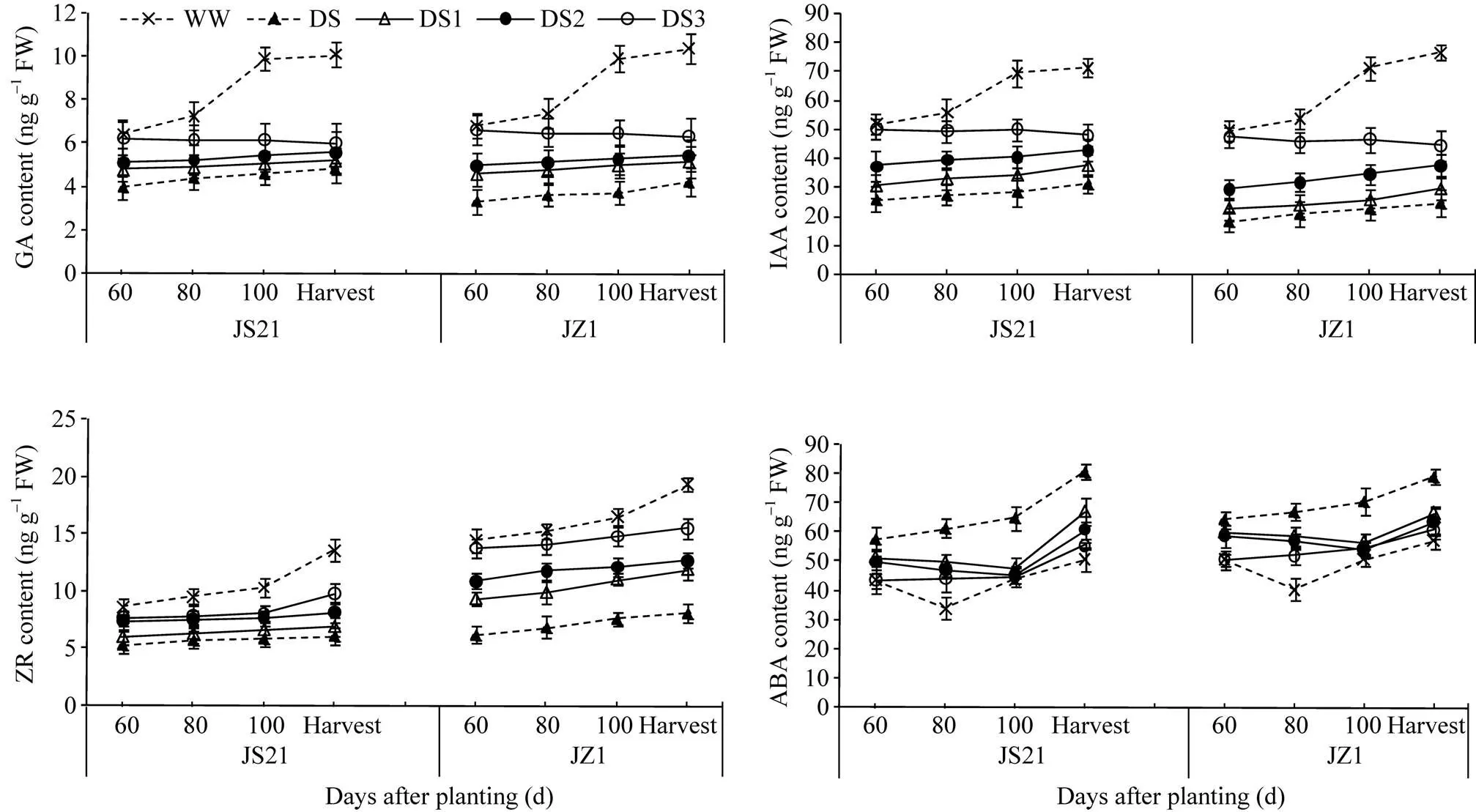
图7 干旱胁迫对甘薯块根内源激素含量的影响
JS21: 济薯21; JZ1: 济紫薯1号。WW: 对照, 正常灌水; DS: 全生育期干旱胁迫; DS1: 发根分枝期干旱胁迫; DS2: 蔓薯并长期干旱胁迫; DS3: 快速膨大期干旱胁迫。误差线表示3次重复的标准差。
JS21: Jishu 21; JZ1: Jizishu 1. WW: control, well watered; DS: drought stress during the whole growth period; DS1: drought stress during root branching stage; DS2: drought stress during intermediate stage (storage root initiation); DS3: drought stress during final stage (storage root bulking). Error bars show the standard deviations of three replicates.
3 讨论
3.1 不同时期干旱胁迫对甘薯产量的影响
甘薯作为丘陵旱薄地的首选作物, 水源不足限制了产量潜力的发挥。前人研究认为前期干旱甘薯总生物量减少约50%, 中期干旱造成地上和地下生物量分别减少38.4%和31.1%, 后期干旱使地上和地下均减少10%左右[6]。本研究结果表明, 干旱胁迫条件下, 抗旱品种和不抗旱品种的鲜薯和薯干产量均显著下降, 且干旱胁迫时间越早, 持续时间越长, 产量下降幅度越大, 不抗旱品种的减产幅度大于抗旱品种。发根分枝期干旱胁迫减产幅度最大, 该时期是甘薯对水分需求最敏感的时期, 生产中应加强水分管理, 避免过度干旱造成减产。
前人研究认为, 甘薯地上部的株型、叶面积指数、主蔓长等与抗旱性关系密切[21], 收获期的相对茎叶重与薯块产量关系密切[28]。本研究发现, 干旱胁迫条件下, 抗旱品种和不抗旱品种的单株叶片数、蔓长、干物质积累和块根淀粉率均不同程度下降, 且干旱胁迫时间越早下降幅度越大; 不抗旱品种的单株叶片数和地上部干重在生育后期呈现显著下降趋势, 而抗旱品种地上部干重在生育后期仍然能缓慢上升, 说明不抗旱品种在干旱胁迫条件下的自身修复能力远不及抗旱品种, 因此受干旱胁迫的抑制程度高于抗旱品种; 发根分枝期和蔓薯并长期(栽后60 d)是叶片数、茎蔓长和地上部干重增加最快的时期, 是为块根产量打基础的时期, 应保证其充足的水分供应, 否则叶片和块根形成数量少, 源和库的形成均受影响, 即使在中、后期水分得到满足, 源端光合产物产生少, 库端也不能容纳较多的同化物输入, 最终导致减产。因此, 本研究认为, 发根分枝期和蔓薯并长期是甘薯水分供应的两个关键时期;块根快速膨大期是块根发育的高峰期, 严重干旱导致土壤机械阻力增大, 限制了块根的膨大, 块根淀粉的积累速率也随之下降, 最终导致产量和品质的下降。
3.2 干旱胁迫对甘薯叶片内源激素含量的影响及其与地上部干物质积累的关系
茎和叶片是干物质生产的源, 是获得高产的基础, 而叶片内源激素协调作用是影响叶片生长、发育和生理功能的主要内在因素。赵春江等[29]研究表明, GA可促进茎叶生长, IAA则具有双重功效, 前期促进生长, 后期加速衰老, GA和CTK均可延缓叶片衰老, ABA促进衰老。段留生等[30]认为CTK作为一种引导同化物移动的重要信号, 诱导营养物向其移动, 维持或改变植物源库关系。另有研究表明, ABA可促进同化物向库的运输[31-32], 同时作为一种逆境应激激素, 干旱胁迫条件下可促使叶片气孔关闭, 减少水分蒸腾[20,33-35]。本研究中, 地上部干重与叶片GA、IAA和ZR含量呈显著正相关, 说明干旱胁迫条件下, 叶片GA、IAA和ZR含量的下降导致叶片和茎蔓生长减弱, 光合作用下降, 进而干物质积累下降; 而与叶片ABA含量呈显著负相关, 说明逆境条件下, ABA含量的增加使细胞代谢变缓, 茎叶生长缓慢, 干物质积累降低, 从而减少水分过渡消耗, 是抵御干旱胁迫的应激反应; 另外, 与对照相比, 抗旱品种叶片GA、IAA和ZR含量的下降幅度小于不抗旱品种, 说明干旱胁迫条件下, 抗旱品种可维持较高水平的GA、IAA和ZR含量, 延长叶片功能期, 提高抗旱性。
3.3 干旱胁迫对甘薯块根内源激素含量的影响及其与地下部干物质积累的关系
作物贮藏器官的形成和膨大是多种内源激素协同作用的结果, IAA、GA和CTK均有强化库器官活性、定向诱导同化物向之运输的作用[36], ABA可促进碳水化合物向甘薯块根内的运转和积累, CTK和ABA含量在甘薯块根形成和膨大方面起着关键作用, 与块根产量呈显著正相关[17,37]。另有研究认为, GA含量的减少是马铃薯结薯的重要条件[38]。ABA含量与马铃薯块茎的增大呈显著正相关[39]。莲藕膨大过程中ABA 含量不断升高, CTK含量不断下降, GA 和IAA含量则先升高后下降[40]。本研究中, 地下部干重与块根GA、IAA和ZR含量呈显著正相关, 结合前人研究[36,38], 认为GA含量的下降影响了块根的形成, IAA的降低限制了光合产物向块根的运输, ZR含量的下降影响块根的形成和膨大以及同化物向库器官的运输; 与对照相比, 不抗旱品种块根中GA、IAA和ZR含量下降幅度大于抗旱品种, 说明干旱胁迫条件下, 不抗旱品种块根激素水平较低, 影响块根的膨大, 这或许是导致不抗旱品种减产幅度大的主要原因之一。前人研究认为[16, 37], ABA可促进光合产物向块根运输, 促进块根膨大, 在不定根转化成块根和块根膨大方面起着关键作用, 本研究中, 所有处理的地下部干重和块根ABA含量均在生育后期达到最大, 说明ABA可促进干物质的积累, 这与前人的研究结果一致; 而在干旱胁迫条件下, 不同处理间块根ABA含量与地下部干重呈显著负相关关系, 且胁迫时间越早, 持续时间越长, ABA含量越高, 地下部干重越低, 说明干旱胁迫条件下, ABA作为一种信号物质, 由根系迅速感知胁迫信号, 以ABA 的形式将干旱信息传递到地上部, 造成植株代谢活动减弱, 从而在形态和生理等方面发生与胁迫相适应的变化, 借以提高自身的抗旱力, 地下部干重的下降正是对干旱胁迫的适应性反应, 且品种抗旱性越强, 地下部干重下降的幅度越小。
本研究中, 干旱胁迫引起叶片和块根GA、IAA和ZR含量下降, ABA含量上升, 且胁迫时间越早, 影响越大。全生育期干旱胁迫的叶片GA、IAA和ZR的含量从栽后40 d开始一直呈下降趋势, 块根中GA、IAA和ZR的含量在全生育期虽呈缓慢上升趋势, 但一直处在较低的水平, 这或许是造成产量最低的原因之一。发根分枝期和蔓薯并长期干旱胁迫的叶片和块根中GA、ZR和IAA含量复水后虽有缓慢上升, 但上升幅度远低于正常灌水处理, 认为早期干旱胁迫导致叶片和块根内源激素水平变化无法在复水后得到有效修复。快速膨大期干旱胁迫的叶片和块根中内源激素含量与对照相比变化不大, 认为栽后60 d, 叶片和块根内源激素含量已达到较高水平, 足以维持后期的生长, 这可能是此时期减产最小的原因之一。
4 结论
不同生育时期干旱胁迫均导致甘薯产量下降, 其主要原因是干旱影响内源激素的合成, 抑制甘薯叶片、茎蔓和根系的生长。早期干旱胁迫导致的内源激素水平变化(GA、ZR和IAA含量降低、ABA含量升高)无法在复水后得到有效修复; 而甘薯进入块根快速膨大期已有较高的内源GA、ZR和IAA水平和较低的ABA水平, 干旱胁迫对其影响较小。因此, 干旱胁迫时间越早, 对甘薯产量影响越大, 发根分枝期是甘薯块根产量对水分最敏感的时期。
[1] 张宪初, 王胜亮, 吕军杰, 张春强. 旱地水分田供需状况及增产措施研究. 干旱地区农业研究, 1999, 17(4): 93–97Zhang X C, Wang S L, Lyu J J, Zhang C Q. Research on field water supply and requirement condition of dryland sweet potato and yield-increasing method., 1999, 17(4): 93–97 (in Chinese with English abstract)
[2] Lewthwaite S L, Triggs C M. Sweetpotato cultivar response to prolonged drought., 2012, 42: 1–10
[3] 江苏省农业科学院, 山东省农业科学院. 中国甘薯栽培学. 上海: 上海科学技术出版社, 1984. pp 51–56 Jiangsu Academy of Agricultural Sciences, Shandong Academy of Agricultural Sciences. Chinese Sweetpotato Cultivation. Shanghai: Shanghai Scientific and Technical Publishers, 1984. pp 51–56 (in Chinese)
[4] 张天年, 吴旭银, 武宝悦, 王文颇. 不同土壤含水量对甘薯生长的影响. 河北农业技术师范学院学报, 1993, 7(3): 11–17 Zhang T N, Wu X Y, Wu B Y, Wang W P. The influence of different soil water content on growth of sweet potato., 1993, 7(3): 11–17 (in Chinese with English abstract)
[5] 肖利贞. 土壤干旱对甘薯生育及产量的影响. 华北农学报, 1995, 10(2) : 106–110 Xiao L Z. Influence of soil aridity on the growth, development and yield of sweet potato., 1995, 10(2): 106–110 (in Chinese with English abstract)
[6] 李长志, 李欢, 刘庆, 史衍玺.不同生长时期干旱胁迫甘薯根系生长及荧光生理的特性比较.植物营养与肥料学报, 2016, 22: 511–517 Li C Z, Li H, Liu Q, Shi Y X. Comparison of root development and fluorescent physiological characteristics of sweet potato exposure to drought stress in different growth stages., 2016, 22: 511–517 (in Chinese with English abstract)
[7] 郑海青, 王玉泉. 闽东南甘薯生产与气象条件关系的研究. 中国农业气象, 1996, 17(3): 14–18 Zheng H Q, Wang Y Q. Study on the relation between the production of sweet potato and meteorological conditions in southeast of Fujian., 1996, 17(3): 14–18 (in Chinese with English abstract)
[8] Velikova V, Yordanov I, Tsonev T. Plant responses to drought, acclimation, and stress tolerance., 2000, 38: 171–186
[9] Shao H B, Chu L Y, Jaleel C A, Manlvannan P, Panneerselvam R, Shao M A. Understanding water deficit stress-induced changes in the basic metabolism of higher plants-biotechnologically and sustainably improving agriculture and ecoenvironment in arid regions of the globe., 2009, 29: 131–151
[10] Pustovoitova T N. Changes in the levels of IAA and ABA in cucumber leaves under progressive soil drought., 2004, 51: 513–517
[11] Xie Z J, Jiang D, Jiang D, Cao W X, Dai T B, Jing Q. Relationships of endogenous plant hormones to accumulation of grain protein and starch in winter wheat under different post-anthesis soil water statuses., 2003, 41: 117–127
[12] 徐云姬, 顾道健, 张博博, 张耗, 王志琴, 杨建昌. 玉米果穗不同部位籽粒激素含量及其与胚乳发育和籽粒灌浆的关系. 作物学报, 2013, 39: 1452–1461 Xu Y J, Gu D J, Zhang B B, Zhang H, Wang Z Q, Yang J C. Hormone contents in kernels at different positions on an ear and their relationship with endosperm development and kernel filling in maize., 2013, 39: 1452–1461 (in Chinese with English abstract)
[13] 罗宏海, 韩焕勇, 张亚黎, 张旺锋. 干旱和复水对膜下滴灌棉花根系及叶片内源激素含量的影响. 应用生态学报, 2013, 24: 1009-1016 Luo H H, Han H Y, Zhang Y L, Zhang W F. Effects of drought and re-watering on endogenous hormone contents of cotton roots and leaves under drip irrigation with mulch., 2013, 24: 1009–1016 (in Chinese with English abstract)
[14] 周宇飞, 王德权, 陆樟镳, 王娜, 王艺陶, 李丰先, 许文娟, 黄瑞冬. 干旱胁迫对持绿性高粱光合特性和内源激素ABA、CTK 含量的影响. 中国农业科学, 2014, 47: 655–663 Zhou Y F, Wang D Q, Lu Z B, Wang N, Wang Y T, Li F X, Xu W J, Huang R D. Effects of drought stress on photosynthetic characteristics and endogenous hormone ABA and CTK contents in green-stayed sorghum., 2014, 47: 655–663 (in Chinese with English abstract)
[15] 张明生, 谢波, 谈峰. 水分胁迫下甘薯内源激素的变化与品种抗旱性的关系. 中国农业科学, 2002, 35: 498–501 Zhang M S, Xie B, Tan F. Relationship between changes on endogenous hormone of sweetpotato under water stress and drought resistance., 2002, 35: 498–501 (in Chinese with English abstract)
[16] 王庆美, 张立明, 王振林. 甘薯内源激素变化与块根形成膨大的关系. 中国农业科学, 2005, 38: 2414–2420 Wang Q M, Zhang L M, Wang Z L. Formation and thickening of tuberous roots in relation to the endogenous hormone concentrations in sweetpotato., 2005, 38: 2414–2420 (in Chinese with English abstract)
[17] Nakatani M, Komeichi M. Changes in the endogenous level of zeatin riboside, abscisic acid and indole acetic acid during formation and thickening of tuberous roots in sweetpotato., 1991, 60: 91–100
[18] 钮福祥, 华希新, 郭小丁, 邬景禹, 李洪民, 丁成伟. 甘薯品种抗旱性生理指标及其综合评价初探. 作物学报, 1996, 22: 392–398 Niu F X, Hua X X, Guo X D, Wu J Y, Li H M, Ding C W. Studies on several physiological indexes of the drought resistance of sweet potato and its comprehensive evaluation., 1996, 22: 392–398 (in Chinese with English abstract)
[19] 陈京. 抗旱性不同的甘薯品种对渗透胁迫的生理响应. 作物学报, 1999, 25: 232–236 Chen J. Physiological response for different drought resistance of sweet potato under osmotic stress., 1999, 25: 232–236 (in Chinese with English abstract)
[20] Zhang M S, Xie B, Tan F. Relationship between changes of endogenous hormone in sweet potato under water stress and variety drought-resistance., 2002, 1: 626–630
[21] 张明生, 谢波, 戚金亮, 谈锋, 张启堂, 杨永华.甘薯植株形态、生长势和产量与品种抗旱性的关系. 热带作物学报, 2006, 27(1): 39–43 Zhang M S, Xie B, Qi J L, Tan F, Zhang Q T, Yang Y H. Relationship of drought resistance of sweet potato with its plant type, growth vigour and yield under water stress., 2006, 27(1): 39–43 (in Chinese with English abstract)
[22] 张明生, 彭忠华, 谢波, 谈锋, 张启堂, 付玉凡, 杨春贤, 杨永华. 甘薯离体叶片失水速率及渗透调节物质与品种抗旱性的关系. 中国农业科学, 2004, 37: 152–156Zhang M S, Peng Z H, Xie B, Tan F, Zhang Q T, Fu Y F, Yang C X, Yang Y H. Relationship between water loss rate of cutting leaves and osmotic regulators under water stress and drought resistance in sweet potato., 2004, 37: 152–156 (in Chinese with English abstract)
[23] Kim S H, Mizuno K, Fujimural T. Regulated expression of ADP lucose pyrophosphorylase and chalcone synthase during root development in sweetpotato., 2002, 38: 173–179
[24] Chowdhury S R, Singh R, Kundu D K, Antony E, Thakur A K, Verma H N. Growth, dry matter and yield of sweet potato (L.) as influence by soil mechanical impedance and mineral nutrition under different irrigation regimes., 2002, 16: 25–29
[25] 李冀南, 李朴芳, 孔海燕, 熊俊兰, 王绍明, 熊友才. 干旱胁迫下植物根源化学信号研究进展. 生态学报, 2011, 31: 2610–2620 Li J N, Li P F, Kong H Y, Xiong J L, Wang S M, Xiong Y C. Current progress in eco-physiology of root-sourced chemical signal in plant under drought stress., 2011, 31: 2610–2620 (in Chinese with English abstract)
[26] 袁振, 汪宝卿, 姜瑶, 解备涛, 董顺旭, 张海燕, 段文学, 王庆美, 张立明. 甘薯耐旱性品种苗期筛选及耐旱性指标研究. 山东农业科学, 2015, 47(3): 22–26 Yuan Z, Wang B Q, Jiang Y, Xie B T, Dong S X, Zhang H Y, Duan W X, Wang Q M, Zhang L M. Seedling screening of drought resistance varietiesof sweetpotato and drought resistance index research., 2015, 47(3): 22–26 (in Chinese with English abstract)
[27] 陈建勋, 王晓峰. 植物生理学实验指导(第2版). 广州: 华南理工大学出版社, 2006. pp 64–66 Chen J X, Wang X F. Guidance of Plant Physiological Experiment, 2nd edn. Guangzhou: South China University of Technology Publishers, 2006. pp 64–66 (in Chinese)
[28] 谈锋, 张启堂, 陈京, 李坤培. 甘薯品种抗旱适应性的数量分析. 作物学报, 1991, 17: 394–398Tan F, Zhang Q T, Chen J, Li K P. Quantitative analysis of adaptability of drought resistance in sweet potato cultivars., 1991, 17: 394–398 (in Chinese with English abstract)
[29] 赵春江, 康书江, 王纪华, 郭晓维, 李鸿祥. 植物内源激素对小麦叶片衰老的调控机理研究. 华北农学报, 2000, 15(2): 53–56 Zhao C J, Kang S J, Wang J H, Guo X W, Li H X. Hormone regulation mechanism on wheat leaf aging., 2000, 15(2): 53–56 (in Chinese with English abstract)
[30] 段留生, 田晓莉. 作物化学控制原理与技术. 北京: 中国农业大学出版社, 2005. pp 40–45 Duan L S, Tian X L. Crop Chemical Regulation Mechanism and Technique. Beijing: China Agricultural University Press, 2005. pp 40–45 (in Chinese)
[31] Schussler J R, Brenner M L, Brun W A. Relationship of endogenous abscisic acid to sucrose level and seed growth rate of soybeans., 1991, 96: 1308–1313
[32] Lee B T, Martin P, Bangerth F. Phytohormone levels in the florets of a single wheat spikelet during preanthesis development relationships to grain set., 1988, 39: 927–933
[33] Jackson M B. Positive and negative messages from roots induce foliar desiccation and stomatal closure inflooded pea plants., 1983, 34: 483–506
[34] Guan L Q, Scandalios J G. Effect of the plant growth regulator abscisic acid high osmoticum on the developmental expression of the maize catalase genes., 1998, 104: 413–422
[35] 沈元月, 黄从林, 张秀海, 曹呜庆. 植物抗旱的分子机制研究. 中国生态农业学报, 2002, 10(1): 30–34 Shen Y Y, Huang C L, Zhang X H, Cao M Q. Plant drought tolerance molecular mechanism., 2002, 10(1): 30–34 (in Chinese with English abstract)
[36] 李卓杰. 植物激素及其应用. 广州: 中山大学出版社, 1993. pp 10–56 Li Z J. Plant Hormone and Application. Guangzhou: Zhongshan University Press, 1993. pp 10–56 (in Chinese)
[37] 张立明, 王庆美, 何钟佩. 脱毒和生长调节剂对甘薯内源激素含量及块根产量的影响. 中国农业科学, 2007, 40: 70–77 Zhang L M, Wang Q M, He Z P. Effects of virus-eliminating and plant growth regulators on the endogenous level of hormone and tuber root yield of sweetpotato., 2007, 40: 70–77 (in Chinese with English abstract)
[38] Xu X, Lammeren A M V, Vermeer E, Vreuqdenhil D. The role of gibberellin abscisic acid, and sucrose in the regulation of potato tuber formation in vitro., 1998, 117: 575–584
[39] 刘梦云, 毛雪飞, 门福义, 蒙美莲, 胡志全.马铃薯块茎内源激素变化与块茎增大生长的相关规律. 华北农学报, 1997, 12(2): 86–92 Lui M Y, Mao X F, Men F Y, Meng M L, Hu Z Q. Correlation law between the change of intrinsic hormones of potato tuber and growth of the tuber., 1997, 12(2): 86–92 (in Chinese with English abstract)
[40] 李良俊, 潘恩超, 许超, 叶枝荣, 曹碚生. 莲藕膨大过程中内源激素、水杨酸和多胺含量的变化. 园艺学报, 2006, 33: 1106–1108 Li L J, Pan E C, Xu C, Ye Z R, Cao B S. Changes of endogenous hormones, polyamines and salicylic acid content during rhizome development ofGaertn., 2006, 33: 1106–1108 (in Chinese with English abstract)
Effects of Drought Stress at Different Growth Stages on Endogenous Hormones and Its Relationship with Storage Root Yield in Sweetpotato
ZHANG Hai-Yan1,2, DUAN Wen-Xue2, XIE Bei-Tao2, DONG Shun-Xu2, WANG Bao-Qing2, SHI Chun-Yu1,*, and ZHANG Li-Ming3,*
1Agronomy College, Shandong Agricultural University, Tai’an 271018, Shandong, China;2Crop Research Institute of Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China;3Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China
Field experiments were conducted under a rain exclusion shelter using two sweetpotato ((L.) Lam) cultivars (Jishu 21, drought-tolerant, and Jizishu 1, drought-sensitive) with four drought stress treatments during the whole growth period (DS), root branching stage (DS1), the intermediate stage (storage root initiation) (DS2), and the final stage (storage root bulking) (DS3). A separate well watered experiment was as a control (WW). Compared with the control, the fresh and dry weight of two cultivars in all treatments decreased significantly in three years. The dry weight of DS treatment had the highest decrease, with an average of 44.62% and 56.21% for Jishu 21 and Jizishu 1, respectively. The impact of DS1 was the second, with an average decrease of 32.03% and 44.03% for Jishu 21 and Jizishu 1, respectively, followed by DS2, with an average decrease of 30.41% and 39.39%, respectively. The impact of DS3 was the lowest, with an average decrease of 13.66% and 17.88%, respectively. The impact of drought stress on dry weight of Jishu 21 was lower than that of Jizishu 1. The drought stress significantly inhibited the growth of aboveground part, and the formation and bulking of storage roots. Number of leaves per plant, vine length, dry weight of aboveground and underground parts, and starch content were decreased under drought stress, compared with the control. DS had the highest impact, followed by DS1 and DS2; DS3 had the lowest impact. GA, IAA, and ZR contents in leaves and roots of both cultivars decreased, while ABA content increased. There were significant positive correlations between dry weight of aboveground part and GA, IAA, and ZR contents in leaves, dry weight of underground part and GA, IAA, and ZR contents in storage roots. However, ABA content in leaves and storage roots was negatively correlated with dry weight of aboveground part and underground part, respectively. In summary, drought stress applied during different growth stages reduced the yield of fresh and dry roots. The earlier the application of drought stress, the greater influence on levels of endogenous hormones and storage root yields. Root branching stage of sweetpotato is most sensitive to drought stress.
sweetpotato; drought stress; endogenous hormone; yield
2017-04-23;
2017-09-10;
2017-10-27.
10.3724/SP.J.1006.2018.00126
通信作者(Corresponding authors): 史春余, E-mail: scyu@sdau.edu.cn; 张立明, E-mail: zhanglm11@sina.com
E-mail: zhang_haiyan02@163.com
本研究由国家现代农业产业技术体系建设专项(CARS-10-B08), 山东省薯类产业创新团队项目(SDAIT-16-09), 山东省重点研发计划项目(2016GNC111002)和农业部黄淮海薯类科学观测实验站资助。
This study was supported by the China Agriculture Research System (CARS-10- B08), Shandong Province Modern Agricultural Technology System Tubers and Root Crops Innovation Team (SDAIT-16-09), Shandong Province Key Research and Development Project (2016GNC111002), and Scientific Observing and Experimental Station of Tubers and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture, P. R. China.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20171027.1743.016.html

