基于90K芯片标记的小麦芒长QTL定位
张传量,简俊涛,冯洁,崔紫霞,许小宛,孙道杰
(1西北农林科技大学农学院,陕西杨凌 712100;2南阳市农业科学院,河南南阳 473000)
0 引言
【研究意义】小麦的芒作为变态叶,具有一定的光合作用,是植物进化和适应自然环境的结果,也可以作为区分不同小麦品种和基因定位的重要形态标记[1]。在小麦灌浆后期,当旗叶已经开始衰老且其光合能力下降时,芒仍能保持较高的光合速率,其光合产物成为小麦籽粒同化物来源的重要补充[2-5]。芒的表层加厚、厚壁组织和疏导组织发达具有明显的抗旱性结构特征[2]。芒具有表皮坚硬倒钩状硅质毛,不利于害虫的飞落, 降低害虫在麦穗上产卵的机会, 具有一定的抗虫性。小麦芒对增产也具有重要意义,有芒的小麦品种通常可比无芒品种增产10%以上[6-7]。因此,对芒长性状进行定位分析,获取与性状紧密连锁或共分离的分子标记,可为分子育种提供依据。【前人研究进展】研究表明,芒性状属于数量性状,有4个主要的抑制基因(B1、B2、B3、Hd)和1个促芒基因A以及部分微效基因共同决定芒的发育,芒的抑制作用B1>B2>B3>Hd,Hd是引起勾芒产生的原因[5,8]。B1被定位在5AL的末端,与分子标记Xgwm291紧密连锁[5,9];LI等[10]利用硬粒小麦的双端体材料将B2定位于 6BL-5和 6BL-6缺失片段末端之间,与分子标记Xwmc539、Xgpw5130和Xwmc748邻近;SOURDILLE等[8]把Hd定位在4AS的Xfba78标记附近。近期,宫希等[11]研究发现,抑芒基因B1与5AL上的分子标记wpt-1038 紧密连锁,勾芒基因Hd与4AS上的标记Xgpw4448紧密连锁,且2个基因对芒长的抑制作用具有累加效应。SNP标记的密度远远高于传统分子标记的密度,对于数量性状的QTL定位更为高效、便捷[12-14]。另一方面,目前QTL定位多以双亲的衍生群体为材料来进行,此种方法难以将双亲中无多态性的关键基因位点检测出来[15-16];相比之下巢式关联作图群体(NAM)包含更多的亲本,基因位点的多态性更为丰富,因而具有更大的QTL检测功效,其结果更为可靠[16-18]。【本研究切入点】然而,目前尚未见到小麦芒性相关基因紧密连锁的SNP标记。【拟解决的关键问题】利用90K标记构建高密度连锁图谱和包含1个共同亲本的2个RIL群体对其芒长QTL进行定位分析,挖掘控制芒性状能够在多环境下检测到的主效QTL,为相关基因克隆和分子育种打下基础。
1 材料与方法
1.1 材料以及田间种植
用3个优良品种(系)小偃81、周8425B和西农1376(简称XY81、Z8425B和XN1376)构建了小偃81/周 8425B(简称 XZ)、小偃 81/西农 1376(简称XX)的2个组合的F9∶10代RIL群体,分别由102个和120个家系构成。3个亲本中,小偃81属于短芒材料,8425B和西农1376属于中长芒材料。将3个亲本及2个RIL群体于2016年10月至2017年6月在陕西杨凌(简称YL)、河南南阳(简称NY)和河南驻马店(简称ZMD)三地分别种植。完全随机区组设计,设2次重复,每株系种植2行,行长为2.0 m,行间距为0.25 m,株距6.7 cm,单粒播种。田间管理按照常规标准进行,生长期间无病虫害暴发。
1.2 分子标记的检测
90K标记利用Illumina SNP Genotyping技术测试平台(北京博奥生物有限公司),使用微珠芯片技术(Bead Array)进行检测,利用Genomestudio v1.0软件进行多态性分析。
1.3 表型性状的测定及数据处理
小麦蜡熟期每个株系选4株,每株随机取3穗,每穗随机取2个侧芒,用游标卡尺测量长度,取平均值用于表型及遗传力分析。
利用IciMapping的ANOVA功能进行田间数据分析及遗传力的估算。用基于完备区间作图模型IciMapping[19]的BIP功能对陕西杨凌、河南南阳和河南驻马店试验点 3种环境下芒长的表型值分别进行QTL定位,并利用此软件的MET功能进行3种环境的联合分析以及 QTL与环境互作分析[17,20-21]。在a=0.05显著水平下进行1 000次排列检验,确定芒长性状QTL的LOD阀值,采用正向-反向逐步回归法控制背景,步长设为1 cM。并依据STUBER等[22]提出的判别标准确定QTL作用方式。QTL的命名方法为群体大写缩写,加Q加性状缩写,加QTL所在的染色体,同一染色体上多个QTL用-1、-2、-3……来表示。例如Qal5A-1代表5A染色体上检测出来的第一个控制芒长的QTL。将在联合分析和单环境下都能够检测到,且单环境下表型贡献率>10%的QTL定义为“主效QTL”;将在3个环境中都检测到的QTL定义为“环境钝感QTL”[23]。
2 结果
2.1 表型数据分析
从表 1和图 1可以看出,2个群体的共同亲本XY81与另外2个亲本Z8425B、XN1376在芒的长度上存在较大差异。不同株系的目标性状差异大且2个群体的偏度绝对值<1,峰度绝对值>1,符合QTL作图条件,可用于QTL定位研究[24]。2个群体均出现了不同程度的超亲分离现象,且群体的遗传力较大,可以初步判断至少存在一个效应较强的控制位点。

图1 周8425B、西农1376和小偃81的穗芒形态Fig. 1 Awn feature of Z8425B, XN1376 and XY81
2.2 遗传图谱的构建
利用90K基因芯片81 587个标记对ZX和XX群体基因型进行多态性分析。小偃81和周8425B组配的 XZ群体中亲本之间共筛选出 11 037个多态性标记,利用IciMapping的bin功能对其进行冗余标记的删除,最终1 663个标记被连锁到图谱上,基因组全长为4 412.14 cM,平均图距2.65 cM,覆盖了小麦21条染色体组。分布于小麦A、B和D染色体组的标记数分别为735、790和138个,连锁长度分别为2 059.51、1 908.44和444.19 cM,平均图距最长的是2D染色体3.99 cM,平均图距最短的是4D染色体0.99 cM。小偃81和西农1376组配的XX群体中亲本之间共筛选出9 728个多态性标记,删除冗余后1 855个标记被连锁到图谱上,基因组全长为4 281.67 cM,平均图距2.31 cM,覆盖小麦21条染色体组。分布于小麦A、B和D染色体组的标记数分别为761、939和155个,连锁长度分别为1 836.14、1 961.39和484.14 cM,平均图距分别为2.41、2.09和3.12 cM。其中连锁图谱中 5B染色体标记数目最多 180个,4D染色体标记数目最少4个;5A染色体图距最长337.92 cM,2D染色体图距最短23.52 cM。平均图距最长的是3D染色体4.25 cM,平均图距最短的是3B染色体1.78 cM。
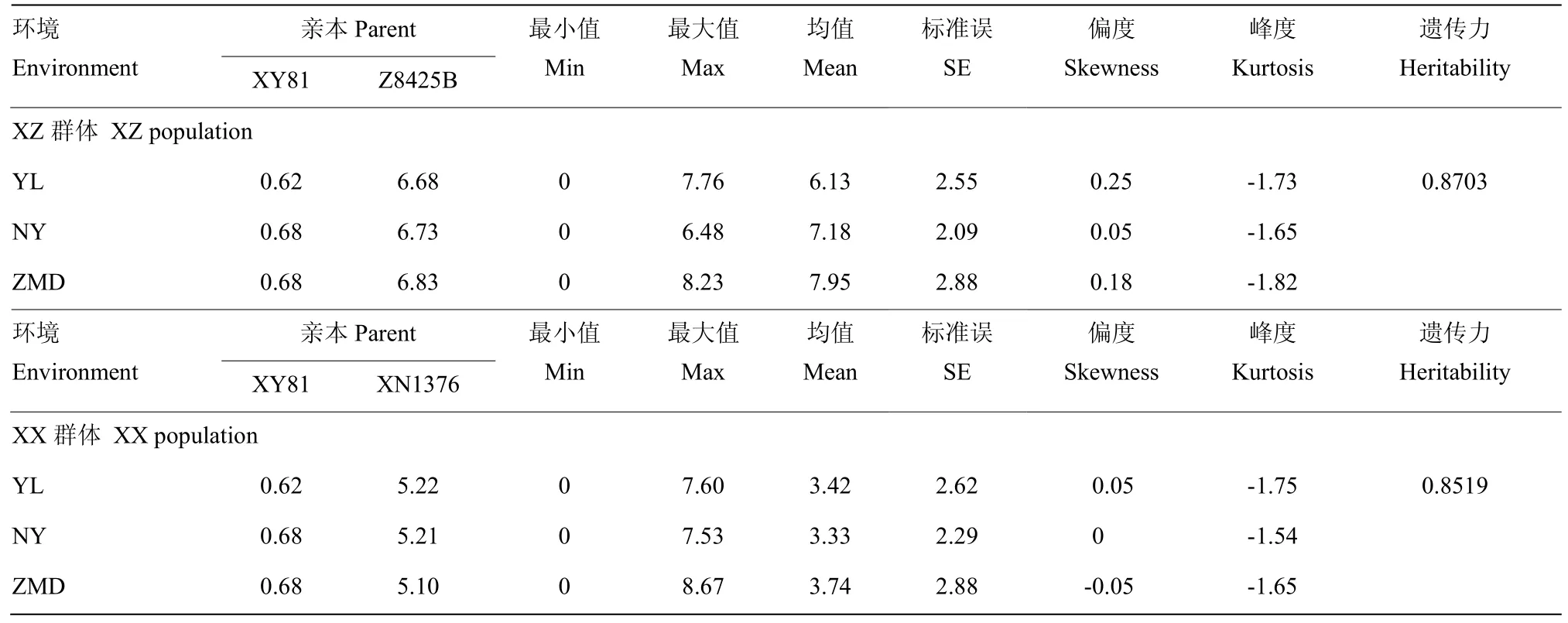
表1 亲本及RIL家系的芒长表型统计分析Table 1 Statistic analysis of parent and RIL family for plant awn length
2个图谱的比较分析可以看出(附表1),90K的连锁标记数在小麦基因组A、B和D间分布不均衡,但均表现为B基因组的标记数>A基因组的标记数>D基因组的标记数。就2个连锁群之间公共标记而言,其中A染色体组公共标记最多,D染色体组公共标记最少。对于单条染色来说,3B染色体上公共标记最多86个;1B、2D、3D和4D染色体上没有共同标记。各个染色体上的标记数分布详情见附表1。
2.3 芒长QTL定位结果分析
2.3.1 芒长QTL定位 2个群体共检测到6个控制芒长的QTL,位于5A、1B、3B、6B和2D染色体上(表2)。其中1个主效的QTL位点Qal5A-1,在2个群体3种环境下都能被检测到,属于环境钝感QTL,加性效应来源于父本小偃81,对芒长具有非常强的抑制作用,此位点被定位在 5A染色体的末端,且在置信区间内有一个共同的分子标记RAC875_c8121_1147,ZX群体定位的Qal5A-1与分子标记 RAC875_c8121_1147的遗传距离仅为1.28 cM,表型变异的贡献率为78.52%,可降低芒长效应值2.2 cm。XX群体定位的Qal5A-1与分子标记RAC875_ c8121_1147的遗传距离仅为0.13 cM,表型变异的贡献率为48.99%,可降低芒长效应值1.8 cm,详情见表2和图2。1个微效的QTL位点Qal6B-1(MET)加性效应来源于母本周8425B,表型变异的贡献率为1.39%,单个QTL可以增加芒长效应值 0.27 cm;4个微效的 QTL位点Qal1B-1(MET)、Qal3B-1(MET)、Qal2D-1(ZMD)和Qal2D-2(NY和MET)加性效应来源于母本周西农1376,分别可解释表型变异的3.66%、3.93%、5.53%和3.51%,可增加芒长效应值0.45—0.72 cm。XZ群体检测的2个QTL位点,其中1个主效位点Qal5A-1,1个微效QTL位点Qal6B-1,2个QTL表型变异的贡献率总和为 79.91%,略小于该群体芒长的遗传力87.03%。XX群体检测出5个QTL位点,1个主效位点Qal5A-1和 4个微效位点Qal1B-1、Qal3B-1、Qal2D-1、Qal2D-2,5个 QTL位点表型变异的贡献率总和为63.96%,小于该群体芒长的遗传力85.19%。2.3.2 芒长QTL与环境互作分析 从表2的第2、3列来看,单个环境检测出来的QTL,除环境ZMD中Qal2D-1外,其余的都能在联合分析中被鉴定出来,有3个(即Qal6B-1、Qal1B-1和Qal3B-1)未在单环境中检测出。此外,由于随机误差的存在,同一个QTL在单环境的位置估计也不尽相同,XX群体的Qal5A-1位点利用杨凌的表型数据被定位在 5A染色体的 75 cM处,置信区间为73.2—76.2 cM,其他3种情况(NY、ZMD和MET)被定位在5A染色体的74 cM处,置
信区间为73.7—76.2 cM,联合分析利用了更多的表型数据,得到的74 cM可能更接近于真实的位置。从表3的加性遗传效应来看,联合分析得到的6个QTL,加性遗传效应值的大小近似相同,说明这些QTL在3个环境间有着稳定的遗传效应。从表3的最后3列给出的加性与环境的互作效应来看,互作效应都远低于平均加性效应,说明QTL与环境间的互作不是影响芒长性状的主要因素。

图2 两个群体不同环境下小麦芒长的QTL分布Fig. 2 QTL distribution of wheat awn length detected in two populations in different environments
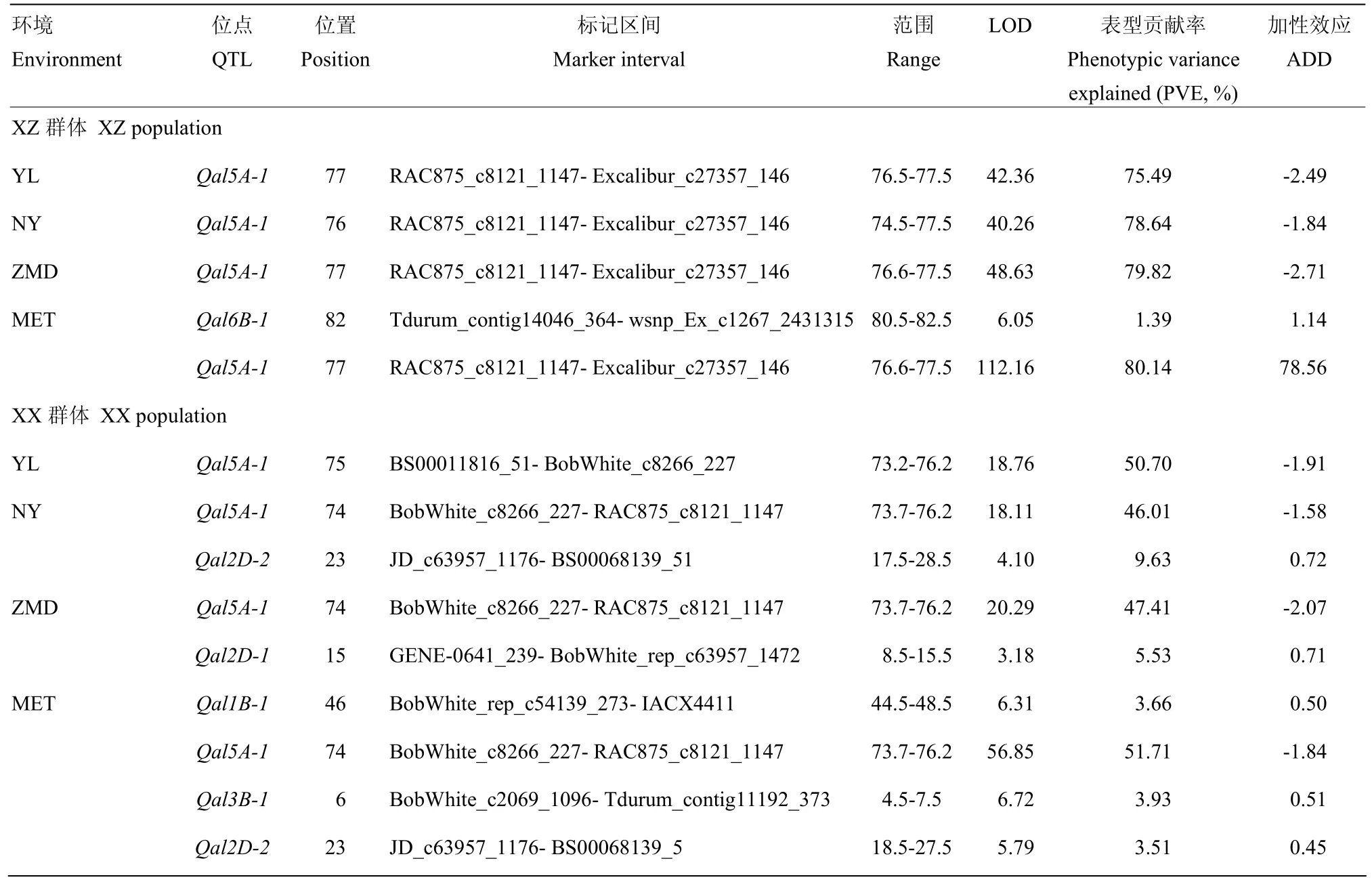
表2 不同环境下定位到影响小麦芒长的QTLTable 2 Location of QTL affecting wheat awn length in different environments
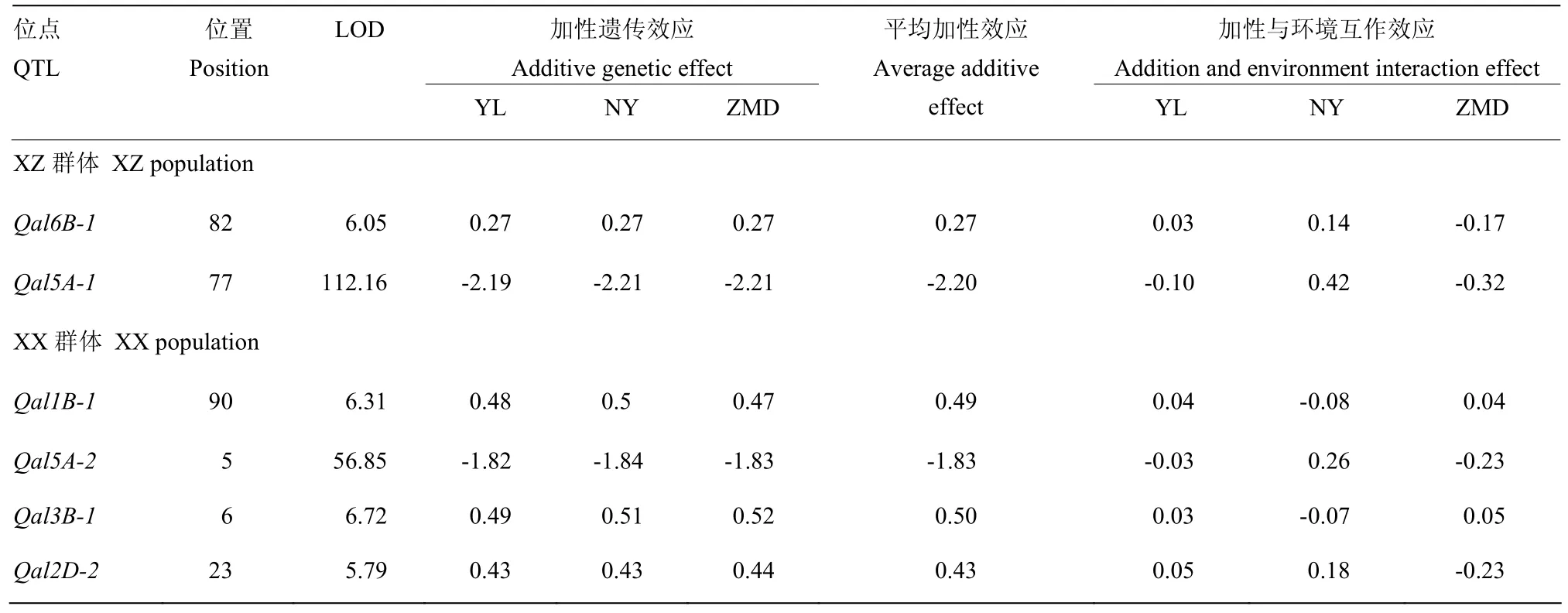
表3 QTL与环境互作分析检测到芒性状QTL的位置和遗传效应Table 3 Analysis of interaction between QTL and environment detected the awn character QTL location and genetic effect
3 讨论
3.1 连锁图谱对QTL定位的影响
本研究从XZ和XX 2个RIL群体中得到的连锁图谱,分别含有1 663和1 885个多态性SNP标记,标记间的平均图距分别为2.65和2.31 cM。同传统的RFLP、SSR标记构建的连锁图谱相比,本研究中用90K标记所构建的标记数目远高于其他研究。通过增加标记数目,提高连锁图谱的标记密度,缩小平均图距,增加了QTL检测精度,使在其他标记图谱的大间隔区段检测QTL成为可能。2个连锁图谱存在的共同问题是染色体组间标记数目分布不均衡,可能有以下2种原因,一是由于小麦基因组非常庞大且具有80%以上 DNA重复序列[25-26],构建图谱误差较大,存在大量间隙;二是因为小麦的进化过程中,并没有形成含有D染色体组的四倍体小麦,减少D染色体组之间的基因交流,致使D染色体组相对其他染色体组具有较高的保守性[26-28]。
3.2 群体类型对芒长QTL定位影响
QTL定位过程中,所构建的定位群体的类型及大小对定位的结果及QTL的作用方式都有较大的影响。目前用于 QTL定位研究的群体主要有DH群体、F2群体、BC群体、RIL群体等。RIL群体通过多代自交,染色体间的重组概率显著提高,连锁基因的交换更为充分,染色体上相邻的不同QTL位点更容易分解开,有利于基因型与环境互作和 QTL定位分析研究[23]。BUCKLER等[17]用25个自交系与B73构建了巢式关联作图群体(NAM),进行开花期QTL分析,认为NAM 群体比单个的作图群体有更大的检测 QTL功效,检测结果更可靠。受研究规模制约,本研究使用1个共同的父本小偃81与另外2个不同来源的母本周8425B和西农1376构建RIL群体用于芒长QTL检测。在2个群体共同检测到的1个主效的QTL,即Qal5A-1在不同的环境下都能被识别出,属于环境钝感QTL,具有非常高的遗传稳定性。遗憾的是Qal5A-1对于不同群体的表型变异的贡献率不同,可能是因为2个群体的遗传背景不同导致的。另外这一主效位点被定位在 5A染色体长臂上的末端,对芒长具有非常强的抑制作用,该位点的效应极有可能源于强抑芒基因B1。与前人的定位结果相比较,ZX群体定位的Qal5A-1与分子标记 RAC875_c8121_1147的遗传距离仅为1.28 cM,XX群体定位的Qal5A-1与分子标记RAC875_c8121_1147的遗传距离仅为0.13 cM,远远高于杜斌等定位的精确度[5,9,11]。LI等[10]把抑芒基因B2定位在6B染色体上,本研究的Qal6B-1位点对芒长的效应值具有促进作用,两位点不属于同一位点。另外5个微效的QTL位点,即Qal6B-1、Qal1B-1、Qal3B-1、Qal2D-1和Qal2D-2,它们的表型变异的贡献率分别为1.39%、3.66%、3.93%、5.53%和3.51%,推测可能是新的QTL位点。2个群体的家系都出现了不同程度的超亲分离,对于极短芒或无芒家系形成原因,可能为基因互作引起的,导致极短芒或无芒家系形成。
4 结论
2个群体检测到1个主效位点Qal5A-1,此位点被定位在 5A染色体末端,与分子标记 RAC875_c8121_1147紧密连锁,对芒长具有强烈的抑制作用,表型变异的解释率高,遗传稳定性强,属于环境钝感QTL,可以针对芒长性状构建近等基因系和精细定位。
[1] BARIANA H S, PARRY N, BARCLAY I R, LOUGHMAN R,MCLEAN R J, SHANKAR M, WILSON R E, WILLEY N J,FRANCHI M. Identification and characterization of stripe rust resistance geneYr34in common wheat.Theoretical and Applied Genetics, 2006, 112(6): 1143-1148.
[2] 李晓娟. 高产小麦旗叶和芒细胞结构及其光合性能的研究[D]. 北京: 中国科学院, 2006.LI X J. Cytological structure of flag leaves and awns in relation to their photosynthetic characteristics in high-yield genotypes of wheat[D]. Beijing: Chinese Academy of Sciences, 2006. (in Chinese)
[3] 李寒冰, 胡玉熹, 白克智, 匡廷云, 周馥, 林金星. 小麦芒和旗叶叶绿体结构及低温荧光发射光谱的比较研究. 电子显微学报, 2002,21(2): 97-101.LI H B, HU Y X, BAI K Z, KUANG T Y, ZHOU F, LIN J X.Comparison of chloroplast ultrastructure and 77K fluorescence emission spectra between awns and flag leaves in wheat.Journal of Chinese Electron Microscopy Society, 2002, 21(2): 97-101. (in Chinese)
[4] LI X, WANG H, LI H, ZHANG L, TENG N, LIN Q, WANG J,KUANG T, LI Z, LI B, ZHANG A, LIN J. Awns play a dominant role in carbohydrate production during the grain-filling stages in wheat (Triticum aestivum).Physiologia Plantarum, 2006, 127(4):701-709.
[5] 杜斌, 崔法, 王洪刚, 李兴锋. 小麦芒长抑制基因 B1近等基因系的鉴定及遗传分析. 分子植物育种, 2010, 8(2): 259-264.DU B, CUI F, WANG H G, LI X F. Characterization and genetic analysis of near-isogenic lines of common wheat for awninhibitor gene B1. Molecular Plant Breeding, 2010, 8(2): 259-264. (in Chinese)
[6] RAI K N, RAO A S. Effect of d2dwarfing gene on grain yield and yield components in pearl millet near-isogenic lines. Euphytica, 1991,52(1): 25-31.
[7] MOTZO R, GIUNTA F. Awnedness affects grain yield and kernel weight in near-isogenic lines of durum wheat. Australian Journal of Agricultural Research, 2002, 53(12): 1285-1293.
[8] SOURDILLE P, CADALEN T, GAY G, GILL B, BERNARD M.Molecular and physical mapping of genes affecting awning in wheat.Plant Breeding, 2002, 121: 320-324.
[9] KOSUGE K, WATANABE N, KUBOYAMA T, MELNIK V M,YANCHENKO V I, ROSOVA M A, GONCHAROV N P. Cytological and microsatellite mapping of mutant genes for spherical grain and compact spikes in durum wheat. Euphytica, 2008, 159(3): 289-296.
[10] LI H, HAN Y C, GUO X X, XUE F, WANG C Y, JI W Q. Genetic effect of locus B2 inhibiting awning in double-ditelosomic 6B of Triticum durum DR147. Genetic Resources and Crop Evolution, 2015,62(3): 407-418.
[11] 宫希, 蒋云峰, 徐彬杰, 乔媛媛, 华诗雨, 吴旺, 马建, 周小鸿, 祁鹏飞, 兰秀锦. 利用普通六倍体小麦和西藏半野生小麦杂交衍生的重组自交系定位小麦芒长QTL. 作物学报, 2017, 43(4): 496-500.GONG X, JIANG Y F, XU B J, QIAO Y Y, HUA S Y, WU W, MA J,ZHOU X H, QI P F, LAN X J. Mapping QTLs for awn length in recombinant inbred line population derived from the cross between common wheat and Tibetan semi-wild wheat. Acta Agronomica Sinica,2017, 43(4): 496-500. (in Chinese)
[12] BROOKES A J. The essence of SNPs. Gene, 1999, 234(2): 177-186.
[13] RAFALSKI A. Applications of single nucleotide polymorphisms in crop genetics. Current Opinion in Plant Biology, 2002, 5(2): 94-100.
[14] 郑德波, 杨小红, 李建生, 严建兵, 张士龙, 贺正华, 黄益勤. 基于SNP标记的玉米株高及穗位高QTL定位. 作物学报, 2013, 39(3):549-556.ZHENG D B, YANG X H, LI J S, YAN J B, ZHANG S L, HE Z H,HUANG Y Q. QTL identification for plant height and ear height based on SNP mapping in maize (Zea mays L.). Acta Agronomica Sinica,2013, 39(3): 549-556. (in Chinese)
[15] 王建康, 李慧慧, 张学才, 尹长斌, 黎裕, 马有志, 李新海, 邱丽娟,万建民. 中国作物分子设计育种. 作物学报, 2011, 37(2): 191-201.WANG J K, LI H H, ZHANG X C, YIN C B, LI Y, MA Y Z, LI X H,QIU L J, WAN J M. Molecular design breeding in crops in China.Acta Agronomica Sinica, 2011, 37(2): 191-201. (in Chinese)
[16] LI H, BRADBURY P, ERSOZ E, BUCKLER E S, WANG J. Joint QTL linkage mapping for multiple-cross mating design sharing one common parent. PLoS ONE, 2011, 6(3): e17573.
[17] BUCKLER E S, HOLLAND J B, BRADBURY P J, ACHARYA C B,BROWN P J, BROWNE C, ERSOZ E, FLINT-GARCIA S, GARCIA A, GLAUBITZ J C, GOODMAN M M, HARJES C, GUILL K,KROON D E, LARSSON S, LEPAK N K, LI H, MITCHELL S E,PRESSOIR G, PEIFFER J A, ROSAS M O, ROCHEFORD T R,ROMAY M C, ROMERO S, SALVO S, VILLEDA H S, DA SILVA H S, SUN Q, TIAN F, UPADYAYULA N, WARE D, YATES H, YU J,ZHANG Z, KRESOVICH S, MCMULLEN M D. The genetic architecture of maize flowering time. Science, 2009, 325: 714-718.
[18] MCMULLEN M D, KRESOVICH S, VILLEDA H S, BRADBURY P,LI H, SUN Q, FLINT-GARCIA S, THORNSBERRY J, ACHARYA C, BOTTOMS C, BROWN P, BROWNE C, ELLER M, GUILL K,HARJES C, KROON D, LEPAK N, MITCHELL S E, PETERSON B,PRESSOIR G, ROMERO S, ROSAS M O, SALVO S, YATES H,HANSON M, JONES E, SMITH S, GLAUBITZ J C, GOODMAN M,WARE D, HOLLAND J B, BUCKLER E S. Genetic properties of the maize nested association mapping population. Science, 2009, 325:737-740.
[19] 王建康. 数量性状基因的完备区间作图方法. 作物学报, 2009,35(2): 239-245.WANG J K. Inclusive composite interval mapping of quantitative trait genes. Acta Agronomica Sinica, 2009, 35(2): 239-245. (in Chinese)
[20] HACKETT C A, RUSSELL J, JORGENSEN L, GORDON S L,BRENNAN R M. Multi-environment QTL mapping in blackcurrant(Ribes nigrum L.) using mixed models. Theoretical and Applied Genetics, 2010, 121(8): 1483-1488.
[21] MESSMER R, FRACHEBOUD Y, BÄNZIGER M, VARGAS M,STAMP P, RIBAUT J M. Drought stress and tropical maize:QTL-by-environment interactions and stability of QTLs across environments for yield components and secondary traits. Theoretical and Applied Genetics, 2009, 119(5): 913-930.
[22] STUBER C W, EDWARDS M D, WENDEL J F. Molecular marker-facilitated investigations of quantitative trait loci in maize. II.Factors influencing yield and its component traits. Crop Science, 1987,27(4): 639-648.
[23] 李清超, 李永祥, 杨钊钊, 刘成, 刘志斋, 李春辉, 彭勃, 张岩, 王迪, 谭巍巍, 孙宝成, 石云素, 宋燕春, 张志明, 潘光堂, 黎裕, 王天宇. 基于多重相关RIL群体的玉米株高和穗位高QTL定位. 作物学报, 2013, 39(9): 1521-1529.LI Q C, LI Y X, YANG Z Z, LIU C, LIU Z Z, LI C H, PENG B,ZHANG Y, WANG D, TAN W W, SUN B C, SHI Y S, SONG Y C,ZHANG Z M, PAN G T, LI Y, WANG T Y. QTL mapping for plant height and ear height by using multiple related RIL populations in maize. Acta Agronomica Sinica, 2013, 39(9): 1521-1529. (in Chinese)
[24] 李慧慧, 张鲁燕, 王建康. 数量性状基因定位研究中若干常见问题的分析与解答. 作物学报, 2010, 36(6): 918-931.LI H H, ZHANG L Y, WANG J K. Analysis and answers to frequently asked questions in quantitative trait locus mapping. Acta Agronomica Sinica, 2010, 36(6): 918-931. (in Chinese)
[25] BENNETT M D, LEITCH I J. Nuclear DNA amounts in angiosperms:targets, trends and tomorrow. Annals of Botany, 2011, 107(3):467-590.
[26] 肖静, 田纪春. 小麦 (T. aestivum L.) D基因组的研究进展. 分子植物育种, 2008, 6(3): 537-541.XIAO J, TIAN J C. Reviewed on D genome of T. aestivum L..Molecular Plant Breeding, 2008, 6(3): 537-541. (in Chinese)
[27] 陈建省, 陈广凤, 李青芳, 张晗, 师翠兰, 孙彩铃, 邓志英, 刘凯,谷植群, 田纪春. 利用基因芯片技术进行小麦遗传图谱构建及粒重QTL分析. 中国农业科学, 2014, 47(24): 4769-4779.CHEN J S, CHEN G F, LI Q F, ZHANG H, SHI C L, SUN C L,DENG Z Y, LIU K, GU Z Q, TIAN J C. Construction of genetic map using genotyping chips and QTL analysis of grain weight. Scientia Agricultura Sinica, 2014, 47(24): 4769-4779. (in Chinese)
[28] 贾继增, 张正斌, DEVOS K, GALE M D. 小麦21条染色体RFLP作图位点遗传多样性分析. 中国科学: 生命科学, 2001, 31(1):13-21.JIA J Z, ZHANG Z B, DEVOS K, GALE M D. Genetic diversity analysis of 21 chromosomes of wheat with RFLP marker. Scientia Sinica Vitae, 2001, 31(1): 13-21. (in Chinese)

