番荔枝花发育不同阶段的差异蛋白质组分析
刘锴栋,莫亿伟,冯少娴,吴婉仪,黎海利,钟军弟,袁长春
(1岭南师范学院生命科学与技术学院,广东湛江 524048;2绍兴文理学院生命科学学院,浙江绍兴 312000)
0 引言
【研究意义】番荔枝(Annona squamosaL.)又称林檎、释迦果,为番荔枝科(Annonaceae)落叶小乔木,是热带、亚热带优稀水果。番荔枝在中国南方如广东、福建、海南、广西等省均有大面积种植[1-4]。番荔枝的芽为复芽,其腋芽被叶柄抱嵌,若叶片不脱落,腋芽一般不会萌发。在生长季节,主要将老熟枝条中任一节位的叶片摘除,并结合剪顶或摘心,腋芽就可以抽发新梢,先发新梢 80%以上能成花[3]。此外,番荔枝的花具有雌雄异熟和雌蕊先熟的特性,往往出现“花而不实”、坐果不良和结果不稳定等现象,且自然授粉坐果率很低,这制约了番荔枝产业的进一步发展[5-6]。通过对比花发育不同阶段的差异表达蛋白,可以找出与番荔枝花发育相关的重要蛋白。双向电泳技术(Two-dimensional gel electrophoresis,2-DE)是一种根据蛋白质等电点和相对分子量的不同来进行分离的技术,是蛋白质组学研究的重要手段之一[7]。运用2-DE技术分离花发育不同阶段的差异表达蛋白,并对差异蛋白进行质谱鉴定和功能分析,对研究番荔枝花发育机理具有重要的理论意义。【前人研究进展】开花是植物从营养生长阶段向生殖生长阶段转变的一个重要时间点。一个完整的花发育过程包括花诱导、花萌发和花器官成熟等[8]。利用不断进步的蛋白质分析技术,花发育过程中的差异蛋白谱已在多种植物得到解析。利用 2-DE技术,发现多个代谢过程参与了苜蓿开花过程。这可能为苜蓿花发育提供了能量基础[9]。通过对桦树不同花发育时期蛋白变化的分析,揭示了蛋白变化与特定花发育阶段的内在关联[10]。此外,通过比较花器官发育正常和不正常的花器官蛋白质图谱,为改良花发育,提高成花率提供了大量候选蛋白。通过对龙眼成花转变与成花逆转的蛋白谱分析,发现了41个差异蛋白,这些蛋白为研究龙眼成花逆转的生物学过程提供了基础[11]。王珊[12]比较了梅树完全花和不完全花的蛋白质组,发现差异蛋白与糖代谢、淀粉代谢以及光合作用有关。比较日本白梅正常花和异常花,发现白梅雌蕾的发育依赖于多个生理生化过程[13]。笔者课题组前期对番荔枝花发育的分子机理进行了初步的研究,利用高通量测序技术,对番荔枝从花芽到开花等4个不同阶段进行转录组分析,共获得71 948条Unigenes序列信息,并发现番荔枝花发育不同阶段都进行着各种旺盛的生物合成和代谢活动,且4个开花调控途径(光周期途径、春化途径、自主途径、GA调控途径)均已启动[14]。此外,笔者课题组成功克隆了AsLEAFY、AsAG等花发育相关基因,并发现这些基因可能都参与了番荔枝花发育过程和对激素信号的响应[3-4]。【本研究切入点】对于番荔枝花发育过程的蛋白表达变化情况,获得的信息还不多,有待进一步研究。【拟解决的关键问题】本研究利用双向电泳和质谱鉴定技术对番荔枝花发育不同阶段蛋白差异表达情况进行分析,结合生物信息学技术,确定其功能,以找出与番荔枝花发育有关的蛋白,从蛋白水平上为揭示番荔枝花发育的分析机制提供基础。
1 材料与方法
试验于2015年6月至2016年12月在岭南师范学院试验地及岭南师范学院热带果树协同创新中心进行。
1.1 试验材料
番荔枝sugar-apple(Annona squamosaL.)栽培于试验地,品种为‘普通番荔枝’,树龄为5年,常规栽培管理。于2015年7—8月分别采集4个阶段的花,分别为花芽(1 mm<花芽<2 mm)(A)、花蕾(5 mm<花蕾<6 mm)(B)、开花前期(花瓣轻微张开)的花(C)及开花期(花瓣张开)的花(D)。取样后立即用液氮速冻后保存于-80℃冰箱中,用于双向电泳分析。
1.2 方法
1.2.1 蛋白质的提取及含量测定 称取1 g番荔枝花样品在液氮中研磨,研磨过程加入100 mg PVPP,样品悬浮于 10 mL提取液,再加入10 mL Tris饱和酚,充分混合后,4℃下,20 000×g离心30 min,吸出上层酚相,转移到15 mL离心管中,再加入跟酚相同体积的提取液,以上步骤重复两次。最后一次取出来的酚相再加入酚的5倍体积的醋酸铵甲醇溶液对蛋白进行沉淀,充分振荡后,-20℃沉淀过夜。沉淀过夜的蛋白质4℃存放,然后20 000×g,离心30 min倒掉上清液,加入5 mL甲醇对蛋白进行洗涤,用移液器反复吹打均匀后4℃存放,20 000×g,离心30 min。重复一次操作。加入5 mL丙酮对蛋白进行洗涤,用移液器反复吹打均匀后 4℃存放,20 000×g,离心 30 min。重复一次操作。洗涤两次之后加入4 mL丙酮,吹打均匀后将蛋白质平均分到4支1.5 mL EP管中,4℃下,20 000×g离心20 min。倒去上清液后,室温干燥得到沉淀的蛋白团块。在干燥后的蛋白质团块中加入 200 µL RB(7 mol·L-1Urea、2 mol·L-1Thiourea、4% CHAPS),将蛋白质充分分散。超声助溶,80 W,0.8 s开,0.8 s关,超声4下后放于冰上冷却,再重复1次,超声后,4℃下,20 000×g,离心20 min,取出上清液,采用Bradford蛋白定量方法测定蛋白浓度,保存在-80℃超低温冰箱。
1.2.2 双向电泳
1.2.2.1 第一向固相pH梯度等电聚焦 双向电泳第一向采用长度24 cm,pH 4—7的线性干胶条,取120 μg蛋白提取液与水化缓冲液(1% DTT、1% IPG Buffer、1×BPB、RB)混合至总体积460 μL,混合液加入到GE水化盘的槽中,覆盖上干胶条,胶面朝下,泡胀过夜(10—12 h)。第二天,把泡胀好的胶条转移到GE的等电聚焦盘,按照以下参数进行聚焦:500 V聚焦1 h;1 000 V聚焦1 h;从1 000 V在3 h内升到8 000 V;8 000 V聚焦 5 h 36 min。第一向电泳结束后,将胶条置于平衡缓冲液(50 mmol·L-1Tris-HCl、6 mol·L-1Urea、30% Glycerol、2% SDS、0.002%Bromophenol blue)振荡2次,每次15 min。第一次平衡和第二次平衡分别在缓冲液中加入 100 mmol·L-1DTT和250 mmol·L-1IAA,IAA平衡时要避光。平衡完毕后取出胶条轻轻润洗,并去除多余的平衡缓冲液,准备第二向电泳。
1.2.2.2 第二向 SDS-PAGE电泳 将平衡好的胶条置于第二向凝胶上方,排除气泡使二者紧密接触,用 1%琼脂糖凝胶封固胶条,接通电源。第一阶段2 W/Gel 1 h;第二阶段17 W/Gel,直至溴酚蓝到达凝胶底端,约4.5 h。双向电泳结束后,SDS-PAGE 凝胶置于固定液(100 mL 乙醇、25 mL冰醋酸、50%超纯水)中固定2 h以上;凝胶固定后,将其转移到敏化液(75 mL 乙醇、0.788 g硫代硫酸钠、17 g无水乙酸钠),敏化1 h;超纯水冲洗4次,每次10 min;加入银染液染色(0.625 g硝酸银加蒸馏至250 mL)1 h;超纯水冲洗2次,每次1 min;显色液显色(6.25 g碳酸钠、100 µL甲醛,加蒸馏水至250 mL);显色8 min后用终止液终止(3.65 g Na2EDTA·H2O 加蒸馏水至250 mL),终止时间为45 min;最后用超纯水冲洗2次,每次30 min。
1.2.3 质谱鉴定与数据库分析 MICROTEK ScanMaker i800扫描仪扫描脱色后的凝胶,用Image master 2D 5.0软件分析 4个阶段的凝胶图谱,采用YANG等[15]的方法,使用蛋白相对表达体积(%VOL)来表述每一个匹配蛋白点在不同时期的表达丰度。差异蛋白点为相对表达丰度上调(出现)或下调(消失)差异大于2倍(Ratio>2.0),并且在统计学 T 检验上P<0.05(Student’s t test)的蛋白质。差异蛋白点使用 Ultraflex Ⅲ MALDL-TOF-MS质谱仪(Bruker公司,美国)进行分析,同时利用得到的 peaklist 文件进行在线MASCOT(http://www.Matrixscience.com)检索。以检索结果中分数最高,并且超过mascot系统阈值的蛋白为最可信蛋白。应用 GO数据库(http://www.geneontology.org/)计算每一个GO分类(term)的差异蛋白数目。
2 结果
2.1 番荔枝花发育不同阶段的蛋白点表达丰度分析
为了找到与番荔枝花发育相关的蛋白,以番荔枝为材料,收集了番荔枝花发育4个阶段的样本材料(图1)。进一步运用比较蛋白质组学的方法,获得了 4个样本的双向电泳图谱(图 2)。通过蛋白图谱比较分析发现,番荔枝花双向电泳图谱中的每张凝胶图谱上都可以检测到800多个重复蛋白点。通过控制2倍上、下调来筛选不同阶段的差异蛋白质,发现其中有50个蛋白点的表达丰度在不同阶段花之间存在差异。

图1 番荔枝花发育不同阶段材料Fig. 1 Materials of different developmental stages of sugar apple flowers
2.2 差异蛋白点的鉴定及功能分类
50个差异蛋白点经质谱鉴定分析,并采用MASCOT在线(http://www.atrixscience.com)检索,结果有36个得到成功鉴定,蛋白质鉴定成功率为72%(表1)。鉴定出的36个蛋白质可分为7个主要的功能类别,且不同功能类别蛋白所占比例各不相同。这些功能类别包括:呼吸与能量代谢(11个蛋白质,30.6%),蛋白合成与代谢(8个蛋白质,22.2%),转录与翻译(3个蛋白质,8.3%),胁迫与防御(2个蛋白质,5.6%),细胞分化与增殖(3个蛋白质,8.3%),次生物质代谢(8个蛋白质,22.2%)和未知功能蛋白(1个蛋白质,2.8%)。
2.3 差异蛋白质亚细胞定位分析
利用PROSITE_Prorule程序,预测所有鉴定得到的差异蛋白的亚细胞定位。研究表明,共有29个蛋白具有显著的亚细胞定位特征。其中,12个差异蛋白定位于细胞液中,组成了最大的一类亚细胞定位蛋白。另有11个蛋白分别定位于叶绿体及3个叶绿体相关的亚细胞器中,包括2个叶绿体类囊体膜蛋白,2个叶绿体类囊体内腔蛋白,2个叶绿体膜定位蛋白,5个叶绿体定位蛋白。此外,还有1个蛋白定位于细胞内膜上,2个蛋白定位于内质网孔中(图3)。
2.4 差异表达蛋白点GO功能分析
应用GO数据库,对成功鉴定的差异蛋白进行注释及功能分析。结果发现36个鉴定到的蛋白,分别归属于20个GO分类(term)(部分蛋白归属于2个或2个以上的GO分类)。其中,25个蛋白质属于离子结合分类(GO:0043167)。其他拥有超过两个差异蛋白的GO分类分别为:跨膜运输载体活性分类(GO:0022857,3个蛋白),ATG 酶活性分类(GO:0016887,3个蛋白),非折叠蛋白结合分类(GO:0051082,2个蛋白),激酶活性分类(GO:0016301,2个蛋白),裂解酶活性分类(GO:0016829,2个蛋白),翻译因子活性分类(GO:0008135,2个蛋白)(图4)。
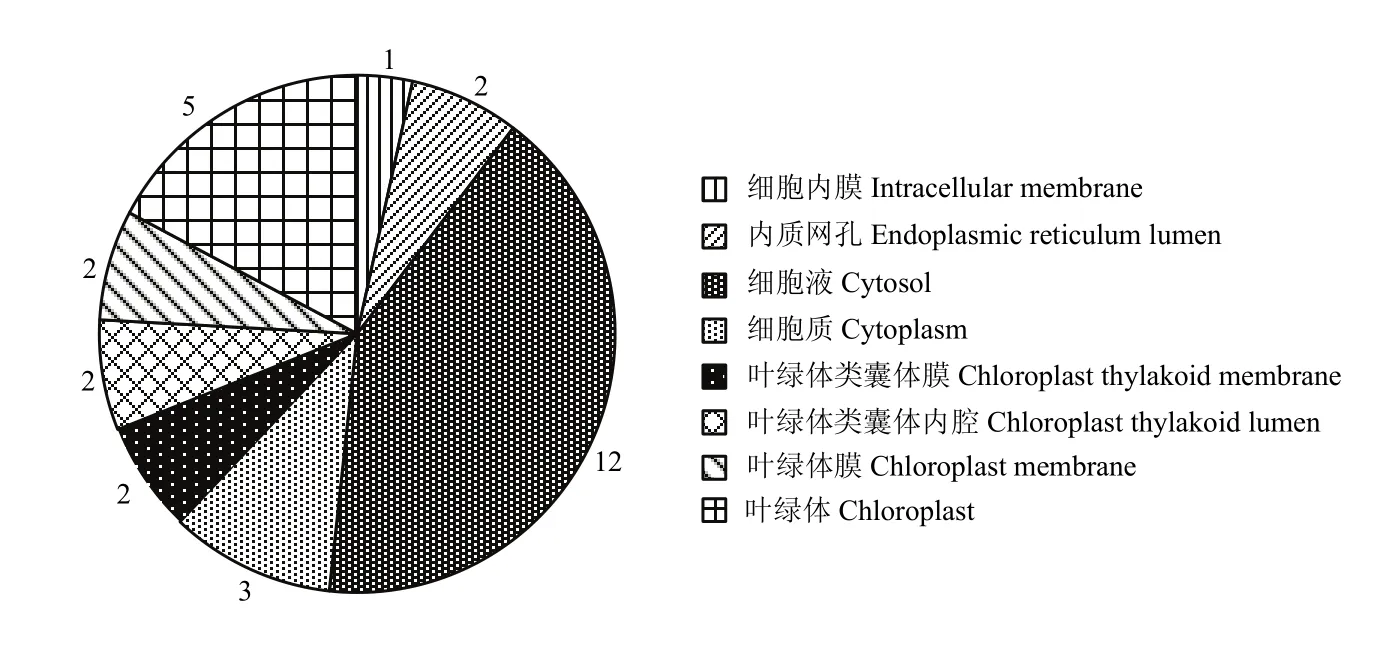
图3 番荔枝花发育不同时期相关差异表达蛋白亚细胞定位分析Fig. 3 Subcellular localization analysis of deferentially expressed proteins in different developmental stages of sugar-apple flowers
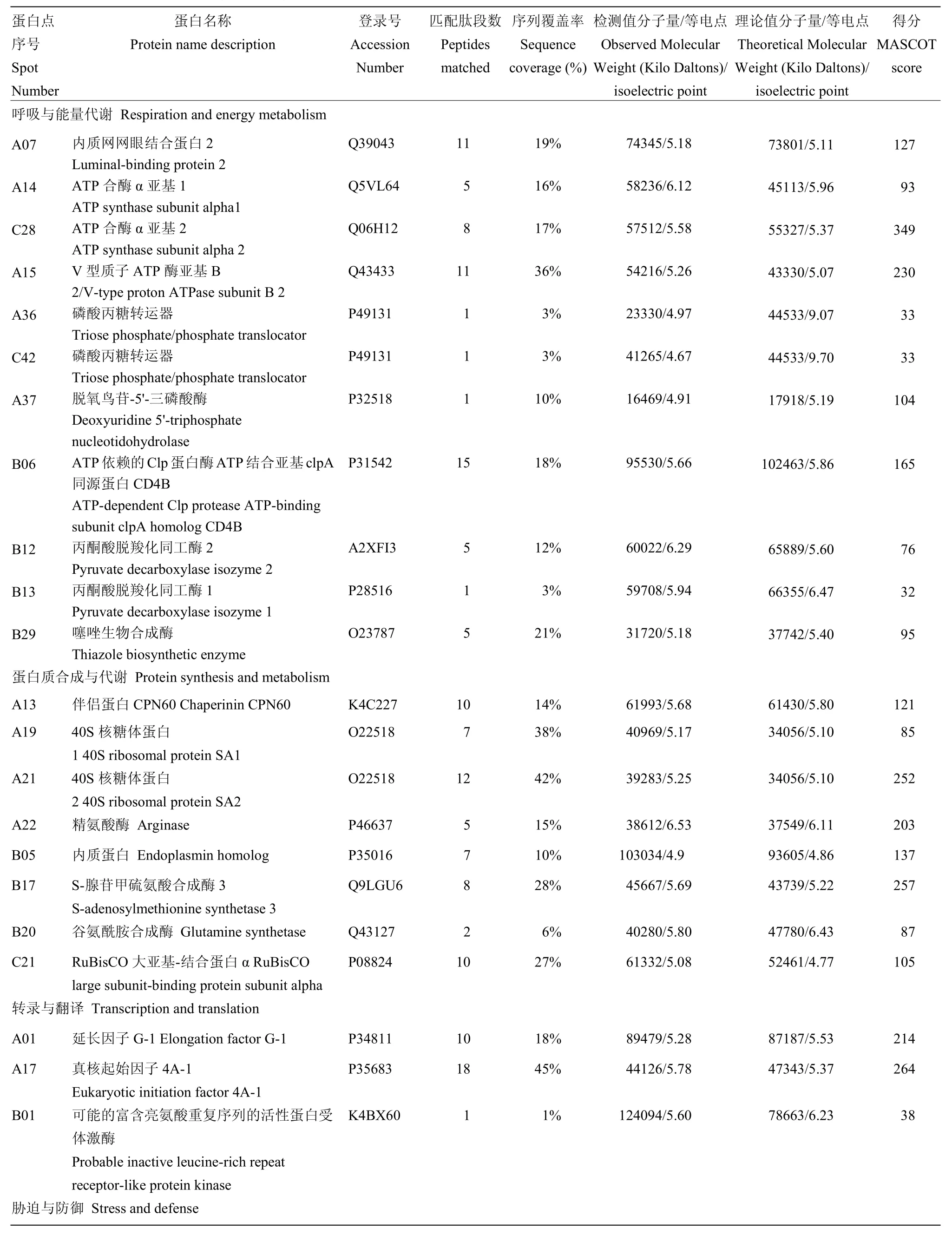
表1 番荔枝花发育不同阶段的差异表达蛋白质的质谱鉴定结果Table 1 Identification of deferentially expressed protein spots by MALDL-TOF-MS and database searching in different developmental stages of sugar-apple flowers
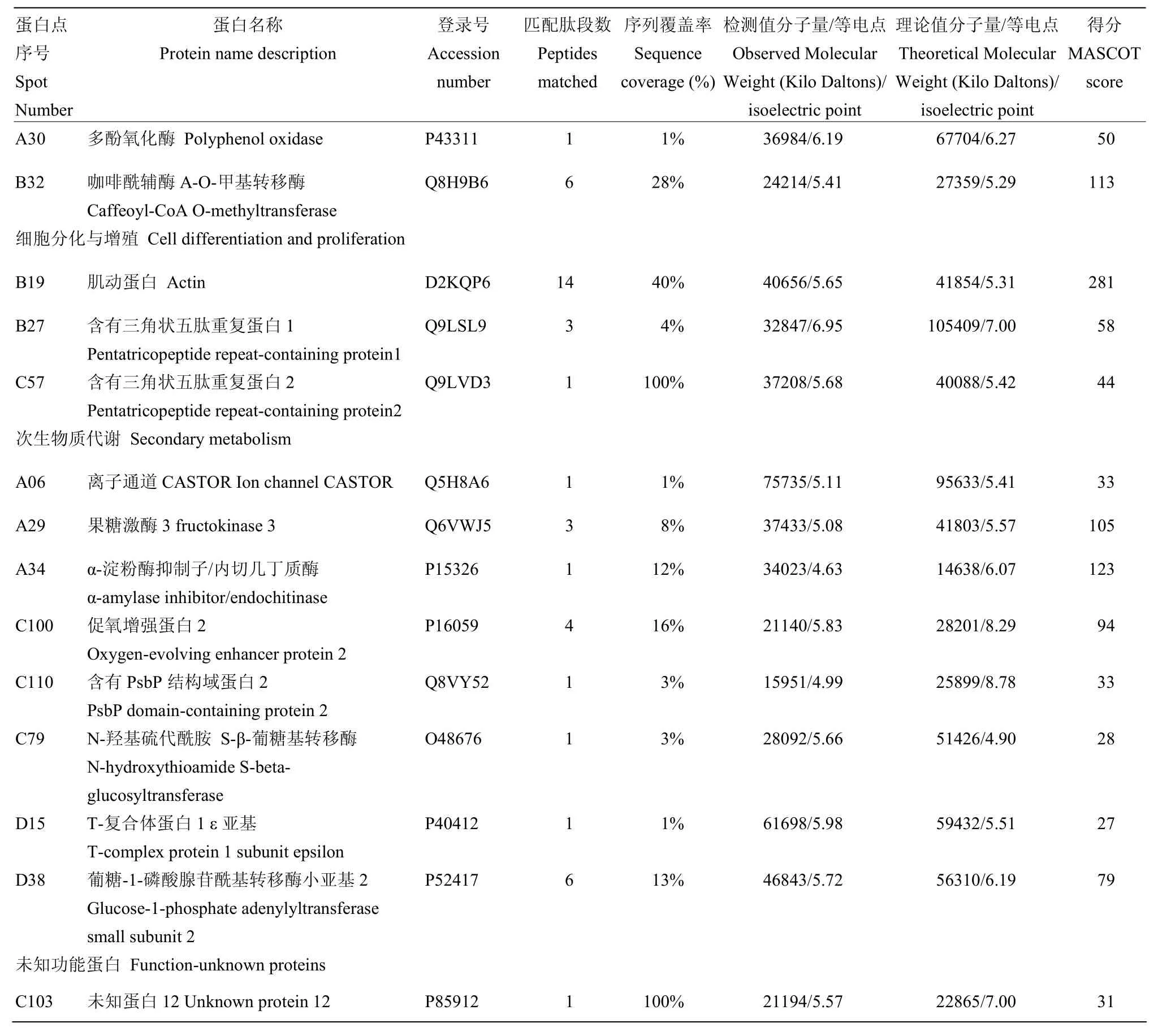
续表1 Continued table 1
2.5 差异蛋白点的表达趋势分析
在上述鉴定到的蛋白中,部分蛋白表达量随着花发育而逐渐上调,部分蛋白表达则逐渐下调。依据所得蛋白的不同分组,分析36个蛋白在番荔枝花发育4个不同阶段的表达丰度差异。在11个呼吸与能量代谢相关蛋白中,3个蛋白(A07、C28、C42)随着花发育表达量不断下降,而另外 4个蛋白(A36、A37、B13、B29)则表达量显著上升。在蛋白合成与代谢相关蛋白中,2个蛋白(A13和A22)在花发育的4个阶段都处于低水平表达,而另5个蛋白(B17、B20、A19、A21和 C21)表达量显著上升。一个胁迫与防御相关蛋白(B32)在开花期表达量达到最大值。2个细胞分化与增殖相关蛋白(B27和C57)表达也呈逐渐升高的趋势。5个次生物质代谢相关蛋白(A06、A29、A34、C100和C110)随着花发育而表达逐渐降低,蛋白质C79和D38在花蕾阶段表达达到最大值后,又逐渐呈下降趋势(图5)。
3 讨论
在鉴定得到的差异蛋白中,呼吸与能量代谢所占的比例最大。前人研究表明,能量代谢与植物花发育过程有着密切的联系[16]。在烟草中的研究表明,多个糖代谢关键酶,如 UDP-glucose pyrophosphorylase,sucrose synthase和sucrose phosphate synthase,被发现与花发育有关[17]。同样,通过 2D-PAGE技术,人们发现糖代谢、淀粉代谢、光合作用和光呼吸相关蛋白的表达为白梅正常开花的必要条件[13]。在本研究中,多个能量代谢相关蛋白,如两个ATP合酶α亚基和丙酮酸脱羧化同工酶,都在番荔枝花发育过程呈现显著的差异表达。这可能与花发育过程需要耗费大量的能量有关。
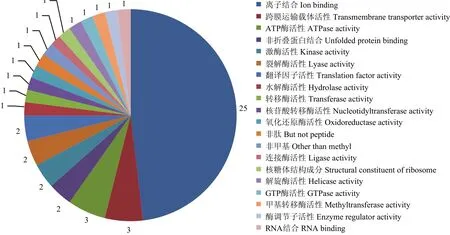
图4 鉴定蛋白的功能分类图Fig. 4 Functional categories of the identified proteins
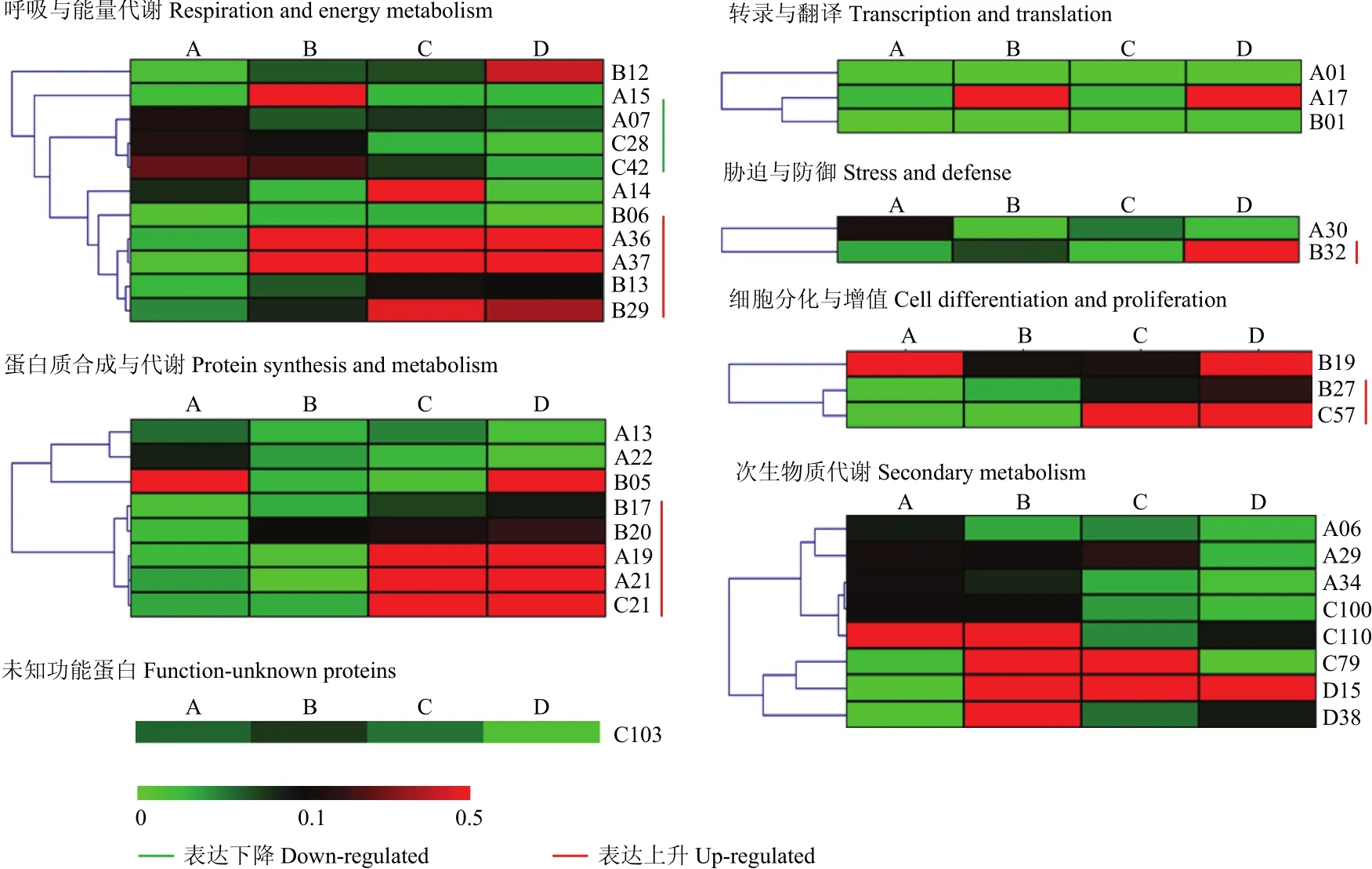
图5 差异蛋白的表达趋势分析Fig. 5 Expression pattern analysis of deferentially expressed proteins
此外,在本研究所鉴定的差异蛋白中,第二大类别为蛋白质合成与代谢相关蛋白。有报道表明,荔枝花发育期,蛋白质合成总体上逐渐增强[18]。在棉花花粉发育过程中,大量与酯酶和过氧化物酶同工酶相关的蛋白质被合成[19]。在本研究中,8个与蛋白合成与代谢相关的蛋白被鉴定为差异蛋白,这表明番荔枝花发育的不同阶段需要不同的蛋白质参与。而细胞的分化与增殖和花发育的关系则有较多的报道。人们研究发现花发育的过程,即是花器官分化和增殖的过程[20]。在拟南芥中,众多的基因,如TSO1、AIL6等控制着花序顶端分生组织的分化与增殖[21-22]。本研究还报道了两个含有三角状五肽重复蛋白(Pentatricopeptide repeat-containing protein),它们的表达随着番荔枝花发育阶段的变化而改变,这些蛋白在花发育过程中的功能还有待于进一步研究。
植物次生代谢及其产物与花发育紧密相连[23]。2-DE凝胶电泳分析揭示大花茉莉整个次生代谢网络,其中花青素的降解、挥发物的形成与其开花有关[24]。高温影响甜椒(Capsicum annuumL.)花粉管的萌发,而次生代谢的一个关键酶——果糖激酶,参与其温度依赖的花粉管萌发[25]。本试验也鉴定了番荔枝果糖激酶,这表明它可能与番荔枝花粉管的萌发有关。
植物花发育过程包括翻译水平、转录水平及转录后水平的调控等,其分子调控机制比较复杂。在鉴定得到的36个差异蛋白中,有3个蛋白与转录和翻译有关,这正说明番荔枝的花发育,也是一个基因转录调控与蛋白翻译调控并存的过程。除了以上蛋白外,还鉴定得到一个功能未知的蛋白C103,这可能和番荔枝蛋白数据库的信息较少有关。
前期笔者通过高通量测序的手段,分析了番荔枝花不同发育阶段的转录组数据。结合蛋白表达谱的分析,发现两者之间存在一定相关性。在转录组中,差异表达基因的27.67%与番荔枝的代谢过程有关[14]。而在本研究中,共有 22.2%的差异表达蛋白与次生物质代谢相关。两者各自占差异基因和差异蛋白的比例非常接近。与呼吸与能量代谢相关的差异蛋白中,V型质子ATP酶亚基B2、磷酸丙糖转运器、脱氧鸟苷-5'-三磷酸酶、丙酮酸脱羧化同工酶 1、丙酮酸脱羧化同工酶2、噻唑生物合成酶等6个蛋白在前期转录组数据中都能关联到相应的差异基因。且 V型质子 ATP酶亚基B2、丙酮酸脱羧化同工酶1和噻唑生物合成酶这 3个蛋白与转录组数据中相关基因的表达趋势一致,推测这些蛋白与番荔枝花发育密切相关。而在蛋白质合成与代谢途径中,谷氨酰胺合成酶和RuBisCO大亚基-结合蛋白α这2个蛋白与转录组数据中的相关基因都呈现出不断上调的表达趋势。在烟草中过量表达谷氨酰胺合成酶改变了植株的开花时间及氮的合成[26]。在朝天椒的雄性不育系及其恢复系的差异蛋白质组研究中也鉴定到了 RuBisCO大亚基-结合蛋白α[27]。这些结果都暗示着这 2个蛋白可能在番荔枝花发育进程中的蛋白质合成代谢途径中发挥着重要的作用。此外,在转录与翻译途径中,富含亮氨酸重复序列的活性蛋白受体激酶蛋白在前期的转录组数据中找到了9个与其相对应的基因。在拟南芥中,富含亮氨酸重复序列的活性蛋白受体激酶蛋白与花粉管的生长密切相关[28-29]。有趣的是,在转录组中共有187个与植物胁迫及防御相关的基因被鉴定为差异基因。在玉米早期花药蛋白质组分析中也找到较多的胁迫与防御相关的基因[30]。而在本试验中,两个与植物防御相关的蛋白,多酚氧化酶和咖啡酰辅酶A-O-甲基转移酶,也得到了鉴定。多酚氧化酶和咖啡酰辅酶A-O-甲基转移酶在转录组数据中分别关联到3个和1个与它们表达趋势一致的差异基因。推测这两个蛋白可能参与了番荔枝花发育胁迫与防御应答过程。蛋白质组和转录组之间的更多相关性以及关联到的差异蛋白与番荔枝花发育之间的关系,还有待进一步深入研究。
4 结论
通过比较番荔枝4个不同花发育阶段的蛋白表达图谱,鉴定得到36个差异蛋白,注释并分析了它们参与的生物学功能。其中包括11个呼吸与能量代谢相关蛋白质,8个蛋白合成与代谢相关蛋白质,2个胁迫与防御相关蛋白质,8个次生物质代谢相关蛋白质,3个细胞分化与增殖相关蛋白质,3个转录与翻译相关蛋白质和一个未知功能蛋白质。结果表明,能量代谢、次生代谢、蛋白质合成等生物过程可能参与了番荔枝开花过程的调控。
[1] 刘锴栋, 袁长春, 敬国兴, 黎海利, 刘金祥. 外源草酸对采后番荔枝后熟及耐藏性的影响. 食品科学, 2013, 34(14): 329-334.LIU K D, YUAN C C, JING G X, LI H L, LIU J X. Effect of exogenous oxalic acid treatment on ripening and preservation ofAnnona squamosaL. fruits during postharvest storage.Food Science,2013, 34(14): 329-334. (in Chinese)
[2] LIU K D, LI H L, YUAN C C, HUANG Y L, CHEN Y, LIU J X.Identification of phenological growth stages of sugar apple (AnnonasquamosaL.) using the extended BBCH-scale.Scientia Horticulturae,2015, 181: 76-80.
[3] 刘锴栋, 黄素娜, 姜艳, 黎海利, 袁长春, 刘金祥, 陈燕. 番荔枝开花调控转录因子基因AsLEAFY的克隆与表达分析. 园艺学报,2015, 42(8): 1467-1476.LIU K D, HUANG S N, JIANG Y, LI H L, YUAN C C, LIU J X,CHEN Y. Cloning and expression analysis of flowering related transcription factorAsLEAFYfrom sugar apple.Acta Horticulturae Sinica, 2015, 42(8): 1467-1476. (in Chinese)
[4] 刘锴栋, 黎海利, 钟舒婷, 袁长春, 陈燕, 刘金祥, 钟军弟. 番荔枝花器官发育基因AsAG的克隆、亚细胞定位及表达分析. 中国农业科学, 2016, 49(1): 142-154.LIU K D, LI H L, ZHONG S T, YUAN C C, CHEN Y, LIU J X,ZHONG J D. Cloning, subcellular localization and expression analysis ofAsAGfrom sugar apple (Annona squamosaL.).Scientia Agricultura Sinica, 2016, 49(1): 142-154. (in Chinese)
[5] 彭松兴, 林超明, 杨帅, 李建国. 阿蒂莫耶番荔枝人工授粉的进一步研究. 福建果树, 2008(2): 1-3, 8.PENG S X, LIN C M, YANG S, LI J G. A further study on hand-pollination ofAnnona atemoyaHort.Fujian Fruits, 2008(2):1-3, 8. (in Chinese)
[6] 邓穗生, 高爱平, 陈业渊. 6种番荔枝属果树雄蕊特性的研究. 热带作物学报, 2012, 33(9): 1654-1658.DENG S S, GAO A P, CHEN Y Y. Characteristics of the stamens of sixAnnonaspp.Chinese Journal of Tropical Crops, 2012, 33(9):1654-1658. (in Chinese)
[7] O'FARRELL P H. High resolution two-dimensional electrophoresis of proteins.Journal of Biological Chemistry, 1975, 250(10): 4007-4021.
[8] TAN F C, SWAIN S M. Genetics of flower initiation and development in annual and perennial plants.Physiologia Plantarum, 2006, 128(1):8-17.
[9] CHEN L, CHEN Q, ZHU Y, HOU L, MAO P. Proteomic identification of differentially expressed proteins during Alfalfa(Medicago sativaL.) flower development.Frontiers in Plant Science,2016, 7: 1502.
[10] 梁艳. 白桦花发育不同时期内源激素及蛋白质变化分析[D]. 黑龙江: 东北林业大学, 2003.LIANG Y. Changes of endogenous hormones and protein expression inBetula platyphyllaSuk during the flower development [D].Heilongjiang: Northeast Forestry University, 2003. (in Chinese)
[11] 游向荣. 龙眼成花转变与成花逆转的差异蛋白质组学研究[D]. 福州: 福建农林大学, 2009.YOU X R. Analysisi of differential proteomics on longan(Dimocarpus longanLour.) floral reversion and normal flowering [D].Fuzhou: Fujian Agriculture and Forestry University, 2009. (in Chinese)
[12] 王珊. 果梅完全花与不完全花相关性状的差异及其蛋白质组学的初步分析[D]. 南京: 南京农业大学, 2008.WANG S. Prelinminary studies on differences of related characteristics between perfect flower and imperfect flower and protemics in Japanese Apricot [D]. Nanjing: Nanjing Agricultural University, 2008. (in Chinese)
[13] GAO Z H, WANG S, CAI B H, FANG J G, ZHANG Z, ZHANG Y M.Proteomic analysis of perfect and imperfect flowers in Japanese apricot (Prunus mumeSieb. et Zucc.).Acta Horticulturae, 2012,932(932): 43-49.
[14] LIU K D, FENG S X, PAN Y L, ZHONG J D, CHEN Y, YUAN C C,LI H L. Transcriptome analysis and identification of genes associated with floral transition and flower development in sugar apple (Annona squamosaL.).Frontiers in Plant Science, 2016, 7: 1695.
[15] YANG P, LI X, WANG X, CHEN H, CHEN F, SHEN S. Proteomic analysis of rice (Oryza sativa) seeds during germination.Proteomics,2007, 7(18): 3358-3368.
[16] LEBON G, RONDEAU M, SANCHEZ L, BARKA EA, VAILLANTGAVEAU N, CLÉMENT C, JACQUARD C. Modulation of the activity of enzymes involved in carbohydrate metabolism during flower development of grapevine (Vitis ViniferaL.).Open Journal of Plant Science, 2016, 1(1): 10-17.
[17] COLEMAN H D, BEAMISH L, REID A, JIYOUNG P, MANSFIELD S D. Altered sucrose metabolism impacts plant biomass production and flower development.Transgenic Research, 2010, 19(2): 269-283.
[18] 肖华山, 吕柳新, 陈伟. 荔枝雌花发育期蛋白质的特异性. 热带作物学报, 2002, 23(4): 33-38.XIAO H S, LV L X, CHEN W. Studies on specific proteins of Litchi(Litchi chinensisSonn.) in the process of female flower development.Chinese Journal of Tropical Crops, 2002, 23(4): 33-38. (in Chinese)
[19] 王林嵩, 陆文梁. 棉花花粉发育过程中同工酶和蛋白质的研究. 西北植物学报, 1997, 17(4): 458-462.WANG L S, LU W L. Study on isoenzyme and proteins during pollen development inGossypium Hirsutum.Acta Botanica Boreali-Occidentalia Sinica, 1997, 17(4): 458-462. (in Chinese)
[20] ZIK M, IRISH V F. Flower development: initiation, differentiation,and diversification.Annual Review of Cell and Developmental Biology, 2003, 19(1): 119-140.
[21] LIU Z, RUNNING M P, MEYEROWITZ E M. TSO1 functions in cell division duringArabidopsisflower development.Development, 1997,124(3): 665-672.
[22] KRIZEK B A, EADDY M. AINTEGUMENTA-LIKE6 regulates cellular differentiation in flowers.Plant Molecular Biology, 2012,78(3): 199-209.
[23] KOTILAINEN M, ALBERT V A, ELOMAA P, HELARIUTTA Y,KOSKELA S, MEHTO M, POLLANEN E, UIMARI A, YU D,TEERI T H.. Flower development and secondary metabolism inGerbera hybrida, an asteraceae.Flowering Newsletter, 1999, 19(28):20-31.
[24] BARAKIVA A, OVADIA R, ROGACHEV I, BAROR C, BAR E,FREIMAN Z, NISSIM-LEVI A, GOLLOP N, LEWINSOHN E,AHARONI A, WEISS D, KOLTAI H, OREN-SHAMIR M. Metabolic networking inBrunfelsia calycinapetals after flower opening.Journal of Experimental Botany, 2010, 61(5): 1393-1403.
[25] KAMI L, ALONI B. Fructokinase and hexokinase from pollen grains of Bell Pepper (Capsicum annuumL.): Possible role in pollen germination under conditions of high temperature and CO2enrichment.Annals of Botany, 2002, 90(5): 607.
[26] SEGER M, GEBRIL S, TABILONA J, PEEL A, SENGUPTAGOPALAN C. Impact of concurrent overexpression of cytosolic glutamine synthetase (GS1) and sucrose phosphate synthase (SPS) on growth and development in transgenic tobacco.Planta, 2015,241:69-81.
[27] WU Z, CHENG J, QIN C, HU Z, YIN C, HU K. Differential proteomic analysis of anthers between cytoplasmic male sterile and maintainer lines inCapsicum annuumL.International Journal of Molecular Sciences, 2013, 14(11): 22982-22996.
[28] CHANG F, GU Y, MA H, YANG Z. AtPRK2 promotes ROP1 activation via RopGEFs in the control of polarized pollen tube growth.Molecular Plant, 2013, 6: 1187-1201.
[29] LIU P L, XIE L L, LI P W, MAO J F, LIU H, GAO S M, SHI P H,GONG J Q. Duplication and divergence of leucine-rich repeat receptor-like protein kinase (LRR-RLK) genes in basal AngiospermAmborella trichopoda.Frontiers in Plant Science, 2016, 7: 1952.
[30] 张智敏, 叶娟英, 龙海飞, 洪玥, 陆平利. 玉米早期花药蛋白质组和磷酸化蛋白质组分析. 生物工程学报, 2016, 32(7): 937-955.ZHANG Z M, YE J Y, LONG H F, HONG Y, LU P L. Global proteomic and phosphoproteomic analysis of the premature maize anther.Chinese Journal of Biotechnology, 2016, 32(7): 937-955. (in Chinese)

