原发性开角型青光眼视网膜纤维层厚度、视野缺损与房水中sCD44浓度的相关性研究
刘思彤,吴志鸿
原发性开角型青光眼(primary open angle glaucoma,POAG)是一种常见的以视网膜神经节细胞(retinalganglial cells, RGC)选择性死亡导致的以视网膜神经纤维层(retinal nerve fiber layer, RNFL)缺损和视野缺损为特征的视神经退行性疾病[1],是目前常见的致盲性眼病之一,占青光眼发病率的60%~70%[2],迄今发病机制尚未明确。除了传统观念的机械压力学说和血管缺血学说,细胞因子也通过多种途径参与到RGC的凋亡过程[3]。国内外研究表明,POAG患者房水中存在较高浓度的可溶性CD44(soluble CD44, sCD44)分子,且其浓度明显高于正常人和原发性闭角型青光眼患者[4,5]。Nolan等[6]研究发现sCD44与POAG患者的视野丢失有关;Knepper等[4,7]研究发现,POAG患者中sCD44具有细胞毒性,可抑制体外培养人眼小梁网细胞(human trabecular meshwork, HTM)和RGC的生长,其在POAG中的等电点明显不同于其他类型青光眼,是POAG的一个生物学特征。本研究旨在探讨POAG患者视网膜视盘周围RNFL厚度及视野缺损程度与房水中sCD44浓度的相关性,以期进一步探索POAG发病原因及机制,并为POAG治疗提供新的靶点。
1 对象与方法
1.1 对象 选取2015-07至2017-05就诊于武警总医院眼科的POAG患者40例(40眼)为研究对象(观察组),其中男17例,女23例,年龄45~70岁,平均(55.47±10.52)岁。按视野平均缺损程度(mean defect,MD)分成A组(MD≤-6 dB,n=14眼)、B组(-6 dB<MD<-12 dB,n=17眼)、C组(MD≥-12 dB,n=9眼)三组。同时选取同期手术,且年龄相匹配的白内障患者20例(22眼)为对照组,包括男9例,女11例,年龄52~70岁,平均(58.39±5.85)岁。本研究由武警总医院伦理委员会批准,获得患者知情同意,并签署知情同意书。
1.2 纳入及排除标准 POAG纳入标准: 经临床诊断为POAG的患者,采用全国青光眼学组提出的标准:(1)眼压>21 mmHg(1 mmHg=0.133 kPa);(2)青光眼性视乳头损害和RNFL缺损;(3)青光眼性视野缺损;(4)前房角开放。具有以上四项或具有1、4项与2或3者才诊断为POAG。白内障对照组纳入标准:(1)术后视力或矫正视力≥0.6,屈光度≤±2.50 D;(2)Goldmann压平眼压计测量眼压≤21 mmHg;(3)视盘C/D<0.6,双眼C/D值差≤0.2;(4)无青光眼家族史;(5)视野检查无异常。排除标准:(1)患心血管系统及免疫系统疾病;(2)曾经历内眼手术和眼部外伤;(3)有视网膜和视神经病变者;(4)有影响免疫的药物用药史;(5)不能进行光学相干断层成像(optical coherence tomography, OCT)检查者;(6)不同意参与本研究者。
1.3 方法
1.3.1 一般检查 所有研究对象均接受全面详细的眼科检查,包括最佳矫正视力,裂隙灯检查,眼压测量,眼底检查,测量眼轴、前房深度及角膜中央厚度。同时均接受全身的基本检查包括心率、血压及病史询问。每次检查均由同一医师完成。
1.3.2 视野检查 采用全自动视野机的阈值检测程序中的中心视野24-2程序进行视野检查,利用SIT A-Fast统计分析策略计算视野MD;采用红外摄像仪自动监测受检眼的固视状态。检查前对患者进行指导并预习操作,检查均由有经验的同一检查者完成。其中,POAG组均于首次就诊时检查,白内障对照组均于术后第二周复查时进行视野检查。
1.3.3 OCT检查 采用德国ZEISS视网膜光学相干断层扫描仪进行OCT检查,RNFL扫描以视乳头为中心,检查参数为:激光波长840 nm,轴向分辨率5 μm,横向分辨率15 μm,扫描深度2 mm,扫描长度12 mm,直径3.45 mm,获取视盘周围RNFL的厚度,选取信号强度在40分以上,图像清晰,无断层的图片。检查均由有经验的同一检查者完成。
1.3.4 房水样本的采集与保存 房水采集于手术中进行,严格按照无菌操作原则,用1 ml注射器于透明角膜缘穿刺进入前房,缓慢抽取房水样本50~100 μl,注入0.5 ml经消毒干燥的Eppendorf管中并作标记,迅速置于-80 ℃冰箱保存。
1.3.5 sCD44浓度测定 采用双抗体夹心免疫酶联吸附法(enzyme linked immunosorbent assay, ELISA)测定房水样本中sCD44的浓度。根据人sCD44 ELISA试剂盒(北京科诺迪有限公司)的监测范围,把房水样本按比例稀释后加入样本孔,试剂盒中的标准品加入标准品孔,每孔50 μl。除空白孔外均加入检测抗体100 μl后按照操作步骤在全自动酶标仪450 nm波长处测定各孔光密度(optical density, OD)值。
1.4 统计学处理 采用SPSS 23.0软件分析数据,计数资料以频数表示,组间比较采用Person χ2检验。计量资料均符合正态分布且方差齐,以x±s表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用LSD-t检验;采用Spearman秩相关检验分析视野MD及RNFL厚度与sCD44浓度的相关性,以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 观察组与对照组在性别、年龄、眼轴方面的比较,差异无统计学意义(P>0.05),具有可比性;但观察组的眼压、杯盘比、视野MD均显著高于对照组,差异均有统计学意义(P<0.05,表1)。
2.2 两组房水中sCD44浓度的比较 观察组房水中sCD44平均浓度为(217.17±25.36)ng/L,显著高于对照组的(137.94±16.55)ng/L,差异有统计学意义(t=-13.17,P<0.001)。A、B、C三个亚组中 POAG 患者与对照组房水中sCD44浓度比较结果见表2,经单因素方差分析各组sCD44浓度不全相同(F=197.38,P<0.001);进一步行LSD-t检验,A、B、C三组房水中sCD44浓度均较对照组显著升高,差异均有统计学意义(P<0.05);A、B、C三组房水中sCD44浓度依次升高,各组间比较差异均有统计学意义(P<0.05)。
表1 原发性开角型青光眼患者与白内障患者一般资料的比较

表1 原发性开角型青光眼患者与白内障患者一般资料的比较
注:观察组为原发性开角型青光眼患者,对照组为白内障患者;MD,平均缺损;1 mmHg=0.133 kPa
组别 例数 男/女 年龄(岁) 眼压(mmHg) 眼轴(mm) 杯盘比 视野MD(dB)观察组 40 17/23 55.47±10.52 29.83±6.73 24.45±0.83 0.77±0.24 -10.46±7.37对照组 20 9/11 58.39± 5.85 17.22±3.16 24.50±0.98 0.26±0.08 -1.64±0.74 t/χ2值 0.03 -1.42 10.10 -0.21 1.94 -7.50 P值 0.85 0.16 <0.001 0.840 <0.001 <0.001
2.3 两组视盘周围RNFL厚度的比较 观察组视盘周围RNFL平均厚度为(86.02±17.03)μm,显著低于对照组的(117.98±11.38)μm,差异具有统计学意义(t=9.65,P<0.001)。观察组内A、B、C三个亚组与对照组视盘周围RNFL厚度比较见表2,经单因素方差分析各组RNFL厚度不全相同(F=135.96,P<0.001);进一步行LSD-t检验,A、B、C三组RNFL厚度均较对照组变薄,差异均有统计学意义(P<0.05);A、B、C三组RNFL厚度依次变薄,各组间差异均有统计学意义P<0.05)。
表2 原发性开角型青光眼患者与白内障患者视野MD、RNFL厚度及房水中sCD44浓度比较

表2 原发性开角型青光眼患者与白内障患者视野MD、RNFL厚度及房水中sCD44浓度比较
注:观察组为原发性开角型青光眼患者,对照组为白内障患者;MD,平均缺损;sCD44,可溶性CD44;RNFL,视神经纤维层;与对照组相比,①P<0.05;与A组相比,②P<0.05;与B组相比,③P<0.05
组别 例数 视野MD(dB) sCD44 浓度(ng/L)视盘RNFL厚度(μm)对照组 22 -1.37±0.60 137.94±16.55 117.98±11.38观察组A组 14 -5.03±0.49① 189.14±16.71① 98.56± 7.52①B组 17 -8.82±1.70①② 224.17± 7.48①② 87.07±11.65①②C组 9 -22.82±5.46①②③ 247.55± 7.29①②③ 64.54± 8.61①②③F值 199.64 197.38 135.96 P值 <0.001 <0.001 <0.001
2.4 两组房水样本中sCD44浓度与视野MD及RNFL厚度相关性分析 对两组房水样本中sCD44浓度与视野MD行Spearman秩相关分析(图1),结果显示:房水中sCD44的浓度与视野MD值呈显著负相关(rs=-0.916,P<0.05)。对两组房水样本中sCD44浓度与视盘周围RNFL厚度行Spearman秩相关分析(图2),结果显示:房水中sCD44的浓度与视盘周围RNFL厚度值呈显著负相关(rs=-0.915,P<0.05)。
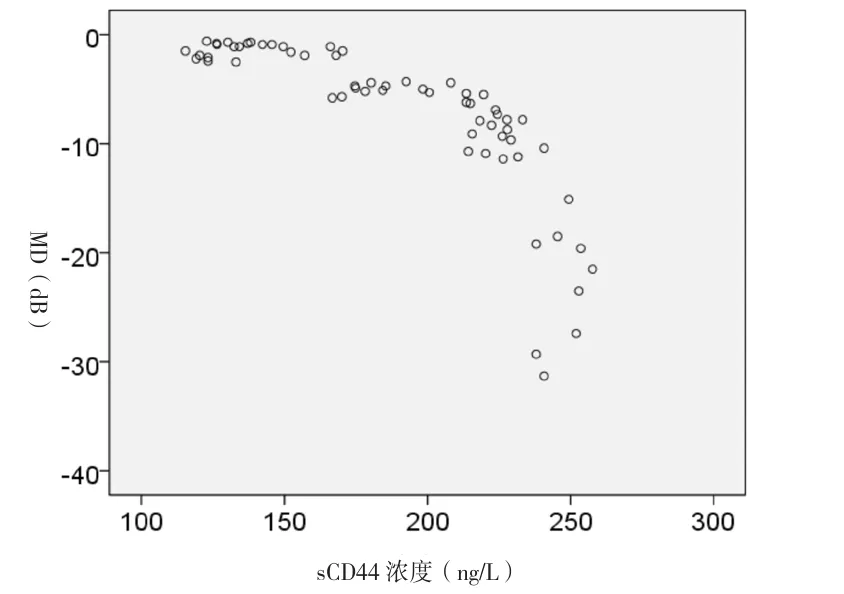
图1 两组sCD44浓度与视野MD散点图
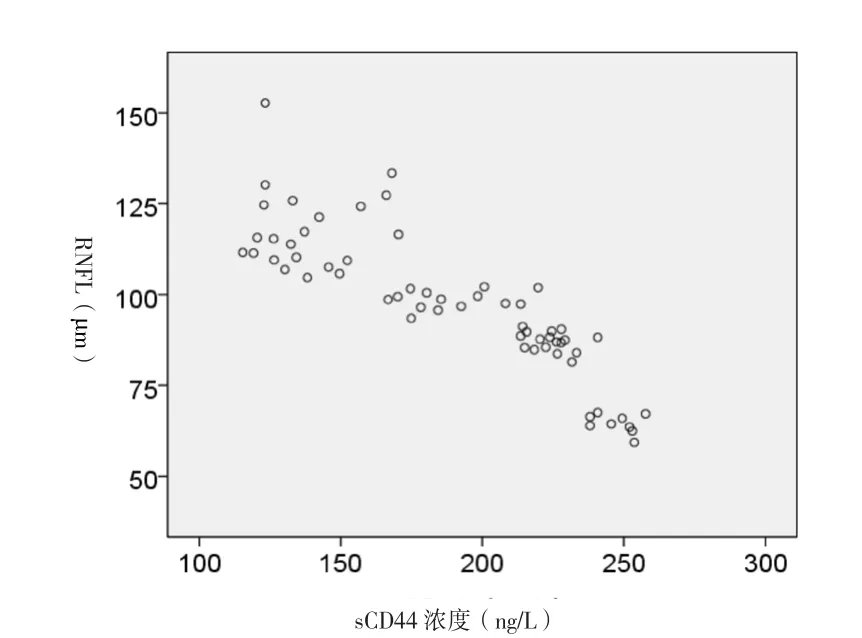
图2 两组sCD44浓度与视盘RNFL厚度散点图
3 讨 论
POAG与闭角型青光眼不同,临床表现多样,无明显症状,早期不易发现,因而具有更大的危险性[8]。以往的研究发现,HTM与RGC的凋亡是青光眼发病的一个重要因素。青光眼的病理基础主要是由RGC及其轴突的丢失,从而导致盘沿、视乳头形态凹陷和RNFL的厚度发生改变,最终导致视野缺损甚至失明。临床研究发现,当RGCs丢失达30%~50%时,临床才能检测到视功能损害,但此时已处于疾病中晚期[9]。有研究报道,当视网膜光敏度下降5 dB时,RGCs丢失高达20%[10]。随着OCT技术的发展,临床上可通过测量RNFL的厚度对青光眼患者进行早期诊断[11],并有研究证明RNFL厚度的改变与视野缺损对POAG的诊断具有一致性[12],但OCT的RNFL检测对未出现视野缺损青光眼患者的诊断价值具有争议。随着分子生物学的发展,细胞因子sCD44在POAG发病及诊断中的价值逐渐受到重视。
CD44是一种广泛分布于多种细胞表面的跨膜糖蛋白,其配体主要为透明质酸(hyaluronic acid, HA),具有促进细胞生长、增殖、黏附、发育及分化的作用。在角膜内皮细胞、虹膜、睫状体及小梁网组织中均检测到CD44的表达。sCD44属于黏附分子CD44家族成员之一,是由膜CD44分子外功能区受到各种因素的影响脱落形成并存在于体液中的功能片段[13],可在房水中检测到其表达。Miller等[14]发现sCD44蛋白含量在POAG患者玻璃体中的浓度明显高出正常人3倍多。sCD44在功能上对抗CD44,与HTM表面CD44竞争结合HA,从而干扰细胞内信号转导,进而参与POAG的发病过程[15,16]。此外,CD44是线粒体发挥功能的必要蛋白,sCD44竞争成为线粒体内蛋白使线粒体嵴断裂,导致细胞死亡也可能是引起POAG的机制之一[17]。Choi等[18]研究发现POAG中sCD44具有细胞毒性,可作用于体外培养人眼TM和RGC,抑制细胞的生长。凌云与刘海霞[19]研究指出sCD44的生物利用度不仅依赖HA,且这种结合力受眼压影响,随着眼压升高,HA聚合物发生变化,与sCD44结合力降低,游离的sCD44浓度升高,一旦超过临界值,就会对靶细胞产生毒性作用。sCD44在POAG中的等电点明显不同于其他类型青光眼,低磷酸化sCD44的出现及其浓度的升高是POAG及正常眼压性青光眼的特异性指标。本研究也证实了POAG患者中sCD44浓度平均较对照组明显增高,差异具有统计学意义。
尽管国内外研究都表明,POAG患者房水中存在较高浓度的sCD44,且其浓度明显高于正常人和原发性闭角型青光眼患者,但房水中sCD44的浓度与视野损害程度及视盘RNFL厚度的相关性研究报道较少。本研究结果显示,POAG患者房水中sCD44的浓度与视野MD及视盘RNFL厚度均呈显著负相关,随着sCD44浓度的升高,视野MD逐渐变大,视盘RNFL厚度逐渐变薄,说明房水中sCD44浓度与视野MD及RNFL有关,即sCD44浓度与POAG病程相关,其浓度越高,RNFL及视野的损害越严重,这与文献[4,7]的研究结果相同。分析原因,可能是sCD44浓度的升高造成RGC的凋亡及丢失,使得RNFL变薄,从而影响视野;也有可能是sCD44通过促进TM凋亡,进而增加房水排出阻力,引起POAG的发生[20]。
总之,本研究发现在POAG患者房水中sCD44浓度升高,且与视野MD及视盘RNFL厚度呈负相关,这为治疗和预防POAG进展提供了新的思路。但目前对sCD44如何通过房水作用于TM及RGC,从而引起POAG发生的作用机制尚未完全阐释,今后仍需进一步研究。
[1]张 勇, 谢 琳. 青光眼患者房水中细胞因子的研究进展[J]. 国际眼科杂志, 2017, 17(10): 1864-1866. DOI:10.3980/j.issn.1672-5123.2017.10.15.
[2]蔡克波, 朱 颖. 银杏叶胶囊对眼压控制的开角型青光眼患者视神经保护作用的研究[J]. 医学临床研究 , 2016, 33(1): 106-111. DOI: 10.3969/j.issn.1671-7171.2016.01.035.
[3]Huang P, Qi Y, Xu Y S, et al. Serum cytokine alteration is associated with optic neuropathy in human primary open angle glaucoma [J]. J Glaucoma, 2010, 19(5) : 324-330.DOI: 10.1097/IJG.0b013e3181b4cac7.
[4]Knepper P A, Mayanil C S, Goossens W, et al. Aqueous humor in primary open-angle glaucoma contains an increased level of CD44S [J]. Invest Ophthalmol Vis Sci,2002, 43(1): 133-139.
[5]李中国, 王林农. 可溶性CD44分子在不同类型青光眼房水中的表达特征及意义[J]. 实用医学杂志, 2008, 24(19): 3321-3323. DOI: 10.3969/j.issn.1006-5725.2008.19.018.
[6]Nolan M J, Giovingo M C, Miller A M, et al. Aqueous humor sCD44 concentration and visual field loss in primary open-angle glaucoma [J]. J Glaucoma, 2007, 16(5): 419-429. DOI: 10.1097/IJG.0b013e318050ab4b.
[7]Knepper P A, Miller A M, Choi J, et al. Hypophosphrylation of aqueous humor sCD44 and primary open-angle glaucoma [J]. Invest Ophthalmol Vis Sci, 2005, 46(8):2829-2837. DOI: 10.1167/iovs.04-1472.
[8]Fard M A, Afzali M, Abdi P, et al. Comparison of the pattern of macular ganglion cell-inner plexiform layer defect between ischemic optic neuropathy and open-angle glaucoma [J]. Invest Ophthalmol Vis Sci, 2016, 57(3):1011-1016. DOI: 10.1167/iovs.15-18618.
[9]王亚丽, 吴青松, 李家璋, 等. OCT检测POAG患者RNFL厚度的改变及视野缺损情况[J]. 国际眼科杂志 , 2017, 17(9): 1716-1719. DOI: 10.3980/j.issn.1672-5123.2017.9.28.
[10]傅诗雅. 青光眼动物模型中自噬与视网膜神经节细胞的关系[J]. 中华实验眼科杂志, 2017, 35(2): 180-183.DOI: 10.3760/cma.j.issn.2095-0160.2017.02.018.
[11]潘艳杰, 王保君, 张海涛, 等. 视网膜神经节细胞复合体厚度与神经纤维层厚度的相关性以及在青光眼诊断中的意义[J]. 眼科新进展, 2013, 33(9): 843-846. DOI:10.13389/j.cnki.rao.2013.09.019.
[12]Shah S B, Garcia A G, Leiby B E, et al. Color reflectivity discretization analysis of OCT images in the detection of glaucomatous nerve fiber layer defects [J]. J Glaucoma, 2016,25(4): 346-354. DOI: 10.1097/IJG.0000000000000363.
[13]Zhang Y, Thant A A, Machida K, et al. Hyaluronan-CD44s signaling regulates matrix metalloproteinase-2 secretion in a human lung carcinoma cell line QG90 [J]. Cancer Res,2002, 62(14): 3962-3965.
[14]Miller A M, Choi J, Knepper P A. Does the vitreous humor act as a reservoir for cytotoxic sCD44? [J]. Invest Ophthalmol Vis Sci, 2002, 43(13): 1033.
[15]Bajorath J. Molecular organization,structural features,and ligand binding characteristics of CD44, a highly variable cell surface glycoprotein with multiple functions[J]. Proteins, 2000, 39(2): 103-111. DOI: 10.1002/(SICI)1097-0134(20000501)39:23.3.CO;2-7.
[16]Budak Y U, Akdogan M, Huysal K. Aqueous humor level of sCD44 in patients with degenerative myopia and primary open-angle glaucoma [J]. BMC Res Notes, 2009, 2(1):224. DOI: 10.1186/1756-0500-2-224.
[17]陈书扬, 吴瑜瑜, 朱益华, 等. 体外培养人眼小梁细胞黏附分子CD44s的表达[J]. 福建医科大学学报, 2005, 39(3): 284-287. DOI: 10.3969/j.issn.1672-4194.2005.03.011.
[18]Choi J, Miller A M, Nolan M J, et al. Soluble CD44 is cytotoxic to trabecular meshwork and retinal ganglion cells in vitro [J]. Invest Ophthalmol Vis Sci, 2005, 46(1): 214-222. DOI: 10.1167/iovs.04-0765.
[19]凌 云, 刘海霞. 高度近视与原发性开角型青光眼的关联机制[J]. 华中科技大学学报(医学版), 2013,42(6): 737-740. DOI: 10.3870/j.issn.1672-0741.2013.06.026.
[20]梁宗宝. sCD44分子对POAG小梁网细胞凋亡的影响及相关凋亡信号通路的研究[D]. 福州: 福建医科大学,2011.

