RAW 264.7细胞与骨髓源巨噬细胞向破骨细胞分化特性的比较
曾 立,耿 欢,邢更彦
骨质疏松症是一种由于骨形成和骨吸收的负相平衡导致骨骼脆弱,以骨量减少与骨的微观结构破坏为特点并增加了骨折风险为特征的疾病[1]。中国已进入老龄社会,随着老年人口比例的增加和人均寿命的延长,骨质疏松症及骨质疏松性骨折的发病率逐年提升。骨质疏松性骨折是骨质疏松症最严重的后果,也是导致中老年人残疾并丧失自理能力最常见的原因之一[2]。
骨质疏松症与破骨细胞数量增多和骨吸收活性的增强有密切联系[3],破骨细胞是骨组织中由单核巨噬细胞分化来的、特殊的,且唯一具有吞噬骨组织功能的多核巨细胞[4,5],因此,对破骨细胞的研究非常重要。简捷快速获取破骨细胞是进行相关实验的前提,然而,破骨细胞是终末分化的细胞,无法传代,在体外存活时间短,获取相对困难[6]。目前,科研人员主要用RAW 264.7细胞与骨髓源巨噬细胞(bone marrow-derived macrophages,BMMs)来诱导破骨细胞。RAW 264.7细胞是小鼠单核巨噬细胞白血病细胞,BMMs是骨髓来源的巨噬细胞[7],RAW 264.7是较BMMs更晚期分化阶段的破骨细胞前体细胞[8],两者诱导破骨细胞的效率与诱导出破骨细胞的功能是否有差异还需深入研究。本实验旨在观察小鼠单核巨噬细胞RAW 264.7与BMMs在核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)的诱导下生成破骨细胞数量与骨吸收功能的差异,以研究RAW 264.7细胞是否可替代BMMs用于诱导破骨细胞。
1 材料与方法
1.1 试剂与材料 α-MEM培养基、DMEM培养基、胎牛血清(Gibco公司,美国);抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(Sigma公司,美国);CD11b抗体(Abcam,英国);RANKL、巨噬细胞集落刺激因子(macrophage colonystimulating factor,M-CSF)(R&D公司,美国);鬼笔环肽染色液(Invitrogen,美国);25 cm2培养瓶、24孔骨细胞培养板(康宁,美国);红细胞裂解液(上海碧云天);荧光倒置显微镜(奥林巴斯,日本);4周雄性C57BL/6小鼠(购自北京维通利华);RAW 264.7小鼠单核巨噬细胞(购自北京协和细胞库)。
1.2 实验方法
1.2.1 小鼠BMMs的提取与培养 4周雄性C57BL/6小鼠麻醉后脱臼处死,75%乙醇浸泡5 min,于超净台中取出股骨与胫骨,剪去干骺端,用5 ml注射器抽取无菌磷酸缓冲盐溶液(phosphate-buffered saline,PBS)冲洗骨髓腔,动作轻柔,直至冲出的PBS由淡红色变为透亮的白色。收集冲洗液离心(200×g,3 min),弃上清;沉淀加入5倍体积红细胞裂解液,于冰上裂解10 min,离心(200×g,3 min),弃上清;沉淀用α-MEM培养基重悬,离心(200×g,3 min),弃上清;5 mlα-MEM完全培养基(含10%胎牛血清,1%青链霉素)重悬沉淀;接种至25 cm2培养瓶,每毫升α-MEM完全培养基加入30 ng M-CSF,置于CO2培养箱(37℃,5% CO2)培养[9],3 d后对贴壁细胞进行免疫荧光鉴定。实验重复3次。
1.2.2 小鼠单核细胞的CD11b免疫荧光鉴定 将上步所得贴壁细胞悬液接种至激光共聚焦培养皿;加入1 ml含有30 ng/ml M-CSF的α-MEM完全培养基,第2天细胞贴壁良好后,去除培养液,PBS漂洗2遍,4%多聚甲醛固定20 min,PBS漂洗2遍,0.1% Triton-100通透10 min,PBS漂洗2遍,3%牛血白蛋白(bovine serum albumin,BSA)室温封闭1 h,PBS漂洗2遍,阳性组加入500 μl稀释好的CD11b抗体,阴性对照组加入500 μl正常兔IgG抗体。4 ℃孵育过夜后PBS漂洗3遍,10 min/次,加入500 μl绿色荧光二抗室温孵育2 h,PBS洗3遍,10 min/次,加入500 μl Hoechst染色10 min后,激光共聚焦显微镜观察并采集图片。实验重复3次。
1.2.3 破骨细胞的诱导 BMMs细胞悬液(5×103/cm2)接种至48孔板中,每孔加入500 μlα-MEM完全培养基(含M-CSF,20 ng/ml;RANKL,20 ng/ml)诱导,每2 d换液,4 d后可见破骨细胞。以5×103/cm2的密度将RAW 264.7细胞接种于48孔板中,每孔加入500 μl DMEM高糖完全培养基(含RANKL,20 ng/ml)诱导,每2 d换液,4 d后进行TRAP染色。实验重复3次。
1.2.4 破骨细胞的TRAP染色 BMMs及RAW 264.7细胞用上述方法诱导后,两种细胞分别设立对照组与诱导组,对照组不加RANKL。诱导4 d后,去除原培养基,PBS漂洗2遍,4%多聚甲醛固定20 min,PBS漂洗2遍,0.1%Triton-100通透10 min,PBS漂洗2次,加入TRAP染色液;避光37℃孵育1 h,PBS洗2遍,肉眼可见孔内细胞被染为酒红色,显微镜下观察。实验重复3次。
1.2.5 破骨细胞纤维肌动蛋白环的荧光染色 BMMs及RAW 264.7细胞经RANKL诱导4 d后,去除原培养基,PBS漂洗2次,4%多聚甲醛室温固定20 min,PBS漂洗2遍,0.1% Triton-100通透10 min,PBS漂洗2次,鬼笔环肽染色20 min,PBS漂洗2遍,Hoechst染色10 min,PBS漂洗2遍,荧光显微镜下采集照片。
1.2.6 破骨细胞骨吸收功能检测 BMMs及RAW 264.7细胞以5×103/cm2的密度接种于24孔骨细胞培养板,均设对照组与诱导组,用上述方法诱导,对照组不加RANKL。每2 d换液,4 d后移除培养液,用去离子水漂洗2遍,加入4%次氯酸钠漂洗5 min;去离子水漂洗2遍,室温晾干,普通倒置显微镜下观察。实验重复3次。
1.3 统计学处理 采用SPSS 16.0 统计软件对数据进行统计学分析,实验数据均为计量资料,组间比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 BMMs表面抗原CD11b的鉴定 骨髓原始细胞经M-CSF刺激培养后,表面CD11b抗体检测显示:阳性组几乎所有的细胞均被染成了绿色,蓝色为细胞核,阴性对照组未被染上绿色,证实原始细胞经M-CSF刺激后所得的细胞是BMMs,见图1。
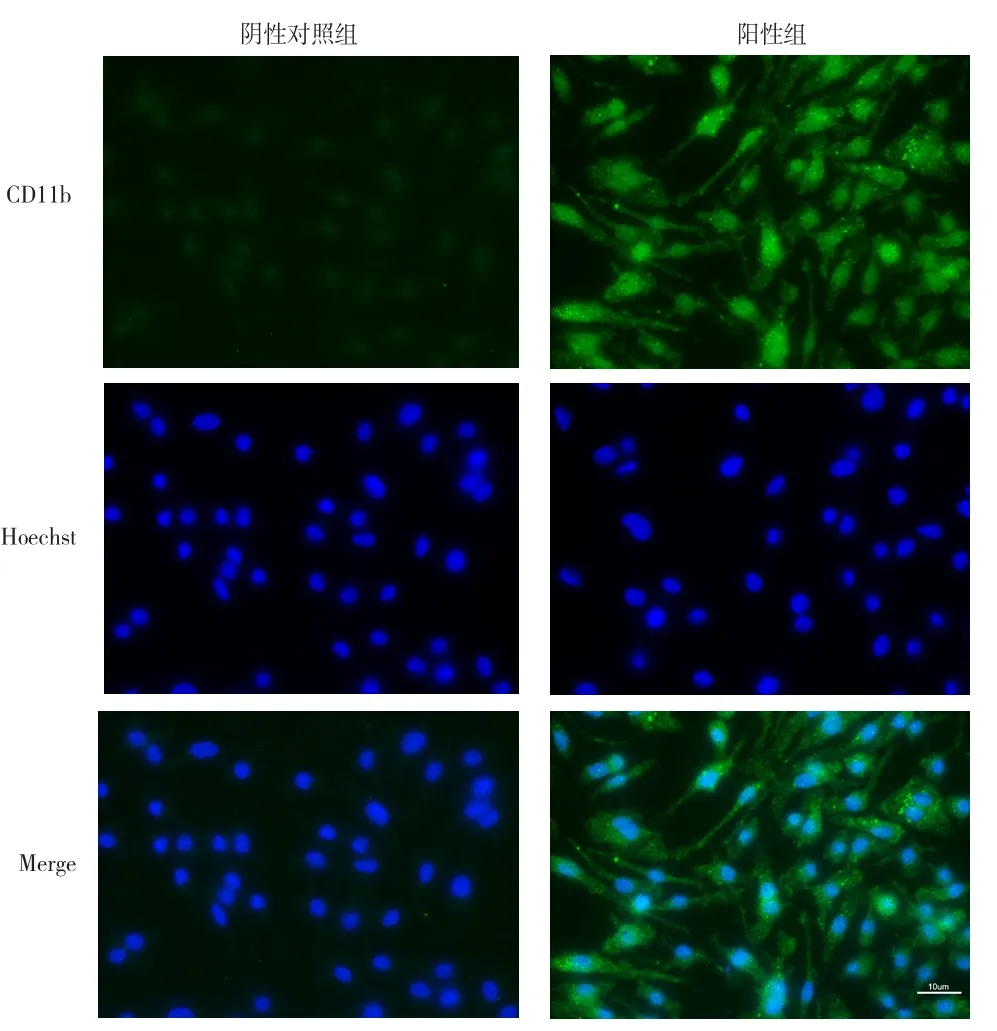
图1 CD11b在BMMs中的表达(标尺=10 μm)
2.2 破骨细胞的TRAP染色结果 RAW 264.7细胞与BMMs诱导4 d后出现大量圆形、椭圆形体积巨大细胞,行TRAP染色可见为酒红色(TRAP阳性)的多核巨细胞,有的核可达上百个,对照组未见TRAP阳性的多核巨细胞,见图2。即RAW 264.7细胞与BMMs均可诱导出大量TRAP阳性的破骨细胞,结果显示,BMMs与RAW 264.7细胞诱导出的破骨细胞数量差异无统计学意义。
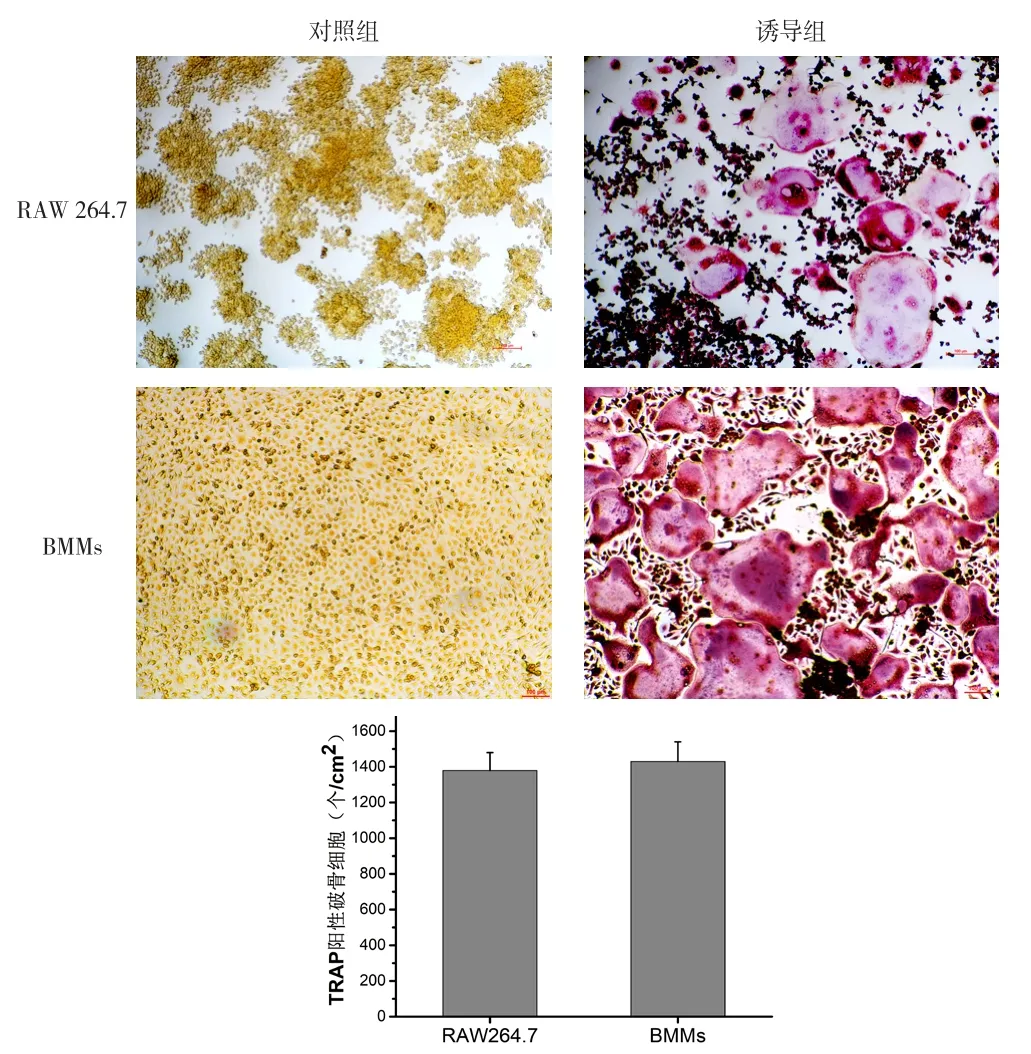
图2 RAW 264.7细胞与BMMsTRAP染色(标尺 =100 μm)
2.3 破骨细胞纤维肌动蛋白环的荧光染色 诱导4 d后红色鬼笔环肽染色显示,RAW 264.7细胞与BMMs经过诱导均出现形成纤维肌动蛋白环的成熟破骨细胞,复染Hoechst可见细胞内有大量的蓝色细胞核,有的可达上百个,统计分析后两种细胞诱导出的具有纤维肌动蛋白环结构的细胞数量差异无统计学意义,见图3。
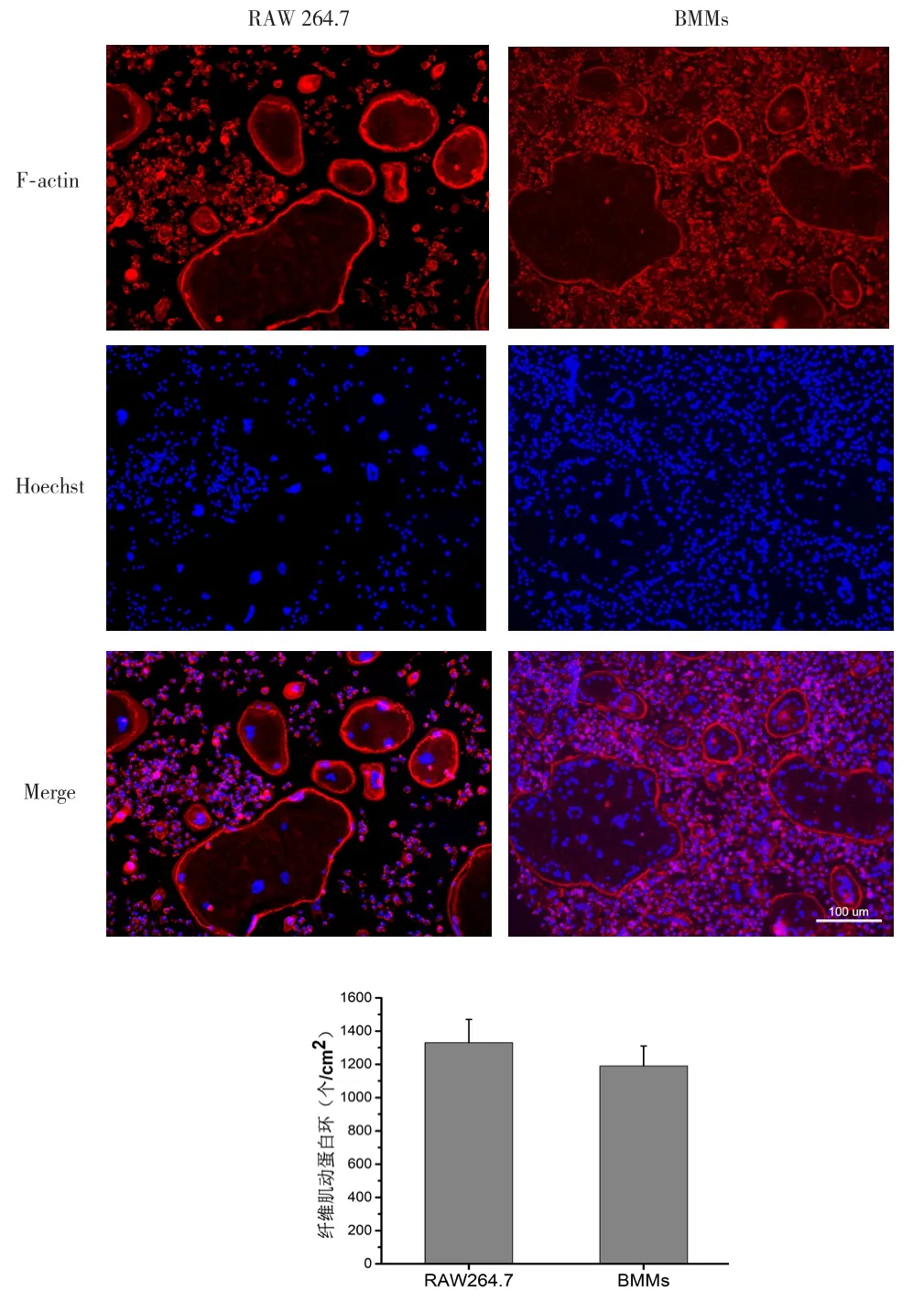
图3 RAW 264.7细胞与BMMs红色鬼笔环肽染色(标尺 =100 μm)
2.4 破骨细胞的骨板吸收结果 RAW 264.7细胞与BMMs在24孔骨细胞培养板中诱导4 d后,可见大量圆形、椭圆形、不规则形的白色吸收瘢痕,对照组未见吸收瘢痕;RAW 264.7细胞与BMMs诱导出的破骨细胞在骨细胞培养板上的吸收瘢痕差异无统计学意义,见图4。
3 讨 论

图4 RAW 264.7细胞与BMMs经RANKL诱导后的骨吸收结果(标尺=100 μm)
长期以来多数研究人员认为骨的生理平衡主要是通过内分泌系统来调节的,但研究表明,免疫系统与神经系统在骨生理平衡的调节过程中起着重要作用[10,11]。成骨细胞的骨形成与破骨细胞的骨吸收维持着骨组织的稳态,打破这种稳态会导致骨代谢性紊乱疾病如骨质疏松症[12]、骨硬化病等。破骨细胞是由单核巨噬细胞融合而来[13],是骨组织中唯一具有骨吸收功能的细胞,研究破骨细胞对发现药物的新靶点具有重要意义。M-CSF与RANKL是破骨细胞分化与成熟过程中最重要的两个细胞因子[4],用M-CSF与RANKL可诱导单核细胞分化为破骨细胞[14]。M-CSF促进单核细胞的增殖与细胞骨架的形成,RANKL是破骨细胞分化的关键细胞因子,其与破骨细胞前体细胞上RANK受体结合后,募集下游的肿瘤坏死因子受体相关因子6结合到RANK在胞内的特殊结构域[14,15],激活向破骨细胞分化的信号通路,如MAPKs与NF-κB信号通路[16],激活转录因子NFATC1,最终引起破骨细胞分化[17]。
BMMs是骨髓源巨噬细胞,CD11b是巨噬细胞的特殊表面标记[18],表达CD11b的巨噬细胞可经RANKL诱导分化为破骨细胞[7],通过CD11b免疫荧光鉴定骨髓原始细胞经M-CSF刺激获得的贴壁细胞为巨噬细胞。研究证实,BMMs可经M-CSF与RANKL诱导为成熟的破骨细胞[15],而RAW 264.7细胞是小鼠单核巨噬细胞系,只需RANKL刺激即可分化为破骨细胞[3]。二者是体外诱导破骨细胞的主要细胞来源,但在破骨分化的效率及破骨细胞的活性差异方面研究较少。
RAW 264.7细胞与BMMs诱导破骨细胞需要4 d[19],且在诱导破骨细胞生成的过程中,影响其生成效率的最关键因素不是RANKL的浓度,而是破骨细胞前体细胞的接种密度[13,19]。本实验结果显示,RAW 264.7细胞与BMMs经20 ng/ml RANKL诱导4 d后均出现TRAP阳性与纤维肌动蛋白环形成的成熟多核破骨细胞,同时两种细胞诱导出的破骨细胞骨吸收活性均较好。RAW 264.7细胞与BMMs诱导破骨细胞效率与时间无差异,且破骨细胞的骨吸收能力也无统计学差异。但BMMs获取繁琐,纯化困难且需M-CSF刺激,耗时费力,RAW 264.7细胞培养简单且只需要RANKL就可诱导出大量的破骨细胞。
总之,本研究发现RAW 264.7细胞与BMMs向破骨细胞分化的特性无明显差异,但鉴于RAW 264.7细胞培养简单且易于诱导出大量破骨细胞,笔者认为可以用其替代BMMs诱导破骨细胞。
[1]Hayashi M, Nakashima T, Taniguchi M, et al.Osteoprotection by semaphorin 3A [J]. Nature, 2012, 485(7396): 69-74. DOI: 10.1038/nature11000.
[2]Kanis J A, Oden A, Johnell O, et al. The burden of osteoporotic fractures: A method for setting intervention thresholds [J]. Osteoporosis Int, 2001, 12(5): 417-427.DOI: 10.1007/s001980170112.
[3]Rodan G A, Martin T J. Therapeutic approaches to bone diseases [J]. Science, 2000, 289(5484): 1508-1514.DOI: 10.1126/science.289.5484.1508.
[4]Luo J, Yang Z, Ma Y, et al. LGR4 is a receptor for RANKL and negatively regulates osteoclast differentiation and bone resorption [J]. Nat Med, 2016, 22(5): 539-546. DOI:10.1038/nm.4076.
[5]耿 欢,林 琛,邢更彦. 小鼠巨噬细胞系RAW 264.7向破骨细胞分化的诱导条件 [J]. 中华灾害救援医学, 2017, 5(3): 143-147. DOI: 10.13919/j.issn.2095-6274.2017.03.006.
[6]Wang Y, Brooks P J, Jang J J, et al. Role of actin filaments in fusopod formation and osteoclastogenesis [J]. Biochim Biophys Acta, 2015, 1853 (7): 1715-1724. DOI:10.1016/j.bbamcr.2015.04.001.
[7]Takeshita S, Kaji K, Kudo A. Identification and characterization of the new osteoclast progenitor with macrophage phenotypes being able to differentiate into mature osteoclasts [J]. J Bone Miner Res, 2000, 15 (8):1477-1488. DOI: 10.1359/jbmr.2000.15.8.1477.
[8]Xu J, Wang C, Han R, et al. Evidence of reciprocal regulation between the high extracellular calcium and RANKL signal transduction pathways in RAW cell derived osteoclasts [J]. J Cell Physiol, 2005, 202(2): 554-562. DOI: 10.1002/jcp.20159.
[9]Ye S, Fowler T W, Pavlos N J, et al. LIS1 regulates osteoclast formation and function through its interactions with dynein/dynactin and Plekhm1 [J]. PloS One, 2011, 6(11):e27285. DOI: 10.1371/journal.pone.0027285.
[10]Elefteriou F. Regulation of bone remodeling by the central and peripheral nervous system [J]. Arch Biochem Biophy,2008, 473(2): 231-236. DOI: 10.1016/j.abb.2008.03.016.
[11]Takayanagi H. Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems [J]. Nat Rev Immunol, 2007, 7(4): 292-304. DOI: 10.1038/nri2062.
[12]Seeman E, Delmas P D. Bone quality-the material and structural basis of bone strength and fragility [J]. New Engl J Med, 2006, 354(21): 2250-2261. DOI: 10.1056/NEJMra053077.
[13]Takeshita S, Namba N, Zhao J J, et al. SHIP-deficient mice are severely osteoporotic due to increased numbers of hyper-resorptive osteoclasts [J]. Nat Med, 2002, 8(9):943-949. DOI: 10.1038/nm752.
[14]Heo D N, Ko W K, Moon H J, et al. Inhibition of osteoclast differentiation by gold nanoparticles functionalized with cyclodextrin curcumin complexes [J]. Acs Nano, 2014, 8(12): 12049-12062. DOI: 10.1038/srep27336.
[15]Boyle W J, Simonet W S, Lacey D L. Osteoclast differentiation and activation [J]. Nature, 2003, 423(6937):337-342. DOI: 10.1038/nature01658.
[16]Pengjam Y, Madhyastha H, Madhyastha R, et al. NF-kappa B pathway inhibition by anthrocyclic glycoside aloin is key event in preventing osteoclastogenesis in RAW 264.7 cells [J]. Phytomedicine, 2016, 23(4): 417-428. DOI:10.1016/j.phymed.2016.01.006.
[17]Chen N, Gao R F, Yuan F L, et al. Recombinant human endostatin suppresses mouse osteoclast formation by inhibiting the NF-kappa B and MAPKs signaling pathways[J]. Front Pharmacol, 2016, 7: 145. DOI: 10.3389/fphar.2016.00145.
[18]Serafini P, Borrello I, Bronte V. Myeloid suppressor cells in cancer: Recruitment, phenotype, properties,and mechanisms of immune suppression [J]. Semin Cancer Biol, 2006, 16(1): 53-65. DOI: 10.1016/j.semcancer.2005.07.005.
[19]Levaot N, Ottolenghi A, Mann M, et al. Osteoclast fusion is initiated by a small subset of RANKL-stimulated monocyte progenitors, which can fuse to RANKL-unstimulated progenitors [J]. Bone, 2015, 79: 21-28. DOI: 10.1016/j.bone.2015.05.021.

