经自然腔道取标本完全腹腔镜下结直肠癌根治术的研究*
赵丹,陈杰,丁成明,贾泽明,彭健
(中南大学湘雅医院 普外科,湖南 长沙 410008)
随着生活水平的提高我国结直肠癌的发生率也逐年增高,腹腔镜手术为结直肠癌患者带来了福音,与开腹手术相比,腹腔镜手术更具优势[1-2]:如创伤小、恢复快、全身反应轻、痛苦小和符合美容学要求等,自20世纪80年代以来腹腔镜下结直肠癌根治术迅猛发展,并逐步取代开腹式结直肠癌根治术,成为结直肠癌治疗的首选手术方式,越来越受到广大患者及外科医师的青睐。但是,传统的腹腔镜结直肠手术方法仍然存在一些安全隐患[3-4],如腹壁的辅助切口有时愈合时间长,有发生切口感染、切口疝等风险,增加患者痛苦和住院成本。因此,笔者创新性使用经自然腔道取标本(natural orifice specimen extraction,NOSE)法,在完全腹腔镜下完成手术,经肛门或阴道取出标本,并与传统腹腔镜方法进行比较,观察两组的术中状况、术后康复和生活质量指标,探讨NOSE法在安全性、可行性以及术后效果上是否具有优势,为腹腔镜结直肠癌的治疗提供新的思路和选择。
1 资料与方法
1.1 一般资料
选取2015年4月-2017年6月入住我科的40例结直肠癌患者,所有患者均完善了常规术前检查,符合病例纳入标准要求。两组患者的年龄、性别、体质指数(body mass index,BMI)及肿瘤大小等一般资料差异无统计学意义(P>0.05),具有可比性。NOSE组20例,其中男12例,女8例,平均(52.15±3.50)岁,BMI 21.7 kg/m2;传统腹腔镜组20例,其中男13例,女7例,平均(53.05±4.50)岁,BMI 20.6 kg/m2。本研究经过医院伦理委员会通过。
1.2 病例纳入与排除标准
1.2.1 纳入标准 ①年龄≥18岁且≤65岁;②术前完善肠镜检查并经肠镜取活检,证实为结直肠腺癌;③术前影像学[CT和磁共振成像(magnetic resonance imaging,MRI)检查]评估显示结直肠癌未侵出浆膜层,提示肿瘤直径≤6.0 cm;④X线、CT和B超等检查结果中未发现肿瘤转移或种植于邻近器官;⑤取得患者知情同意,愿意配合的患者。
1.2.2 排除标准 ①年龄<18岁;②因急性肠梗阻、穿孔或出血行急症手术病例;③合并其他脏器恶性肿瘤或(和)肿瘤直径>6.0 cm;④同时合并其他部位手术病例或中转开腹;⑤CT或MRI等辅助检查证实肿瘤侵犯邻近脏器或远处转移等致无法行根治性切除术;⑥腹腔镜手术禁忌证;⑦不愿合作,依从性不佳者。
1.3 手术方法
所有患者在术前均进行一般资料、生命体征、血常规和生化检验值等评估;患者手术过程中采用截石体位,进行术前消毒并建立无菌面,脐下1.0 cm处用穿刺针刺入腹腔,并建立气腹,气腹压设定15 mmHg,然后按照五孔法于相应部位插入Trocar建立手术操作通道。手术操作过程中,术中严格遵守手术探查原则,选择中间入路法,提起暴露好的乙状结肠及其系膜,在骶骨岬右前方的肠系膜处切开腹膜,并找准间隙,沿着肠系膜下动脉根部的方向进行延长,并进一步裸化肠系膜下动脉根部,清扫淋巴结,用Hem-o-lock夹在肠系膜下动脉汇入腹主动脉1.0 cm左右处夹闭肠系膜下动脉,并将其切断。继续向上游离,找到肠系膜下静脉,裸化后,于胰腺下缘约1.0 cm处夹闭并切断。然后,切开乙状结肠和降结肠外侧的腹膜及腹膜返折,再向内牵拉翻转结直肠,与右侧游离平面贯通,然后沿着贯通的部位向结肠的近端分离乙状结肠和部分降结肠系膜。下一步将直肠及其系膜向前方稍牵拉,保持一定张力,然后于骶前筋膜前方间隙游离直肠直到距肿瘤下缘2.0 cm以上。在盆腔的脏层和壁层筋膜之间进行直肠两侧的游离,直肠前方的游离在Denonvililer筋膜前后两层之间进行。手术过程视肿瘤距肛门的位置确定是否需要切断肛尾韧带,于拟切割闭合肠管处将直肠裸化。
1.3.1 传统腹腔镜组 在肿瘤下缘≥2.0 cm处离断肠管。在下腹部做一约5.0 cm的切口并经此处取出标本。在肿瘤上缘10.0 cm处以荷包钳夹闭并穿入荷包缝线,将远端肠管切断,移除包含肿瘤的肠管标本,近端肠管内置入合适型号的管型吻合器抵钉座,收紧荷包线打结固定。会阴部手术医师再次消毒会阴部并扩肛,用稀释络合碘水灌洗肛管直肠腔,然后将管型吻合器从肛门置入,与近端肠管内的吻合器抵钉座对接、收紧、激发,完成吻合。盆腔注入适量生理盐水,确保水超过吻合口,然后从肛门充气,观察吻合口处是否存在气泡来检测吻合情况。确定吻合可靠后予以生理盐水冲洗腹腔,检查无出血点后于吻合口处放置一根腹腔引流管,排出腹腔积气后关闭腹腔。
1.3.2 NOSE组 在肿瘤下缘≥2.0 cm、肿瘤上缘至少10.0~15.0 cm处用切割闭合器离断肠管,标本放入标本袋。会阴部手术医师再次消毒会阴部并扩肛,用稀释络合碘水灌洗肛管直肠腔,腹腔镜下将远端肠管切开,从肛门置入保护套,将管型吻合器抵钉座从肛门置入的保护套内送入腹腔,然后经肛门保护套内伸入卵圆钳,将离断肿瘤肠管标本经直肠肛门完整拖出。腹腔镜下切割闭合直肠远端,将残端放入保护套沿主操作孔取出。切开近端结肠闭合部并放入吻合器抵钉座,用直线切割闭合器闭合并切断,用标本袋经主操作孔取出残端,于近端结肠残端切开一直径约0.5 cm小孔,取出抵钉座的连接杆;然后将管型吻合器从肛门置入,与近端肠管内的吻合器抵钉座对接、收紧、激发,完成吻合。证实吻合确切与否及冲洗、引流方法与传统腹腔镜组相同。
1.4 观察指标及评价标准
术中观察指标:手术中的失血量、从置入腹腔镜到伤口缝合的时间(手术时间)。术后康复情况指标为观察常见并发症的发生率,如伤口出血、切口疝、吻合口漏、吻合口出血。生活质量评分使用SF-36生活质量评分表,将主观指标量化,将患者的自我感觉、自我感受、疼痛情况、情绪和人际关系等融入问卷中,根据每个条目的权重值进行赋分,并将各个维度的得分转化为十分制,具体计算公式为最终得分=(实际初得分-最低可能得分)/(最高可能得分-最低可能得分)×10,每个维度的最高得分是10分,最小为0分。得分越高,生命质量越高。
1.5 统计学方法
使用SPSS 18.0统计软件进行统计分析,计数资料用χ2检验、计量资料用均数±标准差(±s)表示,各组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术中出血量、手术时间及住院时间的比较
比较术中两组患者的情况和术后总住院时间,结果显示,NOSE组的手术时间平均为3.01 h,传统组平均2.51 h,传统组大约节约半小时,NOSE组术中出血量平均为69.25 ml,低于传统组85.75ml,差异均有统计学意义(P<0.05)。而两组患者在住院时间上差异无统计学意义(P>0.05)。见表1。
2.2 两组患者术后生活质量评分比较
术后1个月对患者进行术后生活质量情况的对比,在躯体、角色、认知、疼痛及整体健康状况5个方面,NOSE组更具有优势,疼痛感降低,角色适应能力强,躯体功能活动影响小,差异有统计学意义(P<0.05);而两组患者在情绪的把控和参与社会活动及精力方面,差异无统计学意义(P>0.05)。见表2。
2.2 两组患者术后并发症情况
术后观察两组患者发生伤口出血、切口疝、吻合口漏、吻合口出血的发生率,所有患者从术后第1天随访至出院后1个月,未发生1例术后并发症,术后恢复良好。
表1 两组患者术中出血量、手术时间及住院时间比较 (±s)Table 1 Comparison of blood volume,operation time and hospitalization time between the two groups (±s)

表1 两组患者术中出血量、手术时间及住院时间比较 (±s)Table 1 Comparison of blood volume,operation time and hospitalization time between the two groups (±s)
手术时间/h术中出血量/ml术后住院时间/d NOSE组(n =20)3.01±0.4369.25±6.138.25±1.02传统组(n =20)2.51±0.2485.75±7.608.95±1.85 t值4.62-7.56-1.48 P值0.0000.000 0.146组别
表2 两组患者术后生活质量评分比较 (分,±s)Table 2 Comparison of postoperative quality of life between the two groups (points,±s)
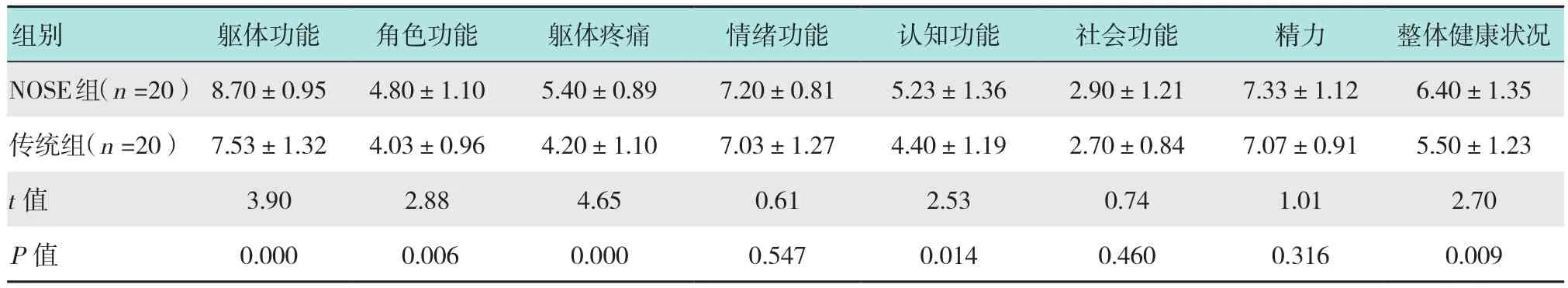
表2 两组患者术后生活质量评分比较 (分,±s)Table 2 Comparison of postoperative quality of life between the two groups (points,±s)
组别躯体功能角色功能躯体疼痛情绪功能认知功能社会功能精力整体健康状况NOSE组(n =20)8.70±0.954.80±1.105.40±0.897.20±0.815.23±1.362.90±1.217.33±1.126.40±1.35传统组(n =20)7.53±1.324.03±0.964.20±1.107.03±1.274.40±1.192.70±0.847.07±0.915.50±1.23 t值3.902.884.650.612.530.741.012.70 P值0.000 0.0060.0000.5470.0140.4600.3160.009
3 讨论
结直肠癌患者对手术能否保肛、癌症术后效果以及术后生活自理能力等方面都存在很多疑虑,减少术后并发症对患者康复和自理能力的恢复非常重要,有报道指出结直肠癌开腹手术并发症发生率为4.0%~28.0%[5],切口疝的发生率为0.5%~2.0%[6]。近年来,部分低位直肠癌行保肛手术者逐步应用腹腔镜技术,有效地控制了术后并发症及切口疝的发生[7]。研究表明,腹腔镜下结直肠癌手术不会影响肿瘤根治效果[8-9],并在长期肿瘤学效果、长期生存率等方面与开腹手术效果相当或优于开腹手术[10]。FRANKLIN等[11]和DARZI等[12]报道的结直肠癌患者在腹腔镜下切除肿瘤并经肛门取标本的手术方法,回避了在腹部做切口的缺陷。另外,FRANKLIN等[13]还报道了切除乙状结肠病变部位并经肛门取出的案例。在这些研究中,通过肛门取出切除的直肠或乙状结肠病变肠管,均获得了良好疗效。NOSE法充分利用直肠断端,不再额外增加腹部创伤,经腹部和肛门同步操作,借助腹腔镜器械使用传统的五孔腹腔镜技术,在自然腔道建立标本取出通道,尽量避免外科损伤[14-15]。开腹结直肠癌根治术到创伤较小的NOSE术的转变呼应了快速康复理念,顺应了时代要求,满足了患者对于减少创伤的需求。本研究中,在手术平均时间上NOSE组要明显长于传统组,可能是由于对手术医生的技术要求较高,手术步骤较为繁琐,如裸化两切缘肠管、修剪腹腔镜下系膜及从自然腔道取出标本等。NOSE组的术中出血量要少于传统组,可能是由于腹壁的创伤小。两组在住院时间上差异无统计学意义(P>0.05)。但根据SF-36分析显示,在躯体功能、角色功能、躯体疼痛、认知功能及整体健康状况5个方面NOSE组均优于传统组,差异有统计学意义(P<0.05)。两组患者术后均无并发症发生,综合以上两组比较的数据显示NOSE手术是安全可行的,说明NOSE组患者术后生活体验感更好,生活质量高,更容易被患者选择和接受。
综上所述,NOSE法的优点符合大众对于无痛和美容的需求。NOSE法因腹部无伤口,患者不再担心伤口疼痛和伤口裂开,从心理上放松,因而敢于早期下床活动和有效咳嗽,从而促进胃肠蠕动和避免肺部感染,也有利于早期肛门排气。这既减轻了患者腹胀症状又可以早期进食进行肠内营养,加速康复过程。因此,严格掌握手术适应证,选择合适的病例,开展大样本、前瞻性的随机对照研究,将成为工作的重点,具有极大的临床价值。
[1]LACY A M, GARCÍA-VALDECASAS J C, DELGADO S, et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial[J].Lancet, 2002, 359(9325): 2224-2229 .
[2]MARTEL G, CRAWFORD A, BARKUN J S, et al. Expert opinion on laparoscopic surgery for colorectal cancer parallels evidence from a cumulative meta-analysis of randomized controlled trials[J].PLoS One, 2012, 7(4): e35292.
[3]胡俊杰, 周志祥. 直肠癌NOSE手术技术应用现状与规范[J].实用肿瘤杂志, 2015, 30(3): 209-213.
[3]HU J J, ZHOU Z X. The present situation and norm of the surgical technique of rectal cancer[J]. Journal of Practical Oncology, 2015,30(3): 209-213. Chinese
[4]邹科见, 蔡国豪, 周卫平, 等. 免腹部辅助切口全腹腔镜下直肠癌根治术的临床应用[J].海南医学, 2014, 25(18): 2678-2680.
[4]ZHOU K J, CAI G H, ZHOU W P, et al. The clinical application of laparoscopic radical rectal cancer by laparoscopic surgery[J].Hainan Medical Journal, 2014, 25(18): 2678-2680. Chinese
[5]GARCÍA-GRANERO E, FAIZ O, MUÑOZ E, et al. Macroscopic assessment of mesorectal excision in rectal cancer: a useful tool for improving quality control in a multidisciplinary team[J]. Cancer,2009, 115(15): 3400-3411.
[6]WIGGERS T, VAN DE VELDE C J. The circumferential margin in rectalcancer recommendations based on the Dutch Total Mesorectal Excision Study[J]. Eur J Cancer, 2002, 38(7): 973-976.
[7]FUKUNAGA M, KIDOKORO A, IBA T, et al. Laparoscopyassisted low anterior resection with a prolapsing technique for low rectal cancer[J]. Surg Today, 2005, 35(7): 598-602.
[8]高浩基, 赵任. NOSE在结肠直肠恶性肿瘤手术中的应用[J].外科理论与实践, 2016, 21(6): 537-539.
[8]GAO H J, ZHAO R. The application of NOSE in colorectal cancer surgery[J]. Journal of Surgery Concepts & Practice, 2016, 21(6):537-539. Chinese
[9]徐永鹏, 刘正, 王贵玉, 等. 腹部无切口经直肠肛门外翻切除标本的低位直肠癌根治术11例[J]. 肿瘤研究与临床, 2014,26(12): 813-815.
[9]XU Y P, LIU Z, WANG G Y, et al. There were 11 cases of low rectal rectal cancer of the abdomen without incision and rectal rectal resection[J]. Cancer Research and Clinic, 2014, 26(12): 813-815. Chinese
[10]AWAD Z T, QURESHI I, SEIBEL B, et al. Laparoscopic right hemicolectomy with transvaginal colon extraction using a laparoscopic posterior colpotomy: a 2-year series from a single institution[J]. Surg Laparosc Endosc Percutan Tech, 2011, 21(6):403-408.
[11]FRANKLIN M E Jr, RAMOS R, ROSENTHAL D, et al.Laparoscopic colonic procedures[J].World J Surg, 1993, 17(1):51-56.
[12]DARZI A, SUPER P, GUILLOU P J, et al. Laparoscopic sigmoid colectomy: total laparoscopic approach[J]. Dis Colon Rectum,1994, 37(3): 268-271.
[13]FRANKLIN M E, KAZANTSEV G B, ABREGO D, et al.Laparoscopic surgery for stage Ⅲ colon cancer: long-term follow-up[J]. Surg Endosc, 2000, 14(7): 612-616.
[14]王猛, 刘正, 陈瑛罡, 等. 腹部无切口经阴道拖出标本的腹腔镜下高位直肠癌根治术(附视频)[J]. 中华结直肠疾病电子杂志, 2014, 3(5): 71-72.
[14]WANG M, LIU Z, CHEN Y G, et al. Laparoscopic radical rectal cancer with no incision in the abdomen (attached video)[J].Chinese Journal of Colorectal Disease: Electronic Edition, 2014,3(5): 71-72. Chinese
[15]HISADA M, KATSUMATA K, ISHIZAKI T, et al. Complete laparoscopic resection of the rectum using natural orifice specimen extraction[J]. World J Gastroenterol, 2014, 20(44):16707-16713.

