水溶性甲壳低聚糖的制备与结构表征
沈文通
(江苏省阜宁县危险化学品管理办公室,江苏 阜宁 224400)
壳聚糖(Chitosan, CTS)是由β(1,4)-2-氨基-2-脱氧-D-葡聚糖(GlcN)和β(1,4)-2-乙酰氨基-2-脱氧-D-葡聚糖(GlcNAc)构成的线性天然高分子共聚物,主要通过甲壳素(Chitin)在浓碱存在下脱乙酰生成[1]。作为唯一的带有氨基的天然碱性多糖,其pKa值一般为6.2~7.0,并且在水溶液中往往会表现出典型的弱阳离子高分子化合物特征[2]。壳聚糖不但具有优良的生物降解性和生物相容性,而且还具有良好的吸附性和生物安全性。同时,壳聚糖的抗微生物活性、金属离子螯合性能和游离基捕集性能也优于甲壳素[3]。但是,壳聚糖分子结构中的羟基和氨基在分子链上的排布的规整性及这种规整性导致的壳聚糖分子链间存在的强烈氢键作用,使壳聚糖在中性或碱性水溶液中的溶解性显著下降,这也对壳聚糖在食品行业中的进一步应用产生了不利影响[4]。为克服这一不足,并结合食品行业的特点和要求,人们提出了多种方法用于壳聚糖的改性,以制备具有良好水溶性的壳聚糖衍生物,其中通过壳聚糖降解制备水溶性的甲壳低聚糖(也称壳寡糖,Chito-oligosaccharides)得到广泛研究。
与壳聚糖相比,甲壳低聚糖不但有更低的分子量,而且分子结构中羟基和氨基在分子链上排布的规整性和分子链间的氢键作用显著降低,因而可在水溶液中表现出良好的溶解性[5]。同时,甲壳低聚糖在保持了壳聚糖具有的生物降解性、生物相容性和生物安全性外,还具有更好的抗氧、防腐、抗肿瘤等活性[6~10]。本文主要对通过过氧化氢直接氧化降解法制备甲壳低聚糖的方法及其影响因素进行研究,并对产物的结构进行表征。
1实验部分
1.1 主要原料与仪器
壳聚糖:生化试剂,脱乙酰度90.84%(电位滴定法测定),国药集团化学试剂有限公司;30%过氧化氢:分析纯,上海凌峰化学试剂有限公司;无水乙醇:分析纯,上海凌峰化学试剂有限公司;氢氧化钠:化学纯,上海凌峰化学试剂有限公司;盐酸:分析纯,上海凌峰化学试剂有限公司。
红外光谱分析仪:Nicolet 670型,美国Nicolet 公司;核磁共振分析仪:DRX500型,BRUKER公司(瑞士)。
1.2 甲壳低聚糖的制备
将4.1 g CTS和120 mL蒸馏水加入到四口反应瓶中并搅拌分散,再在室温下由滴液漏斗向反应瓶慢慢滴加一定体积质量百分数为30%的H2O2水溶液,滴加过程中控制物料温度不高于40 ℃;H2O2水溶液滴加完毕后,水浴加热物料使其升至设定温度,并恒温反应一定时间;反应完成后,对反应物料进行过滤,并将得到的滤液滤液置于旋转蒸发器上于减压条件下浓缩,直到物料呈粘稠的浅黄绿色液体。搅拌下将浓缩后的物料缓慢加入到50mL无水乙醇中,待析出的浅黄白色沉淀物聚集成团后,再将乙醇液分出。向析出的黏结成团的沉淀物中再加入30 mL无水乙醇,并研磨脱水(重复数次,直至黏结成团的沉淀物完全转化为黄白色粒状物);抽滤并将得到的淡黄白色粒状物料置于冷冻干燥器中干燥,即得到水溶性甲壳低聚糖。
1.3 产物的结构表征
用KBr压片法对壳聚糖和甲壳低聚糖进行FT-IR分析,以D2O和TFA-D2O分别作溶剂对甲壳低聚糖和壳聚糖进行1H NMR分析。
1.4 产物的脱乙酰度测定
利用双突跃电位滴定法测定产物的脱乙酰度,过程如下:准确称量一定量的干燥至恒重的甲壳低聚糖样品,并用过量的HCl溶液溶解;用标准NaOH溶液滴定,并作出溶液pH随NaOH标准溶液的变化曲线;根据pH~VNaOH曲线,作出其一级微商关系曲线,并通过两突变点对应的标准NaOH溶液的体积差,按式(1)计算甲壳低聚糖的脱乙酰度α。
(1)
式中:△v为两突变点间的消耗的标准NaOH 溶液体积差(mL);CNaOH为标准NaOH 溶液的浓度(mol·L-1);m为水溶性甲壳低聚糖样品质量(g);16为氨基的相对摩尔质量;0.0994为完全脱乙酰甲壳低聚糖中氨基的理论含量。
2结果和讨论
2.1 H2O2水溶液用量对水溶性甲壳低聚糖收率的影响
在反应温度为60℃和保温时间为7.0 h条件下,考察了质量百分数为30%的H2O2水溶液对水溶性甲壳低聚糖收率的影响,其结果见表1。

表1 不同H2O2水溶液用量时水溶性甲壳低聚糖的收率Table 1 Effect of H2O2 dosage on the yieldof water-soluble chito-oligosaccharides
由表1可以看出,在一定范围内H2O2水溶液用量的增加有利于壳聚糖降解生成水溶性甲壳低聚糖,但用量过大也会由于其对氨基氧化能力的提高而导致产物被部分进一步氧化而转化为其它非水溶性甲壳低聚糖等物质。
2.2 反应温度对水溶性甲壳低聚糖收率的影响
在保温时间为7.0 h和30% H2O2水溶液用量为12.0 mL条件下,考察了反应温度对水溶性甲壳低聚糖收率的影响,其结果见表2。

表2 不同反应温度下水溶性甲壳低聚糖的收率Table 2 Effect of reaction temperature on theyield of water-soluble chito-oligosaccharides
由表2可知,在40~70 ℃范围内,温度的提高有利壳聚糖转化为水溶性甲壳低聚糖;反应温度达80 ℃时,产物的收率会显著下降。同时,实验中还发现,40~60 ℃范围内得到的产物为浅白色或浅黄白色,70 ℃时的产物为黄色,而80 ℃时的产物为棕黄色,这说明过高的反应温度会导致氧化副反应发生程度明显提高。
2.3 保温时间对水溶性甲壳低聚糖收率的影响
在反应温度为60℃和30% H2O2水溶液用量为12.0 mL条件下,考察了保温时间对水溶性甲壳低聚糖收率的影响,其结果见表3。

表3 不同保温时间时水溶性甲壳低聚糖的收率Table 3 Effect of reaction time on the yieldof water-soluble chito-oligosaccharides
由表3 可知,延长反应时间总体上对提高水溶性甲壳低聚糖的收率是有利的,但以7.0~8 h 为宜;但是当反应时间超过7 h后,反应时间的延长对提高水溶性甲壳低聚糖的收率已经影响较小了。
2.4 水溶性甲壳低聚糖脱乙酰度测定结果
通过双突跃电位滴定法测定产物脱乙酰度时得到的pH~VNaOH曲线见图1,对应的一级微商关系曲线见图2。
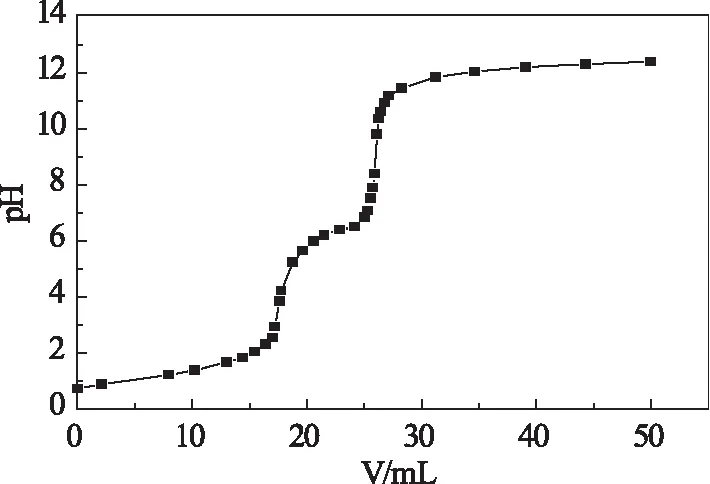
图1 pH~VNaOH关系曲线Fig 1 Relationship curve of pH versus VNaOH

图2 一级微商关系曲线Fig 2 Relationship curve of first derivative
根据一级微商关系曲线中两突变点对应的标准NaOH溶液体积差,按式(1)计算得到的水溶性甲壳低聚糖的脱乙酰度α为85.61%。此值较之于未降解的壳聚糖有所下降,其原因可能与H2O2在反应过程中使壳聚糖间的糖苷键发生断裂时,也部分使壳聚糖结构中的氨基发生了转化。
2.5 水溶性甲壳低聚糖FT-IR测定结果及其归属
壳聚糖及水溶性甲壳低聚糖FT-IR图见图3。

图3 壳聚糖及水溶性甲壳低聚糖的FT-IR图Fig 3 FT-IR spectra of CTS and water-solublechito-oligosaccharides
由图3可以看出,水溶性甲壳低聚糖FT-IR图中的主要吸收峰在壳聚糖的FT-IR图中基本都出现,但其主吸收峰数少于壳聚糖,说明H2O2氧化降解壳聚糖制备水溶性甲壳低聚糖过程中,糖单元的基本结构变化较小。但由于降解反应中存在糖苷键的断裂及H2O2对壳聚糖结构中氨基的作用,会使壳聚糖FT-IR图中原有反映糖苷键、羟基和氨基的吸收峰出现位置及强度有部分程度的变化。
2.6 水溶性甲壳低聚糖1H NMR测定结果及其归属
壳聚糖及水溶性甲壳低聚糖的1H NMR图分别见图4和图5。
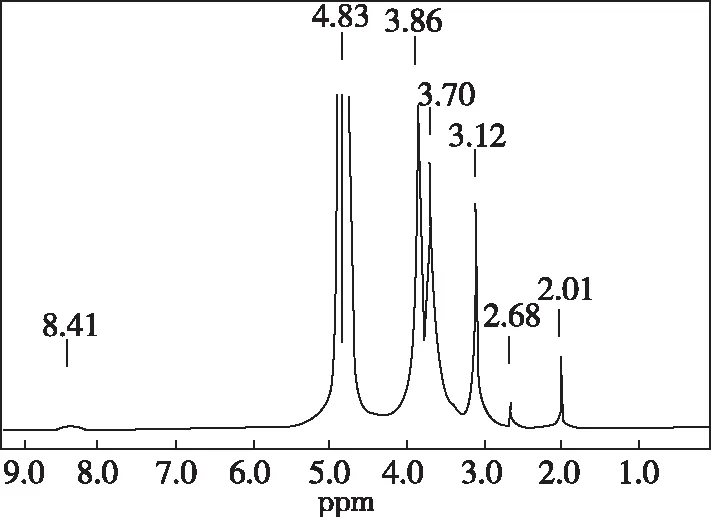
图4 壳聚糖1H NMR图Fig 4 1H NMR spectrum of CTS

图5 水溶性甲壳低聚糖1H NMR图Fig 5 1H NMR spectrum of water-solublechito-oligosaccharides
从图4和图5可以看出,壳聚糖与水溶性甲壳低聚糖的1H NMR图存在一定差异。在壳聚糖的1H NMR图中,4.83和3.12 ppm处的峰分别对应于氨基葡萄糖单元C1和C2上H,3.50、3.70和3.86 ppm处的峰则对应于糖单元中C3、C4、C5和C6上H,2.68 ppm处的峰对应于乙酰氨基葡萄糖单元C2上H,2.01 ppm处的峰对应于乙酰胺基中甲基上H,8.41ppm处的峰对应于糖单元在水中部分链式结构中醛基H。在水溶性甲壳低聚糖的1H NMR图中,8.44ppm处的峰高明显增大,说明壳聚糖降解后生成的产物中有更多的链式结构成分存在;壳聚糖氨基葡萄糖单元C1和C2上H对应的峰则分别在4.71和3.16 ppm处出现,反映糖单元中C3、C4、C5和C6上H对应的峰则分别出现在3.66~4.09 ppm处,反映乙酰胺基中甲基上H的峰出现在2.06 ppm处,而在1.18 ppm处出现的峰应为壳聚糖降解生成的产物中亚甲基上的H。
3结 论
以H2O2为氧化剂,在中性介质中可使壳聚糖氧化降解为水溶性甲壳低聚糖,并且H2O2用量、反应温度和保温时间对产物收率存在影响,过高的反应温度和H2O2用量都不利于水溶性甲壳低聚糖的生成;与壳聚糖相比,产物的脱乙酰度有一定降低,且水溶性甲壳低聚糖产物中含醛基的链式结构组成明显高于壳聚糖;在H2O2用量为3.0~3.5 mL(30%H2O2)/g(CTS),反应温度和保温时间则分别为60 ℃和7.0~8 h的条件下,水溶性甲壳低聚糖的收率可达90%左右。
[1] M. Dash, F. Chiellini , R.M. Ottenbrite., et al. Chitosan—A versatile semi-synthetic polymer in biomedical applications[J]. Progress in Polymer Science, 2011, 36 (8): 981~1 014.
[2] Marguerite Rinaudo. Chitin and chitosan: Properties and applications[J]. Progress in Polymer Science, 2006,31(7):603~632.
[3] M.N.V Ravi Kumar. A review of chitin and chitosan application [J]. Reactive & Functional polymers,2000, 46 (1):1~27.
[4] Hitoshi Sashiwa, Sei-ichi Aiba. Chemically modified chitin and chitosan as biomaterials[J]. Progress in Polymer Science, 2004,29(9):887~908.
[5] Ke Liang B. Chang, Ming-Chih Tai, Fu-Hsiang Cheng. Kinetics and Products of the Degradation of Chitosan by Hydrogen Peroxide[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4 845~4 851.
[6] S. Baxter, S. Zivanovic, J. Weiss. Molecular weight and degree of acetylation of high-intensity ultrasonicated chitosan[J]. Food Hydrocolloids, 2005, 19 (5): 821~830.
[7] W-K Jung, S-H Moon, S-K Kim. Effect of chitooligosaccharides on calcium bioavailability and bonestrength in ovariectomized rats[J]. Life Sciences, 2006,78 (9): 970~976.
[8] J. Shao, Y. Yang, Q. Zhong. Studies on preparation of oligoglucosamine by oxidative degradation under microwave irradiation[J]. Polymer Degradation and Stability, 2003,82 (3): 395~398.
[9] 文镜,吕菁菁,戎卫华 等. 低聚壳聚糖抑制肿瘤作用的实验观察[J].食品科学,2002,23(8):249~251.
[10] 于何宇,王遂. 酶法制备低聚壳聚糖的研究[J]. 食品科学,2008,29(8):464~466.

