酶生物传感器在农残检测中的应用
王 虹 王 军
(江苏警官学院公安科技系,江苏 南京 210031)
农药常被广泛地应用于抵抗病虫灾害、清除杂草、提高产量。食用受到农药污染的蔬菜、水果而造成的急性中毒事件[1]、食品出口过程中因农药残留超标导致退货的国际贸易事件[2]、与农药中毒有关的自杀案件、投毒案件、意外事故也时常出现[3,4]。对农药进行分析检测,其检测结果对判断中毒原因和案件的性质至关重要。
农药检测的常规方法有气相色谱法[5]、液相色谱法[6]、色谱-质谱法[7,8]、光谱分析[9,10]等。这些方法虽然具有高准确度、高精确度,但需要较长的前处理时间,不能进行现场快速检测并获得检测结果。随着生物技术和微电子技术的发展,生物传感器在农药残留检测中则体现出实时快速、简单便携和低成本的分析优势,因此颇受关注[11,12]。本文介绍了酶生物传感器的分类、酶的固定技术,比较了电化学型酶生物传感器、光学型及压电型酶生物传感器的应用领域、检测限和优缺点。
1酶生物传感器
酶生物传感器(Enzymatic Biosensor,EBS)是指将酶与特定的载体或电极结合并将酶促反应的产物信息(如物质浓度变化、光热反应等)经过能量转换器变为电信号输出的一种装置[13]。 根据酶与物质反应机理不同,酶生物传感器一般可以分为胆碱酯酶传感器(CHE)和有机磷水解酶传感器(OPH)[14]。
根据酶生物传感器制作过程中的信号转换器的不同,又可将其分为电化学型生物传感器、光学型生物传感器、压电晶体生物传感器等[15],其中电化学型生物传感器最为常见,按电极反应方式不同分为电位型、电流型(安培型)、电位-电流型以及随着微电子技术发展起来的离子选择性场效应晶体管型(ISFET)[16]。
电化学型EBS的能量转换器即电化学电极,识别元件则为酶活性材料。由于反应在电极周围即完成,故它既有电化学电极响应快、操作简便的特点,又有酶的特异性识别和选择性催化功能,因此在传感领域发展最早,研究内容最丰富,应用范围也最为广泛。
光导纤维EBS由光导纤维、酶分子识别元件及检测器构成[17]。它是依据酶选择性识别待检测物质,催化反应,并伴随可检测的磷光、荧光、拉曼光、化学发光和生物发光等光变化,通过检测器检测到待检测物质浓度[18]。
石英晶体微天平(QCM)依据压电石英晶体谐振测量技术,早期主要用于检测气体有机物和无机物[19],后来发展到压电石英晶体EBS。Abad等[20]将固定有乙酰胆碱酯酶(AChE)的晶体电极浸没在3-吲哚乙酸组织培养基中,来测量对氧磷和西维因,检测限分别可达5.0×10-8和1.0×10-7mol/L。
2检测食品中农残常用的酶生物传感器
图1所示为传感器基本构成,其核心部件是分子识别元件和能量转换器。在酶生物传感器中识别元件即为固定化的酶,可以识别待测物质催化反应,引起的物质的量的变化或光热的变化即经信号转换后用于检测。因此酶的固定技术可以说是酶生物传感器制作中最重要的一项技术。

图1 生物传感器构成示意图Fig 1 sketch drawing of biosensor
2.1 酶固定技术
酶的固定技术是将酶和载体或者电极结合,使酶能够集中在一定空间范围内与待测物质进行催化反应的方式。酶的固定方法会影响酶的稳定性、反应灵敏性和使用寿命等。一般酶固定方法有吸附法、交联法、共价键结合法、包埋法等[21]。
吸附法较为简单,有物理吸附和化学吸附两种。优点在于操作简单,且酶活力损失较小,但是这种固定方法酶易脱落,不够稳定。在丝网印刷电极表面乙酰胆碱酯酶(AChE) 的固定中会用到这种方法[22]。
交联法是由酶分子间或分子内通过交联剂作用发生交联反应,而形成不溶于水的网状结构,这样的网状结构轻薄且易吸附,会附着在一些固体的表面从而使酶得到固定[23]。这种酶固定方法稳定性好,响应快,但酶活性中心易失活所以重复性较差。
共价键结合法是酶的侧链基团和电极表面发生反应形成共价键而相互结合从而使酶得到固定的方法。参加共价结合反应的不能是酶的活性中心,否则会使酶的活性大大降低。这种固定方法由于发生了化学反应故稳定牢固,酶分子不易脱落,使用寿命长,但是化学修饰和激烈的反应可能使酶活性降低,且操作复杂,成本较高。
包埋法是通过物理方法将酶分子包埋在高分子聚合物形成的三维空间网状结构基质中得以固定。与共价键结合法不同,这种方法一般不产生化学修饰,故很少改变酶的高级结构,对酶活性影响较小。缺点是分子量大的底物在凝胶网格内扩散较固难。光纤型EBS的制作中常用这种方法来固定酶,在电流型EBS制作中也常见到[23]。
酶的固定方法各有优点和不足,应该结合具体的酶生物传感器类型、固定的基质性质及传感器作用方式来确定选择合适的固定方法来提高性能。在实际应用中,有时会把两种固定方法结合起来使用以优势互补获得更好的性能。例如将吸附和交联法结合,通过交联网状结构的稳定性来克服吸附法中酶易从载体漏失或脱落的问题,增强了酶的稳定性[24]。
2.2 电化学型酶生物传感器
电化学型酶生物传感器是目前应用最为广泛的一种酶生物传感器。随着研究进展它又分为多个不同的分支种类,表1列出了几种类型电化学型酶生物传感器的制作方式及检测限。在制作方式、检测限、重复性、反应时间以及线性范围方面均有不同。
传统电位型EBS在检测农药残留方面发展最早,它制作简单、灵敏度较高、响应快、线性范围宽、重复性较好,且易于实现自动化、基本无需对待测样品做前处理。但相对而言传统pH电极直接检测的精密度不高、工作曲线也不是很稳定、电极寿命短,因此逐渐被其他类型电化学型EBS所取代。
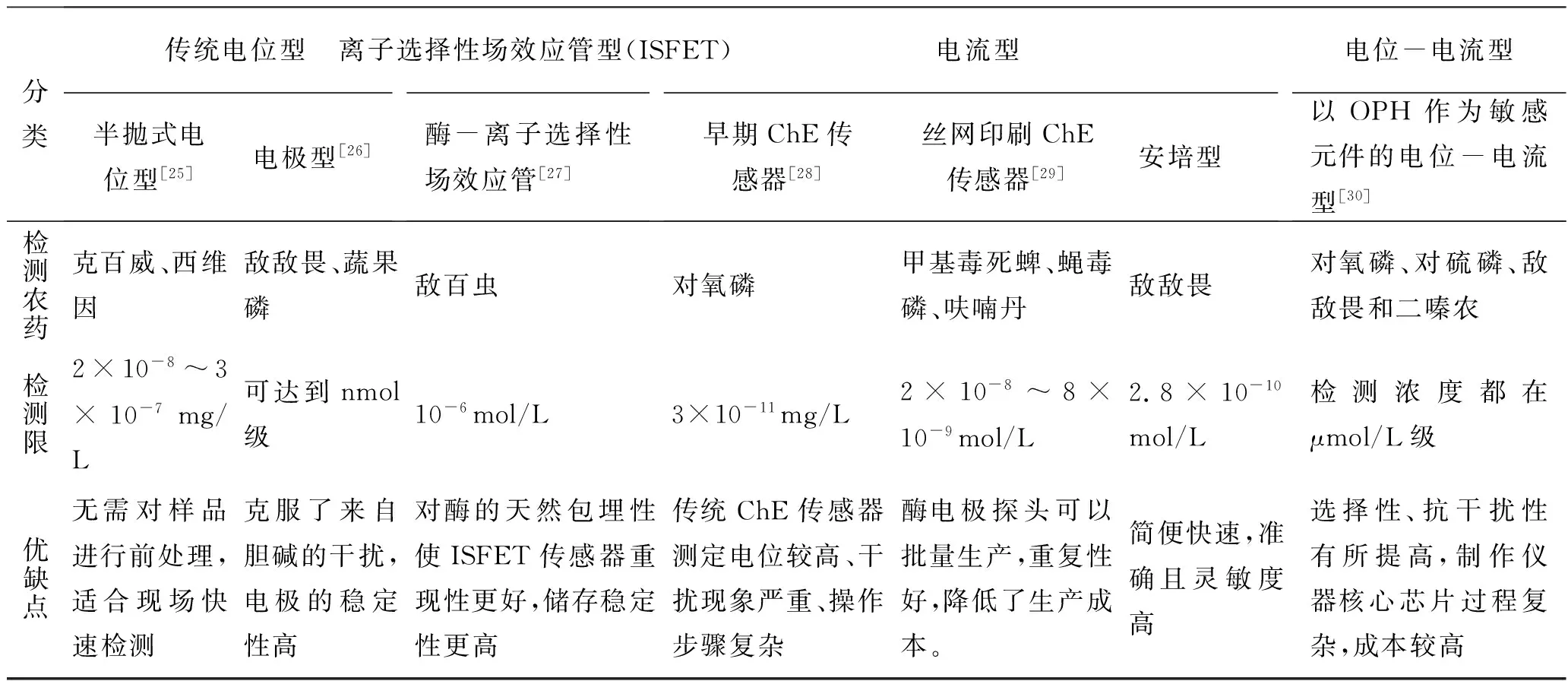
表1 常见电化学型酶生物传感器比较Table 1 the compare of electrochemical enzyme biosensor
离子选择性场效应管(ISFET) EBS是随着微电子技术的发展而产生的。其构造简单,稳定性更高,且检测灵敏度和使用寿命较传统电极高。该种EBS本身也向微型化、集成化发展;同时ISFET适合批量制造,故其市场已较为成熟,具有广阔的应用潜力。
电流型EBS的种类最为繁多,早期的电流型EBS由于检测电位较高,一些电化学活性物质对其干扰较大,影响其灵敏度;加入一些介体修饰后虽然降低了检测电位,并且提高了检测限,但电极制作工艺复杂,重复性差,难以推广应用。后来丝网印刷技术的发展和引入使电流型EBS研究有了新的突破,在选择性、重复性、灵敏度方面均得到提高[16]。丝网印刷技术最大优势是实现了酶电极探头批量生产,且电极重现性好,降低了传感器的成本,在实际推广应用中只需进一步提高酶的稳定性以及成本控制。从表中可以看出,电流型EBS的检测限在几种电化学型EBS中是最高的,可以达到10-8的数量级,在今后的发展中也很有潜力。
电位-电流型EBS作为两者的结合,是一个新的研究方向。它结合了电位型EBS响应时间短、重复性好、检测范围广以及电流型EBS灵敏度高、检测限低的优势,但是受传感器制作成本高及核心芯片制作工艺复杂的限制,到实际应用仍需研究改进。
不同类型的酶生物传感器的优缺点不是一成不变的,与制作方式和应用场合有极大关系,选择不同的酶就会使传感器效果不同。例如胆碱酯酶中,丁酰胆碱酯酶对农药的抑制性比乙酰胆碱酯酶更强,故用其代替乙酰胆碱酯酶所制作的传感器更加的灵敏、检测限也更高,有时甚至能提高一个数量级。有机磷水解酶则是通过水解底物来完成反应的,其针对性、准确性很高,它只需一步反应,故其反应速度比较快,响应时间短,但一般由于底物量较少,对检测精度要求就很高,制作起来也相对比较困难。综上可见,酶生物传感器的效果其实是各个因素的综合结果。
2.3 光学型及压电型酶生物传感器
光学型EBS主要由光纤和生物敏感膜组成,随着研究进展不断有最新技术引入,也存在着一些亟待解决的不足之处。
压电型(石英晶体微天平(QCM))EBS以QCM为信号转换器。QCM是根据压电石英晶体谐振测量技术制成的,晶体吸附外来物后振动频率的变化和附着层的质量变化可以转换为信号输出,具有10-9g级的质量检测能力,它对表面质量负载的高度灵敏特性使之成为传感器制备中较好的信号转换器。表2列出了几种常见的光学型和压电型酶生物传感器的比较结果。

表2 常见光学型及压电型酶生物传感器比较Table 2 the compare of optical and piezoelectric enzyme biosensor
光纤EBS以光为检测信号,灵敏度极高,可以达到10-9~10-10数量级,响应时间短,抗电磁场干扰能力强,信息传递容量大,能量损耗低等,在常量至微量甚至超微量分析方面,具有其他传感技术所不具有的优势。同样由于光的特性,使得光纤EBS易受背景光的干扰,稳定性较差,且制作时固定生物材料难度更大。然而无论如何,光纤EBS快速、可逆,能够实现在线实时检测,这点在实际应用中有重要意义。
压电型(石英晶体微天平(QCM))EBS是一种新颖的生物传感器,它检测灵敏度很高,快速简单,成本较低,且对样品无需破坏处理,可以在线监测。但是压电型EBS对操作环境条件要求严格,湿度和温度都可能影响其结果,故在实际应用中有时难以达到预期效果,不利于推广应用。 但是光纤EBS和压电型EBS的出现,给酶生物传感器的发展提供了新的思路,从能量转换的角度来开发更多种类的传感器。
对比电化学型、光学型、压电型这三大类酶生物传感器,虽有各自发展之先后,但自身都存在一些优点和不足之处。
电化学型EBS以酶作分子识别元件对底物有高度选择性,具有较高的灵敏度,同时电极响应时间短,检测迅速。现在随着发展还出现了以动植物细胞和组织来代替纯酶试剂,降低了生物传感器的制作成本。电化学型EBS适用范围广,性能稳定,其技术已经相对完善且有实际应用意义,有广阔的发展前景。
光学型和压电型EBS是新型的生物传感器,它们都有极高的检测灵敏度(这也是酶生物传感器的特性之一),并且都可以实现在线实时检测。但是两者的制作过程均略显复杂,检测范围受到限制,压电型EBS对操作环境要求严格,因此两者离实际应用推广还有一段距离,但仍是生物传感技术的重要分支,具有重要的研究意义。
3结 论
酶生物传感器开辟了农药残留检测的新领域,在测定农药,特别是痕量微量的农药残留,与其它需用仪器进行分析的方法相比较,它更方便、快速且需对样品所做的前处理较少。但酶生物传感器尤其是一些电化学生物传感器以及一些新型酶生物传感器的研究多在实验室条件下,被开发应用到实际检测中的种类很少。目前要生产用于农药残留日常检测的酶生物传感器并在工业中实现推广还要进行大量的研究工作,其最大问题还是稳定性、灵敏度、重复性和准确性。当前要有所突破克服现有的一些不足还需要研究新的酶固定化技术,做到提高酶活力的同时延长酶生物传感器使用寿命;也可以通过研发新型信号转换技术来研制新型酶生物传感器。今后,酶生物传感器将朝着经济化、小型化、功能多样化、智能化和集成化方面发展。而想要把酶生物传感器应用到公安工作中来,不仅仅是要考虑到它快速检测的优势,还要考虑到酶生物传感器的选择性比较高,但也正是这样其毒物检测范围就会受到限制,通常只能针对某类毒物或者农药进行检测,但公安案件中的检材通常是很复杂多样的,这样的检测结果就会出现假阴性。不管是将多种酶一起固定在基质上形成多酶膜还是一些其他的解决方法,酶生物传感器在公安工作中的真正应用还有很长一段路要走,还有很多实际的问题需要大家一起探索解决,不管如何,酶生物传感器作为一种快速检测方法还是十分有发展潜力的。
[1] 袁义昌,杨群.潍坊市2006-2014年农药中毒报告时间序列分析[J].中国卫生工程学,2017,16(1):56~58.
[2] 王坦,宋玮,李玉博等.我国食用菌出口技术壁垒特点及应对措施研究[J].农产品质量与安全,2016,14(1):61~66.
[3] 江波,陈明,王燕军.通过模拟实验揭示一起投毒案件真相[J].刑事技术,2014,42(1):52~53.
[4] 刘国群,王学珍.儿童意外中毒影响因素分析与干预[J].中国妇幼保健,2014,29(4):556~558.
[5] 夏英,张澜,赵尔成等.分散固相萃取/分散液液微萃取-气相色谱法测定甘蓝中的拟除虫菊酯类农药残留[J].分析测试学报,2014,33(2):192~196.
[6] 刘小文,罗江,张敏等.果蔬中拟除虫菊酯农药残留分析方法进展[J].理化检验(化学分册),2013,49(9):1 141~1 147.
[7] 曹新悦,庞国芳,金铃和等.气相色谱-四极杆-飞行时间质谱和气相色谱-串联质谱对水果、蔬菜中208种农药残留筛查确证能力的对比[J].色谱,2015,33(4):389~396.
[8] 张婷亭,王静静,巩志国等.分散固相萃取-超高效液相色谱-质谱/质谱法测定干果果肉中56种农药残留[J].分析试验室,2016,35(3):287~292.
[9] 王晓彬,吴瑞梅,刘木华等.多菌灵农药的激光拉曼光谱分析[J].光谱学与光谱分析,2016,34(4):1 566~1 570.
[10] 孙俊,周鑫,毛罕平等.基于荧光光谱的生菜农药残留检测[J].农业工程学报,2016,32(19):302~307.
[11] 郭明,梁东军,谭贤.农药残留检测用新型碳纳米管固载酶生物传感器的制备及其电学传感性能分析[J].农药学学报,2014,16(3):319~329.
[12] 王晓朋,曾梅,万德慧等.化学发光生物传感器法测定食品中有机磷与氨基甲酸酯类农药残留[J].食品安全质量检测学报,2014,5(12):4 163~4 171.
[13] 乌日娜,李建科.生物传感器在农药残留分析中的研究现状及展望[J].食品与机械,2005,21(2):54~56.
[14] 赵静,刘晓宇,江丰.电化学酶传感器在有机磷农药残留检测中的应用[J].农产品加工学刊,2010,3(6):60~62.
[15] 傅深娜,侯长军,霍丹群等.用于农残检测的酶抑制生物传感器研究进展[J].广州化工,2013,41(17):20~21.
[16] 王丽红,张林,陈欢林.有机磷农药酶生物传感器研究进展[J].化学进展,2006,18(4):440~452.
[17] 张先恩.生物传感器[M].北京:化学工业出版社,2006.
[18] 蒋雪松,应义斌,王剑平.生物传感器在农药残留检测中的应用[J].农业工程学报,2005,21(4):118~121.
[19] E P. Scheide,G.G.Guilbault,.Piezoelectric detectors for organophosphorus compounds and pesticides[J].Anal. Chem,1972,44(11):1 764~1 768.
[20] J M. Abad,F.Pariente,L.Hernandez,et al..Determination of organophosphorus and carbamate pesticides using piezoelectric biosensors[J].Anal. Chem,1998,70(14):2 848~2 855.
[21] 杨丽娟,郑文刚,赵春江,等.用于农药残留检测的酶生物传感器[J].化学通报,2009,76(3):208~214.
[22] 张淑平,单联刚,经媛元.检测有机磷农药电流型胆碱酯酶传感器的研究进展[J].化学传感器,2006,26(2):8~13.
[23] 赵静,刘晓宇,江丰.电化学酶传感器在有机磷农药残留检测中的应用[J].农产品加工学刊,2010,3(6):60~62.
[24] S H. Chough,A. Mulchandani,P. Mulchandani,et al..Organophosphorus hydrolase-base amperometric sensor:modulation of sensitivity and substrate selectivity[J].Electroanalysis,2002,14(4):273~276.
[25] W Limbut,P. Thavarungkul,P. Kanatharana et al. .Comparative study of controlled pore glass,silica gel and Poraver? for the immobilization of urease to determine urea in a flow injection conductimetric biosensor system[J].Biosens. Bioelectron,2004,19(8):813~821.
[26] T Imato,N. Ishibashi. .Potentiometric butyrylcholine sensor for organophosphate pesticides[J].Biosens. Bioelectron,1995,10(5):435~441.
[27] K Wan,JM. Chovelon,N. Jaffrezic-Renault et al. .Enzyme-octadecylamine Langmuir-Blodgett membranes for ENFET biosensors[J].Sens. Actuat.(B),1999,58(1-3):399~408.
[28] N Mionetto,R. Rouillon,J. L. Marty. .Inhibition of acetylcholinesterase by organophosphorus and carbamates compounds. Studies on free and immobilized enzymes[J].Zeitschrift für Wasser- und Abwasser-Forschung,1992,25(3):171~174.
[29] A Ivanov,GEvtugyn,H. Budnikov et al..Anal.Chholinesterase sensors based on screen-printed electrodes for detection of organophosphorus and carbamic pesticides[J].Bioanal. Chem,2003,377(4):624~631.
[30] M J. Schoning,RKrause,K. Block et al. .A dual amperometric/potentiometric FIA-based biosensor for the distinctive detection of organophosphorus pesticides[J].Sens. Actuat,2003,95(1-3):291~296.
[31] M P. Xavier,BVallejo,M. D. Marazuela et al.. Fiber optic monitoring of carbamate pesticides using porous glass with covalently bound chlorophenol red[J].Biosens. Bioelectron,2000,14(12):895~905.
[32] V G. Andreou,YD. Clonis. .A portable fiber-optic pesticide biosensor based on immobilized cholinesterase and sol-gel entrapped bromcresol purple for in-field use[J].Biosens. Bioelectron,2002,17(1-2):61~69.
[33] J MAbad,FPariente,L. Hernández et al. .Determination of Organophosphorus and Carbamate Pesticides Using a Piezoelectric Biosensor[J].Anal. Chem,1998,70(14):2 848~2 855.
[34] N Kim,I. S. Park,D. K. Kim. .High-sensitivity detection for model organophosphorus and carbamate pesticide with quartz crystal microbalance-precipitation sensor[J].Biosens. Bioelectron,2007,22(8):1 593~1 599.

