鹰嘴豆多糖的分离纯化及其抗氧化作用研究
李 健,金 镭,洪占梅,任颖玲,陈慧慧
(解放军第105医院药剂科,合肥 230031)
鹰嘴豆(CicerarietinumLinn.)为维吾尔族习用药材,别名鸡豌豆、脑豆子和桃豆等。鹰嘴豆盛产于新疆天山北坡,性味甘平、无明显毒性和不良反应,主要功效为补中益气、温肾壮阳,临床多用于解血毒、润肺止咳,对心血管疾病如高血脂、高血压病以及肺病、消化不良等症均有良好的食疗作用。鹰嘴豆服用简单、方便,浸泡后服用可治疗痢疾和白带增多。研究表明,鹰嘴豆可用于治疗失眠、皮肤病和胆病等[1-5],其主要化学成分有三萜及三萜皂苷和异黄酮类化合物。李晓静等[6]在鹰嘴豆的乙酸乙酯部位分离得到4个三萜类化合物。谭永霞等[7]从鹰嘴豆种子中分离得到鹰嘴豆芽素A-7-O-β-D-葡萄糖苷,并确定其为异黄酮类化合物。此外,还有学者相继在鹰嘴豆中分离得到黄烷醇类和脂肪酸类等化合物[8-9]。
多糖是一种天然大分子化合物,由于其自身的独特结构,在防治心血管疾病、肝炎和癌症方面均有良好的作用,还可稳定和调控生物体自身的糖代谢[10]。对所有生物体来说,过多的氧化产生是疾病的根源。研究表明,类风湿、关节炎、动脉粥样硬化和癌症等疾病均与体内自由基过多有关[11]。人工合成的抗氧化剂具有促进肿瘤形成等相关不良反应[12]。多糖具有一定的抗氧化性,随着近年来多糖的研究日益成熟,可视其为一种无毒的新型抗氧化剂[13]。
目前,国内外对鹰嘴豆多糖的研究较少。Ye Zipeng等[14]从鹰嘴豆中分离得到3个高相对分子质量的多糖,其主要结构组成为甘露糖、鼠李糖、半乳糖、半乳糖醛酸、葡萄糖和阿拉伯糖等。胡尔西丹等[15]和于睿等[16]的研究主要集中于响应面优化酶法提取鹰嘴豆多糖和含糖量的测定,这些均一多糖均含有不同程度的糖醛酸。从鹰嘴豆中分离得到不含糖醛酸的均一多糖尚未见报道。
1 仪器与试药
1.1仪器 T6紫外可见分光光度计(北京普析通用仪器有限公司);RS-6旋转蒸发仪(上海申生科技有限公司);AL104电子分析天平(日本岛津公司);DHG-9240A鼓风干燥箱(上海一恒科学仪器有限公司);UV-255旋光仪(德国KRUSS公司);HL-2N恒流泵,BF-3自动部分收集器(上海青浦沪西仪器厂);LD-2冷冻干燥机(北京松源华兴科技有限公司);SZ-2自动双蒸纯水蒸馏器(上海和泰仪器有限公司)。
1.2试药 鹰嘴豆:2015年收获的新疆木垒县旱地上种植的迪西类型(Desi)鹰嘴豆(新疆大龙王食品公司,批号20160115,经石河子大学王琪教授鉴定为迪西类型鹰嘴豆Cicerarietinum);二苯基苦基苯肼(DPPH·,分析纯,Sigma Aldrich公司);维生素C(分析纯,上海骏惠化工有限公司);DEAE-Cellulose 52(Whatman 分装),Sephacryl S-300,均购自GE Healthcare公司;无水乙醇、甲醇,均为分析纯(中国上海振兴化工一厂);蘑菇酪氨酸酶,各单糖对照品(Sigma Aldrich公司);其他试剂均为分析纯。
2 实验方法
2.1多糖的提取 将鹰嘴豆药材用蒸馏水加热提取,加入水质量与药材质量的比例为15∶1,提取过程分为3次,每次3 h,提取罐中的温度保持在95~100 ℃。提取结束后,将滤液合并浓缩、离心后取上清液,在搅拌上清液的条件下,缓缓倒入乙醇,最后用酒精计测量上清液乙醇体积分数达到80%。静置12 h,离心,收集沉淀为鹰嘴豆粗多糖。
2.2粗多糖除蛋白 本实验采用Sevage试剂法去除乙醇沉淀物中的蛋白质。鹰嘴豆粗多糖用10倍量的蒸馏水溶解,按照多糖溶液∶Sevage试剂=5∶1的比例,加入Sevage试剂(氯仿∶正丁醇=1∶4)。混合溶液磁力剧烈搅拌1 h后,移至分液漏斗中,静置30 min,待溶液分层。水层和氯仿层中间可见变性的白色蛋白质,上层水溶液倒出后,继续加入Sevage试剂磁力剧烈搅拌1 h。重复操作,直至蛋白层消失。上层水溶液浓缩、透析(截留相对分子质量为3 000 Da)、冻干,即可得到除蛋白的鹰嘴豆粗多糖(CA)。
2.3均一多糖的分离纯化 离子交换色谱及凝胶渗透色谱柱是用于分离纯化均一多糖的有效方法,本实验采用DEAE-Cellulose 52和Sephacryl S-300 这2种色谱柱分离纯化得到均一多糖。具体步骤如下:粗多糖(CA)用蒸馏水溶解后上柱DEAE-Cellulose 52,洗脱条件选取为0~1.5 mol·L-1不同浓度的氯化钠,收集不同浓度的氯化钠洗脱组分,用硫酸-苯酚法检测并绘制吸光度的曲线图。DEAE-Cellulose 52分离得到不同组分多糖,经浓缩、透析(截留相对分子质量为3 000 Da)和冻干后,继续用凝胶渗透色谱层析柱Sephacryl S-300纯化,合并洗脱组分并进行浓缩、冻干。
2.4糖含量测定 采用硫酸-苯酚法,显色后用分光光度计测定488 nm处吸光度值,以葡萄糖为对照,绘制标准曲线,计算粗多糖中的糖含量[17]。
2.5蛋白质含量 本实验采用考马斯亮蓝G-250显色的方法测定样品中蛋白质的含量,吸光度值设定在595 nm处,以不加白蛋白溶液为空白,绘制标准曲线,计算鹰嘴豆多糖中蛋白质的含量[18]。
2.6硫酸基含量测定 本实验采用硫酸钡比浊法测定从鹰嘴豆中分离得到的均一多糖的硫酸基含量。运用可见分光光度法,最大吸收波长为360 nm,以硫酸钾为对照品,绘制标准曲线,计算粗多糖中硫酸基的含量[19]。
2.7均一多糖纯度验证 本实验采用HPGPC法确定从鹰嘴豆中分离得到的多糖的均一性和相对分子质量。本实验分离得到的多糖样品,用水溶解,配成质量浓度为20 g·L-1的溶液,在HPGPC法下测得保留时间,根据标准葡聚糖制得的标准曲线计算相对分子质量。
色谱条件为:色谱柱包括TSK-GEL G-5000 PWXL凝胶柱和G-3000 PWXL凝胶柱(串联);流动相:0.02 mol·L-1磷酸二氢钾溶液;流速:0.6 mL·min-1;进样量:20 μL;柱温:35 ℃;检测器:Waters 2414示差检测器。
标准葡聚糖为Dextran系列 (Dextran T1000,T500,T70,T40,T10,T5),其相对分子质量分别为1×106,5×105,7×104,4×104,1×104和5×103Da。由仪器分析数据可知:不同相对分子质量的葡聚糖的保留时间Rt和IgM存在一定的线性关系,根据此关系绘制回归方程曲线可计算多糖的相对分子质量。
2.8气相色谱分析单糖组成 本实验所需的单体对照品分别为D-木糖,L-阿拉伯糖,D-甘露糖,D-半乳糖,D-葡萄糖和L-鼠李糖。分别取各标准单体10 mL,置于具塞试管中,在90 ℃的条件下加入10 mg的盐酸羟胺和0.5 mL的吡啶,搅拌反应0.5 h。反应结束后,待试管冷却至室温,迅速加入0.5 mL的乙酸酐,70 ℃反应0.5 h。反应结束后,将样品浓缩至干,用氯仿溶解,气相进样分析。
气相色谱条件:仪器:Agilent Technologies 6820N Network GC Systerm;色谱柱:毛细管柱OV-17(30 m×0.32 mm);分流比:0.06∶1;进口温度:250 ℃;起始温度:200 ℃,以15 ℃·min-1升至220 ℃,保持10 min,再以10 ℃·min-1升至240 ℃,保持10 min。
10 mg鹰嘴豆多糖(CA-1b),加入2 mL的2 mol·L-1的三氟乙酸(TFA),置于具塞试管中,120 ℃油浴反应6 h,使其充分水解,将水解完成后的样品蒸干,用上述对照品乙酰化的方法对其进行乙酰化。
2.9多糖甲基化分析 称取均一多糖样品(CA-1b)10 mg,置于反应瓶中,加入DMSO 3 mL,磁力搅拌30 min,超声60 min,使多糖充分溶解。在密闭的反应瓶中通入氮气,缓慢滴加甲基亚磺酰钠(SMSM,实验室自制)2 mL,反应温度为20~25 ℃,时间1 h。待反应完成后,产物完全避光,在无光照的条件下,冰浴内加入碘甲烷1 mL,加入碘甲烷,放热完毕后,移除冰浴,避光室温反应8 h。产物透析,浓缩至干即得甲基化的多糖样品[20]。
将上述甲基化的样品用2 mL 2 mol·L-1的三氟乙酸溶液溶解,移至具塞试管中。120 ℃油浴反应6 h使其充分水解,多次加入甲醇蒸干样品溶液。将25 mg的硼氢化钠和2 mL水加入反应烧瓶中,室温下搅拌反应8 h。反应完成后样品为碱性,加入乙酸调节pH值为中性,多次加入甲醇蒸干样品溶液。此时与硼氢化钠还原后的样品加入1 mL的吡啶和2 mL的乙酸酐经行乙酰化,95 ℃加热反应1 h,多次加入甲苯蒸干样品溶液,氯仿溶解产物,进行GC-MS分析。
2.10抗氧化作用 采用DPPH·清除作用测定样品的抗氧化作用[21-23]。取10 mL不同浓度的多糖样品溶液和10 mL DPPH·溶液,置于同一具塞试管中,在避光条件下进行反应,混匀,反应30 min,用分光光度计测量525 nm处的吸光度值A。用同样的方法测得等体积纯水和DPPH·溶液的吸光度值A1以及待测多糖溶液与等体积乙醇混合溶液的吸光度值A0。清除率的计算公式为清除率=[1-(A-A0)/A1]×100%。同时,采用维生素C作为对照。
半数清除质量浓度(IC50)的计算:IC50指清除率为50%时所需样品的质量浓度。将待测多糖和维生素C配制成一系列不同质量浓度的溶液,由清除率公式得到各质量浓度多糖对DPPH·的清除率。清除率范围在0%~100%,绘制清除率对质量浓度曲线,计算出清除率为50%时的质量浓度,即为IC50。
3 结果与分析
3.1多糖的分离和纯化 鹰嘴豆粗多糖(CA)经过DEAE-Cellulose 52层析,得到2个不同的多糖。CA-1由0.7 mol·L-1氯化钠溶液洗脱得到,CA-2由0.8 mol·L-1的氯化钠溶液洗脱得到。通过体外自由基清除实验显示,CA-1显示出较好的自由基清除作用,故对CA-1重复多次进样Sephacryl S-300进行纯化,收集20~30管具有吸收峰的样品得到均一多糖CA-1b。
3.2均一多糖的理化性质
3.2.1总糖含量测定 按照2.4项下硫酸-苯酚法,鹰嘴豆多糖水溶液显色后根据分光光度计得到490 nm处的吸光度值,葡萄糖在实验中作为对照,以吸光度值为纵坐标(y)、糖的质量浓度为横坐标(x),计算标准曲线,回归方程为y=7.489 8x-0.004 42,r=0.999 8,葡聚糖质量浓度在1~15 μg·mL-1范围内与吸光度值呈良好的线性关系。同法计算得到CA-1b的总糖含量为95.38%。
3.2.2蛋白含量测定 按照2.5项下考马斯亮蓝法测定粗多糖中的蛋白含量。蛋白质-考马斯亮蓝G-250色素结合物在595 nm波长下的吸光度值与蛋白质含量成正比,本实验以牛血清白蛋白作为标准,以吸光度值为纵坐标(y)、考马斯亮蓝G-250质量浓度为横坐标(x)进行回归,得回归方程:y=0.043 3x+0.013 3,r=0.999 6,考马斯亮蓝G-250的质量浓度在0~10 μg·mL-1范围内与吸光度值呈良好的线性关系。同法计算CA-1b的蛋白含量为0.60%。
3.2.3硫酸基含量测定 按照2.6项下硫酸钡比浊法测定鹰嘴豆粗多糖中硫酸基的含量。以硫酸钾为标准对照,以吸光度值为纵坐标(y)、硫酸基含量为横坐标(x),进行回归,得回归方程:y=0.068 2x+0.080 9,r=0.999 8,硫酸钾质量浓度在0~2.5 μg·mL-1范围内与吸光度值呈良好的线性关系。同法计算CA-1b的硫酸基含量为1.58%。
3.2.4CA-1b纯度验证 HPGPC法又称凝胶过滤法。不同凝胶具有不同的孔径,且不同形状和大小的多糖分子在凝胶色谱柱中的移动速度也有一定的差异。由于不同的相对分子质量决定该多糖在凝胶色谱柱中的移动速度,若多糖流出液检测只有1个对称峰,表明该多糖的相对分子质量在一定范围内平均分布,即可认为该多糖为均一组分。HPGPC法鉴定以上分离得到的CA-1b为单一、均匀的对称峰,其相对分子质量为1.33×106Da。
3.3单糖组成分析 将全水解得到的产物,经过硼氢化钠还原,醋酐乙酰化制备糖醇乙酸酯衍生物,进一步对衍生物样品用水/氯仿(1∶1)萃取得到产物,进行气相(GC)组成分析。结果表明,CA-1b由4种单糖构成,依次分别为阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)。
3.4多糖甲基化分析 采用尿素作为变性剂拆除氢键,经3次甲基化反应后,红外图谱显示无明显的羟基吸收峰。甲基化产物水/氯仿(1∶1)萃取,氯仿相用体积分数为90%的甲酸解聚,用2 mol·L-1的三氟乙酸全水解,经过硼氢化钠还原,醋酐乙酰化制备糖醇乙酸酯衍生物后进行GC-MS分析。结果表明,CA-1b由阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)组成,见图1,其摩尔比为2.2∶3.1∶6.2∶1.0。糖残基的结构比例见表1。CA-1b的重复结构单元见图2。
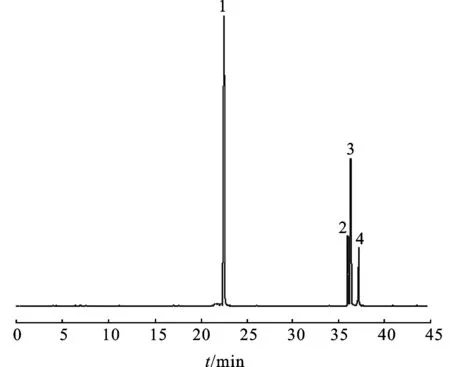
图1CA-1b的GC-MS图谱
1.葡萄糖;2.阿拉伯糖;3.甘露糖;4.半乳糖。
Fig.1 GC-MS chromatograms of the complete hydrolysis of CA-1b
1.Glc;2.Ara;3.Man;4.Gal.
表1CA-1b糖残基的结构比例
Tab.1 Glycosidic linkage composition of methylated CA-1b
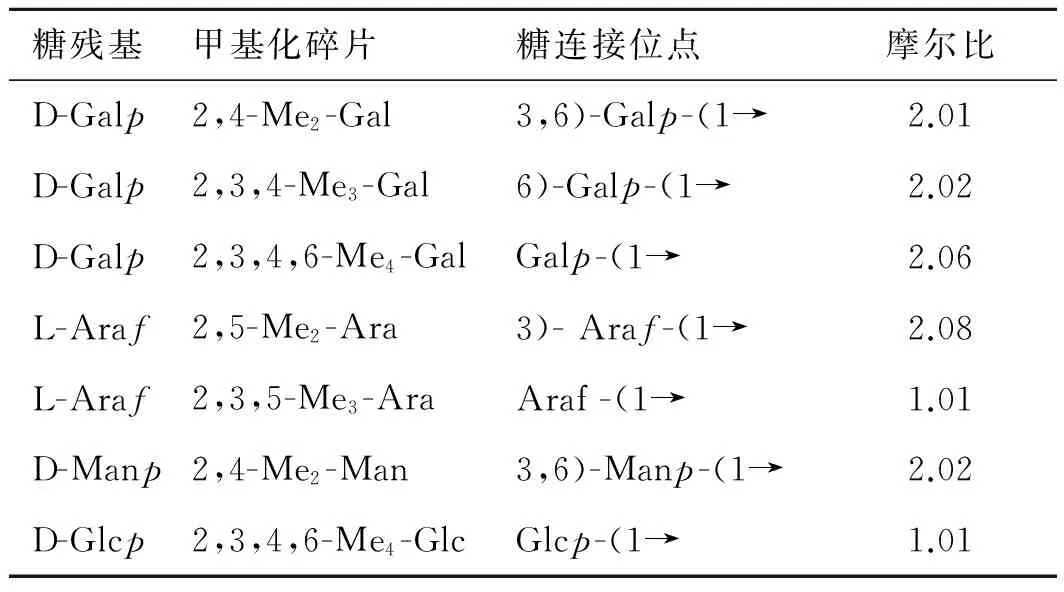
糖残基甲基化碎片糖连接位点摩尔比D-Galp2,4-Me2-Gal3,6)-Galp-(1→2.01D-Galp2,3,4-Me3-Gal6)-Galp-(1→2.02D-Galp2,3,4,6-Me4-GalGalp-(1→2.06L-Araf2,5-Me2-Ara3)-Araf-(1→2.08L-Araf2,3,5-Me3-AraAraf-(1→1.01D-Manp2,4-Me2-Man3,6)-Manp-(1→2.02D-Glcp2,3,4,6-Me4-GlcGlcp-(1→1.01

图2CA-1b的重复结构单元
Fig.2 Repeating structure unit of CA-1b
3.5抗氧化作用 取2.3项下制得的鹰嘴豆多糖CA-1b,分别制成不同质量浓度的溶液,按照2.10项下清除自由基能力评价方法进行抗氧化作用评价,计算其DPPH·的清除率,维生素C作为对照。得到实验结果为:多糖CA-1b分别在2,10,20 和40 μg·mL-1的质量浓度下,其清除率分别为12.1%,45.2%,62.2%和78.3%,计算IC50值为18.2 μg·mL-1。维生素C在相同质量浓度下的清除率分别为89.1%,90.2%,92.2%和93.8%。
4 结论
采用水提醇沉方法,经过除蛋白、透析、离子交换色谱和凝胶渗透色谱柱层析,从鹰嘴豆中提取分离得到了1个均一多糖CA-1b,通过HPGPC法验证其纯度,同时对CA-1b的糖含量、蛋白含量和硫酸基含量等理化参数进行测定,结果显示,CA-1b为首次从鹰嘴豆中分离得到的不含糖醛酸的均一多糖。
通过HPGPC法测定CA-1b的相对分子质量为1 335 kDa,GC-MS的结果表明其为阿拉伯糖(Ara),甘露糖(Man),葡萄糖(Glc)和半乳糖(Gal)组成的杂多糖,摩尔比为2.2∶3.1∶6.2∶1.0。由糖残基组成可推测其重复结构单元。
CA-1b的抗氧化数据表明,其对DPPH·有一定的清除作用,并呈现明显的剂量效应,计算其半数清除质量浓度IC50为18.2 μg·mL-1。结果表明,CA-1b是有效的天然抗氧化剂。
[1] 肖克来提,木尼拉.维药鹰嘴豆的国内外应用简介[J].中国民族医药杂志,2003,11(3):20.
[2] 肖辉,张月明,张文清.豆粉对糖尿病大鼠血糖血脂的调节作用[J].中国临床康复,2005,9(27):99-101.
[3] 吴霞,张秀,叶蕴华,等.GC-MS应用于鹰嘴豆中弱极性化学成分的研究[J].北京大学学报:自然科学版,2007,43(2):166-168.
[4] Saxena P,Saxena P,Shrivastava S K.Chemical composition of some conventional leguminous seeds[J].Ultra Scientist Physical Sci,2000,12(1):76-80.
[5] Rembold H,Weigner C.Chemical composition of chickpea,Cicerarietinum,exudates[J].J Biosci,1990,(45c):922-923.
[6] 李晓静,阿吉艾克拜尔·艾萨,程珍,等.维药鹰嘴豆的化学成分研究[J].现代药物与临床,2010,25(3):188-190.
[7] 谭永霞,孙玉华,陈若芸,等.鹰嘴豆化学成分研究[J].中国中药杂志,2007,32(16):1650-1652.
[8] 陈玲芳,杨新洲,熊慧,等.鹰嘴豆的化学成分研究[J].亚太传统医药,2012,8(7):41-43.
[9] 高鹏.维药鹰嘴豆化学成分的研究[D].上海:东华大学,2007:52-55.
[10]Xu Wentao,Zhang Fangfang,Luo Yunbo,et al. Antioxidant activity of a water-soluble polysaccharide purified fromPteridiumaquilinum[J].Carbohyd Res,2009,(344):217-222.
[11]Mau Jengleun,Lin Hsiuching,Song Sifu.Antioxidant properties of several specialty mushrooms[J].Food Res Int,2002,(35):519-526.
[12]L M Cheung,Peter C K Cheung,Vincent E C Ooi.Antioxidant activity and total phenolics of edible mushroom extracts[J].Food Chem,2003,(81):249-255.
[13]Chen Yi,Xie Mingyong,Nie Shaoping,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies ofGanodermaatrum[J].Food Chem,2008,(107):231-241.
[14]Ye Zipeng,Wang Wei,Yuan Qingxia,et al.Box-Behnken design for extraction optimization,characterization andinvitroantioxidant activity ofCicerarietinumL.hull polysaccharides[J].Carbohyd Polym,2016,(147):354-364.
[15]胡尔西丹,刘海,艾尔肯·依不拉音,等.分光光度法测定鹰嘴豆豆叶、豆茎、豆荚中总多糖含量[J].中国民族民间医药,2010,(21):9-10
[16]于睿,李层层,鲁慧,等.响应面优化酶法提取鹰嘴豆多糖及其红外光谱分析[J].食品科技,2016,41(9):204-208,215.
[17]黄玉仙,易骏,吴岩斌,等.不同种质薯蓣的多糖含量比较研究[J].中药材,2012,35(10):1565-1567.
[18]刘小华,张美霞,于春梅,等.考马斯亮兰法测定壳聚糖中蛋白的含量[J].中国交通医学杂志,2006,20(2):159-160.
[19]邱芳萍,张玲,于健.硫酸钡比浊法对鹿茸多糖中硫酸基含量的测定[J].长春工业大学学报:自然科学版,2005,26(4):268-270.
[20]Ciucanu I,Kerek F.A simple and rapid method for the permethylation of carbohydrates[J].Carbohyd Res,1984,(131):209-217.
[21]Roginsky V,Lissi E A.Review of methods to determine chain-breaking antioxidant activity in food[J].Food Chem,2005,(92):235-254.
[22]Mensor L L,Menezes F S,Leitao G G,et al.Screening of Brazilian plant extracts for antioxidant activity by the use of DPPH free radical method[J].Phytother Res,2001,(15):127-130.
[23]李改艳,刘小丹,张琳娜.款冬花多糖功能饮料的制备及其抗氧化能力测定[J].西北药学杂志,2016,31(4):339-402.

