雷替曲塞联合X线照射对人喉癌细胞Hep-2的协同作用
王 抒, 李 轩, 乔田奎
复旦大学附属金山医院肿瘤科,上海 201508
雷替曲塞联合X线照射对人喉癌细胞Hep-2的协同作用
王 抒, 李 轩, 乔田奎*
复旦大学附属金山医院肿瘤科,上海 201508
目的探讨雷替曲塞与X射线对人喉癌细胞Hep-2的协同作用及其潜在机制。方法CCK-8法检测不同浓度雷替曲塞对Hep-2细胞活力的影响。将Hep-2细胞随机分为对照组、雷替曲塞组、照射组、雷替曲塞+照射组。单击多靶模型绘制细胞存活曲线,检测4组细胞存活情况及放射增敏比(sensitization enhancement ratio,SER);流式细胞仪检测4组Hep-2细胞凋亡情况和周期改变。结果雷替曲塞能抑制Hep-2细胞活力,且呈剂量依赖性(P<0.05)。单击多靶模型显示,雷替曲塞平均致死剂量下SER为1.272。雷替曲塞能显著增加细胞凋亡和G2/M期阻滞(P<0.05)。结论雷替曲塞能协同X线对人喉癌细胞Hep-2的抑制作用,其机制可能与诱导肿瘤细胞凋亡和增加细胞G2/M期阻滞有关。
雷替曲塞;X线;Hep-2细胞;凋亡;细胞周期
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是耳鼻喉科最常见的恶性肿瘤之一。LSCC占头颈部上皮细胞来源恶性肿瘤的第2位,具有高度侵袭性,患者5年总生存率(overall survival,OS)约为61%[1-2]。近年来,对于喉癌的治疗,临床医师和患者越来越重视对喉部结构和功能的保护。放射治疗是治疗喉癌的重要手段之一。对于早期喉癌患者,根治性放疗的效果与手术疗效相当[3]。对于局部晚期喉癌患者,放疗是手术后治疗的重要手段[4]。对于无法行手术切除的喉癌患者或患者有强烈保喉意愿时,可采用放化疗联合治疗[5-6]。然而,由于喉癌细胞对射线的抵抗性,往往导致放疗失败,引起肿瘤复发和转移[7]。因此,寻找有效的放射增敏剂是多年来肿瘤领域的热点。
雷替曲塞是与喹唑啉叶酸化学结构相似的胸苷酸合酶(thymidylate synthase,TS)的特异性抑制剂,近年应用于多种实体肿瘤。在体内,雷替曲塞可以代谢成一系列多聚谷氨酸化合物,这些代谢物具有更强的TS抑制作用[8]。由于雷替曲塞与5-氟尿嘧啶(5-fluorouracil,5-Fu)具有相似的作用机制,因此雷替曲塞的应用范围较广,在结直肠癌[9]、胃癌[10]、食管癌[11]、头颈部恶性肿瘤[12]和恶性间皮瘤[13]等的治疗中均取得了肯定疗效。但雷替曲塞联合放疗在喉癌治疗中的作用目前尚不明确。本研究通过体外实验,探讨雷替曲塞协同X线照射对喉癌细胞的抑制作用,为其临床联合应用提供理论依据。
1 材料与方法
1.1 细胞与试剂 人喉癌细胞系购自中国典型培养物保藏中心(Chinese Type Culture Collection,CTCC)。雷替曲塞由南京正大天晴制药有限公司提供。细胞培养基MEM和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司。Annexin Ⅴ凋亡检测试剂盒、细胞周期试剂盒均购自美国BD公司。CCK-8试剂盒购自日本TaKaRa公司。
1.2 细胞培养 Hep-2细胞用含10% FBS、100 U/mL青霉素、100 μg/mL链霉素的MEM培养基中,置于37℃、5% CO2、95%湿度的培养箱中培养。常规消化传代,选取处于指数生长期的细胞进行实验。
1.3 细胞照射 应用美国Varian直线加速器,剂量率为2 Gy/min。X线能量为6 MV,源皮距100 cm。细胞克隆集落形成实验照射剂量依次为2、4、6、8、10 Gy,其余实验照射剂量均为10 Gy。
1.4 细胞增殖活力的测定 在96孔板中接种指数生长期的Hep-2细胞,每孔细胞数为6×103。加入终浓度分别为0.1、0.25、0.5、1.0、2.0 μg/mL的雷替曲塞,均分别培养24、48 h,每孔加入10 μL CCK-8试剂,避光反应3 h,振匀后用酶标仪于450 nm处检测光密度(optical density,D)值。实验独立重复3次。细胞活力(%)=(处理孔D-空白对照D) /(对照孔D-空白对照D)×100%。
1.5 细胞分组 将Hep-2细胞随机分为对照组、雷替曲塞组(RTX 组)、照射组(IR组)和雷替曲塞加照射组(RTX+IR组)。根据细胞活力的检测结果,RTX组和RTX+IR组照射前加入不影响细胞活力浓度的雷替曲塞。
1.6 细胞克隆集落形成实验 IR组、RTX+IR组分别给予0、2、4、6、8、10 Gy的X线照射后,立即将细胞用胰蛋白酶消化,并以500~3 000个/皿[14]接种到60 mm2培养皿中。孵育14 d后,将菌落用甲醇固定,结晶紫染色。使用显微镜计数染色的集落数(每个集落不少于50个细胞)。实验独立重复3次。克隆形成率(plating efficiency,PE)=(克隆数/接种细胞数) ×100%,细胞生存分数(survival fraction,SF)=(处理组PE/对照组PE)×100%。用单击多靶模型拟合细胞存活曲线计算各组平均致死剂量(mean death dose,D0)、准阈剂量(quasi-threshold dose,Dq)及增敏比(sensitization enhancement ratio,SER)。
1.7 细胞凋亡检测 六孔板指数生长的Hep-2细胞分组处理同上,照射后的细胞继续培养24、48 h,用胰酶消化并收集各组细胞(包括上清液中的细胞),冷PBS清洗2遍,加100 μL缓冲液重悬,再加入Annexin Ⅴ和碘化丙啶(PI)溶液各5 μL,混匀,室温避光孵育15 min后加入300 μL缓冲液,用流式细胞仪(BD FACSCalibur)进行检测。实验独立重复3次。
1.8 细胞周期检测 Hep-2细胞分组处理同上,照射后的细胞继续培养24、48 h,用胰酶消化,收集各组细胞。将收集好的细胞用70%冷乙醇在-20℃下固定过夜,避光将细胞加入含有50 μL/mL的RNase酶和50 μL/mL PI染色液,室温避光孵育30 min后,流式细胞仪检测细胞周期各时相所占比例。实验独立重复3次。
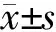
2 结 果
2.1 雷替曲塞对Hep-2细胞增殖活力的影响 用不同浓度雷替曲塞(0.1、0.25、0.5、1.0、2.0 μg/mL)处理Hep-2细胞后,细胞活力被抑制,并呈剂量依赖性(P<0.05);随着时间延长细胞活力进一步下降(P<0.05,图1)。
2.2 雷替曲塞对Hep-2细胞克隆形成的影响 雷替曲塞(0.1 μg/mL)联合X线(2、4、6、8、10 Gy)照射后, 细胞存活分数明显低于相应剂量的接受单纯照射的细胞存活分数(P<0.05,图2);RTX+IR组存活曲线肩区较IR组变窄(图2),SERD0为1.272(表1)。
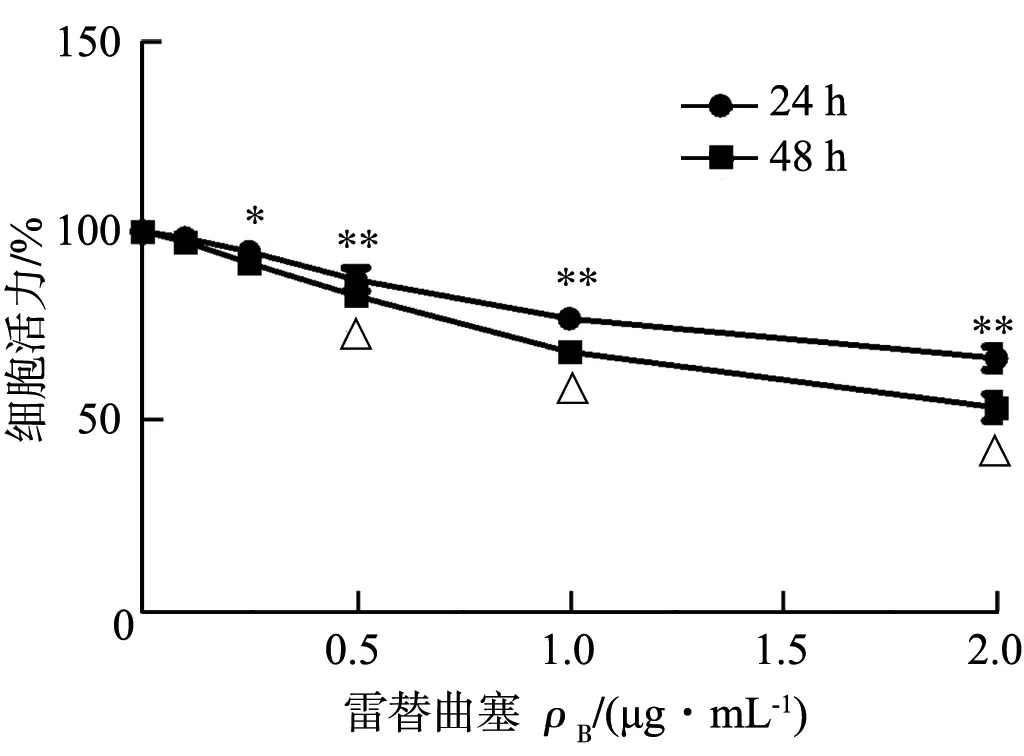
图1 雷替曲塞对Hep-2细胞活力的影响
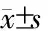
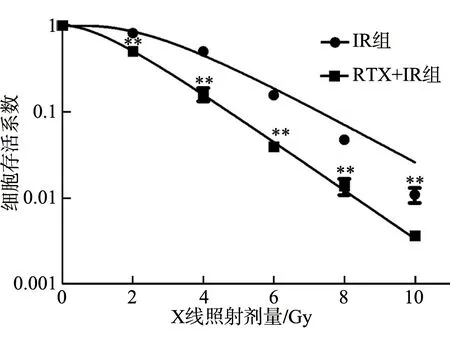
图2 雷替曲塞对Hep-2细胞克隆形成的影响
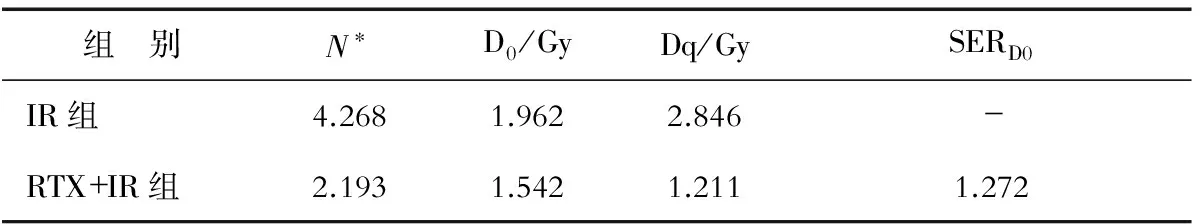
表1 雷替曲塞联合X线照射与单纯X线照射组各放射参数值的比较
*外推值,细胞内关键靶的数目或1个靶所需击中的次数
2.3 细胞凋亡 处理24 h后,对照组、RTX 组、IR组、RTX+IR组细胞凋亡率逐渐升高(P<0.05);处理48 h后,对照组、RTX 组、IR组、RTX+IR组细胞凋亡率逐渐升高(P<0.05)。其中,RTX+IR组细胞凋亡率较对照组、IR组升高(P<0.01,图3)。
2.4 细胞周期 处理24 h后,对照组、RTX组、IR组、RTX+IR组的细胞周期差异有统计学意义(P<0.05);处理48 h后,对照组、RTX组、IR组、RTX+IR组的细胞周期差异有统计学意义(P<0.05)。其中,RTX+IR组与对照组、IR组相比,G2/M期细胞比例明显增加(P<0.001,图4)。
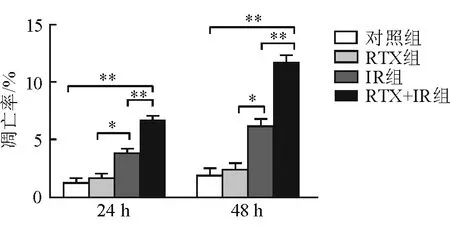
图3 不同组别细胞处理24、48 h后凋亡率比较
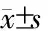
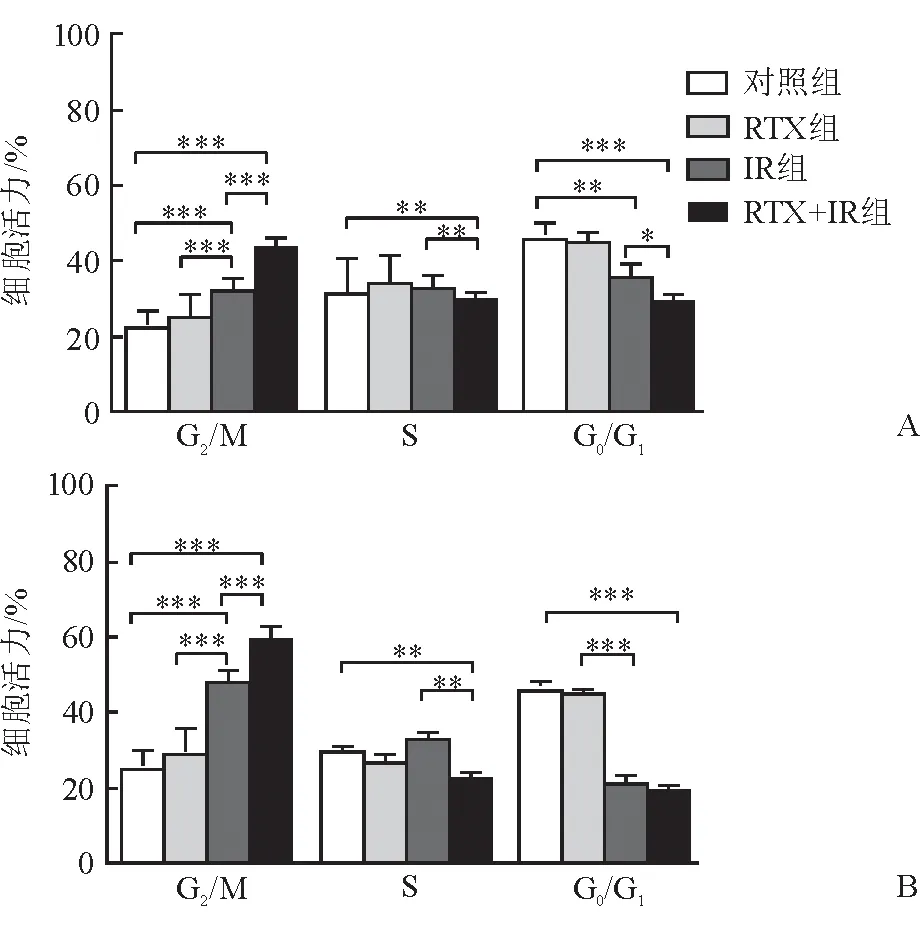
图4 不同组别细胞各细胞周期比例的比较
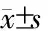
3 讨 论
雷替曲塞为新型水溶性TS特异性选择性抑制剂。其作用机制为:通过还原型叶酸载体(reduced folate carrier,RFC)转运至细胞内,被叶酰多聚谷氨酸合成酶(folylpolyglutamate synthetase,FPGS)代谢为多聚谷氨酰化合物后,选择性抑制TS,进而干扰DNA合成,导致DNA断裂和细胞死亡,从而产生抗肿瘤作用[8]。
雷替曲塞问世早期主要用以治疗结直肠癌,目前研究显示其对多种实体肿瘤均具有抗肿瘤活性[9-13]。雷替曲塞联合奥沙利铂在晚期结直肠癌中较5-Fu更具优势[15];雷替曲塞联合奈达铂使晚期复发或转移性咽喉癌患者总生存时间延长[12];雷替曲塞联合卡铂对转移或复发性头颈鳞癌患者有效率约53%[16]。雷替曲塞不仅用于肿瘤化疗,还可联合靶向或放射治疗。James等[17]进行的Ⅰ期临床研究显示,对于不可切除或复发性直肠癌,雷替曲塞联合放疗有显著疗效。在鼻咽癌[18]及食管鳞癌[19]中,雷替曲塞联合放疗不良反应较轻,治疗效果确切。本研究通过体外实验揭示了雷替曲塞能协同X线照射对人喉鳞癌细胞Hep-2的抑制作用。本研究中,CCK-8法检测结果表明,随着药物浓度和作用时间的增加,细胞增殖活力不断下降。与对照组相比,雷替曲塞为0.1 μg/mL时才对细胞增殖活力差异无统计学意义。故本实验SER研究中采用此浓度。
细胞克隆形成实验是公认的验证肿瘤细胞放射敏感性的“金标准”[20]。本研究结果提示,雷替曲塞联合放疗能显著减少Hep-2细胞的克隆形成数目。单纯放疗及联合治疗时的D0值分别为1.962、1.542 Gy,联合治疗的SER为1.272,提示在放疗之前使用雷替曲塞可提高Hep-2细胞株对放疗的敏感性。
细胞凋亡是放射杀死肿瘤细胞的一个重要途径。肿瘤细胞放射敏感性与细胞凋亡密切相关,凋亡率的增加提示细胞有更大的放射敏感性[21]。本研究显示,低浓度的雷替曲塞对喉癌细胞凋亡率没有明显影响,但RTX+IR组较IR组凋亡率升高。
肿瘤细胞放射敏感性在细胞周期的不同时相有很大差别,G2/M期细胞放射敏感性较G1或S期高;影响细胞周期检测点或周期蛋白表达均会改变肿瘤细胞的放射敏感性[22]。因此,肿瘤细胞的G2/M期阻滞也是提高放射敏感性的重要途径。本研究显示,RTX+IR组较IR组S期细胞比例降低,并出现明显的G2/M期停滞,提示雷替曲塞能提高喉癌细胞的放射敏感性。
放射抵抗是导致肿瘤放疗失败的关键因素之一,可能导致肿瘤转移和复发。本研究通过体外实验证明,雷替曲塞能协同X线对人喉鳞癌Hep-2细胞的抑制作用,其机制可能与诱导肿瘤细胞凋亡和增加G2/M期阻滞有关,为雷替曲塞联合放射治疗在喉癌治疗中的应用提供了实验依据。但本研究只涉及了体外研究,相关体内试验及信号转导通路、基因调控机制有待进一步探讨。
[ 1 ] RUDOLPH E, DYCKHOFF G, BECHER H, et al.Effects of tumour stage,comorbidity and therapy on survival of laryngeal cancer patients: a systematic review and a meta-analysis[J]. Eur Arch Otorhinolaryngol, 2011, 268(2): 165-179.
[ 2 ] HABBOUS S, HARLAND L T, LA DELFA A,et al. Comorbidity and prognosis in head and neck cancers: differences by subsite, stage, and human papillomavirus status[J]. Head Neck, 2014, 36(6): 802-810.
[ 3 ] GREULICH M T, PARKER N P, LEE P, et al. Voice outcomes following radiation versus laser microsurgery for T1glottic carcinoma: systematic review and meta-analysis[J]. Otolaryngol Head Neck Surg, 2015, 152(5): 811-819.
[ 4 ] FORASTIERE A A, WEBER R S, TROTTI A. Organ preservation for advanced larynx cancer: issues and outcomes [J]. J Clin Oncol, 2015, 33(29): 3262-3268.
[ 5 ] POPOVTZER A, BURNSTEIN H, STEMMER S,et al. Phase Ⅱ organ-preservation trial: Concurrent cisplatin and radiotherapy for advanced laryngeal cancer after response to docetaxel, cisplatin, and 5-fluorouracil-based induction chemotherapy[J]. Head Neck, 2017, 39(2): 227-233.
[ 6 ] BOEHM A, LINDNER F, WICHMANN G, et al. Impact of indication-shift of primary and adjuvant chemo radiation in advanced laryngeal and hypopharyngeal squamous cell carcinoma[J]. Eur Arch Otorhinolaryngol, 2015, 272(8): 2017-2025.
[ 7 ] ORTH M, LAUBER K, NIYAZI M, et al. Current concepts in clinical radiation oncology [J]. Radiat Environ Biophys, 2014, 53(1):1-29.
[ 8 ] HAGNER N, JOERGER M. Cancer chemotherapy: targeting folic acid synthesis[J]. Cancer Manag Res, 2010, 2: 293-301.
[ 9 ] CARAVATTA L, PICARDI V, TAMBARO R, et al. Neoadjuvant accelerated concomitant boost radiotherapy and multidrug chemotherapy in locally advanced rectal cancer: a dose-escalation study [J]. Am J Clin Oncol, 2012, 35(5): 424-431.
[10] SHEN J, WANG H, WEI J, et al. Thymidylate synthase mRNA levels in plasma and tumor as potential predictive biomarkers for raltitrexed sensitivity in gastric cancer[J]. Int J Cancer, 2012, 131(6): 938-945.
[11] MACKAY H J, MCINNES A, PAUL J, et al. A phase Ⅱstudy of epirubicin, cisplatin and raltitrexed combination chemotherapy (ECT) in patients with advanced oesophageal and gastric adenocarcinoma [J]. Ann Oncol, 2001, 12(10): 1407-1410.
[12] 迟洪亮.奈达铂联合雷替曲塞治疗晚期喉咽癌17例分析[J].中国医药指南,2014,12(19):199-200.
[13] SURMONT V F, VAN MEERBEECK J P. Raltitrexed in mesothelioma[J]. Expert Rev Anticancer Ther, 2011,11(10): 1481-1490.
[14] SHORT S C, GIAMPIERI S, WORKU M, et al. Rad51 inhibition is an effective means of targeting DNA repair in glioma models and CD133+tumor-derived cells[J]. Neuro Oncol, 2011, 13(5): 487-499.
[15] 胡 俊, 韦永明, 王 银, 等. 雷替曲塞在晚期结直肠癌治疗中的应用价值[J].吉林医学,2011,32(34):7281-7281.
[16] GALETTA D, GIOTTA F, ROSATI G, et al.Carboplatin in combination with raltitrexed in recurrent and metastatic head and neck squamous cell carcinoma: a multicentre phase Ⅱ study of the Gruppo Oncologico Dell’Italia Meridionale (G.O.I.M.)[J]. Anticancer Res, 2005, 25(6C): 4445-4449.
[17] JAMES R D, BOTWOOD N, VERNON C C, et al.Raltitrexed plus radiotherapy for the treatment of unresectable/recurrent rectal cancer:a phase Ⅰ study[J]. Ann Oncol, 2003,14(4): 570-573.
[18] 丁 巍, 姜万荣, 孙向东, 等. 雷替曲塞联合奈达铂同步螺旋断层放疗治疗局部晚期鼻咽癌的临床研究[J].临床肿瘤学杂志,2016, 21(8):727-731.
[19] 夏铀铀, 王 磊, 宋大安,等. 放疗联合雷替曲塞奥沙利铂同步治疗中晚期食管癌的Ⅱ期临床研究[J].中国肿瘤临床, 2014, 41(11):716-719.
[20] KIM H, LEE O H, XIN H W, et al. TRF2 functions as a protein hub and regulates telomere maintenance by recognizing specific peptide motifs[J].Nat Struct Mol Biol,2009,16(4):372-379.
[21] YUAN S, QIAO T, CHEN W. CpG oligodeoxynucleotide 1826 enhances the Lewis lung cancer response to radiotherapy in murine tumor[J]. Cancer Biother Radiopharm, 2011, 26(26): 203-208.
[22] 王宏梅, 陈龙华, 郑小康, 等.抑制ATM表达致鼻咽癌细胞CNE1辐射增敏的细胞周期阻滞研究[J].癌症,2008,27(5): 466-470.
ThesynergisticeffectofraltitrexedcombinedwithX-rayradiationonhumanlaryngealcancerHep-2cells
WANG Shu, LI Xuan, QIAO Tian-kui*
Department of Oncology, Jinshan Hospital, Fudan University, Shanghai 201508, China
Objective: To investigate the synergistic effect of raltitrexed combined with radiotherapy on Hep-2 cells and its potential mechanism.MethodsCCK-8 assay was used to determine the cell viability after Hep-2 cells were treated with different concentrations of raltitrexed. Hep-2 cells were randomly divided into the control group, the raltitrexed group, the radiation group, and raltitrexed + radiation group. Cell survival curves were fitted with a single-hit multi-target model, cell viability and sensitization enhancement ratio(SNR) of the 4 groups were detected, and apoptosis and cycle changes of Hep-2 cells in 4 groups were detected by flow cytometry.ResultsCCK-8 assay proved that raltitrexed could suppress cell viability in a dose-dependent manner. The single-hit multi-target model showed that the SER of mean death dose (D0) was 1.272.Furthermore, the apoptosis rate and the number of Hep-2 cells at G2/M phase were significantly increased in the group treated with the combination of raltitrexed and X-ray as compared to the group treated with X-ray alone (P<0.05).ConclusionsThe inhibitory effect of raltitrexed combined with X-ray on human laryngeal cancer Hep-2 cells may be related to the induction of tumor cell apoptosis and the increase of G2/M phase arrest.
raltitrexed; X-ray; Hep-2 cells; apoptosis; cell cycle
2017-06-17接受日期2017-08-21
上海市金山区卫生和计划生育委员会青年项目(JSKJ-KTQN-2014-01).Supported by the Jinshan District Health and Family Planning Commission Project in Shanghai (JSKJ-KTQN-2014-01).
王 抒,硕士,主治医师. E-mail:wshu830821@163.com
*通信作者(Corresponding author). Tel:021-57039590, E-mail:qiaotk@163.com
10.12025/j.issn.1008-6358.2017.20170522
R 739.65
A
[本文编辑] 姬静芳

