舌静脉注射没食子酸的慢性低灌注大鼠学习记忆能力及脑氧化应激损伤相关指标观察
尚运之,翟志永
(中国医科大学附属盛京医院,沈阳 110014)
舌静脉注射没食子酸的慢性低灌注大鼠学习记忆能力及脑氧化应激损伤相关指标观察
尚运之,翟志永
(中国医科大学附属盛京医院,沈阳 110014)
目的观察舌静脉注射没食子酸(GA)的慢性低灌注大鼠学习记忆能力及脑氧化应激损伤相关指标变化。方法48只大鼠随机分为4组各12只。A、B组大鼠制备慢性低灌注模型,A组在制模前后各5天舌静脉注射100 mg/kg GA,B组给予等量生理盐水;C、D组参照A组手术方法处理大鼠但不结扎双侧颈总动脉,C组在手术前后各5天舌静脉注射100 mg/kg GA,D组给予等量生理盐水。比较各组大鼠的学习记忆能力(逃避潜伏期、目标象限所用时间百分比、游泳速度)及脑氧化应激损伤相关指标[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、总硫醇(TT)]。结果与D组比较,B组第1~4天逃避潜伏期增加(P均<0.05);与B组比较,A组第1~4天逃避潜伏期减少(P均<0.05)。与D组比较,B组目标象限所用时间百分比减少(P均<0.05);与B组比较,A、C组目标象限所用时间百分比增加(P均<0.05)。与D组比较,B组SOD、GSH-Px、TT降低,MDA升高(P均<0.05);与B组比较,A组和C组SOD、GSH-Px、TT升高,MDA降低(P均<0.05)。结论GA能改善慢性低灌注大鼠的学习记忆能力及修复脑氧化应激损伤。
没食子酸;慢性脑低灌注;学习记忆能力;氧化应激
随着我国人民生活水平的提高和生活方式的改变,高血脂、高血糖、高血压疾病频发,脑血管病的发病率及病死率也居高不下[1,2]。慢性脑低灌注状态是血管性痴呆、阿尔茨侮默病(AD)、Binswanger病等多种脑血管疾病发展过程中的一个共同病理过程[3,4]。没食子酸(GA)是一种很好的神经保护剂[5],具有羧基、羟基的芳香族化合物和可水解单宁的组成部分。GA广泛存在于五倍子、茶叶、葡萄、叶下珠、石榴等植物中,具有抗氧化、清除自由基、抗癌、抗炎、抗真菌等多种作用,还可以用于治疗糖尿病[6]。本研究观察了舌静脉注射GA的慢性低灌注大鼠学习记忆能力及脑氧化应激损伤相关指标变化,旨在为慢性脑低灌注所致的认知功能障碍疾病的治疗提供参考依据。
1 材料与方法
1.1 实验动物 雄性Wistar大鼠48只,体质量200~250 g,清洁级,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂及仪器 5,5′-二硫代双(2-硝基苯甲酸)(DTNB)、GA购自Sigma-Aldrich公司,纯度>95%;超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒购自上海信裕生物技术有限公司;谷胱甘肽过氧化物酶(GSH-Px)试剂盒由Randox Company提供;其余试剂都是使用分析纯试剂,购自国药集团化学试剂有限公司。MD-100半自动生化测定仪购自上海益联科教设备有限公司;UV2450-紫外分光光度计购自日本岛津;大鼠Morris水迷宫及分析软件购自上海多毅实业有限公司;Eppendorf 5424R低温离心机购自德国Eppendorf。
1.3 GA给予方法及慢性低灌注模型制备 48只大鼠随机分为A、B、C、D组各12只。A、B组参照文献[7,8]方法(大鼠仰卧位固定,颈部常规消毒铺巾后,在颈腹侧正中切开皮肤,逐层剥离肌肉,暴露颈总动脉,小心分离伴行的迷走神经,将双侧颈总动脉用双重丝线结扎,缝合皮肤)制备慢性低灌注模型,A组在制模前后各5天舌静脉注射100 mg/kg GA[9],B组给予等量生理盐水;C、D组参照A组手术方法处理大鼠但不结扎双侧颈总动脉,C组在制模前后各5天舌静脉注射100 mg/kg GA,D组给予等量生理盐水。
1.4 大鼠学习记忆能力评价 注射GA结束后次日(手术结束后第6天),用Morris水迷宫实验来测定各组大鼠的学习记忆能力。Morris水迷宫由带站台的水池、自动摄像机及Morris水迷宫数据处理软件三部分组成。在测试前将水和牛奶的混合物注入池中,水深30 cm(水面高出站台表面1 cm,大鼠见不到站台),水温(26±1)℃。实验环境要求在隔音、光线偏暗的室内,各次实验间相应的条件保持不变。在实验前1 d,将每只大鼠头部标记,试验周期共4 d,前3 d为训练阶段,第4天为测试阶段。训练阶段每天训练3次,入池位置分别为站台所对及相邻象限,将大鼠置于象限边缘1/2弧度处,并且头朝池壁入水,大鼠入水时摄像机开始记录且Morris水迷宫数据处理软件开始记录及计算。①逃避潜伏期:记录大鼠每次入水到游到站台的时间(s),如大鼠在120 s仍内未找到站台,可在第120 s时将其放置在站台上,此时潜伏期记为120 s,大鼠到达站台后,使其在站台上停留15 s;②目标象限所用时间百分比:在第4天的测试阶段移除站台,将大鼠从原站台所对象限中面向池壁轻轻放入池中自由游泳60 s,记录大鼠花费在原站台所在象限中的时间,并除以60 s,所得为目标象限所占时间百分比;③游泳速度:记录大鼠每次训练及测试时的游泳速度,并取平均值。数据采集及图像分析均由图像自动监视和处理系统完成[10]。
1.5 大鼠脑氧化应激损伤相关指标检测 Morris水迷宫实验结束后第2天,各组大鼠断头取脑,分离脑皮层,制备出10%的组织匀浆液。ELISA法测定SOD活性及MDA含量,具体操作方法严格按照试剂说明书进行测定。GSH-Px检测采用比色法,严格按照GSH-Px试剂盒说明书测定。总硫醇(TT)使用DTNB作为还原剂测定。1 mL tris-EDTA(pH 8.6)缓冲溶液加入50 μL脑匀浆液中,然后定容在紫外分光光度412 nm测定。之后加入20 μL DTNB试剂(10 mmol/L溶液)加入到上述溶液15 min后再测定,然后根据他们的比值计算浓度[11]。

2 结果
2.1 各组大鼠Morris水迷宫逃避潜伏期比较 结果见表1。
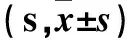
表1 实验第1~4天各组大鼠Morris水迷宫逃避潜伏期比较
注:与D组比较,*P<0.05;与B组比较,#P<0.05。
2.2 各组大鼠Morris水迷宫目标象限所用时间百分比及游泳速度比较 结果见表2。

表2 各组大鼠Morris水迷宫目标象限所用时间百分比及游泳速度比较
注:与D组比较,*P<0.05;与B组比较,#P<0.05。
2.3 各组大鼠脑皮层SOD、MDA、GSH-Px、TT水平比较 结果见表3。

表3 各组大鼠脑皮层SOD、MDA、GSH-Px、TT水平比较
注:与D组比较,*P<0.05;与B组比较,#P<0.05。
3 讨论
随着多种新技术在神经科临床的应用,临床医师对慢性低灌注状态的研究得到越来越多的认识和重视[12]。慢性低灌注是指由动脉狭窄所致脑组织血供长期低于生理阈值而出现慢性缺血性神经系统功能损害的病理状态,可能与脑白质疏松、血管性痴呆、短暂性脑缺血发作、动脉硬化性脑梗死等发病有关[13~16],大量临床研究[17,18]也观察到轻度认知功能障碍、血管性痴呆(VD)、AD患者脑血流量减少,提示脑血流降低与神经元凋亡、认知障碍及痴呆的进展密切相关。永久性结扎大鼠双侧颈总动脉可导致其大脑慢性不完全性缺血,是目前最常用的VD动物模型[19]。多项研究[20,21]表明,在低灌注状态下,认知功能会发生减退,同时伴随有脑部自由基代谢的紊乱,这也是低灌注对脑实质和脑微血管系统造成损害的重要机制。当慢性低灌注发生时,氧化应激机制启动,而氧化应激已被广泛研究证实是导致神经细胞缺血性损伤的重要致病原因之一[1,22]。另外,活性氧物质还可使线粒体产生氧化性病理损伤[23]。
GA是多种中药及其复方制剂中重要的功效成分,广泛存在于葡萄、茶叶、五倍子、刺云、实豆荚等植物中,其酯类化合物作为抗氧化剂被广泛应用于食品、制药及轻工等行业。已有的研究发现,GA具有明显抗肿瘤[24]、抗炎、抗病毒、抗真菌及心脑血管保护[25]和抗氧化[26]等药理作用。有报道[23]显示,大鼠双侧颈总动脉结扎后有15个脑区的局部脑血流量降低25%~87%。本研究显示,与D组比较,B组第1~4天逃避潜伏期增加;与B组比较,A组第1~4天逃避潜伏期减少。与D组比较,B组目标象限所用时间百分比减少;与B组比较,A、C组目标象限所用时间百分比增加。表明虽然处于慢性低灌注时,缺血缺氧状态会对学习记忆功能产生持续作用,但GA可以使这种学习记忆功能下降的趋势有所减弱,从而改善认知功能。
在缺氧状态下,具有抗氧化活性的物质SOD、过氧化氢酶、GSH-Px等减少,过氧化脂质产物MDA增加,外源性给予抗氧化酶或自由基清除剂,对缺血及再灌注心肌有明显保护作用,因此MDA含量可间接反映氧自由基的产生与组织的损伤程度,而SOD活性与GSH-Px则可直接反映机体清除自由基和抗脂质过氧化的能力[23,27]。本研究显示,与D组比较,B组SOD、GSH-Px降低,MDA升高;与B组比较,A组和C组SOD、GSH-Px升高,MDA降低。说明GA对这些参与到氧化应激反应中酶促的相关因子都有一定的调节作用。另外,GA也能参与到非酶促的氧化应激反应中[6]。本研究还显示,与D组比较,B组TT降低;与B组比较,A、C组TT升高。表明GA对非酶促的氧化应激反应也有积极的作用。但是我们的实验也发现,GA处理只能使大鼠经手术后SOD、GSH-Px、MDA、TT恢复到机体内的基础水平,并不能通过GA的作用促使这些指标水平超过大鼠机体基础水平。因而我们的研究进一步说明,GA并不能增加大鼠机体氧化应激相关因子的基础水平,只是在氧化应激相关因子水平发生改变时才会做出相应的改变。造成这一结果可能的推测是,机体内可能存在一种反馈的机制,SOD、GSH-Px、MDA、TT超出基础水平时,会产生其他的反应途径转化这些氧化应激相关的因子[28]。
总之,GA能改善慢性低灌注大鼠的认知缺陷及修复脑氧化应激损伤,GA对认知与神经保护作用的增强是与氧化应激作用相关,但本实验未能直接证明GA如何与这些因子相互作用。由于慢性低灌注引起的损伤会产生一个复杂的级联反应,其中会涉及到多种的信号通路,因此如何更进一步的研究该机制,还需要从细胞水平、分子代谢及信号传导通路等不同角度去挖掘,进而为慢性低灌注所致的认知功能障碍疾病的治疗提供帮助。
[1] Safouris A, Hambye AS, Sculier C, et al. Chronic brain hypoperfusion due to multi-vessel extracranial atherosclerotic disease: a potentially reversible cause of cognitive impairment[J]. J Alzheimers Dis, 2015,43(1):23-27.
[2] 张建斌,李小慧.石榴汁对慢性脑低灌注大鼠认知行为的影响及其作用机制研究[J].中国生化药物杂志,2015,35(3):58-61.
[3] 贾宁,韩锟.EGCG改善APP/PS1转基因小鼠认知功能及减轻海马胰岛素抵抗的机制研究[J].中国生化药物杂志,2014,34(1):12-15.
[4] Salminen A, Jouhten P, Sarajarvi T, et al.Hypoxia and GABA shunt activation in the pathogenesis of Alzheimer′s disease[J].Neurochem Int, 2015,23(5):423-430.
[5] 谢晓艳,刘洪涛,张吉,等.没食子酸体外抗氧化作用研究[J].重庆医科大学学报,2011,36(3):319-322.
[6] 于艳华,卜丽梅,赵丽红,等.没食子酸对缺血再灌注损伤大鼠的保护作用[J].中国老年学杂志,2010,30(20):2935-2937.
[7] Roohbakhsh A, Moghaddam AH, Massoudi R, et al. Role of dorsal hippocampal cannabinoid receptors and nitric oxide in anxiety like behaviours in rats using the elevated plus-maze test[J]. Clin Exp Pharmacol Physiol, 2007,4(3):223-229.
[8] Xu X, Li Z, Yang Z, et al. Decrease of synaptic plasticity associated with alteration of information flow in a rat model of vascular dementia[J]. Neuroscience, 2012,206:136-143.
[9] Hsu CL, Yen GC. Effect of gallic acid on high fat diet-induced dyslipidaemia, hepatosteatosis and oxidative stress in rats[J]. Br J Nutr, 2007,98(4):727-735.
[10] 赵玲,刘丽,李雅莉,等.慢性脑低灌注状态对大鼠学习记忆功能及脑组织自由基代谢的影响[J].中国行为医学科学,2005,14(11):961-963.
[11] Sarkaki A, Fathimoghaddam H, Mansouri SM, et al. Gallic acid improves cognitive, hippocampal long-term potentiation deficits and brain damage induced by chronic cerebral hypoperfusion in rats[J]. Pak J Biol Sci, 2014,17(8):978-990.
[12] 邹璨,郝磊,田洪,等.慢性脑低灌注后失交感神经支配对脑动脉生成的影响[J].第三军医大学学报,2015,37(18):1818-1822.
[13] Narantuya D, Nagai A, Sheikh AM, et al.Microglia transplantation attenuates white matter injury in rat chronic ischemia model via matrix metalloproteinase-2 inhibition[J]. Brain Res, 2010,1316:145-152.
[14] Kwon KJ, Lee EJ, Kim MK, et al. Diabetes augments cognitive dysfunction in chronic cerebral hypoperfusion by increasing neuronal cell death: implication of cilostazol for diabetes mellitus-induced dementia[J]. Neurobiol Dis, 2015,73:12-23.
[15] Hotter B, Ostwaldt AC, Levichev-Connolly A, et al. Natural course of total mismatch and predictors for tissue infarction[J]. Neurology, 2015,85(9):770-775.
[16] Safouris A, Hambye AS, Sculier C, et al. Chronic brain hypoperfusion due to multi-vessel extracranial atherosclerotic disease: a potentially reversible cause of cognitive impairment[J]. J Alzheimers Dis, 2015,43(1):23-27.
[17] Schuff N, Matsumoto S, Kmiecik J, et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer′s disease, measured by arterial spin-labeling magnetic resonance imaging[J]. Alzheimers Dement, 2009,5(6):454-462.
[18] Kume K, Hanyue H, Sato T, et al. Vascular risk factors are associated with faster decline of Alzheimer disease: alongitudinal SPECT study[J]. J Neurol, 2011,258(7):1295-1303.
[19] Farkas E, Luiten PG, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion-related neurodegenerative diseases[J]. Brain Res Rev, 2007,54(1):162-180.
[20] Gupta S, Singh P, Sharma BM, et al. Neuroprotective effects of agomelatine and vinpocetine against chronic cerebral hypoperfusion induced vascular dementia[J]. Curr Neurovasc Res, 2015,12(3):240-252.
[21] Jing Z, Shi C, Zhu L, et al. Chronic cerebral hypoperfusion induces vascular plasticity and hemodynamics but also neuronal degeneration and cognitive impairment[J]. J Cereb Blood Flow Metab, 2015,35(8):1249-1259.
[22] Yang Y, Zhang J, Xiong L, et al. Cognitive improvement induced by environment enrichment in chronic cerebral hypoperfusion rats: a result of upregulated endogenous neuroprotection[J]. J Mol Neurosci, 2015,56(2):278-289.
[23] Sweet JG, Chan SL, Cipolla MJ. Effect of hypertension and carotid occlusion on brain parenchymal arteriole structure and reactivity[J]. J Appl Physiol, 2015,119(7):817-823.
[24] Shi L, Lei Y, Srivastava R, et al. Gallic acid induces apoptosis in human cervical epithelial cells containing human papillomavirus type 16 episomes[J]. J Med Virol, 2016,88(1):127-134.
[25]卜丽梅,关凤英,乔萍,等.没食子酸对大鼠缺血再灌注损伤后细胞凋亡的保护作用及机制研究[J].中国实验诊断学,2010,14(11):1693-1697.
[26] de Cristo Soares Alves A, Mainardes RM, Khalil NM. Nanoencapsulation of gallic acid and evaluation of its cytotoxicity and antioxidant activity[J]. Mater Sci Eng C Mater Biol Appl, 2015,60(3):213-215.
[27] Choi JY, Cui Y, Kim BG. Interaction between hypertension and cerebral hypoperfusion in the development of cognitive dysfunction and white matter pathology in rats[J]. Neuroscience, 2015,303:115-125.
[28] Ma L, Lu ZN, Hu P, et al. Neuroprotective effect of escitalopram oxalate in rats with chronic hypoperfusion[J]. J Huazhong Univ Sci Technolog Med Sci, 2015,35(4):514-518.
10.3969/j.issn.1002-266X.2017.47.010
R741.05
A
1002-266X(2017)47-0035-04
翟志永(E-mail:snezzy@sj-hospital.org)
2017-07-25)

