姜黄素抑制耐紫杉醇食管癌细胞的上皮间质转化作用及机制探讨*
李 克,徐淑宁,刘 莺,李 帅,乔 磊,侯新芳,王居峰
(郑州大学附属肿瘤医院/河南省肿瘤医院消化内一科 450052)
姜黄素抑制耐紫杉醇食管癌细胞的上皮间质转化作用及机制探讨*
李 克,徐淑宁,刘 莺,李 帅,乔 磊,侯新芳,王居峰△
(郑州大学附属肿瘤医院/河南省肿瘤医院消化内一科 450052)
目的建立耐紫杉醇食管癌(EC)细胞系EC9706/PTX,观察姜黄素对EC9706/PTX细胞上皮间质转化(EMT)的抑制作用并探讨其机制,为耐药EC的治疗提供理论依据。方法用中等浓度间歇作用法建立耐紫杉醇EC细胞EC9706/PTX,四甲基偶氮唑蓝(MTT)法测定细胞耐药指数及交叉耐药性,检测不同浓度姜黄素对EC9706/PTX细胞增殖的抑制。使用细胞骨架染色、划痕实验、Transwell侵袭实验检测姜黄素对EC9706/PTX细胞形态变化、迁移和侵袭能力的影响。荧光定量PCR及蛋白免疫印迹(Western blot)检测姜黄素对EC9706/PTX细胞中EMT相关分子标志物E-钙黏蛋白、N-钙黏蛋白、波形蛋白、纤维连接蛋白在mRNA和蛋白水平的表达影响。Western blot检测姜黄素对EC9706/PTX细胞中转录因子NF-κB p65及Snail在蛋白水平的表达影响。结果EC9706/PTX对紫杉醇的耐药指数为28.4,对顺铂、阿霉素产生交叉耐药性,姜黄素能够抑制EC9706/PTX细胞的增殖。在20 μmol/L浓度的姜黄素作用下,EC9706/PTX细胞的迁移和侵袭能力明显降低。荧光定量PCR及Western blot检测显示,细胞耐药后E-钙黏蛋白的表达明显下调,而N-钙黏蛋白表达则明显上调,姜黄素逆转了这一现象。Western blot检测提示,EC细胞发生耐药及EMT后, NF-κB p65及Snail蛋白的表达增强,姜黄素阻断了这一作用。结论姜黄素能够抑制紫杉醇耐药EC细胞的增殖并且能够逆转紫杉醇耐药EC细胞的EMT现象,其机制可能是通过抑制NF-κB-Snail信号通路实现的。
紫杉醇;食管肿瘤;姜黄素;上皮间质化
食管癌(esophageal cancer,EC)在发达国家和发展中国家均表现出高发病率和高病死率两大特征。EC的治疗方法包括手术、放疗、化疗和生物治疗等,化疗容易产生多药耐药性肿瘤细胞,而耐药细胞易发生上皮间质转化(epithelial-mesenchymal transition,EMT)[1],EMT发生会促进癌侵袭、转移,严重影响患者预后和生存期。姜黄素是一种植物多酚、可抑制多种肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤细胞扩散和逆转肿瘤耐药性[2-3]。有学者证实,姜黄素可以通过抑制核因子κB(NF-κB)的激活,进而下调其下游重要转录因子Snail的表达,达到抑制癌细胞EMT的作用[4]。由此笔者提出假设:姜黄素可能通过NF-κB-Snail信号通路抑制EMT来发挥抗耐药EC侵袭的作用。
1 材料与方法
1.1材料 紫杉醇、顺铂、阿霉素、5-氟尿嘧啶(5-FU,美国Sigma公司)。四甲基偶氮唑蓝(MTT,美国Sigma公司),E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)、纤维连接蛋白(fibronectin)、NF-κB p65抗体、Snail抗体(英国Abcam公司),Transwell(美国BD公司),P-IkBɑ(Cell Signaling Technology公司)。

表1 引物序列及目的片段长度
1.2方法
1.2.1EC9706/PTX耐药株的建立 采用中等浓度间歇作用法建立EC耐药细胞EC9706/PTX。取对数生长期的EC9706细胞,药物诱导剂量及过程如下: 2 mg/L 3次→4 mg/L 3次→6 mg/L 3次→ 10 mg/L 3次→历经18个月,建立耐药株。
1.2.2MTT法测定耐药指数 取对数生长期细胞,以5×103个/孔接种于96孔板中,设3个复孔, 24 h后更换含有不同浓度紫杉醇、阿霉素、顺铂、5-FU的培养基,并设不加药物的空白对照。48 h后加入MTT,培养4 h加入二甲基亚砜(DMSO),用多功能酶标仪测定波长490 nm处的吸光度(A)值,用GraphPad Primer 5.0软件计算细胞半数抑制浓度(IC50),耐药指数(RI)=IC50(EC9706/PTX)/IC50(EC9706)。
1.2.3姜黄素抑制EC9706/PTX细胞增殖实验 取对数生长期的EC9706/PTX细胞消化后计数接种于96孔板中,设3个复孔。第2天换用含不同浓度姜黄素(0~80 μmol/L)的培养基, 48 h后用MTT法测定细胞生长指数。生长指数=实验组A值/对照组A值,其中对照组即姜黄素浓度为0 μmol/L,实验重复3次,待实验结果出来后,选取合适的姜黄素浓度进行后续实验。
1.2.4细胞划痕实验观察姜黄素对EC9706/PTX迁移的作用 根据实验1.2.3结果,选定20 μmol/L浓度的姜黄素做进一步实验,实验分为EC9706组,EC9706/PTX组,姜黄素作用EC9706/PTX组(姜黄素作用组)。将3组细胞接种到6孔板中,细胞增殖至融合后,用无菌小枪头划痕,拍照。用含2%血清的RPMI1640培养基继续培养,24 h再拍照,对细胞间距变化进行统计, 细胞迁移率=细胞24 h时间距/细胞0 h时间距。
1.2.5细胞侵袭实验 将Transwell小室水化2 h。取1×105个细胞用无血清RPMI1640稀释至500 μL,小室外加入600 μL含20%血清的RPMI1640,30 h后取出小室,固定、染色、封片。显微镜下对穿过滤膜的细胞进行计数(计数5个视野,每组设3个平行孔)。
1.2.6细胞骨架染色观察姜黄素对EC9706/PTX形态的影响 实验分为EC9706组,EC9706/PTX组,姜黄素作用组。做细胞爬片,甲醛固定后用TritonX-100通透细胞,加入耦联了荧光素的罗丹明染色30 min ,加入4′6-二脒基-2-苯基吲哚DAPI染色3 min,中性树胶封片,荧光显微镜下观察细胞骨架。
1.2.7荧光定量PCR检测姜黄素对EC9706/PTX细胞EMT标志物mRNA水平的影响 收集EC9706组、EC9706/PTX组、姜黄素作用组的细胞,用Trizol法提取RNA,按照反转录试剂盒操作说明将获得的总RNA转录成cDNA。以cDNA为模板扩增E-cadherin、N-cadherin、vimentin、fibronectin片段,引物见表1,以β-actin为内参。用荧光定量 PCR 仪所配软件Rotor-Gene 6000 Series Software 对实验结果进行分析。
1.2.8蛋白免疫印迹(Western blot) 实验分为EC9706组、EC9706/PTX组、姜黄素作用组,检测细胞的E-cadherin、N-cadherin、vimentin、fibronectin在蛋白水平的表达,以β-actin作为内参。细胞加入蛋白裂解液, BCA法测定总蛋白水平,电泳、转膜、封闭、一抗、二抗孵育、洗膜、显影、胶片扫描,图像处理分析。
1.2.9Western blot检测姜黄素对NF-κB-Snail信号通路的影响 实验分为EC9706组、EC9706/PTX组,姜黄素对EC9706/PTX作用24 h组,收集3组细胞,用Western blot分别检测NF-κB p65和Snail的表达,以GADPH作为内参。

2 结 果
2.1MTT检测EC9706/PTX细胞药物敏感性及姜黄素对其增殖的抑制 EC9706/PTX细胞的耐药指数和交叉耐药性见表1,食管癌耐药细胞EC9706/PTX对紫杉醇的RI为28.4,对顺铂、阿霉素产生交叉耐药性。用MTT法检测姜黄素对EC9706/PTX增殖的抑制作用,见图1,0~80 μmol/L姜黄素作用48 h后,EC9706/PTX细胞的增殖受到抑制,呈浓度依赖性,姜黄素浓度超过30 μmol/L时,出现显著抑制,姜黄素对EC9706/PTX的IC50为43.4 μmol/L。根据MTT结果,为了避免姜黄素对细胞增殖的抑制影响后续实验,本研究选择20 μmol/L的姜黄素浓度进行下一步实验。

表1 EC9706及EC9706/PTX对不同抗癌药物的RI测定
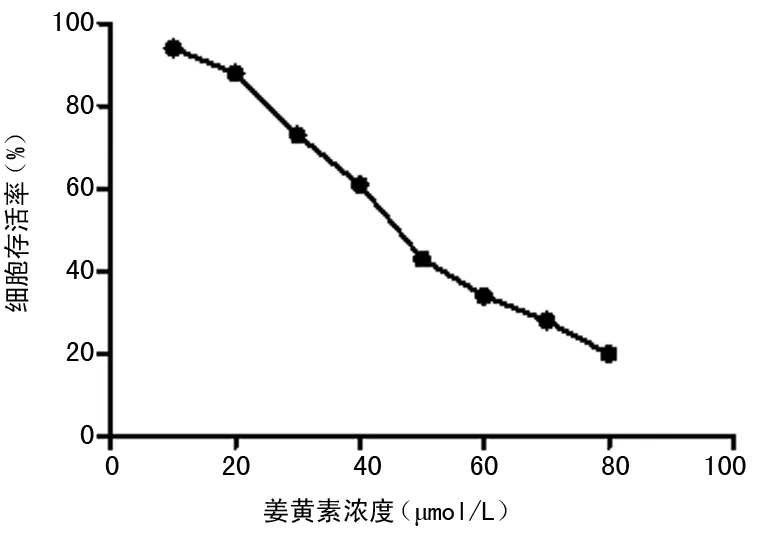
图1 不同浓度姜黄素作用48 h对EC9706/PTX 细胞的活性抑制作用
2.2姜黄素抑制EC9706/PTX 细胞的迁移侵袭 划痕24 h,EC9706/PTX组细胞的迁移速度明显快于EC9706组(t=11.42,P=0.000),而在20 μmol/L浓度的姜黄素作用下,姜黄素作用组细胞迁移减慢,差异有统计学意义(t=7.89,P=0.000),见图2。Transwell小室侵袭实验检测姜黄素对EC9706/PTX侵袭的抑制作用,取5个视野的平均值,实验重复3次,观察到EC9706/PTX组细胞的侵袭能力明显高于EC9706组细胞(t=8.2,P=0.001),而用20 μmol/L浓度的姜黄素对EC9706/PTX作用后,姜黄素作用组细胞的侵袭能力明显下降,差异有统计学意义(t=6.5,P=0.004),见图3。
2.3细胞骨架染色观察姜黄素对EC9706/PTX细胞形态的影响 EC9706/PTX组细胞与EC9706组细胞相比,细胞发生间质化变化,形态不规则,呈纺锤样及成纤维细胞样。在姜黄素作用下,细胞膜肌动蛋白聚集,伪足收缩,细胞发生皱缩,见图4。

A:细胞划痕试验(×40);B:迁移率分析图
图2细胞划痕实验检测各组细胞迁移率

A:显微镜下穿膜细胞(×200); B:穿膜细胞数
图3 Transwell侵袭实验

图4 细胞骨架染色观察姜黄素对各组细胞形态的影响(×1 000)
2.4荧光定量PCR及Western blot检测姜黄素对EC9706/PTX细胞EMT标志物在mRNA和蛋白水平的影响 EC9706/TTX组细胞的E-cadherin表达明显下调,N-cadherin表达明显上调,姜黄素作用组这一现象发生逆转,提示姜黄素可抑制耐紫杉醇食管癌细胞EMT现象。见图5、6。

a:P<0.05,与EC9706/PTX组比较。
图5各组E-cadherin、N-cadherin、vimentin、fibronectin的mRNA表达水平

A:各EMT相关蛋白Western blot图;B:E-cadherin和N-cadherin条带灰度分析图
图6各组E-cadherin、N-cadherin、vimentin、fibronectin的蛋白表达水平

A:NF-κB p65及Snail Western blot图;B:Western blot条带灰度分析图;a:P<0.05,与EC9706/PTX组比较
图7各组NF-κB p65和Snail蛋白表达水平
2.5姜黄素通过抑制NF-κB-Snail信号通路逆转EMT 实验分为EC9706组、EC9706/PTX组、姜黄素作用组,用Western blot检测NF-κB p65和Snail的表达。如图7所示,EC9706/PTX组NF-κB p65和Snail的表达均高于EC9706组,而姜黄素作用下,耐药细胞中NF-κB p65的表达降低,同时Snail的表达被抑制。见图7。
3 讨 论
我国是EC高发国家,发病率逐年上升,而由于EC早期诊断困难,病死率很高。目前采取手术为主,放疗、化疗为辅的综合治疗,但是肿瘤细胞会对化疗药物产生耐药性,耐药细胞具有更强的迁移性,患者晚期常死于化疗后的转移。因此,寻求新的、不良反应小且有效的抗EC新药是医学界迫切需要解决的问题。姜黄素是从草本植物姜黄、郁金等根茎中提取的一种酚性色素,研究证实姜黄素具有抗肿瘤作用,而且毒性小[5-6]。姜黄素对耐药细胞转移迁移作用的影响研究较少,本实验中建立了ECEC9706的耐紫杉醇细胞株,观察姜黄素对耐药细胞的抑制作用。
本实验对EC9706的耐紫杉醇细胞株检测了RI,发现该细胞株对紫杉醇具有很强的耐药性,而且还对其他化疗药物阿霉素和顺铂产生交叉耐药性,可以用作后续实验。细胞周期的失控是肿瘤发病中的重要环节,有研究者发现姜黄素能使EC9706的细胞周期发生明显变化,使EC细胞停滞于DNA合成期,肿瘤细胞生长延迟并逐渐死亡[6]。本实验中用不同浓度的姜黄素作用于耐药细胞,也会抑制细胞的增殖,并且具有浓度依赖性,这和其他学者的研究是一致的。
耐药细胞株EC9706/PTX发生了EMT,细胞骨架染色显示,EC9706亲本细胞呈铺路石样,而耐药细胞形态呈多样化,以梭形和纤维样为主,细胞排列松散有伪足。划痕实验和Transwell小室实验显示耐药细胞的迁移和转移能力增强。荧光定量PCR及Western blot检测EC9706/PTX 细胞EMT标志物在mRNA和蛋白水平的变化,耐药细胞的E-cadherin表达明显下调,N-cadherin表达明显上调,这些结果和其他学者的研究是一致的[7-8]。用姜黄素作用于耐药细胞发现,姜黄素可以逆转耐药细胞的EMT,在形态上,耐药细胞在姜黄素作用下,细胞变小,伪足收缩,迁移转移能力下降,细胞表达的间皮标志N-cadherin下调而上皮标志E-cadherin表达上调,这对于肿瘤耐药在临床上的治疗是有利的。
肿瘤细胞发生EMT是受多个信号通路调控的[9],转化生长因子-β(TGF-β)、Wnt蛋白、肿瘤坏死因子(TNF)及Notch蛋白均可诱导EMT发生[10-11]。核转录因子NF-κB的激活与肿瘤的侵袭和转移有非常重要的关系。NF-κB与IκBɑ紧密结合,各种刺激信号可使IκBɑ磷酸化降解,导致NF-κB的p65磷酸化转移到细胞核,NF-κB p65与下游基因的启动子结合,引起多种细胞因子及迁移相关的蛋白表达[12-13]。Huang等[13]对乳腺癌细胞的研究表明,姜黄素能通过阻碍NF-κB-Snail信号使细胞耐受脂多糖(LPS)诱导的EMT[14]。
NF-κB 能够结合到Snail 的启动子上从而上调Snail转录[15],本实验也发现EC9706/PTX组中NF-κB p65和Snail的表达均高于EC9706组细胞,而姜黄素作用下,耐药细胞中NF-κB p65的表达降低,同时Snail的表达被抑制。
综上所述,姜黄素能够抑制紫杉醇耐药EC细胞的增殖并且能够逆转紫杉醇耐药EC细胞的EMT现象,其机制可能是通过抑制NF-κB-Snail信号通路实现的。
[1]LiL,XuH,DongH,etal.MiR-181aupregulationisassociatedwithepithelial-to-mesenchymaltransition(EMT) and multidrug resistance(MDR) of ovarian cancer cells[J].Eur Rev Med Pharmacol Sci,2016,20(10):2004-2010.
[2]马泳泳,黄进,周淑娟,等.姜黄素对骨髓瘤细胞迁移和侵袭能力的影响及其机制研究[J].中国病理生理杂志,2014,30(1):170-174.
[3]刘斌,邓辰亮,杨松林,等.姜黄素对人黑色素瘤细胞凋亡机制探讨[J].中华肿瘤防治杂志,2014,21(14):1059-1062.
[4]Liao S,Xia J,Chen Z,et al.Inhibitory effect of curcumin on oral carcinoma CAL-27 cells via suppression of Notch-1 and NF-κB signaling pathways[J].J Cell Biochem,2011,112(4):1055-1065.
[5]曹一波,于君,马晶,等.姜黄素对胶质瘤U87增殖和迁移能力的影响[J].解放军医药杂志,2014,26(5):19-26.
[6]石松林,陈兰英,刘用金,等.姜黄素诱导人食管癌EC9706细胞凋亡过程中核磷蛋白的表达与定位变化[J].解剖学报,2014,45(2):221-227.
[7]Radisky S,Radisky C.Matrix metalloproteinase-induced epithelial-mesenchymal transition in breast cancer[J].J Mammary Gland Biol Neoplasia,2010,15(2):201-212.
[8]马平川,何宏月,王芳,等.上皮间质转化相关蛋白E-cadherin、N-cadherin及Snail在子宫内膜异位症相关卵巢癌的表达及意义[J].实用妇产科杂志,2016,32(3):211-215.
[9]田若楠,孙剑经,张林西.姜黄素抗食管癌的机制[J].国际肿瘤学杂志,2016,43(5):379-381.
[10]Felipe LJ,Nofech-Mozes S,Bayani J,et al.EMT in breast carcinoma——a review[J].J Clin Med,2016,5(7):65-79.
[11]吉鸿,卢桂芳,单涛,等.姜黄素通过NF-κB-Snail信号通路抑制LPS诱导的乳腺癌细胞上皮间质化[J].西安交通大学学报(医学版),2014,35(3):399-404.
[12]Cichon A,Nelson M,Radisky C.Regulation of epithelial-mesenchymal transition in breast cancer cells by cell contact and adhesion[J].Cancer Inform,2015,14(Suppl 3):1-13.
[13]Huang T,Chen Z,Fang L.Curcumin inhibits LPS-induced EMT through downregulation of NF-κB-Snail signaling in breast cancer cells[J].Oncol Rep,2013,29(1):117-124.
[14]Qin Y,Zhao D,Zhou G,et al.Apigenin inhibits NF-κB and snail signaling,EMT and metastasis in human hepatocellular carcinoma[J].Oncotarget,2016,7(27):41421-41431.
[15]Wang M,Ren D,Guo W,et al.N-cadherin promotes epithelial-mesenchymal transition and cancer stem cell-like traits via ErbB signaling in prostate cancer cells[J].Int J Oncol,2016,48(2):595-606.
TheinhibitioneffectsofcurcuminonEMTofPTX-resistantesophagealcancercelllineanditsmechanism*
LiKe,XuShuning,LiuYing,LiShuai,QiaoLei,HouXingfang,WangJufeng△
(DepartmentofOncology,CancerHospitalAffiliatedtoZhengzhouUniversity/HenanCancerHospital,Zhengzhou,Henan450003,China)
ObjectiveTo establish the effect of curcumin on PTX-resistant esophageal cancer cell line EC9706/PTX and to investigate the mechanism of curcumin on the epithelial stromalization (EMT) of EC9706/PTX cells.MethodsEC9706/PTX cells were established by medium concentration intermittent method.The drug resistance index and cross resistance were measured by MTT assay.The inhibitory effects of different concentrations of curcumin on EC9706/PTX cell proliferation were detected.The effects of curcumin on the morphological changes,migration and invasion of EC9706/PTX cells were examined by cytostatic staining,scratching and transwell invasion assay.The effects of curcumin on the expression of E-cadherin,N-cadherin,vimentin and fibronectin in EC9706/PTX cells at mRNA and protein levels were detected by fluorescence quantitative PCR and Western blot.The effect of curcumin on the expressions of NF-κB p65 and Snail in EC9706/PTX cells were detected by Western blot.ResultsThe drug resistance index of EC9706/PTX was 28.4,which was cross-resistant to cisplatin and doxorubicin.Curcumin could inhibit the proliferation of EC9706/PTX cells.The migration and invasion of EC9706/PTX cells were significantly decreased under the action of curcumin at 20 μmol/L concentration.Fluorescence quantitative PCR and Western blot analysis showed that the expression of E-cadherin was down-regulated and the expression of N-cadherin was up-regulated,and curcumin reversed this phenomenon.Western blot analysis showed that the expression of NF-κB p65 and Snail protein was enhanced after PTX-resistant generated in EC cell,but curcumin reversed this phenomenon.ConclusionCurcumin can inhibit the proliferation,migration and invasion of EC9706/PTX cells.The mechanism maybe that curcumin inhibits the NF-κB-Snail pathway.
paclitaxcel;esophageal neoplasms;curcumin;epithelial-mesenchymal transition
河南省科技厅基础与前沿项目(112300410044)。
李克(1976-),副主任医师,博士,主要从事肿瘤内科研究。△
,E-mail:13783583966@163.com。
10.3969/j.issn.1671-8348.2017.34.001
R571
A
1671-8348(2017)34-4753-04
2017-08-20
2017-09-28)

