氯化锂通过抑制糖原合酶激酶3β维持缺氧心肌的缝隙连接
周 洋,刘凌曦,赵 飞,唐仕海,肖颖彬,彭华利
(1.四川省乐山市人民医院胸心外科 614000;2.第三军医大学新桥医院心血管外科,重庆 400037)
氯化锂通过抑制糖原合酶激酶3β维持缺氧心肌的缝隙连接
周 洋1,刘凌曦1,赵 飞1,唐仕海1,肖颖彬2,彭华利△
(1.四川省乐山市人民医院胸心外科 614000;2.第三军医大学新桥医院心血管外科,重庆 400037)
目的在心肌慢性缺氧环境下,研究氯化锂对心肌间缝隙连接的影响。方法将25只C57BL/6J小鼠分为常氧组、缺氧组、常氧对照组、缺氧+生理盐水组和缺氧+氯化锂组。缺氧组采用10%氧浓度缺氧4周。缺氧+生理盐水组和缺氧+氯化锂组分别腹腔注射生理盐水和氯化锂。用电生理和心导管检查,评价心律失常情况、心率和射血分数。用免疫荧光观察连接蛋白43(Cx43)的分布情况,蛋白免疫印迹法(Western blot)检测Cx43、磷酸化糖原合酶激酶3β(p-GSK-3β)和糖原合酶激酶3β(GSK-3β)的水平。结果与常氧组比,缺氧组小鼠心率较快[(448±18)次/minvs. (401±13)次/min,P<0.05],左心室射血分数降低[(56±5)%vs. (73±4)%,P<0.05],心律失常评分增加[(3.4±0.5)分vs. (0.6±0.5)分,P<0.05],Cx43表达减少。与缺氧+生理盐水组比,缺氧+氯化锂组的小鼠心率降低[(412±11)次/minvs. (454±18)次/min,P<0.05],射血分数增加[(69±3)%vs. (55±4)%,P<0.05],心律失常评分减少[(1.8±0.4)%vs. (3.0±0.7)%,P<0.05],Cx43增加,p-GSK-3β与总GSK-3β的比值增加。结论在心肌慢性缺氧中,氯化锂能通过抑制GSK-3β信号,维持缝隙连接,降低心律失常发生率。
连接蛋白43;氯化锂;糖原合酶激酶3β;缺氧
心肌间缝隙连接是由连接蛋白构成的参与心脏电活动的结构。连接蛋白43(connexin 43,Cx43)是参与心室肌细胞间缝隙连接的主要结构蛋白[1]。研究表明,心肌间Cx43功能与心律失常的发生密切相关[2]。而心肌慢性缺氧是发生心律失常的重要原因之一[3-4]。目前心律失常的研究多集中在心肌梗死后心律失常,而缺氧诱导的室性心律失常研究较少。氯化锂是一种糖原合酶激酶3β(glycogen synthase kinase-3β,GSK-3β)的抑制剂。最近的研究已经证实氯化锂(LiCl)在心肌梗死模型中具有抗心律失常的作用[5]。而LiCl对缺氧诱导的心律失常的作用效果不清楚。因此,本研究通过建立缺氧诱导心律失常的动物和细胞模型和氯化锂药物干预模型,观察GSK-3β通路和缝隙连接的Cx43的变化,为缺氧心律失常的治疗提供新靶点。
1 材料与方法
1.1动物与试剂 从第三军医大学新桥医院实验动物中心购买20只C57BL/6J小鼠,8周龄,体质量20~25 g,雄性,分为常氧组、缺氧组、常氧对照组、缺氧+生理盐水组、缺氧+氯化锂组(n=5)。主要试剂:LiCl,Cx43抗体(Abcam公司,1∶500),GSK-3β抗体(CST公司,1∶1 000),磷酸化GSK-3β(p-GSK-3β)抗体(CST,1∶500)。
1.2方法
1.2.1小鼠慢性缺氧模型 将缺氧组的5只小鼠放入缺氧仓(Ruskinn′s Invivo2-1000)中(氧含量为10%,温度为25 ℃),常氧组5只小鼠放入温度为25 ℃的空气(氧含量为21%)中培养。缺氧组小鼠自由进食和饮水,测量每天进食和进水量。按照缺氧组小鼠每天进食和进水量控制常氧组小鼠食物和水,保证两组间的每天进食量与进水量一致。缺氧组和常氧组小鼠均于实验第4周末取出,进行相关实验。通过血红蛋白水平验证缺氧模型是否构建成功。
1.2.2小鼠干预模型 将缺氧+生理盐水组5只小鼠和缺氧+氯化锂组5只小鼠均放入氧含量为10%的缺氧仓中4周,建立慢性缺氧动物模型,分为两组:缺氧+生理盐水组和缺氧+氯化锂组,于缺氧第1天开始,每天每只腹腔注射生理盐水或氯化锂(90 mg/kg),直至第4周末。缺氧第4周末,测定小鼠心功能和取血测定血红蛋白后,断颈处死取心脏,锡箔纸包裹,液氮保存。
1.2.3在体电生理研究 将小鼠麻醉,建立人工通气和左侧开胸,用电热毯维持小鼠体温37 ℃。将电极缝在右室流出道心外膜上,用Bloom刺激器(Fischer Imaging Corporation)生成电刺激脉冲,来诱导室性心律失常。室性心律失常包括室性心动过速和心室颤动。对于电脉冲刺激,首先给予150 ms的S1起搏刺激,刺激8个起搏跳动,然后在很短的时间间隔内给予S2,S3,S4 3个额外刺激。心律失常评分体系如下:0分,无诱导出室性心律失常;1分,在3个额外刺激内出现非持续性快速心律失常(持续时间小于或等于15次搏动);2分,在3个额外刺激内出现持续性快速心律失常(持续时间大于15次搏动);3分,在2个额外刺激内出现非持续性快速心律失常;4分,在2个额外刺激内出现持续性快速心律失常;5分,在1个额外刺激内出现非持续性快速心律失常;6分,在1个额外刺激内出现持续性快速心律失常;7分,在8个起搏跳动内出现快速心律失常;8分,在起搏刺激之前心脏停跳。一个心脏发生多种形式的心律失常,采用最高的心律失常评分。
1.2.4免疫荧光观察Cx43表达 取4%多聚甲醛固定好的心肌切片,0.1%Triton X-100破膜15 min,山羊血清封闭37 ℃,30 min。加入Cx43一抗,4 ℃过夜,PBS漂洗5×5 min。加入荧光二抗37 ℃孵育1 h,PBS漂洗5×5 min。加入4,6-二脒基-2-苯基吲哚DAPI 37 ℃孵育10 min,PBS漂洗5×5 min。用荧光显微镜采图。
1.2.5蛋白免疫印迹法(Western blot)测定Cx43,GSK-3β和p-GSK-3β的表达 取心肌组织用液氮研磨制成粉末。用碧云天蛋白提取试剂盒,提取总蛋白,用BCA法测定蛋白浓度。按照4∶1比例加入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(5×),混匀并于100 ℃煮沸5 min后,取等量样本进行SDS-PAGE,湿转法转至聚偏氟乙烯(PVDF)膜上,BSA封闭1 h,Cx43,GSK-3β和p-GSK-3β一抗4 ℃孵育过夜,以β-actin为内参。TBST漂洗3次,每次10 min。再加入相应的二抗室温孵育1 h,TBST漂洗3次,每次10 min,化学发光显影,凝胶成像系统采集图片。图像用Image-Pro Plus 6.0软件测定目的条带和内参条带的灰度值。
1.2.6心导管检测左心室射血分数和心率 用异氟烷麻醉小鼠,气管切开,插管建立人工通气,分离小鼠右侧颈动脉,经小鼠颈动脉置入心导管(Millar Instruments Inc),进入左心室,记录相关血流动力学参数。注射30%高渗盐水5 μL进行盐水校正,取血进行放入定标比色皿(Millar Instruments Inc)进行容积校正,利用PowerLab 4/30数据采集软件(AD Instruments Inc)计算射血分数和心率。

2 结 果
2.1各组室性心律失常情况和左心功能变化 与常氧组相比,缺氧组的心率明显加快(P<0.05),左心室射血分数明显降低(P<0.05),心律失常评分明显增加(P<0.05)。结果见图1。

A:心率分析图;B:射血分数分析图;C:心律失常评分分析图。a:P<0.05,与常氧组比较
图1两组心率、左心室射血分数和心律失常评分情况
A:常氧组(免疫荧光×400);B:缺氧组(免疫荧光×400);C:Western blot及其分析图。a:P<0.05,与常氧组比较
图2两组Cx43的分布和表达情况
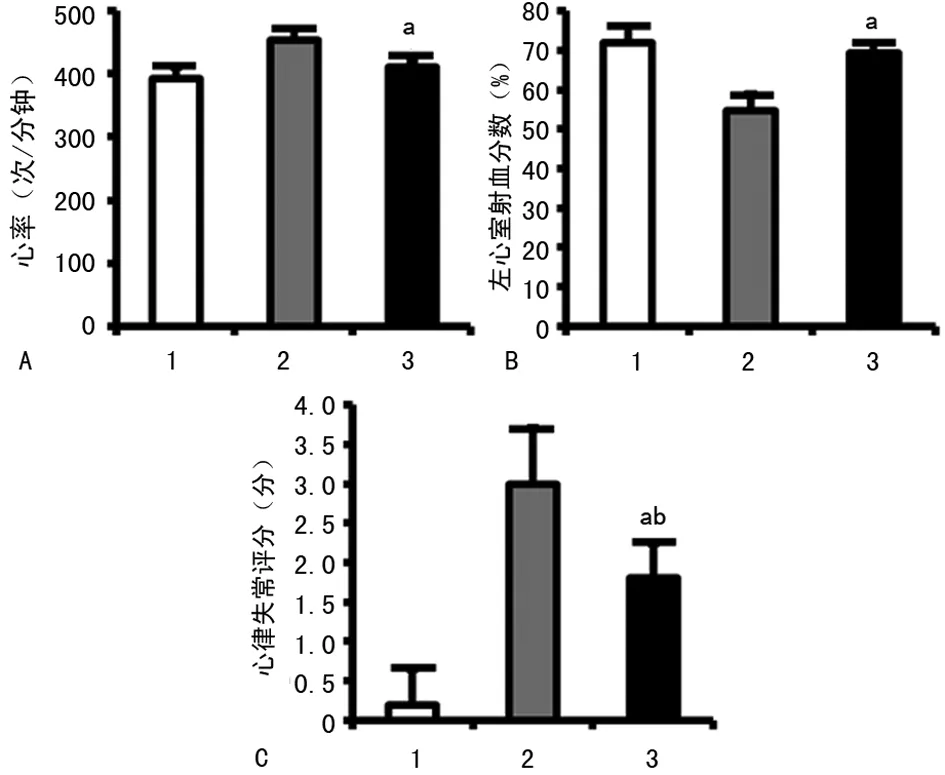
A:心率分析图;B:射血分数分析图;C:心律失常评分分析图;1:常氧组;2:缺氧+生理盐水组;3:缺氧+氯化锂组。a:P<0.05,与缺氧+生理盐水组比较;b:P<0.05,与常氧组比较
图3 3组心率、左心室射血分数和心律失常评分情况
2.2缺氧小鼠模型Cx43细胞分布和表达变化 缺氧组的Cx43在缝隙连接处的水平低于常氧组(P<0.05),且蛋白表达水平低于常氧组(P<0.05),见图2。

A:常氧组;B:缺氧+生理盐水组;C:缺氧+氯化锂组
图4 3组Cx43的分布情况(免疫荧光×400)
2.3氯化锂对缺氧诱导的心律失常和左心功能的影响 缺氧+氯化锂组的小鼠心率、左心室射血分数和心律失常评分与缺氧+生理盐水组比较,均有明显变化(P<0.05),见图3。缺氧+氯化锂组的心率、左心室射血分数与常氧组差异无统计学意义(P>0.05),而心律失常评分仍较常氧组高(P<0.05)。
2.4氯化锂对缺氧小鼠模型中Cx43的分布影响 缺氧+氯化锂组的小鼠Cx43在缝隙连接处的水平较缺氧+生理盐水组有显著改变。而缺氧+氯化锂组与常氧组比较变化无明显变化,见图4。
2.5氯化锂对缺氧小鼠模型中Cx43和GSK3β的蛋白水平影响 与缺氧+生理盐水组相比,缺氧+氯化锂组的小鼠心肌中Cx43明显增加(P<0.05),且p-GSK-3β的水平也明显增加(P<0.05),见图5。
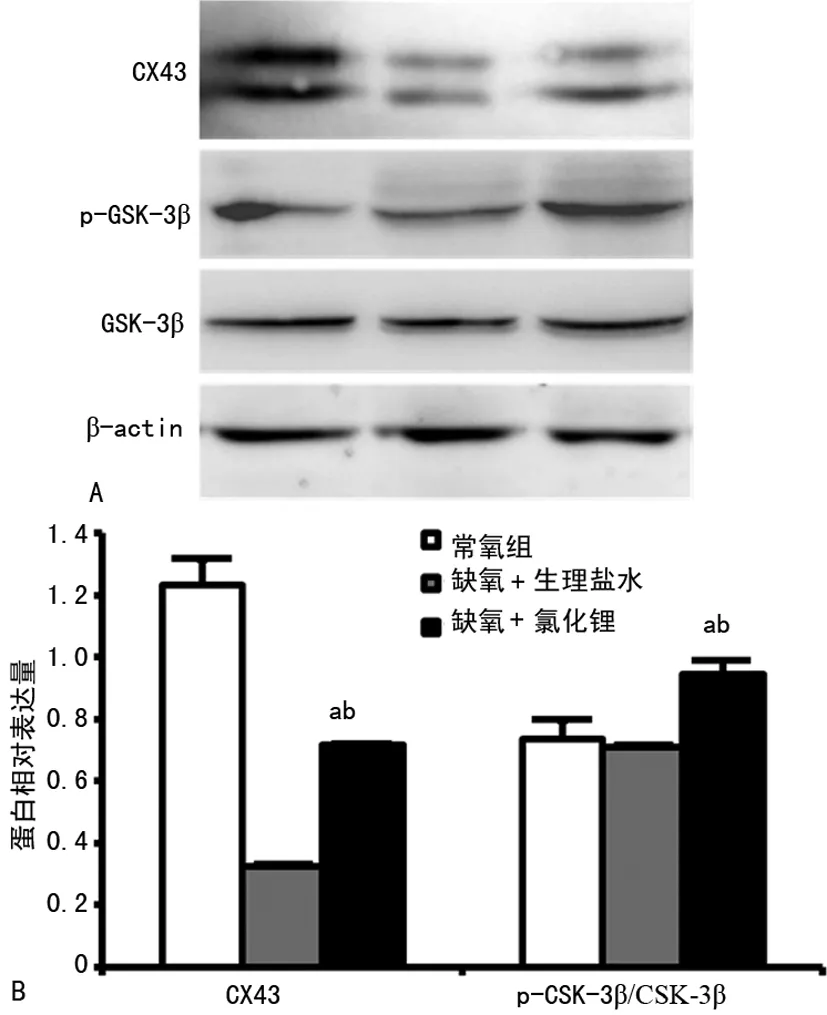
1:常氧组;2:缺氧+生理盐水组;C:缺氧+氯化锂组;a:P<0.05,与缺氧+生理盐水组比较;b:P<0.05,与常氧组比较
图5 3组的Cx43、p-GSK-3β和GSK-3β的蛋白表达情况
3 讨 论
缝隙连接是一类能介导细胞-细胞信号和传导电信号,并允许离子和第二信使等小分子交换的细胞间半通道(连接子)。每一个连接子由6个四聚体的连接蛋白组成。连接蛋白43(connexin 43,Cx43)是心室肌缝隙连接主要结构蛋白,也是心肌电活动的主要决定因素[1]。心肌细胞的Cx43功能失调会导致病理性室性心律失常。在猪的前壁心肌梗死模型中,转染Cx43将减少愈合疤痕边缘的室性心律失常的发生率[2]。慢性缺氧是大部分心血管疾病共有的病理生理过程,例如紫绀型先天性心脏病[6],冠状动脉粥样硬化性心脏病[7]等。而心肌的慢性缺氧常常会影响心电活动,增加室性心律失常发生率[3]。29.8%矫正的法络四联征患者会发生不同程度的心律失常[4]。对于合并器质性心脏病的患者,室性心律失常的发生易引起猝死等严重后果。关于缺氧诱导的心律失常,相比于其他类型的心律失常,研究较少,机制也不清楚。
氯化锂长期被用来治疗双向心境障碍症,具有抑制GSK-3β和模拟经典Wnt-1信号引起β-链蛋白在细胞核中积累的作用[8]。相关研究证实氯化锂具有抗心律失常的作用。氯化锂能通过激活转录因子NF-E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)信号诱导抗氧化反应,减弱神经生长因子(NGF)介导的交感再神经化,发挥抗心律失常作用[5]。氯化锂能通过降低心肌梗死后心律失常发生率[5]。除此之外,锂离子还能与钠离子竞争钠通道[9],或作为钠通道的阻断剂[10],来调节心律失常。
本研究通过建立缺氧诱导心律失常的模型,证实了缺氧具有明显的致心律失常的作用。同时通过药物干预,发现氯化锂能对缺氧诱导的心律失常具有一定的保护作用。并且研究进一步证实了氯化锂通过激活GSK-3β信号调节缝隙连接的Cx43的水平变化,发挥抗心律失常作用。这些结果为临床治疗心律失常提供了新的药物研究靶点,同时提示在治疗心律失常时注意对心肌缺氧的预防。
最近研究发现,氯化锂调节连接蛋白Cx43,不仅仅通过GSK-3β信号促进Cx43基因的转录,还能增加Cx43的磷酸化,增加Cx43蛋白的稳定性[8]。同时,氯化锂不仅能抑制GSK-3β,还能通过磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)信号依赖的方式参与调节交感再神经化,参与抗心律失常的作用[5]。除此之外,锂离子还能激活蛋白激酶A(protein kinase A,PKA)来调节GSK-3β信号,来调节Cx43表达[11-12]。另外,氯化锂还增加缝隙连接的功能,加强细胞间通讯的效率和细胞同步化[8,12]。因此,氯化锂的抗心律失常作用的研究,将有利于阐明不同原因引起的心律失常的具体机制。特别是,缺氧引起的心律失常是目前研究较少的方向。加强缺氧心律失常的重视程度,将有利于临床上对心律失常的预防和治疗,减少相关并发症的发生。
[1]HowarthFC,NowotnyN,ZilahiE,etal.Altered expression of gap junction connexin proteins may partly underlie heart rhythm disturbances in the streptozotocin-induced diabetic rat heart[J].Mol Cell Biochem,2007,305(1/2):145-151.
[2]Greener ID,Sasano T,Wan XP,et al.Connexin43 gene transfer reduces ventricular tachycardia susceptibility after myocardial infarction[J].J Am Coll Cardiol,2012,60(12):1103-1110.
[3]Roche F,Reynaud C,Pichot V,et al.Effect of acute hypoxia on QT rate dependence and corrected QT interval in healthy subjects[J].Am J Cardiol,2003,91(7):916-919.
[4]Chen CA,Dusenbery SM,Valente AM,et al.Myocardial ECV fraction assessed by CMR is associated with type of hemodynamic load and arrhythmia in repaired tetralogy of fallot[J].JACC Cardiovasc Imaging,2016,9(1):1-10.
[5]Lee TM,Lin SZ,Chang NC.Antiarrhythmic effect of Lithium in rats after myocardial infarction by activation of Nrf2/HO-1 signaling[J].Free Radic Biol Med,2014(77):71-81.
[6]Jian Z,Li JB,Ma RY,et al.Pivotal role of activating transcription factor 6 alpha in myocardial adaptation to chronic hypoxia[J].Int J Biochem Cell Biol,2012,44(6):972-979.
[7]Tasoulis MK,Douzinas EE.Hypoxemic reperfusion of ischemic states:an alternative approach for the attenuation of oxidative stress mediated reperfusion injury[J].J Biomed Sci,2016(23):7.
[8]Du WJ,Li JK,Wang QY,et al.Lithium chloride regulates connexin43 in skeletal myoblasts in vitro:possible involvement in Wnt/-Catenin signaling[J].Cell Commun Adhes,2008,15(3):261-271.
[9]Sakmann BF,Spindler AJ,Bryant SM,et al.Distribution of a persistent Sodium current across the ventricular wall in Guinea pigs[J].Circ Res,2000,87(10):910-914.
[10]Darbar D,Yang T,Churchwell K,et al.Unmasking of brugada syndrome by Lithium[J].Circulation,2005,112(11):1527-1531.
[11]Liang MH,Wendland JR,Chuang DM.Lithium inhibits Smad3/4 transactivation via increased CREB activity induced by enhanced PKA and AKT signaling[J].Mol Cell Neurosci,2008,37(3):440-453.
[12]Lee TM,Lin SZ,Chang NC.Both PKA and Epac pathways mediate N-Acetylcysteine-Induced connexin43 preservation in rats with myocardial infarction[J].PLoS One,2013,8(8):e71878.
Lithiumchloridemaintainsthegapjunctionofhypoxicmyocardiumbyinhibitingglycogensynthasekinase3β
ZhouYang1,LiuLingxi1,ZhaoFei1,TangShihai1,XiaoYingbin2,PengHuali1△
(1.DepartmentofCardiothoracicSurgery,thePeople′sHospitalofLeshancity,Leshan,Sichuan614000,China;2.DepartmentofCardiovascularSurgery,XinqiaoHospital,theThirdMilitaryMedicalUniversity,Chongqing400037,China)
ObjectiveTo study the effect of lithium chloride on the gap junction in the myocardium under chronic hypoxia.MethodsTwenty-five C57BL/6J mice were randomly divided into normoxia group,hypoxia group,normoxic control group,hypoxia + saline group and hypoxia + lithium chloride group.Hypoxia group was treated with 10% oxygen concentration for 4 weeks.Hypoxia + saline group and hypoxia + lithium chloride group were intraperitoneal injection of saline and lithium chloride.Electrophysiology and cardiac catheterization were used to assess arrhythmias,heart rate and ejection fraction.The expression of Cx43,phosphorylated glycogen synthase kinase 3β(p-GSK-3β) and glycogen synthase kinase 3β (GSK-3β) were detected by Western blot.ResultsCompared with the normoxia group,the hypoxia group had a faster heart rate [(448 ± 18) bpmvs. (401 ± 13) bpm,P<0.05),and the ejection fraction was decreased [(56±5)%vs. 73±4)%,P<0.05],arrhythmia score increased [(3.4±0.5)%vs. (0.6±0.5)%,P<0.05],Cx43 expression was decreased.Compared to hypoxia + normal saline group,the heart rate decreased[(412±11)bpmvs. (454±18)bpm,P<0.05],ejection fraction increased[(69±3)%vs. (55±4)%,P<0.05],the score of arrhythmia decreased [(1.8±0.4)%vs. (3.0±0.7)%,P<0.05] in hypoxia + lithium chloride group,the expression of Cx43 and the rate of p-GSK-3β to GSK-3β were increased.ConclusionDuring the chronic hypoxia,lithium chloride can sustain the gap junction through inhibition of GSK-3β signaling way,which can also reduce the rate of arrhythmia.
Connexin 43;lithium chloride;glycogen synthase kinase-3β;hypoxia
周洋(1980-),主治医师,博士,主要从事心肌慢性缺氧的研究。△
,E-mail:PengHL08@163.com。
10.3969/j.issn.1671-8348.2017.34.007
R541.7
A
1671-8348(2017)34-4777-03
2017-08-05
2017-09-07)

