HIF-2α及VEGF在结直肠癌组织中的表达及与患者预后的关系
黄澄澄,唐成佳, 余天雾
(重庆医科大学附属永川医院:1.老年病科;2.肝胆外;3.普外科 402160)
HIF-2α及VEGF在结直肠癌组织中的表达及与患者预后的关系
黄澄澄1,唐成佳2△, 余天雾3
(重庆医科大学附属永川医院:1.老年病科;2.肝胆外;3.普外科 402160)
目的探讨HIF-2α及VEGF在结直肠癌中的表达情况,HIF-2α及VEGF与临床病理间的关系。方法免疫组织化学技术检测67例结直肠癌及癌旁组织中HIF-2α及VEGF蛋白的表达情况。结果在结直肠癌组织中HIF-2α、VEGF的表达明显高于癌旁组织; HIF-2α及VEGF的表达率随着肿瘤临床分期、淋巴结转移逐渐增加;HIF-2α的表达率随着肿瘤体积增大逐渐增加,而VEGF表达率与肿瘤体积大小无相关性;HIF-2α及VEGF表达率与患者的年龄、性别、肿瘤发生部位及肿瘤分化程度等无关。HIF-2α与VEGF表达呈正相关; Kaplan-Meier生存分析发现HIF-2α表达与患者生存有关,即高表达患者预后差。结论HIF-2α参与了结直肠癌生长、浸润及转移过程,这一过程可能与调节VEGF的表达有关。
结直肠肿瘤;缺氧诱导因子2α;血管内皮生长因子A
结直肠癌作为消化道常见的实体肿瘤,其生长迅速,可致肿瘤内部慢性缺氧。缺氧诱导因子2α(hypoxia inducible factor 2α,HIF-2α)在肿瘤细胞的慢性缺氧适应性方面起着重要作用。HIF-2α 的活性可能与血管生成的持续生成相关。HIF-2α可能通过调节血管内皮生长因子(vascular endothelial growth factor,VEGF)持续表达而维持血管生成[1]。本研究通过免疫组织化学检测结直肠癌组织中HIF-2α及VEGF表达情况,并分析二者与临床病理的关系。
1 资料与方法
1.1一般资料 收集2009年6月至2010年9月期间重庆医科大学附属永川医院普外科行手术切除的,术后病理诊断为结直肠癌的标本67例,全部病例术前均未接受放疗和化疗,均无炎症性肠病病史,所有入组人员均被告知检查目的,并签署知情同意书。病理分型及分级按WHO分类标准,将高和中分化归为分化较好的低级别组;将低分化、黏液腺癌和印戒细胞癌归为分化较差的高级别组。其中男41例,女26例,平均年龄63.8岁。黏液腺癌22例,印戒细胞癌4例,低分化腺癌10例、高和中分化腺癌31例。分期按TNM标准:Ⅰ~Ⅱ期34例,Ⅲ~Ⅳ期33例。有淋巴结转移32例,无淋巴结转移35例。所有标本经固定、脱水、包埋、切片。
1.2主要试剂 HIF-2α单克隆抗体及免疫组织化学试剂盒及显色试剂盒均购于北京中杉金桥生物有限公司,VEGF多克隆抗体购于武汉博士德生物工程有限公司。
1.3免疫组织化学染色检测HIF-2α及VEGF表达情况 染色按试剂盒说明书操作。以PBS液代替一抗作空白对照。切片脱蜡,pH 9.0乙二胺四乙酸(EDTA)加热修复抗原,3%双氧水37 ℃孵育15 min灭活内源性过氧化物酶,PBS冲洗,正常山羊血清封闭30 min,PBS冲洗,加HIF-2α及VEGF一抗(稀释度均为1∶150)。4 ℃过夜;次日复温,PBS冲洗,加生物素化二抗37 ℃孵育30 min,PBS冲洗,HRP标记链酶卵白素37 ℃孵育30 min,加DAB显微镜下显色,苏木素复染,盐酸乙醇分化,碳酸锂返蓝,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.4结果判断 HIF-2α及VEGF表达以细胞染色强度得分×细胞阳性百分率得分进行判定。无染色0分,淡黄色1分,棕黄色2分,深黄色3分;细胞阳性率小于5%为0分,5%~<25%为1分,25%~<50%为2分,≥50%为3分。上述二项得分相乘,<3分为阴性,≥3分为阳性。统计计算时,0~1分为阴性,其余均为阳性。

2 结 果
2.1免疫组织化学染色检测HIF-2α及VEGF表达情况 结直肠癌组织中HIF-2α主要为细胞质及细胞核表达。HIF-2α阳性率肿瘤组织(62.7%)高于癌旁组织(13.4%)。VEGF主要为细胞质表达(图1),VEGF阳性率肿瘤组织(65.7%)高于癌旁组织(35.8%),差异有统计学意义(P<0.05)。见图1。
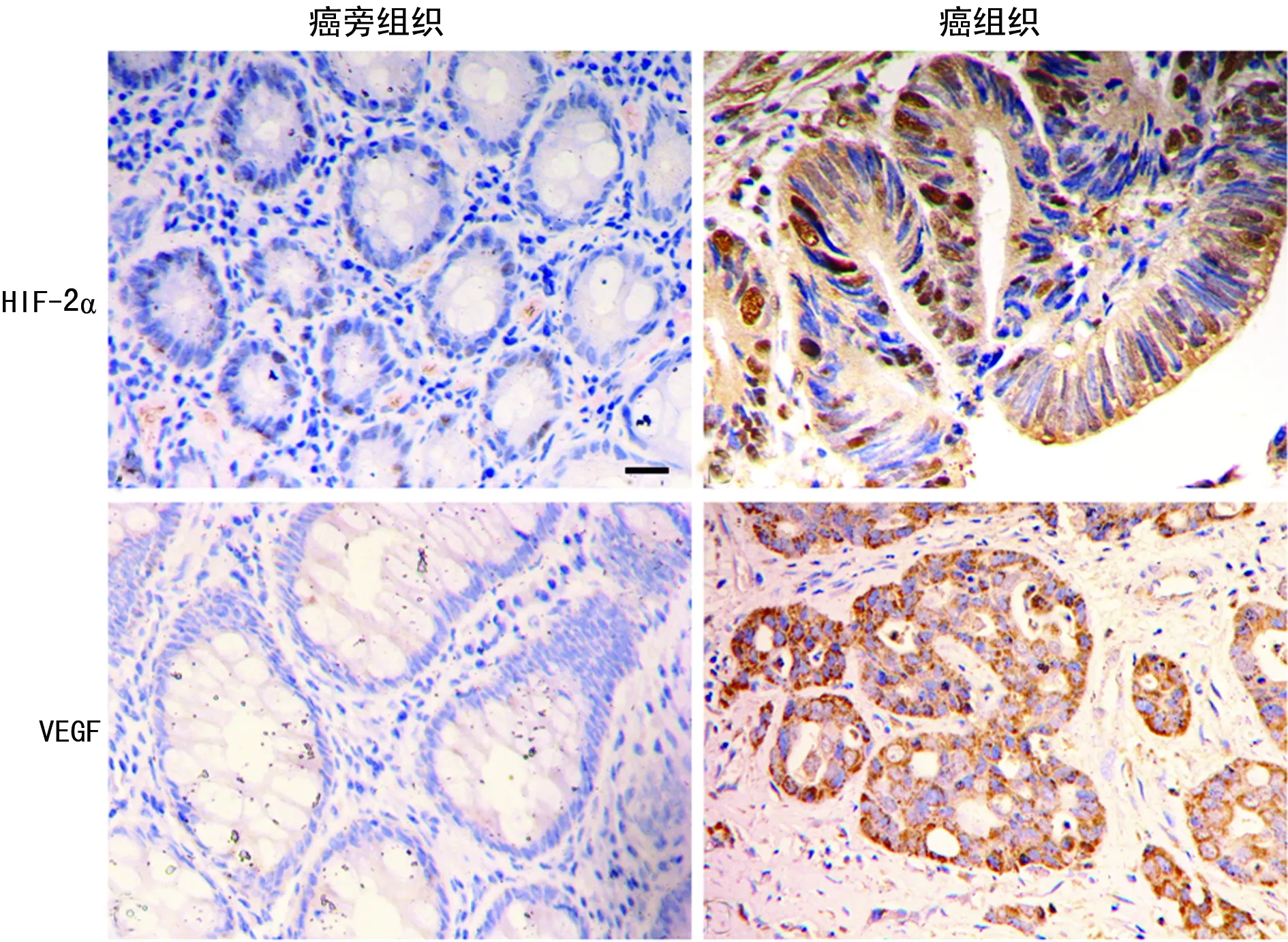
图1 结直肠癌及癌旁组织中HIF-2α及VEGF 的表达(免疫组织化学×200)
2.2HIF-2α及VEGF蛋白在结直肠癌中的表达与患者临床病理联系 HIF-2α及VEGF的表达随着结直肠癌TNM分期的增加逐渐增加,HIF-2α及VEGF的阳性表达率在Ⅲ~Ⅳ期组(75.8%、81.8%)高于Ⅰ~Ⅱ期组(50.0%、50.0%),差异有统计学意义(P=0.03,P=0.01);有淋巴结转移组(75.0%、78.1%)高于无淋巴结转移组(51.4%、54.3%),差异有统计学意义(P=0.05,P=0.04)。HIF-2α阳性表达率在肿瘤直径大于或等于5 cm组(73.8%)高于小于5 cm组(44.0%),差异有统计学意义(P=0.02)。HIF-2α及VEGF表达率与患者的年龄、性别、肿瘤发生部位及肿瘤分化程度无关(P>0.05),且VEGF表达率与肿瘤大小无关(P>0.05),见表1。
2.3结直肠癌中HIF-2α及VEGF相关性分析 经Spearman相关分析,HIF-2α及VEGF的表达呈正相关(r=0.352,P<0.05)。
2.4生存分析 对67例结直肠癌患者进行6年随访调查,其中失访13例,进行Kaplan-Meier生存分析,HIF-2α阳性组及其阴性组的中位生存期分别为64.0、49.0个月,生存曲线显示HIF-2α阳性组的生存时间明显低于HIF-2α阴性组(P=0.04);VEGF阳性组及其阴性组的中位生存期分别为49.0、54.0个月(图2A),而VEGF表达水平与患者生存时间无明显相关性(P=0.18),见图2B。
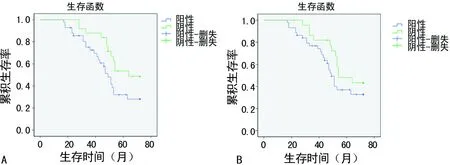
A:HIF-2α;B:VEGF
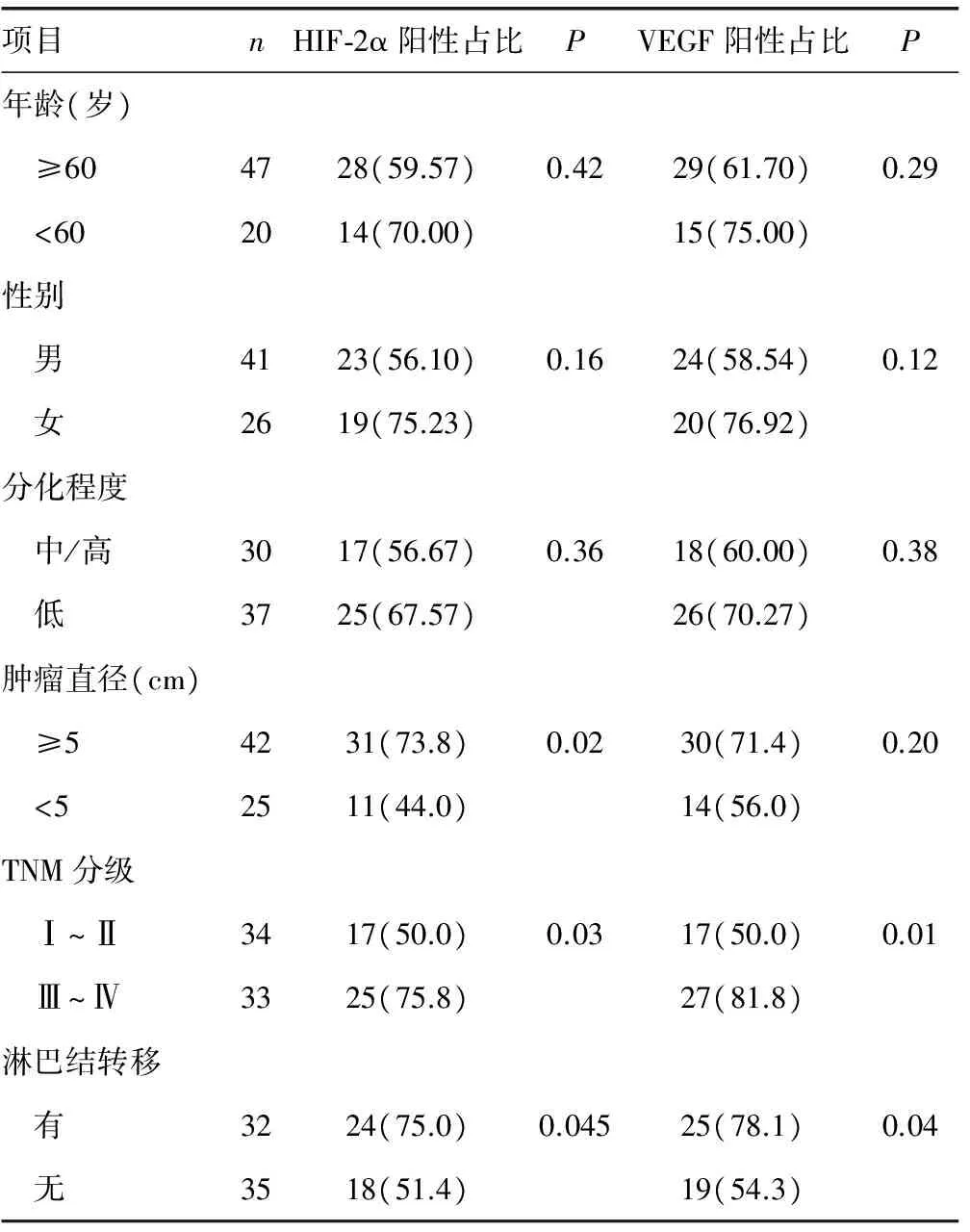
图2 HIF-2α及VEGF的表达与结直肠癌患者的生存曲线表1 结直肠癌中HIF-2α及VEGF蛋白表达与临床病理特征的关系[n(%)]
3 讨 论
结直肠癌作为常见的实体肿瘤,新陈代谢旺盛,瘤体生长速度大于其内新生血管的生长速度,必然会导致其组织氧供不足,低氧诱导因子(HIF)是近年研究的热点基因,HIF包括HIF-1、HIF-2、HIF-3,三者均由调节亚基α和结构亚基β组成的异源二聚体。HIF-2α是HIF-2的功能性调节亚基,在慢性缺氧适应性方面起着重要作用。
HIF-2α的调节途径分为氧依赖及非氧依赖调节途径;氧依赖调节途径:常氧条件下,HIF-2α ODD结构域特定的脯氨酰残基Pro405和Pro531被脯氨酰羟化酶(prolylhydroxylases,PHD)羟化后,与肿瘤抑制蛋白pVHL结合并发生泛素化,并被26s蛋白酶体降解;非氧依赖调节途径:在缺氧情况下,PHD活性降低,HIF-2α不能被羟化,影响其泛素化,从而不能被降解,HIF-2α聚集于细胞质,转移至细胞核,与HIF-β形成HIF异二聚体复合物,调节靶基因的转录活性[2-4]。促进肿瘤细胞的能量代谢、增殖、分化及血管生成[5]。而缺氧条件下,HIF-2α的降解主要通过SUMO化修饰(small ubiquitin-related modifier)进行降解,负性调控HIF-2α的表达,SUMO化修饰的HIF-2α可经泛素-蛋白酶体途径降解[6]。近年国内外研究表明,HIF-2α与胃癌、乳腺癌、胰腺癌、肾癌的浸润转移密切相关[7-10]。Kourakis等[11]通过免疫组织化学检测结肠癌中HIF-2α与BNP3,发现二者过表达均与局部浸润及淋巴结转移有关。Esteban等[12]发现,HIF-2α通过抑制E-cadherin的表达,使细胞间黏附减低促进结直肠癌细胞的浸润转移。但也有人发现,HIF-2α在癌旁组织中表达明显高于肝癌组织,且与包膜或门静脉浸润无关[13]。本研究发现,HIF-2α在结直肠癌组织中主要为细胞核及细胞质表达,且在结直肠癌组织中HIF-2α表达率明显高于癌旁组织,HIF-2α阳性表达率在Ⅲ~Ⅳ期组高于Ⅰ~Ⅱ期组,在有淋巴结转移组高于无淋巴结转移组,差异有统计学意义(P<0.05),提示HIF-2α可能参与结直肠癌细胞的浸润、转移过程,且HIF-2α表达还与肿瘤大小有关,大于或等于5 cm组HIF-2α表达率明显高于小于5 cm组,差异有统计学意义(P<0.05),可能与肿瘤内部缺氧有关,快速生长的实体瘤,瘤体内部不能得到足够的血供,导致供需氧失衡[14],推测瘤体大小与其内部缺氧程度相关。
VEGF是目前已知的最强的血管生成促进因子,它与受体结合活化磷脂酶B,使细胞内磷酸肌醇水平升高,刺激内皮细胞增殖,利于血管生成,肿瘤细胞脱落进入血管和结缔组织基质中导致扩散。本研究发现,结直肠癌组织中VEGF表达明显高于癌旁组织,VEGF阳性表达率在Ⅲ~Ⅳ期组高于Ⅰ~Ⅱ期组,在有淋巴结转移组高于无淋巴结转移组,差异有统计学意义(P<0.05)。
VEGF是HIF-2α重要的下游基因,HIF-2α不仅可以增加VEGF转录,还可增强其稳定性,Xiong等[15]通过shRNA慢病毒载体敲除HeLa细胞HIF-2α表达发现COX-2及VEGF明显下降,且在缺氧条件下,此作用更明显。本研究相关性分析表明HIF-2α与VEGF成正相关,说明HIF-2α可能通过促进结肠癌组织中VEGF表达来增加结直肠癌细胞的浸润与转移能力。经长期随访调查显示,HIF-2α阳性的结直肠癌患者的生存时间明显低于HIF-2α阴性的结直肠癌患者,HIF-2α阳性组的中位生存期明显低于HIF-2α阴性组,提示HIF-2α的表达与患者的预后密切相关。而本研究中发现VEGF的表达与患者生存时间无明显相关性,可能与样本量较小有关。
综上所述,检测结直肠癌组织中HIF-2α的表达情况对评估结直肠癌患者的预后及危险程度提供参考。HIF-2α参与了结直肠癌生长、浸润和转移过程,这一过程可能与调节VEGF的表达有关。
[1]Koh MY,Lemos R,Liu X,et al.The hypoxia-associated factor switches cells from HIF-1α- to HIF-2α-dependent signaling promoting stem cell characteristics,aggressive tumor growth and invasion[J].Cancer Res,2011,71(11):4015-4027.
[2]Aragonés J,Fraisl P,Baes M,et al.Oxygen sensors at the crossroad of metabolism[J].Cell Metab,2009,9(1):11-22.
[3]胡瑛.缺氧诱导因子-1α、2α在恶性肿瘤中不同作用的研究进展[J].癌症进展,2014,12(2):122-125.
[4]Bertout JA,Patel SA,Simon MC.The impact of O2availability on human cancer[J].Nat Rev Cancer,2008,8(12):967-975.
[5]Zhao J,Du F,Shen G,et al.The role of hypoxia-inducible factor-2 in digestive system cancers[J].Cell Death Dis,2015,6(1):e1600.
[6]van Hagen M,Overmeer RM,Abolvardi SS,et al.RNF4 and VHL regulate the proteasomal degradation of SUMO-conjugated Hypoxia-Inducible Factor-2alpha[J].Nucleic Acids Res,2010,38(6):1922-1931.
[7]Li N,Wang HX,Qin C,et al.Relationship between clinicopathological features and HIF-2α in gastric adenocarcinoma[J].Genet Mol Res,2015,14(1):1404-1413.
[8]Gilkes DM,Semenza GL.Role of hypoxia-inducible factors in breast cancer metastasis[J].Future Oncol,2013,9(11):1623-36.
[9]Wang M,Chen MY,Guo XJ,et al.Expression and significance of HIF-1α and HIF-2α in pancreatic cancer.[J] J Huazhong Univ Sci Technolog Med Sci,2015,35(6):874-879.
[10]Rankin EB,Biju MP,Liu Q,et al.Hypoxia-inducible factor-2 (HIF-2) regulates hepatic erythropoietin in vivo[J].J Clin Invest,2007,117(4):1068-1077.
[11]Kourakis MI,Giatromanolaki A,Polychronidis A,et al.Endogenous markers of hypoxia/anaerobic metabolism and anemia in primary colorectal cancer[J].Cancer Sci,2006,97(7):582-588.
[12]Esteban MA,Tran MG,Harten SK,et al.Regulation of E-cadherin expression by VHL and hypoxia-inducible factor[J].Cancer Res,2006,66(7):3567-3575.
[13]Yang SL,Liu LP,Jiang JX,et al.The correlation of expression levels of HIF-1α and HIF-2α in hepatocellular carcinoma with capsular invasion,portal vein tumor thrombi and patients′ clinical outcome[J].Jpn J Clin Oncol,2014,44(2):159-167.
[14]刘芳.缺氧微环境与实体瘤[J].现代诊断与治疗,2007,18(1):36-39.
[15]Xiong J,Zhu FF,Nie MF.Hypoxia-inducible factor-2α (HIF-2α) mediates the effects of hypoxia on the promotion of HeLa cell viability,colony formation,and invasion capacity in vitro[J].Genet Mol Res,2015,14(2):3281-3292.
ExpressionofHIF-2αandVEGFincolorectalcanceranditsrelationshipwithprognosis
HuangChengcheng1,TangChengjia2△,YuTianwu2
(1.DepartmentofGeriatrics;2.DepartmentofHepatologicalSurgery;3.DepartmentofHepatobiliarySurgery,theAffiliatedYongchuanHospitalofChongqingMedicalUniversity,Chongqing402160,China)
ObjectiveTo study the expression of HIF-2α and VEGF in colorectal cancer and to investigate the relationship between them and clinicopathologic parameter.MethodsImmunohistochemistry staining was conducted to detect the expression of HIF-2α and VEGF protein in 67 samples of colorectal tumor tissues and 67 samples of normal adjacent tissue.ResultsThe expression of HIF-2α and VEGF in colorectal cancer tissues was significantly higher than that in adjacent tissues.The expression of HIF-2α and VEGF increased with the clinical stage and lymph node metastasis.The expression of HIF-2α increased with the tumor volume.The expression of HIF-2α and VEGF was not related to the age,sex,tumor location and tumor differentiation of the patients.HIF-2α was positively correlated with VEGF expression.Kaplan-Meier survival analysis showed that HIF-2α expression was associated with survival,that is,the higher expression of HIF-2α the worse of prognosis was obtained.ConclusionHIF-2α is involved in the process of growth,invasion and metastasis of colorectal cancer.This process may be related to the regulation of VEGF expression.
colorectal neoplasms;hypoxia-inducible factor 2α;vascular endothelial growth factor A
黄澄澄(1986-),住院医师,硕士,主要从事消化系统疾病研究。△
,E-mail:285993446@qq.com。
10.3969/j.issn.1671-8348.2017.34.015
R735
A
1671-8348(2017)34-4802-03
2017-08-01
2017-09-05)

