CaO催化糠醛丙酮羟醛缩合反应的研究
熊继东,齐学振
(浙江工业大学药学院,浙江 杭州 310014)
CaO催化糠醛丙酮羟醛缩合反应的研究
熊继东,齐学振
(浙江工业大学药学院,浙江 杭州 310014)
研究了无溶剂条件下糠醛与丙酮缩合制备亚糠基丙酮 (FAc)和二亚糠基丙酮(F2Ac)的反应。采用“等体积浸渍-焙烧法”制备了多种固体碱催化剂,并用BET和CO2-TPD对催化剂进行表征。筛选出了性价比较好的工业化催化剂-CaO,并考察了反应温度、反应时间及物料物质的量比等因素对催化效果的影响。
CaO;糠醛;丙酮;羟醛缩合
0 前言
通过羟醛缩合反应构建C-C键来增加分子内的碳原子数,将生物质平台化合物转化为液态烃类燃料已经成为业内研究的热点[1-3]。丙酮可通过与糠醛在碱催化剂的作用下发生缩合反应,生成亚糠基丙酮(FAc)和二亚糠基丙酮(F2Ac),对缩合产物进行加氢脱氧之后可得到C8-C13的烷烃[4-5]。
对于糠醛与丙酮的缩合反应体系,为了解决催化剂回收难和环境污染等问题[6],研究者们开发了多种固体碱催化剂,如水滑石类、混合碱金属氧化物类和分子筛复合型类固体催化剂,虽然取得了预期的效果,但却存在催化活性低、易失活等其他问题[7-8]。生物质能源的工业化生产,必须考虑到催化剂的性价比问题。因此,筛选出具备高反应活性、高稳定性和再生性好的固体碱催化剂仍是亟待解决的难题之一。
本文制备了一系列固体碱催化剂,考察了无溶剂条件下,在糠醛与丙酮的羟醛缩合反应中的催化性能,并对催化剂分别进行了BET和CO2-TPD表征。随后筛选出再生性良好的催化剂CaO,考察了反应温度、反应时间和物质的量比等因素对反应效果的影响。
1 实验部分
1.1 催化剂的制备
MgO和CaO在使用前,于140℃烘箱干燥12 h,然后在N2保护下升温至900℃(2℃/min)焙烧 5 h。Ca(OH)2于 140 °C 烘箱干燥 12 h。镁铝水滑石(hydrotalcite Al/Mg=3)使用前在N2保护下升温至 450 °C(2 ℃/min)焙烧 5 h。
CaO/MgO、CaO/γ-Al2O3、CaO/SBA-15 和NaOH/γ-Al2O3的制备采用浸渍法。将1 g乙酸钙或NaOH用10 g去离子水溶解后滴加到10 g载体上(MgO、γ-Al2O3或 SBA-15)上,浸渍 12 h 后将其放入100℃烘箱干燥12 h,再将催化剂于马弗炉中升温至800℃(2℃/min)焙烧5 h。
1.2 催化剂的表征
催化剂比表面积和孔结构分析采用贝士德仪器科技(北京)有限公司的3H-2000PS1型吸附仪测定。采用BET公式计算比表面积。催化剂碱性表征采用湖南华思仪器有限公司的DAS-7000动态吸附仪进行CO2-TPD测试。
1.3 无溶剂羟醛缩合反应
糠醛与丙酮的无溶剂缩合反应在100 mL水热釜中进行,采用油浴加热。糠醛用量为10 g,丙酮20.3 g(摩尔比1∶5),加入 2.0 g催化剂,在一定温度下反应一定时间。反应结束后过滤出催化剂。
产物的定量分析在液相色谱(LC-20AT)上进行。分析柱为 C18(Xbridge 4.6×150 mm,3.5 μm),采用水-甲醇为流动相(体积比1∶10),采用二极管阵列检测器( SPD-20A),糠醛、FAc、F2Ac 的紫外最大吸收波长分别为274、322和382 nm。糠醛的转化率和缩合产物的收率的计算公式如下:
(1)糠醛转化率(%)


图1 不同催化剂的作用下的糠醛转化率和缩合产物收率Fig.1 Furfural conversions and condensation adducts yields over different solid base catalysts
(2)亚糠基丙酮收率(%)

(3)二亚糠基丙酮收率(%)

(4)缩合产物总收率(%)

2 结果与讨论
2.1 糠醛与丙酮羟醛缩合催化剂的筛选
分 别 采 用 MgO、CaO、Ca (OH)2、CaO/MgO、CaO/γ-Al2O3、NaOH/γ-Al2O3、CaO/SBA-15 和hydrotalcite作为催化剂应用于糠醛丙酮的无溶剂缩合。反应温度90℃,反应时间3 h,糠醛丙酮摩尔比为1∶5,催化剂用量为糠醛质量的20%。实验结果如图1所示。
由图1可知,MgO表现出非常差的催化活性,Ca(OH)2催化活性并不高,但当CaO作催化剂时,90℃反应3 h,糠醛转化率为80%,FAc和F2Ac收率分别为39%和16%。不同载体MgO、γ-Al2O3、SBA-15负载CaO的催化剂表现出的催化活性差异很大,CaO/MgO和CaO/SBA-15的催化活性比CaO差,而在CaO/γ-Al2O3催化下,糠醛转化率和缩合产物收率都比CaO高,FAc和F2Ac的收率分别为40.9%和24%。传统固体超强碱NaOH/γ-Al2O3催化剂表现了非常好的催化活性,在90℃反应3 h,糠醛转化率达到98%,镁铝水滑石的催化性能比CaO稍强。这几种固体碱的催化 活 性 顺 序 为 NaOH/γ-Al2O3>CaO/γ-Al2O3>hydrotalcite>CaO >CaO/SBA-15>CaO/MgO >Ca(OH)2≈MgO。
对 MgO、CaO、CaO/MgO、CaO/γ-Al2O3、NaOH/γ-Al2O3、CaO/SBA-15、hydrotalcite 催 化 剂 进 行BET和CO2-TPD表征。结果如表1和图2所示。
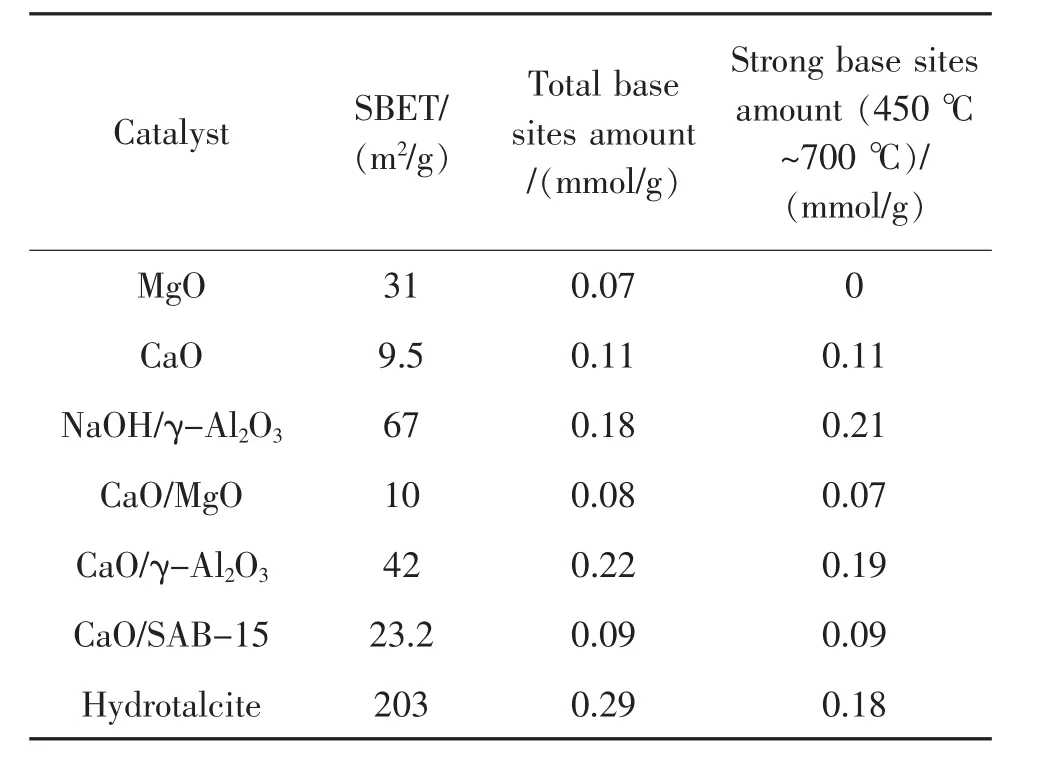
表1 不同催化剂的BET比表面积和碱量分布Table 1 BET surface areas and the amounts of base sites over different solid base catalysts
由表1可知,催化剂的活性与比表面积没有明确联系。尽管MgO具有比CaO较大的表面积,但其催化活性较低。结合图2可知,MgO在100℃到450℃范围内存在一个低的宽峰,而CaO在500℃到680℃范围内存在一个大的CO2脱附峰,这是CaO表面上存在的强碱性位吸附的CO2脱附形成的,说明CaO碱强度明显高于MgO。而结合实验结果与图2,可以发现催化活性高低与催化剂碱强度存在明显的对应关系。催化剂中CO2脱附温度最高的CaO和镁铝水滑石都具有较高的活性,强碱数量最多的NaOH/γ-Al2O3和CaO/γ-Al2O3也具有高的活性,而CO2脱附温度较低的CaO/MgO和强碱中心数量较少的CaO/SAB-15活性较低。这说明无溶剂条件下,糠醛丙酮羟醛缩合发生的活性中心是催化剂的强碱性位,碱性越强,催化活性越高。
通过实验和相关文献可知,活性较高的NaOH/γ-Al2O3和 CaO/γ-Al2O3催化剂在多次回收利用时活性显著降低。而活性相当的CaO和hydrotalcite活性下降较少。与hydrotalcite相比,由于CaO价格低廉,来源广泛,环境友好,因此,从工业化的角度,CaO是糠醛与丙酮羟醛缩合反应更适合的催化剂。

图2 不同固体碱催化剂的CO2-TPD表征Fig.2 CO2-TPD of different solid base catalysts
2.2 反应条件对缩合产物分布的影响
2.2.1 反应温度和反应时间对产物分布的影响
采用CaO作为催化剂时,糠醛丙酮摩尔比为1∶5,催化剂用量为糠醛质量的20%时,反应温度和反应时间对产物分布的实验结果如图3所示。
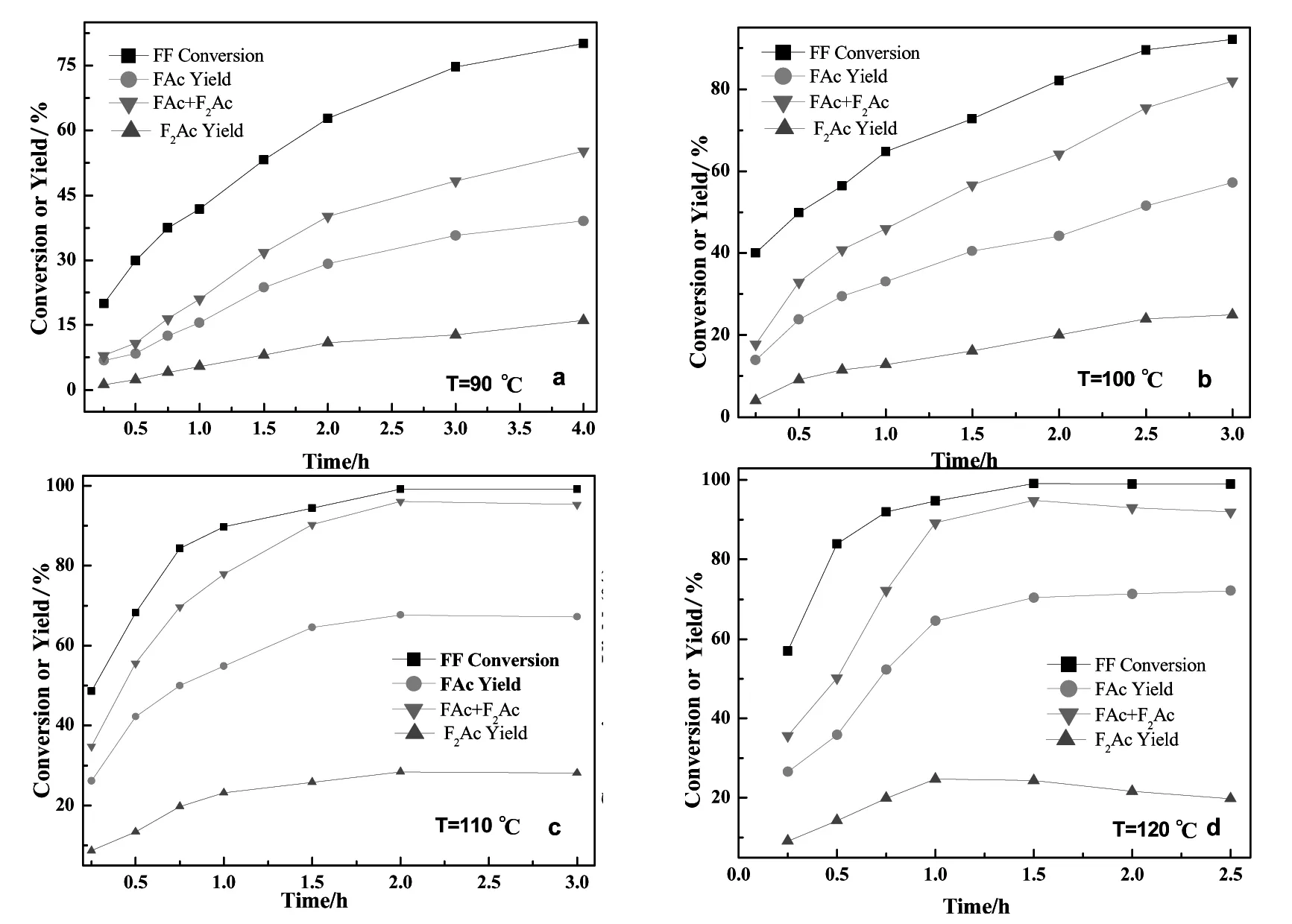
图3 反应温度和反应时间对糠醛转化率和缩合产物分布的影响Fig.3 Furfural conversions and condensation adducts yields over CaO under various reaction temperature and reaction time
由图3可知,在反应温度不超过110℃时,随反应温度的提高和反应时间的延长,糠醛转化率和缩合产物收率持续增加,最后趋于平衡。这是由于 FAc和 F2Ac生成 F3(Ac)2[9]的反应过程是可逆反应。
在图 3(a)、(b)、(c)、(d)中,反应初期,糠醛转化率和缩合产物收率增长迅速,随着反应时间的增加,增长趋势变缓。这是由于CaO与羟醛缩合过程中生成的水反应会生成 Ca(OH)2,Ca(OH)2碱性较弱,催化活性低,因此增长趋势变缓。如图3(a),反应1 h,缩合产物总收率为21%,FAc/F2Ac=2.8;反应2 h时,缩合产物总收率为40%,FAc/F2Ac=2.66;反应4 h时,缩合产物总收率为55%,FAc/F2Ac=2.43。说明在反应过程中,随着时间的延长,F2Ac增长的趋势大于FAc。图3(c)中,反应 2 h,总收率 96%,FAc/F2Ac=2.38;继续延长反应时间至3 h,缩合产物总收率和FAc/F2Ac变化不大。说明110℃反应2 h,糠醛几乎完全转化,而FAc和F2Ac的收率也在2 h之后趋于稳定。但在图3(d)中,当反应温度增加到120℃时,缩合产物总收率先增加后减小。这可能是由于反应生成的F2Ac不具备好的热稳定性,会发生分解生成一部分FAc。
2.2.2 糠醛与丙酮物质的量比对缩合产物分布的影响

图4 糠醛丙酮物质的量比对糠醛转化率和缩合产物分布的影响Fig.4 Furfural conversions and condensation adducts yields over CaO under various molar ratio of acetone to furfural
当反应温度110℃,反应时间2 h,CaO用量为糠醛质量的20%时,不同物质的量比对缩合产物分布的影响如图4所示。由图4可知,随着丙酮糠醛物质的量比的增加,FAc在缩合产物中所占比例越来越大。丙酮糠醛物质的量比为1∶1时,糠醛转化率为95%,FAc/F2Ac=0.29,F2Ac为主产物。物质的量比为1∶5时,糠醛转化率为99%,FAc和 F2Ac收率分别为 67.7%和 28.4%,FAc/F2Ac=2.38,FAc为主产物。丙酮糠醛物质的量比为1∶10时,FAc/F2Ac=4.4。因此,可以通过调节糠醛丙酮物质的量比来控制产物的分布。
2.3 CaO再生性
将反应后的CaO在马弗炉中于800℃下焙烧5 h后重新应用于丙酮糠醛的缩合反应,反应温度110℃,反应时间2 h,糠醛丙酮摩尔比1∶5,CaO与糠醛质量比为1∶5,实验结果如图5所示。
从图5中可以看出,随着重复次数的增加,催化剂活性略有下降。新鲜CaO催化下,缩合产物总收率为96%(FAc/F2Ac=2.38)。3次重复利用时,缩合产物总收率略微下降,为91.6%(FAc/F2Ac=2.41);7次重复利用时,缩合产物总收率降低到83.2%(FAc/F2Ac=2.5)。CaO活性的降低可能是由于积碳或者在缩合以及再生的过程中活性位发生结构变化引起的。但是将第7次重复利用的反应时间延长至3 h(图中7a所示),糠醛转化率和缩合产物收率均与新鲜CaO区别不大。因此,CaO是一种可再生的催化剂。
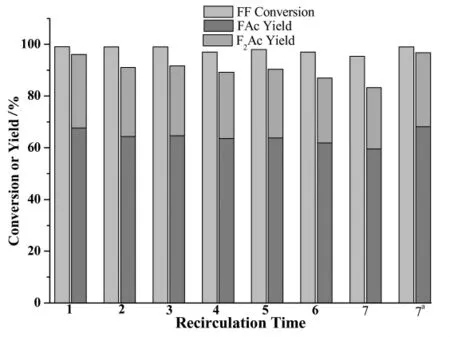
图5 CaO循环利用次数对糠醛转化率和缩合产物分布的影响Fig.5 Furfural conversions and condensation adducts yields over CaOas the function of recycle time
3 小结
(1)采用不同固体碱催化剂进行糠醛与丙酮的无溶剂缩合实验,结果表明:NaOH/γ-Al2O3>CaO/γ-Al2O3>hydrotalcite>CaO>CaO/SBA-15>CaO/MgO>Ca(OH)2≈MgO。筛选出了一种价格低廉、来源广泛、更适合大规模应用的催化剂CaO。
(2)通过对催化剂进行表征发现,催化活性的高低与催化剂碱强度存在对应关系。糠醛丙酮羟醛缩合发生的活性中心是催化剂的强碱性位,碱性越强,催化活性越高。
(3)当CaO作催化剂时,在110℃下反应2 h,缩合产物总收率最高为96%。随着丙酮糠醛摩尔比的增加,FAc在缩合产物中所占比例越来越大。CaO具有良好的可再生性,随着重复次数的增加,催化剂活性略有下降,但延长反应时间依然可以实现缩合产物的高收率。
[1] 杨永,廖兵,庞浩.通过架构C-C键将生物质平台化合物转化为液态烷烃燃料[J].石油化工,2015,44(2):137-143.
[2] Ramos R,Tišler Z,Kikhtyanin O,et al.Solvent effects in hydrodeoxygenation of furfural-acetone aldol condensation products over Pt/TiO2catalyst[J].Applied Catalysis A General,2017,530:174-183.
[3]Nakagawa Y,Liu S,Tamura M,et al.ChemInform Abstract:catalytic total hydrodeoxygenation of biomassderived polyfunctionalized substrates to alkanes[J].Chemsuschem,2015,46(27):1114-32.
[4] Yang J,Li N,Li S,et al.Synthesis of diesel and jet fuel range alkanes with furfural and ketones from lignocellulose under solvent free conditions[J].Green Chemistry,2014,16(12):4879-4884.
[5] Ramos R,Tišler Z,Kikhtyanin O,et al.Towards understanding the hydrodeoxygenation pathways of furfural-acetone aldol condensation products over supported Pt catalysts[J].Catalysis Science & Technology,2015,6 (6):1829-1841.
[6] Sádaba I,Ojeda M, Mariscal R,et al.Mg-Zr mixed oxides for aqueous aldol condensation of furfural with acetone:Effect of preparation method and activation temperature[J].Catalysis Today,2011,167(1):77-83.
[7]Dong N T,Kikhtyanin O,Ramos R,et al.Nanosized TiO2-A promising catalyst for the aldol condensation of furfural with acetone in biomass upgrading[J].Catalysis Today,2016,277:97-107.
[8] Faba L,Díaz E,Ordóñez S.Aqueous-phase furfuralacetone aldol condensation over basic mixed oxides[J].Applied Catalysis B Environmental,2012,s 113-114(9):201-211.
[9] Nadim F,Patrick C,Michel C,et al.Stoichio-kinetic modeling and optimization of chemical synthesis:Application to the aldolic condensation of furfural on acetone[J].Chemical Engineering and Processing,2008,47(3):349-362.
Study on Condensation Reaction of Furfural with Acetaldehyde by CaO Catalyst
XIONG Ji-dong,QIXue-zhen
( Zhejiang University of Technology, Hangzhou, Zhejiang 310014, China)
In this study,the reaction of furfuralacetone (FAc)and difurfurylacetone (F2Ac) was studied by condensation of furfural and acetone in solvent-free condition.A variety of solid base catalysts were prepared by “equal volume impregnation-roasting” and the catalysts were marked by BET and CO2-TPD.The effect of reaction temperature,reaction time and the amount of material and other factors on the catalytic effect was investigated.
CaO;furfural;acetone;aldol condensation
1006-4184(2017)12-0030-05
2017-04-05
熊继东(1990-),男,山东济宁人,硕士在读,主要从事药物分子设计与合成研究。E-mail:xjdctt@126.com。

