Tb3+与磷酸化人中心蛋白1作用的性质研究
赵亚琴,郭小娟
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
Tb3+与磷酸化人中心蛋白1作用的性质研究
赵亚琴*,郭小娟
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
通过荧光发射光谱、微量热等温滴定法和荧光共振光散射方法研究了Tb3+与磷酸化人中心蛋白1(phosphorylated human centrin1,HsCen1p)的作用。结果表明,HsCen1p与Tb3+的结合比为1∶4,与Ⅰ、Ⅱ、Ⅲ和Ⅳ位点的结合能力分别为(0.75 ± 0.40)×104, (0.70 ± 0.40)×104,(8.50 ± 0.40)×104和(1.23 ± 0.07)×105(mol/L)-1,其结合顺序为Ⅳ>Ⅲ>Ⅰ>Ⅱ。另外,研究了Tb3+对HsCen1p聚集性质的影响,发现蛋白HsCen1p的N端结构域在聚集过程中发挥重要作用。
磷酸化;人中心蛋白1;Tb3+
中心蛋白是EF-hand超家族蛋白成员之一,是一种分子量比较小(20 kD)的、酸性钙离子结合蛋白,在不同的细胞过程中扮演着不同的角色。中心蛋白是微管组织中心(microtubule-organizing centers,MTOC)的组成成分,定位在MTOC的不同区域,发挥多种生物功能[1]。最初,中心蛋白是在单细胞绿藻Tetraselmisstriata和Chlamydomonasreinhardtii中作为纤维收缩的组成成分发现的[2-3],后来,在高等植物、酵母、脊椎动物和人类细胞等真核生物中发现了中心蛋白[4]。人体中有四类不同的中心蛋白,分别为centrin1,centrin2,centrin3和centrin4(缩写为HsCen1-HsCen4)[5]。四种人中心蛋白都与视网膜相互连接的鞭毛相关,参与视力的信号转导[6]。神经元细胞中发现了HsCen4;HsCen3主要定位在基体和中心体末端[7];HsCen2调节DNA切除修复、信使RNA输出[8];HsCen1 定位于精细胞的鞭毛基体,通过贡献精细胞的母中心体到卵细胞允许中心体复制,因此与受精卵的第一次有丝分裂相关[9]。
蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本、最普遍、最重要的机制,蛋白质磷酸化是蛋白质翻译后修饰的重要内容,它参与调控生物体内的许多生命活动:调控信号转导、基因表达、细胞周期等诸多细胞过程[10-11]。中心蛋白磷酸化还可能用于调节中心蛋白本身与MTOC其他组分之间的相互作用,并交替调节细胞周期[12-13]。已有的研究结果发现中心蛋白的高度磷酸化可能与肿瘤的发生密切相关[11,14]。蛋白激酶A对HsCen1磷酸化位点为丝氨酸(170位)。
中心蛋白是一种钙结合蛋白,Tb3+与Ca2+有相似配位化学性质,因此本文使用Tb3+为荧光探针,研究了Tb3+与磷酸化人中心蛋白1的结合、对蛋白聚集性质的影响,为人中心蛋白1功能的深入研究提供依据。
1 实验
1.1 材料
七氧化四铽(Tb4O7),纯度达99.99%,湖南稀土金属材料研究所;N-2-羟乙基哌嗪-N′-2-乙磺酸(Hepes),分析纯,Sigma公司;其它试剂均为分析纯。
定点突变采用试剂盒KOD-Plus-Mutagenesis kit (TOYOBO CO. LTD) (JAPAN)购于Trans Gene公司。
1.2 HsCen1的构建、表达、纯化及磷酸化
以pGEX-6p-1为表达载体、人基因组反转录cDNA为模板、通过设定特异性引物和PCR扩增、以BamHI和Sal I为内切酶,在T4DNA 连接酶的作用下得到重组质粒pGEX-6p-1-HsCen1;经过测序鉴定后转入大肠杆菌 BL21(DE3)中获得人中心蛋白1的可溶性表达。蛋白纯化、磷酸化方法与游仆虫中心蛋白类似[15-16]。将纯化得到的蛋白(1×10-4mol/L)与Mg2+(5.71×10-3mol/L)、ATP(1.21×10-3mol/L)、PKA(1.73 μg/μL)溶解在50 mmol/L的Tris-HCl中,30℃条件下恒温水浴10 h,获得磷酸化蛋白。
1.3 等温滴定量热法(ITC)测定
采用等温滴定量热法(ITC200)测定Tb3+与HsCen1p的相互作用,装置包括两个相同的池子,其中一个是样品池,另一个是参比池,两个池子维持相同的温度,测量温度为30℃,参比池为水溶液,样品池为蛋白溶液(200 μL),滴定针内为Tb3+,第一滴滴定体积0.4 μL,以后每滴滴定体积均为1 μL,为保证充分反应每滴的间隔时间为2 min,测量得到Tb3+与HsCen1p相互作用的热力学参数。
1.4 荧光光谱测定
使用Varian-Cary Eclipes Fluorescence Spectrophotometer荧光光谱仪测定HsCen1p突变体与Tb3+的结合,激发波长都是295 nm,扫描范围为480~650 nm,激发狭缝宽度和发射狭缝宽度均为5 nm,反应时间间隔为5 min。
1.5 共振光散射
共振光散射荧光光谱的测定使用F-2500荧光光谱仪。激发狭缝宽度和发射狭缝宽度均为2.5 nm,扫描范围为250~600 nm,反应时间间隔为5 min。
2 结果与分析
2.1 等温滴定量热法测定HsCen1 p与Tb3+的相互作用
以10 mmol/L,pH 7.4的N-2-羟乙基哌嗪-N′-2-乙磺酸Hepes溶液为缓冲,Tb3+滴定蛋白HsCen1p溶液的等温量热结果如图1所示。由图可知,该过程是吸热反应,随着Tb3+加入反应热逐渐增加,继续加入Tb3+反应趋于平稳,吸热反应停止。经过ITC200程序进行数据拟合发现,Tb3+与HsCen1p结合的摩尔比为4∶1,与HsCen1p四个结合位点的结合常数分别为:12.3×104,8.5×104,0.75×104, 0.7×104(mol/L)-1;同时得到了该反应的吉布斯自由能变ΔG、焓变ΔH、熵变ΔS等热力学数值(表1)。由表1可知,Tb3+与HsCen1p每一个结合位点反应的焓变ΔH均大于0、吉布斯自由能变ΔG均小于0、熵变ΔS均大于0,证明该反应为熵驱动反应,是一个可以自发进行的反应。

表1 Tb3+和HsCen1p结合的热力学参数Table 1 Thermodynamic parameters for Tb3+ binding to HsCen1p.

Fig.1 Tb3+ binding with HsCen1p by isothermal titration calorimetry at 30℃.The concentration of the protein was 50 μmol/L图1 Tb3+与HsCen1p结合的等温滴定量热分析图蛋白浓度为50 μmol/L, 反应温度为30℃
2.2 Tb3+与HsCen1 p作用的亲和力
人中心蛋白1包含有四个结合能力不等同的金属离子结合位点(表1)。为获得每一个结合位点与金属离子的亲和力,本文利用生物技术方法在HsCen1p的EF-hand区域引入一个色氨酸(Trp),通过检测Tb3+与HsCen1p色氨酸之间能量转移,求得Tb3+与HsCen1p金属离子结合位点的亲和力。图2A是以295 nm为激发波长,蛋白HsCen1p-E159W(159位E突变为W)与Tb3+结合后,Tb3+在490、545、590和620 nm波长处荧光发射强度随Tb3+浓度变化图。图2B为Tb3+滴定HsCen1p-E159W时,Tb3+在545 nm处敏化荧光变化的滴定曲线,为了消除每次滴定引起的稀释效应,荧光强度变化用摩尔荧光强度FM(F545/[protein]) 表示。由图可见,[Tb3+]/[HsCen1p-E159W]<1时,其荧光强度急剧增强,证明发生了Trp残基到Tb3+的Förster型无辐射能量转移。HsCen1p-E159W的Ⅰ、Ⅱ位点不含有Tyr或Trp氨基酸,而第Ⅲ、Ⅳ部位仅在172位有一个Tyr,无法发生与Tb3+的无辐射能量转移。因此,图2中的Förster型无辐射能量转移归因于从给体W159到受体Tb3+的无辐射能量转移。当[Tb3+]/[HsCen1p-E159W]> 1时,Tb3+荧光敏化微弱增强,[Tb3+]/[HsCen1p-E159W]=4时Tb3+荧光敏化达到最大。由此证明每摩尔HsCen1p可以结合4摩尔Tb3+,其中Ⅳ位点为HsCen1p的最强结合位点。据文献[17]计算得到Tb3+与Ⅳ位点的结合常数KⅣ=1.63×105(mol/L)-1。分别将HsCen1p第Ⅰ、Ⅱ位点A50、F86突变为色氨酸,通过检测突变后蛋白Trp与Tb34的Förster型无辐射能量转移(图3),计算得到HsCen1p第Ⅰ、Ⅱ位点 与Tb3+的结合常数分别为:KⅠ=3.81×104(mol/L)-1和KⅡ=1.89×104(mol/L)-1。结合ITC实验结果与Tb3+敏化荧光实验结果,发现HsCen1四个金属离子结合位点与Tb3+的结合顺序为Ⅳ>Ⅲ>Ⅰ>Ⅱ。
2.3 Tb3+诱导HsCen1p的聚集
Tb3+滴定HsCen1p的荧光共振光散射光谱如图4A所示。由图可见,HsCen1p在370 nm处出现最大共振光散射峰。随着Tb3+加入,HsCen1p的共振光散射峰峰形没有变化,但370 nm处的共振光散射强度逐渐增大,当滴加的Tb3+达到一定量后对HsCen1p的370 nm处共振光散射强度增强效应变缓。如图4B所示,[Tb3+]/[HsCen1p]≤2.0时,共振光散射强度微弱增强,2.0≤[Tb3+]/[HsCen1p]≤4.0时,共振光散射强度显著增强,直到[Tb3+]/[HsCen1p]=4达到最大。中心蛋白存在两类结合位点,其中一类为N端低亲和位点,另一类为C端高亲和位点。Tb3+与C端结合引起蛋白微弱聚集,当与N端结合引起蛋白强聚集,因此推测N端结构域在HsCen1p聚集过程中起主要作用。
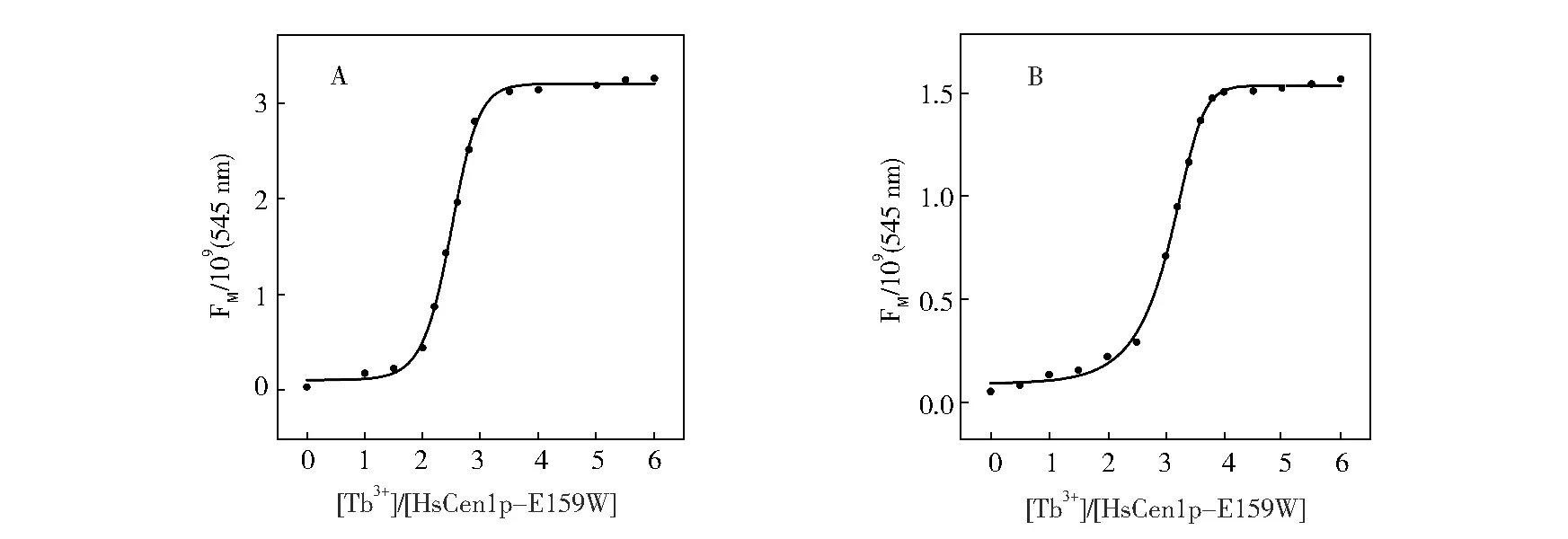
Fig.3 Titration curve for the addition of Tb3+ to HsCen1p-A50W(A)、HsCen1p-F86W(B) by measuring the fluorescence intensity at 545 nm in 10 mmol/L Hepes and at pH 7.4图3 pH为7.4、10 mmol/L Hepes溶液中,Tb3+滴定HsCen1p-A50W(A)、HsCen1p-F86W(B)时545 nm处敏化荧光滴定曲线

Fig.4 Resonance light scattering spectra of HsCen1p induced by Tb3+(A) and the titration curves of HsCen1p with the addition of Tb3+ at 370 nm (B) in 10 mmol/L Hepes,pH 7.4, 25℃, the concentration of protein was 3 μmol/L图4 在25℃, 10 mmol/L Hepes和pH 7.4条件下,蛋白浓度为3 μmol/L,Tb3+滴定HsCen1p的荧光共振光散射谱图(A)及其在370 nm处的荧光共振光散射滴定曲线(B)
3 结论
本文通过等温滴定量热法、荧光共振光散射法研究了蛋白HsCen1p与金属Tb3+的相互作用。结果表明:HsCen1p与Tb3+的作用为吸热的、熵驱动反应;每摩尔HsCen1p可以结合4摩尔Tb3+,计算得到了Tb3+与HsCen1p四个EF-hand结构域的亲和力,蛋白与Tb3+结合顺序为Ⅳ>Ⅲ>Ⅰ>Ⅱ;HsCen1p的N端结构域在蛋白聚集过程中起重要作用。
[1] Kilmartin J V.Sfi1p Has Conserved Centrin-binding Sites and an Essential Function in Budding Yeast Spindle Pole Body Duplication[J].JCellBiol,2003,162(7):1211-21.DOI:10.1083/jcb.200307064.
[2] Huang B,Mengersen A,Lee V D.Molecular Cloning of cDNA for Caltractin,A Basal Body-associated Ca2+-binding Protein:Homology in Its Protein Sequence with Calmodulin and the Yeast CDC31 Gene Product[J].JCellBiol,1988,107:133-140.DOI:10.1083/jcb.107.1.133.
[3] Sanders M A,Salisbury J L.Centrin Plays an Essential Role in Microtubule Severing During Flagellar Excision in Chlamymonas Reinhardtii[J].JCellBiol,1994,124:795-805.DOI:10.1083/jcb.124.5.795.
[4] Dora G,Yves B.The E144 Residue of Scherffelia Dubia Centrin Discriminates Between the DNA Repair Protein XPC and the Centrosomal Protein Sfi1[J].FEBSOpenBiol,2014,4:33-42.DOI:10.1016/j.fob.2013.11.005.
[5] Belinda P R,Myrna R,Jessica D O.Relative Stability of Human Centrins and Its Relationship to Calcium Binding[J].Biochemistry,2013,52:1236-1248.DOI:10.1021/bi3014172.
[6] Laoukili J,Perret E,Middendorp S,etal.Differential Expression and Cellular Distribution of Centrin Isoforms During Human Ciliated Cell Differentiation in Vitro[J].JCellSci,2000,113:1355-1364.
[7] Gavet O,Alvarez C,Gaspar P,etal.Centrin4p,A Novel Mammalian Centrin Specifically Expressed in Ciliated Cells[J].MolBiolCell,2003,14:1818-1834.DOI:10.1091/mbc.E02-11-0709.
[8] Resendes K K,Rasala B A,Forbes D J.Centrin 2 Localizes to the Vertebrate Nuclear Pre and Plays a Role in mRNA and Protein Export[J].MolCellBiol,2008,28:1755-1769.DOI:10.1128/MCB.01697-07.
[9] Palermo G D,Joris H,Devroey P,etal.Pregnancies After Intra Cytoplasmic Sperm Injection of Single Spermatozoon Into an Oocyte[J].Lancet,1992,340:17-18.
[10] Hanft L M,Cornell T D.Molecule Specific Effects of PKA-mediated Phosphorylation on Rat Isolated Heart and Cardiac Myofibrillar Function[J].ArchBiochemBiophys,2016,601:22-31.DOI:10.1016/j.abb.2016.01.019.
[11] Zhao Y Q,Yan J.The Biochemical Effect of Ser166 Phosphorylation on Euplotes Octocarinatus Centrin[J].JBiolInorgChem,2013,18(1):123-136.DOI:10.1007/s00775-012-0957-1.
[12] Salisbury J L,Baron A,Surek B,etal.Striated Flagellar Roots:Isolation and Partial Characterization of a Calciummodulated Contractile Organelle[J].JCellBiol,1984,99(3):962-970.DOI:10.1083/jcb.99.3.962.
[13] Lukasiewicz K B,Greenwood T M,Negron V C,etal.Control of Centrin Stability by Aurora A[J].PlosOne,2011,6(6):e21291.DOI:10.1371/journal.pone. 0021291.
[14] Lingle W L,Lutz W H,Ingle J N,etal.Centrosome Hypertrophy in Human Breast Tumors:Implications for Genomic Stability and Cell Polarity[J].ProcNatlAcadSciUSA,1998,95(6):2950-2955.
[15] 赵亚琴,楚雪峰.TNS与人中心蛋白2作用的荧光光谱研究[J].山西大学学报:自然科学版,2016,39(1):103-107.DOI:10.13451/j.cnki.shanxi.univ(nat.sci).2016.01.017.
[16] Zhao Y Q,Yan J.Analysis of Lanthanide-Induced Conformational Change of the C-terminal Domain on Centrin[J].JFluoresc,2012,22:485-494.DOI:10.1007/s10895-011-0982-4.
[17] Zhao Y Q,Feng J Y.The Characterization for the Binding of Calcium and Terbium to Euplotes Octocarinatus Centrin[J].SpectroActaA,2009,71:1756-1761.DOI:10.1016/j.saa.2008.06.029.
CharacterizationfortheBindingofTerbiumtoPhosphorylatedHumanCentrin1
ZHAO Yaqin*,GUO Xiaojuan
(KeyLaboratoryofChemicalBiologyandMolecularEngineeringoftheMinistryofEducation,InstituteofMolecularScience,Taiyuan030006,China)
Properties of terbium ions binding to phosphorylated human centrin1(HsCen1p) were characterized by fluorescence emission, isothermal titration calorimetry (ITC) and resonance light scattering (RLS).The results suggested that Tb3+may bind with HsCen1p at the ratio of 4∶1. The conditional binding constants of Tb3+with HsCen1p were calculated to be (0.75 ± 0.40)×104, (0.70 ± 0.40)×104,(8.50 ± 0.40)×104and (1.23 ± 0.07)×105(mol/L)-1with the order of Ⅳ >Ⅲ>Ⅰ>Ⅱ. In addition, Tb3+-induced aggregation of HsCen1p was also studied by RLS,the N-terminal domain of HsCen1p plays significant role in the protein aggregation.
phosphorylation;human centrin1;Tb3+
10.13451/j.cnki.shanxi.univ(nat.sci.).2017.04.024
2016-12-08;
2016-12-29
国家自然科学基金(20901048;21571117);教育部博士点专项基金(20131401110011)
赵亚琴(1977-),女,山西平遥人,硕士生导师,从事生物无机化学研究。E-mail: zhaoyaqin@sxu.edu.cn
Q591
A
0253-2395(2017)04-0804-05

