氧化石墨烯的环境行为和毒性效应研究进展
胡俊杰,劳志朗,吴康铭,范洪波
东莞理工学院生态环境与建筑工程学院,广东 东莞 523808
氧化石墨烯的环境行为和毒性效应研究进展
胡俊杰,劳志朗,吴康铭,范洪波*
东莞理工学院生态环境与建筑工程学院,广东 东莞 523808
由于具有优异的光学、力学、电学特性,氧化石墨烯纳米材料被广泛应用于传感、航空航天、新能源、疾病诊断等方面。随着氧化石墨烯的大量生产和广泛应用,其对环境的健康风险也日益引起关注。阐明氧化石墨烯的潜在毒性效应及其作用机制,对于科学客观评价其对人体和生态环境健康风险具有十分重要的意义。文章在总结了纳米氧化石墨烯在不同环境介质中的迁移、转化行为基础上、系统综述了氧化石墨烯对水生生物、陆生植物、大鼠以及微生物的毒害效应并探讨了氧化石墨烯生物毒害效应的可能机制。研究发现,氧化石墨烯在环境介质中主要形成稳定胶体且具有难以降解和易于多介质间迁移等特点;同时,氧化石墨烯还可以进入藻类、鱼类、植物、大鼠以及微生物细胞内并引起氧化应激反应导致炎症发生、多种细胞器损伤和组织器官形态异常。此外,研究还发现纳米氧化石墨烯还会导致DNA氧化损伤和DNA断裂等遗传毒性和诱导生殖毒性相关的小RNA异常表达。因此,对不同环境介质中纳米氧化石墨烯的环境行为和毒性效应进行深入研究具有十分重要的意义。今后可在纳米氧化石墨烯的暴露定量分析,纳米氧化石墨烯与生物大分子间的交互作用及长期低剂量下纳米氧化石墨烯的毒性效应3个方面加强研究。文章可为进一步阐明氧化石墨烯的健康风险提供理论参考。
氧化石墨烯;环境行为;生态毒性;毒性机制
石墨烯(Graphene)是一种由碳原子以 sp2杂化方式形成的蜂窝状单层二维平面结构,是由英国曼切斯特大学的科研人员采用微机械剥离法从石墨中分离出来的单层石墨微片(Novoselov et al.,2004)。它的发现打破了“热力学涨落不允许任何二维晶体在有限温度下存在”的理论。由于具备十分良好的强度、柔韧、导电、导热、光学特性,石墨烯,特别是氧化石墨烯(Graphene Oxide,GO)被广泛应用于传感(Zhao et al.,2016)、航空航天、光伏电池(Jariwala et al.,2013;Yang et al.,2017;Acik et al.,2016)、疾病诊断(Tonelli et al.,2015)、细菌抑制(Ji et al.,2016)等方面。GO的特殊结构使其具有巨大的比表面积,对环境中的污染物有着强吸附能力,其在生产、使用、回收、处理等过程中能富集土壤、大气和水环境中的有毒有害物质,从而在环境中积累并对生物产生潜在影响,最终影响人体健康和生态系统的安全。
近几年来,关于GO对动物、植物、微生物的毒性研究逐渐增多。已有研究表明,GO对水生和陆生生态系统具有毒害效应(李丽娜等,2016;Ge et al.,2016;Jahan et al.,2017;Selck et al.,2016)。GO能够通过胞外覆盖、胞内氧化胁迫或直接破坏细胞膜等方式对细胞产生危害,而且即使在低浓度无明显毒性的情况下,GO也可以与其他物质形成复合物进而对生物产生毒害效应。这无不表明GO对生态环境存在潜在的不良效应。因此,系统地分析GO在各类环境介质中的赋存和迁移特征,深入阐明GO对生态环境的毒害效应,探讨GO对生物的毒性作用机理,有利于科学客观地评价GO的生态风险。
1 氧化石墨烯的环境行为
1.1 氧化石墨烯在水体中的环境行为
GO自身性质和水环境理化性质(pH、离子类型、离子强度等)能够极大影响GO在水环境中的胶体特性和稳定性,而GO种类和浓度是导致其在水体中环境行为差异的主要因素。由于GO具有强吸附能力,不可避免地放大了水环境中污染物迁移归趋的不确定性,如GO对水体中的Cu2+、Zn2+等重金属离子具有强吸附能力(Wei et al.,2017),这可能导致GO与被吸附物质联合对水生生物产生毒性,加大GO在水生生态系统的生态风险。
石墨烯可分为纯石墨烯(pristine graphene,pG)、氧化石墨烯(graphene oxide)、还原性氧化石墨烯(reduced graphene oxide, rGO)和少层石墨烯(FLG)。纯石墨烯具有强疏水性,且不同片层之间由于π-π键的相互作用易发生团聚现象,甚至沉积下来。由于纯石墨烯具备良好的化学惰性,化学性质稳定,导致其在水体中难以被降解。GO因表面含有大量亲水基团而具有良好的亲水性,在纯水中能均匀地分散,形成稳定的胶体溶液(Yu et al.,2016)。然而,在自然水体中,受水环境理化性质(pH、离子强度、离子类型、光照等)的影响,GO可以发生分散-团聚、吸附和还原(吕小慧等,2016)。Yang et al.(2016)研究表明,少层石墨烯(FLG)的浓度是影响其在水性介质中的聚集和稳定性的关键因素,这说明石墨烯的层数也会影响其在水体中的行为。
当胶体溶液的pH在GO的等电点(3.8~4.7)附近时,GO易发生团聚而沉积下来,而当悬浮体系pH值远离等电点时,片层之间表现出斥力作用并随等电点的远离拉长而逐渐增强,最终导致GO分散(任文杰等,2014)。对于离子类型的影响,有研究显示对于GO悬浮液,重金属阳离子的去稳能力比普通阳离子(Ca2+,Mg2+,Na+,K+)更强。并且重金属离子的去稳能力强弱表现为Cr3+>>Pb2+>Cu2+>Cd2+>Ca2+> Mg2+>>Ag+>K+>Na+(Yang et al.,2016)。Lanphere et al.(2013)研究表明,GO水力学直径和平均电泳淌度随离子强度的增加而增大。当离子强度大于0.1 mol·L-1KCl时,GO发生团聚现象。此外,二价离子对水力学直径和平均电泳淌度的影响强于单价离子,这是由电荷屏蔽效应引起的(Chowdhury et al.,2014)。
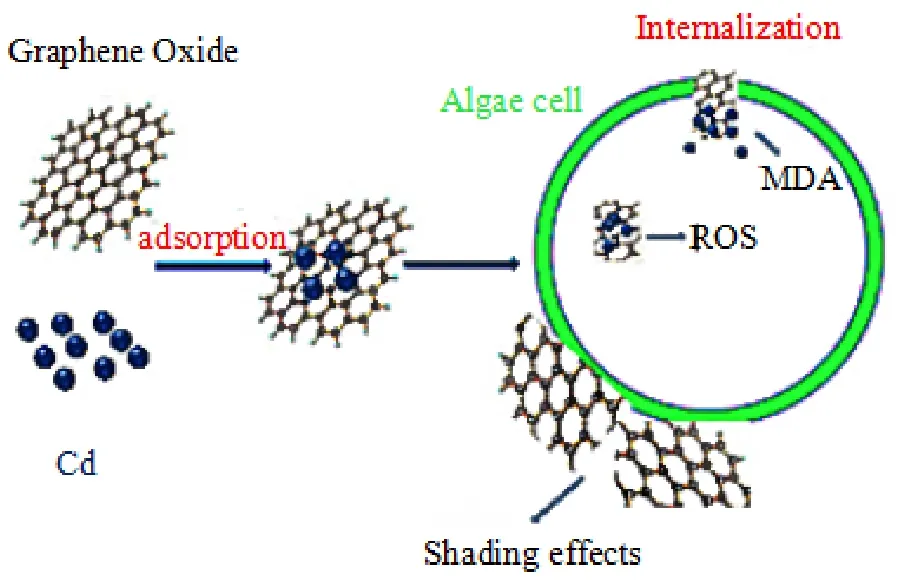
图1 GO和Cd对微囊藻细胞的毒性效应示意图Fig.1 The toxicity effect of GO and Cd on microcystis cells
1.2 氧化石墨烯在土壤中的环境行为
GO在土壤中的行为研究主要集中在其在多孔介质中的迁移特征。GO在土壤中的迁移行为是影响其归趋和土壤微生物群落变化的重要因素。由于截留、扩散和沉积作用,GO会附着在多孔介质中;但随着环境理化性质的改变,GO可能会悬浮进入地下水中(Ren et al.,2014)。Liu et al.(2013)通过砂柱实验发现多孔介质对GO的保留能力极其依赖于溶液离子浓度。Feriancikova et al.(2012)观测到在低离子浓度(1 mmol·L-1NaCl)下,GO颗粒的保留减少。当离子浓度增加到 100 mmol·L-1NaCl时,GO颗粒的保留显着增加,但受其保留能力的限制。这表明pH对GO在多孔介质中的迁移行为无明显影响,而离子强度是影响GO在多孔介质中迁移的决定性因素(Lanphere et al.,2013)。
2 氧化石墨烯的毒性效应
2.1 氧化石墨烯对水生生物的毒性
2.1.1 氧化石墨烯对藻类的毒性
藻类广泛存在于水生生态系统中,是水生植物的重要成员,同时也是水中溶解氧的主要来源。而在生物圈中,80%的氧气来源于藻类,由此可知藻类对生态系统的重要性。近几年,有关GO对藻类毒性的研究不断增多。Hazeem et al.(2017)的研究表明,GO对海藻Picochlorum sp.不同生长阶段的生长和光合色素也同样具有毒性效应,GO在高浓度下对海藻细胞有致死效应并且会减少细胞内叶绿素a的含量,然而在0.5 mg·L-1浓度中,GO会促进海藻的生长和光合色素的增加。此外,关于GO的毒性研究并不仅局限于GO对环境生物的影响,对于GO与其他物质的联合毒性也进行了深入研究。已有研究显示,低浓度GO(1 mg·L-1)虽然对铜绿微囊藻(Microcystis aeruginosa)没有显著毒性,但其会加剧 Cd2+的细胞毒性(图 1)。研究结果表明,GO/Cd2+以氧化应激作为主要的毒性机制对微囊藻产生作用(Tang et al.,2015)。与之相反,在铜浓度为1 mg·L-1时,GO减缓了铜对斜生栅藻(Scenedesmus obliquus)的生态毒性,即对于斜生栅藻,GO与铜表现出拮抗作用(Hu et al.,2016)。
Zhao et al.(2017)探究了GO家族材料对淡水藻类的毒性机理,发现GO可通过遮蔽效应以及氧化应激诱导膜损伤而产生毒性,多层石墨烯和还原性氧化石墨烯则由于分散能力较弱而缺少对藻细胞的遮蔽效应。研究结果表明,氧化应激和物理渗透、提取诱导的藻细胞膜损伤可能是 MG和 rGO的主要毒性作用机制。此外,在藻类培养基中,GO家族材料的吸附及遮蔽效应导致的养分衰竭也会引起间接毒性。Hu et al.(2014)观察GO与微藻细胞相互作用,发现含氮基团致使GO附着于细胞表面。此外,GO可以进入细胞内,对微藻细胞内的细胞器造成损伤,抑制细胞分裂,并发生氧化应激。最后,代谢组学研究显示,GO可能引起与重要生物过程相关的代谢紊乱,从而抑制微藻细胞的生长。这可能是GO造成藻类细胞生长受到抑制甚至死亡的重要原因。
GO覆盖在导致藻类生物膜受损的同时,对自身的生态毒性却存在一定的缓解。硅藻生物膜即使在高浓度下也能粘附少层GO而较低水体的潜在风险,可能是GO直接接触和遮蔽效应的组合效应导致了生物膜和纳米颗粒之间的强相互作用(Garacci et al.,2017)。大量研究发现,高浓度GO可以诱导大部分藻类细胞产生氧化应激,使细胞内 ROS含量增加,进而破坏细胞的完整性(Nogueira et al.,2015;Tang et al.,2015;Ouyang et al.,2015)。
上述研究表明,GO对藻类除了能产生直接毒性外,还能产生间接毒性。此外,与其他物质的联合毒性也使得对GO的生态风险评估变得复杂。GO对于藻类的毒性可能取决于藻的种类、GO浓度和暴露时间等,且GO与其他物质联合既存在协同作用,也存有拮抗作用。
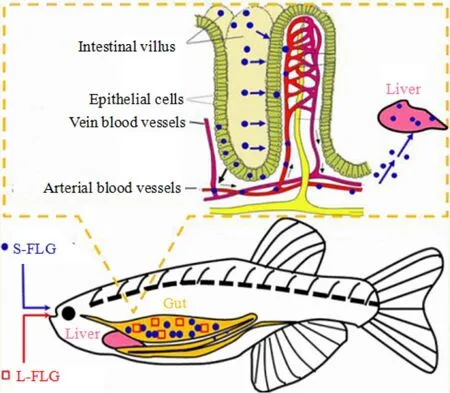
图2 S-FLG和L-FLG在斑马鱼体内分布示意图Fig.2 The Distribution diagram of S-FLG and L-FLG in zebrafish
2.1.2 氧化石墨烯对鱼类的毒性
鱼类是水生生态系统不可或缺的一部分,通过鱼类,可以了解到水生生态系统变化的程度、方向和规模(Izzo et al.,2016),同时对水生生态系统的健康程度进行科学客观的评价。目前,绝大多数关于GO对水生动物的毒性研究中,拥有体积小、发育快等特性的斑马鱼(Brachydanio rerio)被广泛研究。
Lu et al.(2017)利用C-14标记的少层GO进行GO迁移研究,发现GO能被斑马鱼摄取并滞留在体内,其中大块 FLG主要聚集在肠道内,而小块 FLG在肠道和肝脏中都有分布。不仅如此,小块FLG还能进入细胞和血液中(图2),影响斑马鱼机体的正常运转。Chen et al.(2016)将斑马鱼分别暴露于 1、5、10和 50 mg·L-1GO中,发现 GO并没有明显的急性毒性,但会引起组织解体、细胞排列松散以及细胞边界瓦解。Souza et al.(2017a)发现在2、10、20 mg·L-1GO环境中,成体斑马鱼鳃组织遭到损伤,肝组织出现病灶,且过早凋亡和坏死的鳃细胞数量增多,而这很可能源于鳃细胞中产生的活性氧(ROS)。因为中、高浓度的ROS可通过细胞氧化应激反应诱导细胞凋亡甚至致其坏死。
GO的尺寸大小、浓度高低以及生物体的发育程度,都会影响GO的毒性效应。生物体发育程度低,机体排异机制尚未完善,因此可能会受到更大的伤害。GO可以通过基团的相互作用粘附并包裹胚胎绒毛膜,堵塞孔隙,致使胚胎缺氧和孵化延迟。还可以由内吞作用进入胚胎,损伤线粒体,并转移到眼睛、心脏和卵黄囊等区域,诱发眼睛发育畸形,心脏和卵黄囊水肿(Chen et al.,2016)。此外,微量浓度的GO会诱导斑马鱼胚胎过量产生ROS,致其发育受损(Lu et al.,2017)。Soares et al.(2017)发现在10 mg·L-1GO中暴露6 d后,斑马鱼幼体心率加快、脑细胞损伤以及多巴胺水平下降。Hu et al.(2017)还发现,当将斑马鱼幼体置于微量 GO中时,幼体DA神经元缺失90%以上,α-突出核蛋白和泛素增多69%~522%,且表现出类似帕金森的症状。GO还能进入幼体脑部,甚至是间脑细胞核内,造成幼体脑细胞线粒体形态和超微结构损伤。任朝秀(2016)将斑马鱼暴露于微量GO中,发现GO可以从水中转移到亲代斑马鱼体内,并遗传给子代,分布于其脑部;且亲代因代谢紊乱导致子代出现神经功能障碍,致使子代 DA神经元缺失率达66%~87%,泛素和乙酰胆碱酯酶明显上调,说明GO即使在微量浓度下,其毒性也依然显著,而且还具有一定的遗传毒性。相比于斑马鱼,Mesarič et al.(2015)也发现GO能够与丰年虾(Artemia salina)体内的乙酰胆碱酯酶、谷胱甘肽-S-转移酶和过氧化氢酶等发生作用而使其生命活动受到影响,甚至致其死亡。
2.2 氧化石墨烯对陆生植物的毒性
目前关于GO对陆生植物的毒性研究集中在对种子发芽、幼苗生长的直接毒性影响方面,研究对象主要有蔬菜类、豆科类、水稻等,且GO对陆生植物的直接毒性影响大都表现为抑制作用,包括抑制植物根的生长、种子的发芽等。然而,由于植物种类和暴露浓度的不同,GO对某些陆生植物的生长表现出促进作用。Begum et al.(2011)研究了在500~2000 mg·L-1浓度范围内GO对白菜(Brassica pekinensis)、番茄(Lycopersicon esculentum)、红菠菜(Senecio fuluipes)和莴苣(Lactuca sativa)幼苗的植物毒性,发现在20 d后,与对照组相比,白菜、番茄、红菠菜的生长明显受到严重抑制,且叶片数量、大小随着GO浓度的增加而减少,植物细胞内 ROS的含量增加,从而导致暴露于高浓度GO的植物细胞生长受到抑制或坏死。然而,在相同条件下莴苣没有或很少表现出毒性作用。由此说明,GO对植物的毒性效应很大程度取决于浓度、暴露时间和作物种类。
Cakir et al.(2016)研究了GO对豆类的种子发芽和幼苗生长情况的潜在影响。通过设置不同浓度GO和空白对照评估根和芽的生长。当使用2000 mg·L-1GO溶液处理时,发现豆类的种子发芽大多受到影响,并表现出浓度依赖性。在此研究中,GO的存在导致了种子发芽率变小、根与苗的长度变短、重量降低。
与之相反,GO对番茄种子的萌发却具有积极的影响,这归因于GO能渗透种皮。渗透可能损坏种皮以促进其吸水,导致种子迅速萌发并提高发芽率。而在番茄幼苗的生长阶段,GO可能对幼苗生物量的积累产生不利影响。GO渗透液泡及其在根尖中的沉积是降低生物量生产的原因。此外,被GO处理过的幼苗的茎和根长于对照组幼苗的茎和根。据此推测,伸长量可能与GO处理的幼苗中赤霉素生物合成升高有关(Zhang et al.,2015)。Jiao et al.(2016)研究 GO 对番茄种子的影响,发现GO促进番茄根的生长,结果表明,GO是通过影响脱落酸和吲哚乙酸的生物合成来干扰植物生长的。这表明了GO可能通过影响植物激素的合成干预植物的生长。
Liu et al.(2015)研究了GO对水稻种子萌发和生长的影响。将种子暴露在不同浓度的GO溶液(50~200 mg·L-1)下,发现GO不同程度地抑制了幼苗的形态。当GO浓度增大时,水稻种子发芽率降低。GO还可抑制水稻幼苗的形态发生,而 5 mg·L-1GO却能改善部分生长指标。因此,关于GO对植物毒性的评估还需要精确细分浓度梯度来进一步探究。
GO对陆生植物同样具有间接毒性,能放大有毒物质的毒性效应。例如,砷及其化合物常见于环境中,能在陆生植物体内积累,而GO能极大扩大其在小麦中的植物毒性,导致生物量和根数减少以及氧化应激增强。与As或GO单独作用相比,GO联合As可抑制碳水化合物的代谢,增强氨基酸和次生代谢,同时破坏脂肪酸代谢和尿素循环。GO对小麦的上述效应具有浓度依赖性(Hu et al.,2013)。鉴于As广泛存在于陆生植物中(Zhao et al.,2009),故应充分考虑GO的间接纳米毒性。
关于 GO对陆生植物的毒性机理,常海伟等(2015)采用水培实验,探究了磺化 GO对小麦幼苗的毒性效应。发现培养10 d后,低浓度磺化GO对小麦根系的生长具有显著的促进作用(P<0.05)。磺化石墨烯处理的小麦幼苗根系和叶片组织中超氧化物歧化酶、过氧化氢酶和丙二醛随着磺化石墨烯浓度的增加都呈现先下降后上升的趋势,这可能与磺化石墨烯自身的抗氧化能力有关。这说明以具有抗氧化性的官能团修饰石墨烯可以减弱石墨烯对陆生植物的氧化胁迫,降低其毒性。此外,石墨烯还能造成细胞器损伤导致植物细胞死亡。Begum et al.(2013)用 GO 处理拟南芥(Arabidopsis thaliana)T87细胞后,发现其细胞内线粒体、细胞核、细胞膜都受到损坏,同时ROS含量成倍增加,导致细胞死亡;进一步研究发现 ROS调控线粒体损伤引起了T87细胞的死亡。
2.3 氧化石墨烯对大鼠的毒性
相较于水生动物,GO对大鼠的影响显得更加复杂。在对神经系统的影响研究方面,赵香琴(2013)发现 GO处理后的大鼠生长发育、精神状态以及运动行为都没有明显异常,并且在中枢及外周神经系统中均无GO颗粒的存在。此外GO直接作用于神经干细胞(neural stem cells,NSCs)及海马神经元24 h或120 h均未引起明显的细胞毒性效应,因此GO可能没有进入NSCs及神经元,也没有诱导细胞的氧化应激。这表明GO对神经系统可能具有良好的生物相容性。不止是神经系统,生物体的其他系统或器官也可能会受到 GO的影响。El-Yamany et al.(2017)往小鼠腹膜内注射GO纳米片,观察到肝脏中超氧化物歧化酶和过氧化氢酶的活性以及GSH水平下降,并且GO剂量越高,反复注射天数越多,肝脏受到的危害越大。Li et al.(2016)还发现,GO不仅对肝脏有危害,还会对肺、脾造成影响,将GO通过尾静脉注射注入小鼠体内,持续7 d,小鼠肺、肝和脾都出现了浓度依赖性的不同程度的炎症,而其他器官并没有受到GO的影响。Mao et al.(2016)进一步研究,将C-14标记的FLG通过气管内滴注进小鼠体内,观测到FLG主要保留在肺中,但也有小部分会进入到肝脏和脾脏中。张颖等(2017)探讨了GO对大鼠角膜上皮细胞的致损伤作用,结果显示,随着GO浓度的增加,细胞的活性逐渐下降,细胞破碎、死亡的概率上升,而且随着GO最低有效浓度(0.005 μg·L-1)干预时间的增加,细胞活性也大幅下降。可以看出,GO会对生物体的个别系统或器官造成伤害,并且表现出浓度和时间依赖性。
GO还会加重机体病症,产生间接毒性。Shang et al.(2017)通过小鼠哮喘模型来研究GO的毒性,结果显示,小鼠体内ROS增加,lgE增多,Th2应答上调;加重了小鼠过敏性哮喘症状,导致气道重塑、胶原沉积、粘液分泌过多以及气道高反应性。而施用维生素E后,上述影响受到弱化,表明GO可能通过诱导氧化应激来扰乱机体的免疫活动,进而对生物体造成危害。因此,可以利用抗氧化药物来抵御GO产生的一些危害。
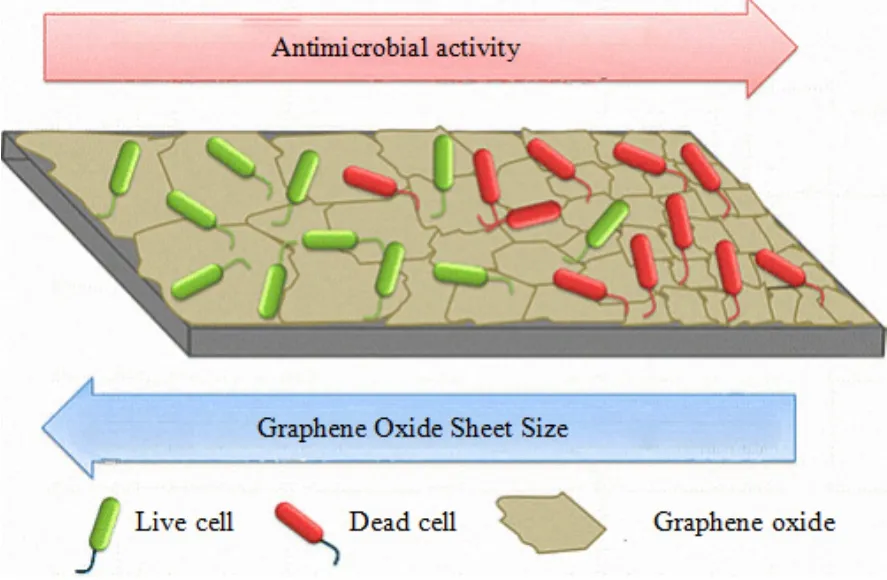
图3 氧化石墨烯纳米片的尺寸对抗菌性能的影响Fig.3 Effect of size of graphene oxide nanosheets on antibacterial properties
2.4 氧化石墨烯对微生物的毒性
GO是生物医学中最具有发展前景的细菌抑制材料(Yousefi et al.,2017;Hu et al.,2010),其对动物细胞具有生物相容性,故对细菌具有高抗菌性。现阶段关于GO对微生物毒性的研究主要集中在对细菌毒性的研究上。
诸多研究表明,GO对细菌大都表现出抗菌性,这主要依赖于GO的自身性质和细菌种类。GO的尺寸、层数、官能团密度都会影响其对细菌的毒性效应。2015年,Perreault et al.(2015)利用革兰氏阴性细菌(大肠杆菌)对GO的抗菌性与尺寸之间的关系进行了研究,结果发现在GO表面涂层上,当GO微片面积从0.65下降至0.01 μm2时,GO表面涂层的抗菌活性提高了4倍(图3)。这说明面积越小的GO微片拥有更良好的抗菌效果,主要归因于与微片的高缺陷密度相关的氧化机制。相反,在细胞悬浮液中,GO的抗菌能力随着面积的增加而增加。Wang et al.(2013)利用粗粒分子动力学模拟技术探究了GO层数对GO进入细胞的影响,以3层GO的角部刺入脂双层,插入和旋转后3层GO平行于脂双层,且其穿透脂双层的能量壁垒约为2.7 kBT,大于单层GO的。这表明多层GO可能具有强损伤能力,即高抗微生物性(Zou et al.,2016)。另有研究表明,在GO上官能团(如羧基、羟基、环氧基团等)的密度可以增加GO接触细菌的机会(Liu et al.,2011),这让GO的表面修饰对细菌毒性具有较大影响。
GO对细菌的毒性机制是复杂的。大部分研究证明 GO对细菌的抗菌性主要是对细菌细胞膜完整性的破坏,包括机械损伤和氧化损伤,这可能是GO抗菌性表现出浓度、时间依赖性的重要原因。GO的片状结构使其具有锋利的边缘,这导致其在与细菌接触时可能会对细菌的细胞膜产生不可逆的机械损伤(Akhavan et al.,2010)。GO对细菌的氧化胁迫导致超氧离子介导氧化应激也是 GO表现出细菌毒性的重要原因(Gurunathan et al.,2012)。Liu et al.(2014)研究了石墨、GO、石墨氧化物对大肠杆菌的抗菌性,发现菌体内的活性氧簇(ROS)没有显著变化,但谷胱甘肽的含量明显增加,这间接说明了石墨烯的抗菌性可能与其氧化损伤有关。
GO对细菌的毒性特征已被应用于GO抗菌材料领域,目前对GO抗菌材料的研究主要集中在表面修饰对GO抗菌材料性能的影响方面。例如:在Ag/GO的基础上研发了Ag/ZnO/rGO,后者表现出更为优异的抗菌性能(Ko et al.,2017)。相比于生物医学对GO的抗菌性要求,生态环境则需要GO无毒无害,这就要求研发者通过改变GO的理化性质或对GO进行化学修饰以减少其对自然界中土著细菌的毒害作用。
2.5 氧化石墨烯的遗传毒性和生殖毒性
GO也能对DNA造成影响,表现出遗传毒性。Mohamed et al.(2017)发现,GO能够影响DNA的迁移,还能导致DNA损伤,造成DNA片段化。Szmidt et al.(2016)利用鸡胚模型探究了GO的毒性,结果表明,纯石墨烯(pG),氧化石墨烯和还原性氧化石墨烯(rGO)都能够造成鸡胚肝脏细胞中的线粒体损伤,而且在pG和rGO处理后,肝脏中DNA损伤标志物8-OHdG的浓度显著降低。此外,赵云利(2015)用Rho B荧光探针标记GO以探究GO对秀丽线虫(Caenorhabditis elegans)的毒性效应,获得了GO诱导异常表达的miRNAs和mRNAs谱,进而提出了可能参与GO毒效应调控的miRNAs-mRNAs分子网络。而Zhao et al.(2016)在研究GO对秀丽隐杆线虫生殖毒性的实验中,进一步确定了miRNA调节GO诱导的生殖毒性。
3 氧化石墨烯的毒性效应机制
目前的研究还未完全揭示 GO的毒性效应机制,然而研究发现微量浓度的GO会诱导斑马鱼胚胎过量产生ROS,致其发育受损(Lu et al.,2017)。同时通过探索 GO对细菌的分子水平毒性,发现GO可以与磷脂分子和 DNA发生相互作用。Gurunathan et al.(2012)观察到GO能破坏绿脓杆菌(Pseudomonas aeruginosa)的DNA链。Li et al.(2014)利用DNA/RNA包裹的GMS在分子识别、抗癌药物递送、DNA移位和测序等方面的应用,证实了GMS与细菌DNA具有强相互作用。Tu et al.(2013)通过生物电子显微镜观察到细菌细胞膜与GO作用后产生了大量的空腔结构,表明GO在机械损伤细胞膜的同时,还能将细胞膜上的磷脂分子吸附到GO表面。目前关于GO对遗传物质影响方面的研究较少,对GO分子水平毒性的研究仍滞留在表观层面,未来还需进行深入研究。
4 展望
GO作为一种特性优异的新型材料,有着广阔的发展前景,但在广泛应用的同时也必须时刻关注其对生态环境的影响,重视潜在的风险问题。从目前的研究可知,GO具有生态毒性,不仅能通过遮蔽效应、机械损伤、氧化应激等方式影响生物体内细胞的正常运作,还能深入到细胞器甚至是 DNA中,以机械损伤或与其中的酶等物质发生反应进而对机体产生危害。然而,要准确阐明GO与生物酶的相互作用方式和影响基因表达的机制,仍需要进一步研究。
目前已有多项研究利用放射性物质标记GO,以观察其在生物体内的分布和行为,这种方式能直观有效的定性、定量分析其毒性效应。研究生产只含有特定基团修饰的GO来探究其生态环境作用机理也将是一个值得发展的有效手段。
当前很多关于GO毒性的研究都集中在短期暴露及急性毒性方面,然而很多时候,低剂量长期暴露会给生物带来更大的危害。因此,今后的研究需多关注长期暴露对生物的影响。
由于GO对生态环境具有潜在毒性,所以要规范使用GO材料,也要对使用后的废渣进行合理的回收处理,可通过表面改性、团聚沉淀等方式降低甚至消除其毒性。
ACIK M, DARLING B. 2016. Graphene in perovskite solar cells: device design, characterization and implementation [J]. Journal of Materials Chemistry A, 4(17): 6185-6235.
AKHAVAN O, GHADERI E. 2010. Toxicity of graphene and graphene oxide nanowalls against bacteria [J]. ACS nano, 4(10): 5731-5736.
BEGUM P, FUGETSU B. 2013. Induction of cell death by graphene in Arabidopsis thaliana (Columbia ecotype) T87 cell suspensions [J].Journal of Hazardous Materials, 260(18): 1032-1041.
BEGUM P, IKHTIARI R, FUGETSU B. 2011. Graphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuce [J].Carbon, 49(12): 3907-3919.
CAKIR Y, CAKIR O U C. 2016. Phytotoxicity of graphene in tomatoes and bean[C]//Fifth International Conference on Agro-Geoinformatics.IEEE.
CHEN M, YIN J, LIANG Y, et al. 2016. Oxidative stress and immunotoxicity induced by graphene oxide in zebrafish [J]. Aquatic Toxicology, 174: 54-60.
CHEN Y, HU X, SUN J, et al. 2016. Specific nanotoxicity of graphene oxide during zebrafish embryogenesis [J]. Nanotoxicology, 10(1):42-52.
CHOWDHURY I, DUCH M C, MANSUKHANI N D, 2014. Response to comment on “Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment” [J]. Environmental Science& Technology, 48(2): 1359.
EL-YAMANY N A, MOHAMED F F, SALAHELDIN T A, et al. 2017.Graphene oxide nanosheets induced genotoxicity and pulmonary injury in mice [J]. Experimental & Toxicologic Pathology Official Journal of the Gesellschaft Fur Toxikologische Pathologie, 69(6):383-392.
FERIANCIKOVA L, XU S. 2012. Deposition and remobilization of graphene oxide within saturated sand packs [J]. Journal of Hazardous Materials, 235-236(2): 194-200.
GARACCI M, BARRET M, MOUCHET F, et al. 2017. Few Layer Graphene sticking by biofilm of freshwater diatom Nitzschia palea as a mitigation to its ecotoxicity [J]. Carbon, 113: 139-150.
GE Y, PRIESTER J H, MORTIMER M, et al. 2016. Long-term effects of multi-walled carbon nanotubes and graphene on microbial communities in dry soil [J]. Environmental Science & Technology,50(7): 3965-3974.
GURUNATHAN S, HAN J W, DAYEM A A, et al. 2012. Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosa [J]. International Journal of nanomedicine, 7: 5901-5914.
HAZEEM L J, BOUOUDINA M, DEWAILLY E, et al. 2017. Toxicity effect of graphene oxide on growth and photosynthetic pigment of the marine alga Picochlorum sp. during different growth stages [J].Environmental Science and Pollution Research, 24(4): 4144-4152.
HU C, HU N, Li X, et al. 2016. Graphene oxide alleviates the ecotoxicity of copper on the freshwater microalga Scenedesmus obliquus [J].Ecotoxicology and environmental safety, 132: 360-365.
HU W, PENG C, LUO W, et al. 2010. Graphene-based antibacterial paper[J]. ACS Nano, 4(7): 4317-4323.
HU X C, WEI Z, MU L. 2017. Graphene oxide nanosheets at trace concentrations elicit neurotoxicity in the offspring of zebrafish [J].Carbon, 117: 182-191.
HU X G, KANG J, LU K C, et al. 2013. Graphene oxide amplifies the phytotoxicity of arsenic in wheat [J]. Scientific Reports, 4:6122.
HU X G, LU K C, MU L, 2014. Interactions between graphene oxide and plant cells: Regulation of cell morphology, uptake, organelle damage,oxidative effects and metabolic disorders [J]. Carbon, 80(1): 665-676.
IZZO C, DOUBLEDAY Z A, GRAMMER G L, et al. 2016. Fish as proxies of ecological and environmental change [J]. Reviews in Fish Biology and Fisheries, 26(3): 265-286.
JAHAN S, YUSOFF I B, ALIAS Y B. 2017. Reviews of the toxicity behavior of five potential engineered Nanomaterials (ENMs) into the aquatic ecosystem [J]. Toxicology Reports, 4: 211-220.
JARIWALA D, SANGWAN V K, LAUHON L J, et al. 2013. Carbon nanomaterials for electronics, optoelectronics, photovoltaics, and sensing [J]. Chemical Society Reviews, 44(25): 2824-2860
JI H, SUN H, QU X. 2016. Antibacterial applications of graphene-based nanomaterials: recent achievements and challenges [J]. Advanced drug delivery reviews, 105(Pt B): 176-189.
JIAO J, CHENG F, ZHANG X, et al. 2016. Preparation of Graphene Oxide and Its Mechanism in Promoting Tomato Roots Growth [J]. Journal of Nanoscience & Nanotechnology, 16(4): 4216-4223.
KO Y C, FANG H Y, CHEN D H. 2017. Fabrication of Ag/ZnO/reduced graphene oxide nanocomposite for SERS detection and multiway killing of bacteria [J]. Journal of Alloys and Compounds, 695:1145-1153.
LANPHERE J D, LUTH C J, WALKER S L. 2013. Effects of solution chemistry on the transport of graphene oxide in saturated porous media[J]. Environmental Science & Technology, 47(9): 4255-4261.
LI Y, WANG Y, TU L, et al. 2016. Sub-Acute Toxicity Study of Graphene Oxide in the Sprague-Dawley Rat [J]. International journal of environmental research and public health, 13(11): 1149.
LI Y, WU Q, ZHAO Y, et al. 2014. Response of microRNAs to in vitro treatment with graphene oxide [J]. ACS Nano, 8(3): 2100-2110.
LIU L, GAO B, WU L, et al. 2013. Deposition and transport of graphene oxide in saturated and unsaturated porous media [J]. Chemical Engineering Journal, 229(4): 444-449.
LIU S, WEI H, LI Z, et al. 2015. Effects of Graphene on Germination and Seedling Morphology in Rice [J]. Journal of Nanoscience &Nanotechnology, 15(4): 2695-2701.
LIU S, ZENG T H, HOFMANN M, et al. 2011. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide:membrane and oxidative stress [J]. ACS Nano, 5(9): 6971-6980.
LU K, DONG S, PETERSEN E J, et al. 2017. Biological Uptake,Distribution, and Depuration of Radio-Labeled Graphene in Adult Zebrafish: Effects of Graphene Size and Natural Organic Matter [J].ACS Nano, 11(3): 2872-2885.
MAO L, HU M, PAN B, et al. 2016. Biodistribution and toxicity of radio-labeled few layer graphene in mice after intratracheal instillation[J]. Particle and fibre toxicology, 13(1): 7.
MESARIČ T, GAMBARDELLA C, MILIVOJEVIĆ T, et al. 2015. High surface adsorption properties of carbon-based nanomaterials are responsible for mortality, swimming inhibition, and biochemical responses in Artemia salina larvae [J]. Aquatic toxicology, 163:121-129.
MOHAMED W, DIN T, TOHAMY A, et al. 2017. Evaluation of genotoxic and hepatotoxic effects of graphene oxide nanosheets in male albino mice [J]. The Egyptian Journal of Experimental Biology (Zoology),13(1): 43-53.
NOGUEIRA P F M, NAKABAYASHI D, ZUCOLOTTO V. 2015. The effects of graphene oxide on green algae Raphidocelis subcapitata [J].Aquatic Toxicology, 166: 29-35.
NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. 2004. Electric field effect in atomically thin carbon films [J]. Science, 306(5696):666-669.
OUYANG S, HU X, ZHOU Q. 2015. Envelopment–Internalization Synergistic Effects and Metabolic Mechanisms of Graphene Oxide on Single-Cell Chlorella vulgaris Are Dependent on the Nanomaterial Particle Size [J]. ACS applied materials & interfaces, 7(32):18104-18112.
PERREAULT F, DE FARIA A F, NEJATI S, et al. 2015. Antimicrobial properties of graphene oxide nanosheets: why size matters [J]. ACS nano, 9(7): 7226-7236.
REN W, CHENG H M. 2014. The global growth of graphene [J]. Nature Nanotechnology, 9(10): 726-730.
SELCK H, HANDY R D, FERNANDES T F, et al. 2016. Nanomaterials in the aquatic environment: A European Union–United States perspective on the status of ecotoxicity testing, research priorities, and challenges ahead [J]. Environmental toxicology and chemistry, 35(5): 1055-1067.
SHANG S, LI J, ZHAO Y, et al. 2017. Oxidized graphene-aggravated allergic asthma is antagonized by antioxidant vitamin E in Balb/c mice[J]. Environmental Science and Pollution Research, 24(2): 1784-1793.
SOARES J C, PEREIRA T, COSTA K M, et al. 2017. Developmental neurotoxic effects of graphene oxide exposure in zebrafish larvae(Danio rerio) [J]. Colloids and Surfaces B: Biointerfaces, 157:335-346.
SOUZA J P, BARETTA J F, SANTOS F, et al. 2017. Toxicological effects of graphene oxide on adult zebrafish (Danio rerio) [J]. Aquatic Toxicology, 186: 11-18.
SZMIDT M, SAWOSZ E, URBAŃSKA K, et al. 2016. Toxicity of different forms of graphene in a chicken embryo model [J]. Environmental Science and Pollution Research, 23(19): 19940-19948.
TANG Y, TIAN J, LI S, et al. 2015. Combined effects of graphene oxide and Cd on the photosynthetic capacity and survival of Microcystis aeruginosa [J]. Science of the Total Environment, 532: 154-161.
TONELLI F M P, GOULART V A M, GOMES K N, et al. 2015.Graphene-based nanomaterials: biological and medical applications and toxicity [J]. Nanomedicine, 10(15): 2423-2450.
TU Y, LV M, XIU P, et al. 2013. Destructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheets [J]. Nature nanotechnology, 8(8): 594-601.
WANG J, WEI Y, SHI X, et al. 2013. Cellular entry of graphene nanosheets: the role of thickness, oxidation and surface adsorption [J].Rsc Advances, 3(36): 15776-15782.
WEI Y, XU L, YANG K, et al. 2017. Electrosorption of Toxic Heavy Metal Ions by Mono S- or N-Doped and S, N-Codoped 3D Graphene Aerogels [J]. Journal of the Electrochemical Society, 164(2): 17-22.
YANG J, PANG Y, HUANG W, et al. 2017. Functionalized Graphene Enables Highly Efficient Solar Thermal Steam Generation [J]. ACS nano, 11(6): 5510-5518.
YANG K, CHEN B, ZHU X, et al. 2016. Aggregation, Adsorption, and Morphological Transformation of Graphene Oxide in Aqueous Solutions Containing Different Metal Cations [J]. Environmental Science & Technology, 50(20): 11066-11075.
YOUSEFI M, DADASHPOUR M, HEJAZI M, et al. 2017. Anti-bacterial activity of graphene oxide as a new weapon nanomaterial to combat multidrug-resistance bacteria [J]. Materials Science and Engineering:C, 74: 568-581.
YU S, YANG G, LU K, et al. 2016. Colloidal properties and stability of aqueous suspensions of few-layer graphene: Importance of graphene concentration [J]. Environmental Pollution, 220: 469-477.
ZHANG M, GAO B, CHEN J, et al. 2015. Effects of graphene on seed germination and seedling growth [J]. Journal of Nanoparticle Research, 17(2): 1-8.
ZHAO F J, ZHAO F J, MA J F, et al. 2009. Arsenic uptake and metabolism in plants [J]. New Phytologist, 181(4): 777-794.
ZHAO J, CAO X, WANG Z, et al. 2017. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae [J]. Water research, 111: 18-27.
ZHAO Y, LI X, ZHOU X, et al. 2016. Review on the graphene based optical fiber chemical and biological sensors [J]. Sensors and Actuators B: Chemical, 231: 324-340.
ZHAO Y, WU Q, WANG D. 2016. An epigenetic signal encoded protection mechanism is activated by graphene oxide to inhibit its induced reproductive toxicity in Caenorhabditis elegans [J]. Biomaterials, 79:15-24.
ZOU X, ZHANG L, WANG Z, et al. 2016. Mechanisms of the antimicrobial activities of graphene materials [J]. Journal of the American Chemical Society, 138(7): 2064-2077.
常海伟, 任文杰, 刘鸿雁, 等. 2015. 磺化石墨烯对小麦幼苗生长及生理生化指标的影响[J]. 生态毒理学报, 10(4): 123-128.
李丽娜, 滕应, 任文杰, 等. 2016. 石墨烯施用后对土壤酶活性及土壤微生物群落的影响[J]. 土壤, 48(1): 102-108.
吕小慧, 陈白杨, 朱小山. 2016. 氧化石墨烯的水环境行为及其生物毒性[J]. 中国环境科学, 36(11): 3348-3359.
任朝秀. 2016. 痕量氧化石墨烯对斑马鱼神经功能障碍的诱导及其子代效应[D]. 天津: 南开大学: 1-15.
任文杰, 滕应. 2014. 石墨烯的环境行为及其对环境中污染物迁移归趋的影响[J]. 应用生态学报, 25(9): 2723-2732.
张颖, 安文珍, 李康, 等. 2017氧化石墨烯对大鼠角膜上皮细胞的致损伤作用[J]. 眼科新进展, 37(1): 1-4.
赵香琴. 2013. 氧化石墨烯对 SD大鼠神经系统毒性的体内外研究[D].重庆: 重庆医科大学: 12-22.
赵云利. 2015. 氧化石墨烯致秀丽线虫毒效应分子机制及预防策略研究[D]. 南京: 东南大学: 1-15.
Research Progress in Environmental Behavior and Toxicity of Graphene Oxide
HU Junjie, LAO Zhilang, WU Kangming, FAN Hongbo*
The School of Environment and Civil Engineering, Dongguan University of Technology, Dongguan 532808, China
Because of excellent optical, mechanical and electrical properties, graphene oxide (GO) nanoparticle is widely used in the area of sensors, aerospace, new energy and disease diagnosis. With the increasing amount of graphene usage, the environmental health risks of GO are becoming more and more concerned. Therefore, clarify the environmental behavior and ecological effect of GO is the key to evaluate the ecological potential risk and understand its bio-safety. This paper reviewed the progress of the occurrence and migration characteristic of GO in different environmental matrix, and the toxic effects and related potential mechanism of GO on aquatic organism, terrestrial plants, rats and microorganisms found in recent years were also summarized. GO mainly forms stable colloids in water and shown resistance to biodegradation and easy migration among multi-mediums. Moreover,GO could enter into the cells of alga, fish, plant, rat and microorganism and had the characteristics of difficult degradation and easy multi-mediums migration. GO also could enter the algae, fish, plants, rats, and microbial cells and causd oxidative stress reactions leading to inflammation and damage of the various organelles and organization and further causd abnormal of organs. In addition,GO could also lead to genetic toxicity, such as DNA oxidative damage and DNA breakage, and also abnormal expression of microRNA which related to reproductive toxicity. Therefore, it is of great significance to study the environmental behavior and toxicity of GO in different environmental media. In the future, quantitative analysis of GO nanoparticle exposure, interaction between oxidized graphene and biological macromolecules and long-term low doses effects of GO exposure should be further studied. In this paper, the environmental behavior and toxicity effects of GO are reviewed and it can provide a theoretical reference for further elucidating the health risks of GO.
graphene oxide (GO); environmental behavior; ecotoxicity; toxic mechanism
10.16258/j.cnki.1674-5906.2017.12.023
X171.5
A
1674-5906(2017)12-2169-08
胡俊杰, 劳志朗, 吴康铭, 范洪波. 2017. 氧化石墨烯的环境行为和毒性效应研究进展[J]. 生态环境学报, 26(12):2169-2176.
HU Junjie, LAO Zhilang, WU Kangming, FAN Hongbo. 2017. Research progress in environmental behavior and toxicity of graphene oxide [J]. Ecology and Environmental Sciences, 26(12): 2169-2176.
国家自然科学基金(NSFC-81273127);东莞理工学院高层次人才科研启动经费(GC200109-17)
胡俊杰(1984年生),男,讲师,博士,研究方向为污染物的环境行为与健康效应。E-mail: hujunjie022@126.com
*通信作者:范洪波(1964年生),男,教授,博士,研究方向为储能材料及节能环保技术。
2017-09-27

