TPS1新辅助化疗对局部晚期鼻咽癌的疗效观察
韩亚骞 何 倩 刘 林 刘 峰 张 琳 罗 乐 马宏志 李 云 席许平 肖 锋 吴湘玮 王 晖
TPS1新辅助化疗对局部晚期鼻咽癌的疗效观察
韩亚骞 何 倩 刘 林 刘 峰 张 琳 罗 乐 马宏志 李 云 席许平 肖 锋 吴湘玮 王 晖
目的研究局部晚期鼻咽癌使用TPS1新辅助化疗的ORR及不良反应,探讨TPS1替代TPF新辅助化疗的可能性。方法对29例局部晚期鼻咽癌,使用TPS1新辅助化疗2个周期后行同步放化疗。结果TPS1新辅助化疗后BMI(体重指数)变化中位数0.34(0~1.1),总体放化疗后BMI(体重指数)变化中位数1.1(0.73~2.11)。新辅助化疗后鼻咽部即时疗效评价:CR 4例(13.8%),PR 24例(82.8%),SD 1例(3.4%),ORR 96.6%。总体放化疗后鼻咽部即时疗效评价:CR 22例(75.9%),PR 7例(24.1%),ORR 100.0%。TPS1新辅助化疗后全组无4级不良反应,罕见3级不良反应,大多为0~1级不良反应,2级反应主要为恶心(48.0%),呕吐(21.0%),白细胞减少(24.0%)和中性粒细胞减少(14.0%)。整体放化疗结束后全组无4级不良反应,少见3级不良反应(口腔黏膜炎除外)。主要急性毒副作用表现为血液毒性,放射性皮炎,口腔黏膜炎,口干,脱发和呕吐。结论对局部晚期鼻咽癌使用TPS1新辅助化疗有很好的近期疗效及较低的毒副反应,TPS1有替代TPF方案的可能。
TPS1;新辅助化疗;局部晚期;鼻咽癌;疗效
鼻咽癌在中国是常见肿瘤,绝大部分病例分布在亚洲东南部。治疗前鼻咽癌原发肿瘤的体积和临床分期是影响疗效和生存期的主要因素[1-2]。新辅助化疗具有减少肿瘤远处转移的潜在优势,并且可以在放疗前减少肿瘤体积,缩小肿瘤放疗的靶区,因而能够提高放疗的疗效,减少毒副作用[3]。
研究表明TPF新辅助化疗方案在PFS、OS上都优于传统的PF方案[4-5]。但是,TPF方案中5-Fu持续静滴需要使用外周静脉置入的中心静脉导管(PICC)插管,不仅使患者住院时间延长,还不宜在门诊放疗和基层医院中广泛推广,并且PICC插管在临床上也出现过局部皮疹及感染的案例。笔者使用TPS1方案对局部晚期鼻咽癌实施新辅助化疗的效果进行了研究。
1 资料与方法
1.1 入组条件
①经病理活检确诊为WHOⅡ、Ⅲ型非角化型癌;②Ⅲ、Ⅳa期(08分期)局部晚期鼻咽癌;③年龄≥16岁;④KPS≥70分;⑤无放化疗禁忌症;⑥胃部无活动性溃疡史;⑦肾功能正常。
1.2 一般资料
2015年12月至2016年5月共32例入组,有3例未能完成第1个周期TPS1化疗并更改方案出组。其中1例因第1个周期内出现2级疲劳及2级低血压要求更换方案出组,1例因出现3级皮疹出组,1例因出现3级白细胞和粒细胞减少出组。共29例局部晚期鼻咽癌完成治疗,其中男女比例为1.9∶1,中位年龄49岁(38~64岁),血浆EB病毒DNA定量检测阳性18例(62.1%),病理结果:非角化型癌未分化性23例(79%),非角化型癌分化性6例(21%);临床分期:Ⅲ期17例(58.6%),Ⅳa期12例(41.4%)。全组TNM分布情况见表1。
1.3 治疗方式
完善相关检查后行TPS1新辅助化疗2个周期(多西他赛60 mg/m2,d 1;顺铂60 mg/m2,d 1;S1 (替吉奥) 60 mg/m2,d 1~d 14,2次/d,口服),2个周期化疗后予以同步放化疗,放疗采用IMRT调强放疗,靶区命名及勾画按照鼻咽癌2010专家共识执行,处方剂量为PGTVnx:72 Gy/32 f,PGTVnd:70.4 Gy/32 f,PCTV1:64 Gy/32 f,PCTV2:57.6/32 f,PCTV3:50.4 Gy/28 f,同步化疗方案为单药DDP70 mg/m2,2~3个周期。
1.4 评价方法
TPS1新辅助化疗后和整体放化疗结束后,按照RECIST标准评价疗效,并分别使用CTCAE 3.0分级记录毒副作用。
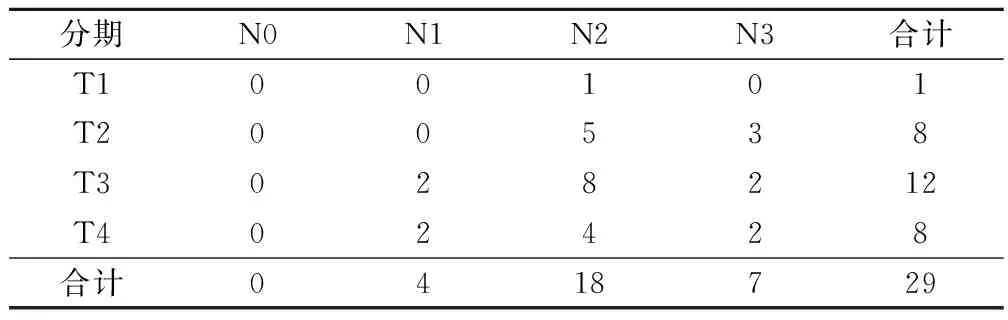
表1 全组T、N分布情况/例
2 结果
2.1 临床疗效
TPS1新辅助化疗后BMI(体重指数)变化中位数为0.34(0~1.1),总体放化疗后BMI(体重指数)变化中位数为1.1(0.73~2.11)。新辅助化疗后鼻咽部即时疗效评价:CR 4例(13.8%),PR 24例(82.8%),SD 1例(3.4%),ORR 96.6%。总体放化疗后鼻咽部即时疗效评价:CR 22例(75.9%),PR 7例(24.1%),ORR 100.0%。见表2。
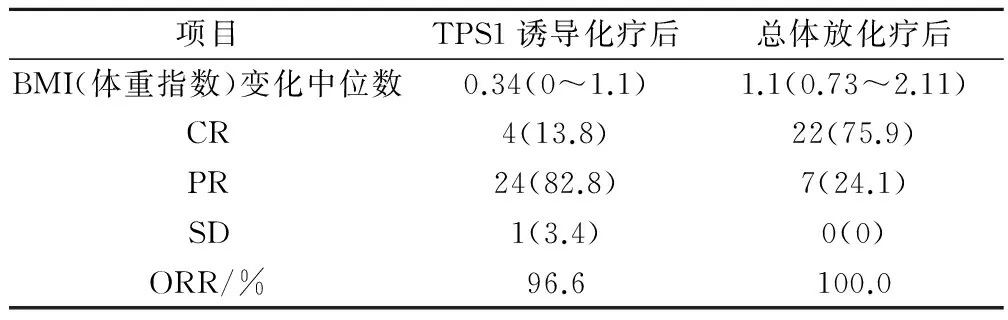
表2 TPS1诱导化疗后、总体放化疗后体重指数变化及鼻咽部即时疗效评价
2.2 TPS1新辅助化疗后不良反应
TPS1新辅助化疗后全组无4级不良反应,罕见3级不良反应。由表3可见,大多不良反应为0~1级,2级反应主要为恶心(48%),呕吐(21%),白细胞减少(24%)和中性粒细胞减少(14%)。
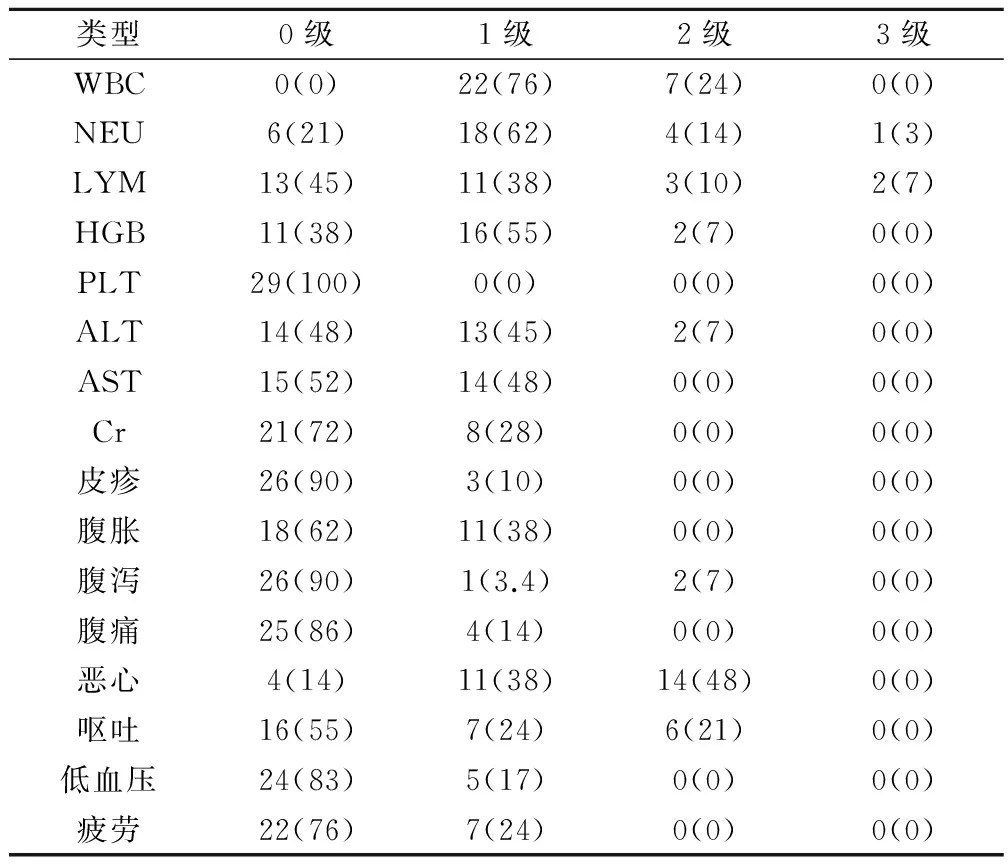
表3 TPS1新辅助化疗后不良反应情况(例,%)
2.3 整体放化疗综合治疗后不良反应
整体放化疗结束后全组无4级不良反应,少见3级不良反应(口腔黏膜炎除外)。主要毒副作用为血液毒性,放射性皮炎,口腔黏膜炎,口干,脱发和呕吐,见表4。

表4 整体放化疗后不良反应情况(例,%)
3 讨论
S1 (替吉奥)为替加氟与其它两种生化修饰剂吉美嘧啶(CDHP)、奥替拉西(OXO)按1∶0.4∶1(摩尔比)组成的复方制剂。其中替加氟为氟脲嘧啶(5-Fu)的前体药物,进入体内后通过肝脏P450酶转化为5-Fu后发挥抗癌作用,其他两种成分分别发挥增加替加氟疗效和降低毒性的作用。朱仲玲等[6]对S1进行了药动力学研究,发现口服S1后,5-Fu的半衰期延长至1.73 h,5-Fu作用时间显著延长,从而提高抗癌活性,而且多次给药后,替吉奥片主要成分的药代动力学行为没有发生明显变化。S1问世以来多用于胃肠道肿瘤,目前越来越多的研究支持S1在头颈部肿瘤的疗效。Tahara等[7]对40例局部晚期或复发/转移的头颈部癌采用TPS诱导化疗,分为6组,其中多西他赛3个剂量50,60,70 mg/m2),顺铂(70 mg/m2),S1 3个剂量(40,60,80 mg/m2/day),d 1~d 14,共3~4个周期,发现多西他赛70 mg/m2,顺铂70 mg/m2,S1 60 mg/m2/day共3周期的诱导化疗方案患者耐受性良好,缓解率达到70%。我们根据目前常用的TPF方案[8]更改为S1 60 mg/m2/d 1~d 14,2次/d,口服。另有部分学者使用S1联合DDP、S1联合NDP治疗头颈部癌,均显示出S1具有较低的毒副作用及较好的疗效[9-10]。
在鼻咽癌的治疗中S1的研究相对较少,多用于同步放化疗。杨洁等[11]对早期鼻咽癌予以S1同步放化疗并与单纯放疗对比,发现S1同步放化疗组的局控率优于单纯放疗组。李志义等[12]对局部晚期鼻咽癌予以S1同步放化疗对比单纯放疗,结果S1同步放化疗组PR率明显高于单纯放疗组,胃肠道反应及骨髓抑制均为Ⅰ~Ⅱ度,2年和3年生存率高于单纯放疗组,1,2,3年复发率均明显低于单纯放疗组。Peng等[13]对39例复发并转移的鼻咽癌行单纯S1化疗,中位周期4个周期(1~10个周期),CR1例(2.6%),PR12例(30.7%),SD16例(41%),PD10例(25.7%),中位OS为13.9个月。在复发并转移的鼻咽癌患者中,S1可以较好的控制肿瘤进展并保持较高的生活质量。
本研究中,在TPS1新辅助化疗期间出现了低血压的不良反应,这在其他文献中较少提及,初步分析其原因可能与联合用药相关。总之,本研究结果显示对局部晚期鼻咽癌使用TPS1新辅助化疗具有良好的疗效及较低的毒副反应,该方案在临床使用中极为方便。目前笔者正在开展TPS1与TPF这2种不同的新辅助化疗方案在局部晚期鼻咽癌的临床对照研究,进一步扩大样本量并进行随机分组,比较2组之间的毒性反应、客观缓解率、局控率,并行生存分析。笔者希望采用TPS1新辅助化疗能够取得和TPF方案相同的疗效和较低的毒副作用,以解决门诊放疗的新辅助化疗难题及基层医院开展多药联合化疗的问题,使该方案在局部晚期鼻咽癌的新辅助化疗方案中得以推广。
[1] Feng M,Wang W,Fan Z,et al.Tumor volume is an independent prognostic indicator of local control in nasopharyngeal carcinoma patients treated with intensity-modulated radiotherapy〔J〕.Radiat Oncol,2013,8(1):1-10.
[2] 赵 充,肖巍魏,韩 非,等.419例鼻咽癌患者调强放疗疗效和影响〔J〕.中华放射肿瘤学杂志,2010,19(3):191-196.
[3] Lee NY,Le QT.New developments in radiation therapy for head and neck cancer:intensity-modulated radiation therapy and hypoxia targeting〔J〕.Semin Oncol,2008,35(3):236-250.
[4] Posner MR,M.D,Hershock DM,et al.Cisplatin and Fluorouracil Alone or with Docetaxel in Head and Neck Cancer〔J〕.New England Journal of Medicine,2007,357(17):1705-1715.
[5] Vermorken JB,Remenar E,Van HC,et al.Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer〔J〕.N Engl J Med,2007,357(17):1695-1704.
[6] 朱仲玲,薛津怀,阎 昭,等.肿瘤患者单次和多次口服替吉奥片的药动学研究〔J〕.中国肿瘤临床,2011,38(10):594-597.
[7] Tahara M,Araki K,Okano S,et al.Phase I trial of combination chemotherapy with docetaxel,cisplatin and S-1 (TPS) in patients with locally advanced or recurrent/metastatic head and neck cancer〔J〕.Ann Oncol,2011,22(1):S148.
[8] 郭 灵,林焕新,徐 敏,等.TPF诱导化疗治疗局部晚期鼻咽癌的Ⅰ期临床研究〔J〕.癌症,2010,29(2):143-147.
[9] Nakamura K,Tahara M,Kiyota N,et al.Phase II Trial of Concurrent Chemoradiotherapy with S-1 Plus Cisplatin in Patients with Unresectable Locally Advanced Squamous Cell Carcinoma of the Head and Neck:Japan Clinical Oncology Group Study (JCOG0706)〔J〕.Jpn J Clin Oncol,2009,39(7):460-463.
[10] Ohashi T,Ohnishi M,Tanahashi S,et al.Efficacy and Toxicity of Concurrent Chemoradiotherapy with Nedaplatin and S-1 for Head and Neck Cancer〔J〕.Jpn J Clin Oncol,2011,41(3):348-352.
[11] 杨 洁,李晓江,任艳鑫,等.替吉奥联合根治性放疗与根治性放疗治疗早期鼻咽癌的比较〔J〕.昆明医科大学学报,2012,33(10):93-96.
[12] 李志义,沙 丹,刘双霞,韩月臣.局部晚期鼻咽癌替吉奥化疗同步放疗临床观察〔J〕.中华肿瘤防治杂志,2013,20(23):1825-1827.
[13] Peng PJ,Cheng H,Ou XQ,et al.Safety and efficacy of S-1 chemotherapy in recurrent and metastatic nasopharyngeal carcinoma patients after failure of platinum-based chemotherapy:multi-institutional retrospective analysis〔J〕.Drug Des Devel Ther,2014,8:1083-1087.
ClinicalObservationofTPS1NeoadjuvantChemotherapyforPatientswithLocallyAdvancedNasopharyngealCarcinoma
HANYaqian,HEQian,LIULin,etal.
HunanCancerHospital,Changsha,410013
ObjectiveTo investigate the ORR and toxicity of TPS1 neoadjuvant chemotherapy for locally advanced nasopharyngeal carcinoma,and to explore the possibility of replacing TPF with TPS1.Methods29 patients with locally advanced nasopharyngeal carcinoma were treated with TPS1 neoadjuvant chemotherapy for 2 cycles followed by concurrent chemoradiotherapy.ResultsThe median change of BMI (body mass index) after neoadjuvant chemotherapy with TPS1 was 0.34 (0~1.1),the median change of BMI was 1.1 (0.73~2.11) after overall treatment.Immediate effect of nasopharyngeal region after TPS1 neoadjuvant chemotherapy,the CR,PR,SD and ORR were 13.8%,82.8%,3.4% and 96.6%,respectively.Immediate effect of nasopharyngeal region after overall treatment,the CR,PR and ORR were 75.9%,24.1% and 100.0%,respectively.After TPS1 neoadjuvant chemotherapy,the maximum toxxicity were no grade 4 toxicities,grade 3 rarely,mostly concentrated in grade 0~1,2 grade mainly concentrated in nausea (48.0%) and vomiting (21.0%),leukopenia (24.0%) and neutropenia (14.0%).After Overall treatment,the maximum toxicity were no grade 4 toxicities,rare grade 3 (except for oral mucosal inflammation).The main acute toxicity was mainly hematological toxicity,radiation dermatitis,oral mucositis,dry mouth,vomiting and hair loss.Conclusion
TPS1 neoadjuvant chemotherapy for locally advanced nasopharyngeal carcinoma achieved good treatment response with low toxicity,and the TPS1 has the potential to replace the TPF regimen.
TPS1;Neoadjuvant chemotherapy;Locally advanced;Nasopharyngeal carcinoma
(ThePracticalJournalofCancer,2017,32:1791~1793)
湖南省自然科学基金项目(编号:2016JJ4059);肿瘤放射治疗转化医学湖南省重点实验室项目(编号:2015TP1009)
410013 湖南省肿瘤医院
10.3969/j.issn.1001-5930.2017.11.015
R739.63
A
1001-5930(2017)11-1791-03
2016-09-23
2017-06-10)
(编辑:吴小红)

