靶向抑制胃癌细胞中TROP2基因的表达对胃癌细胞增殖及凋亡的影响研究
罗文杰, 刘明华
1.雅安市人民医院消化内科,四川 雅安 625000; 2.西南医科大学药理学教研室
靶向抑制胃癌细胞中TROP2基因的表达对胃癌细胞增殖及凋亡的影响研究
罗文杰1, 刘明华2
1.雅安市人民医院消化内科,四川 雅安 625000; 2.西南医科大学药理学教研室
目的探讨RNA干扰肿瘤相关钙信号传导因子2(TROP2)基因的表达对胃癌细胞增殖及凋亡的影响及机制。方法以人胃黏膜正常细胞GES-1作为对照,RT-PCR检测人胃癌SGC-7901、MNK-28、BGC-823细胞中TROP2 mRNA表达;TROP2 siRNA、Control siRNA转染SGC-7901细胞,不作任何处理的细胞作为空白对照组,48 h后Western blotting检测TROP2、Ki67、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达;CCK8实验和流式细胞仪分别检测细胞的增殖及凋亡情况。结果TROP2 mRNA在人胃癌SGC-7901、MNK-28、BGC-823细胞表达均显著高于GES-1细胞(P<0.01),TROP2基因在SGC-7901细胞中的表达最高,选择作为后续的研究对象;转染TROP2 siRNA后TROP2蛋白表达显著降低(P<0.01);与对照组及Control-siRNA组比较,TROP2-siRNA组细胞存活率及Ki67、β-catenin、Cyclin D1蛋白表达显著降低,细胞凋亡率及Cleaved caspase3蛋白表达显著升高(P<0.01)。结论RNA干扰抑制TROP2基因的表达可降低胃癌细胞的增殖及诱导细胞凋亡,其机制是下调Wnt/β-catenin信号通路。
胃癌;TROP2基因;增殖;凋亡;Wnt/β-catenin信号通路
胃癌是最常见的消化道肿瘤,其发病率和死亡率在世界范围内分别位居第4位和第2位,其发生及发展是一个多因素、多步骤的复杂过程,包括抑癌基因的失活、癌基因的激活等[1]。肿瘤的基因治疗作为一种特异性强、高效的治疗方法已受到广泛关注。研究[2-4]显示,肿瘤相关钙信号传导因子2(tumor-associated calcium signal transducer 2,TROP2)又称为EGP-1、TACSTD2、GA733-1,在正常组织中不表达或低表达,而在肺癌、乳腺癌、宫颈癌等肿瘤中高表达,是一种原癌基因,其表达影响肿瘤的侵袭能力及预后。TROP2基因对胃癌细胞增殖凋亡的影响及机制的研究尚不明确。RNA干扰(RNA interference,RNAi)是由双链RNA介导的能使基因在转录后发生沉默的现象,具有高度的特异性和有效性,是研究基因功能有效的途径[5]。本研究利用RNAi技术沉默胃癌细胞中TROP2基因表达,观察细胞的增殖及凋亡情况,并进一步探讨其作用机制,为寻找胃癌基因靶向治疗新靶点提供理论依据。
1 材料与方法
1.1细胞人胃黏膜正常细胞GES-1及人胃癌SGC-7901、MNK-28、BGC-823细胞均由中国科学院细胞库提供。
1.2主要试剂和仪器胎牛血清、胰蛋白酶、青链霉素、RPMI 1640培养基均购自美国Gibco公司;荧光定量试剂盒及反转录试剂盒购自日本Takala公司;CCK8细胞增殖试剂盒、BCA试剂盒、Annexin V-FITC凋亡试剂盒均购自碧云天生物技术研究所;siRNA购自美国Santa Cruz公司;TROP2、Ki67、Cleaved caspase3、β-catenin、Cyclin D1抗体购自美国Abcam公司;倒置显微镜购自日本OLYMPUS公司;流式细胞仪购自美国Becton Dickinson公司;酶标仪、电泳凝胶图像分析系统、聚丙烯酰胺凝胶电泳仪均购自Bio-Rad公司;CO2细胞培养箱购自美国西盟公司。
1.3细胞培养取出保存在液氮罐中的人胃黏膜正常细胞GES-1及人胃癌SGC-7901、MNK-28、BGC-823细胞,即刻置于37 ℃的水浴锅中解冻,细胞解冻期间轻轻摇动冻存管,使其在1~2 min内溶解,溶解后的细胞置于37 ℃、体积分数为5%的CO2、95%饱和湿度的恒温孵育箱中,用RPMI 1640细胞培养液培养(含有质量浓度为100 g/L的胎牛血清、100 mg/L的青霉素和100 mg/L的链霉素)。细胞生长密度为80%~90%时,用质量浓度为2.5 g/L的胰蛋白酶消化细胞,用完全培养基终止消化,根据实验需要传代,取生长至对数期的细胞用于实验研究。
1.4各个胃癌细胞株中TROP2基因的mRNA表达检测Trizol法提取人胃黏膜正常细胞GES-1及人胃癌SGC-7901、MNK-28、BGC-823细胞中的总RNA,紫外分光光度计检测RNA的浓度,OD260/OD280在1.8~2.0被认为是质量好的RNA,根据逆转录试剂盒操作说明将总RNA反转录为cDNA,利用Primer premier 6.0软件设计目的基因TROP2及内参基因GAPDH的RT-PCR引物。引物序列如下:TROP2引物序列:上游引物:5′-CCTCATCGCCGTCATCGT-3′,下游引物:5′-CGGTTCCTTTCTCAACTCCC-3′。GAPDH引物序列:上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物:5′- GAAGATGGTGATGGGATTTC-3′。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s;60 ℃ 15 s,72 ℃ 20 s,以上共40个循环。72 ℃延伸15 min,4 ℃保存。每个样品设置6个重复孔,利用2-△△Ct法计算TROP2 mRNA相对表达量。2-△△Ct=基因相对表达,△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
1.5TROP2siRNA转染SGC-7901细胞将生长至对数期的SGC-7901细胞以5×105ml-1接种于6孔细胞培养板中,细胞生长融合度80%以上时进行转染。转染分为三组,即转染TROP2的靶向siRNA序列组(TROP2-siRNA组)、阴性对照siRNA组(Control-siRNA组)、未做任何处理的空白对照组。整个转染过程严格按照美国Invitrogen 公司LipofectamineTM2000转染说明进行操作。
1.6转染TROP2siRNA后的SGC-7901细胞中TROP2的蛋白表达检测上述转染后的三组细胞培养48 h后,收集细胞,加入RAPI细胞裂解液置于冰上反应30 min,4 ℃,12 000 r/min离心15 min,收集蛋白。取少量蛋白样品利用BCA试剂盒测定蛋白的浓度,总蛋白30 μg的量在上样缓冲Buffer中煮沸变性10 min,置于质量浓度为120 g/L的聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,电泳结束后半干法PVDF转膜,质量浓度为50 g/L的脱脂奶粉TBST溶液中室温封底90 min,孵育1∶400稀释的TROP2和1∶1 000稀释的GAPDH一抗,4 ℃过夜后用TBST洗涤3次,每次10 min,随后加入二抗反应90 min,37 ℃孵育2 h。TBST清洗后化学发光增强剂(ECL)显色、显影、定影。以GAPDH作为内参,分析TROP2的蛋白表达水平。
1.7CCK8检测细胞增殖取转染后的上述三组细胞,以1×104ml-1接种于96孔细胞培养板中,每组设置6个复孔,置于37 ℃、体积分数为5%的CO2培养箱中培养48 h,收集细胞。每孔细胞中加入10 μl的CCK8试剂,37 ℃孵育4 h。酶标仪测定各孔吸光度前用空白对照孔调零,调零完成后在570 nm波长处测定吸光度A。实验重复3次。计算细胞增殖率。细胞增殖率(%)=(转染组细胞A/对照组细胞A)×100%。
1.8流式细胞仪检测细胞凋亡收集转染48 h的上述三组细胞,加入预冷的PBS洗涤细胞2次,结合缓冲液重悬细胞,制成单细胞悬液,并调整细胞浓度为1×106ml-1。流式管中加入100 μl的细胞悬液,再分别加入 5 μl的Annexin V-FITC及PI 10 μl,室温避光孵育15 min,加入400 μl的PBS于反应管中。1 h内上流式细胞仪,检测细胞的凋亡情况。
1.9Westernblotting检测Ki67、Cleavedcaspase3、β-catenin、CyclinD1蛋白表达收集转染48 h的上述三组细胞,提取细胞中的蛋白,按照1.6方法检测Ki67、Cleaved caspase3、β-catenin、Cyclin D1蛋白表达情况。
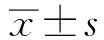
2 结果
2.1TROP2基因在胃癌细胞中的表达以人胃黏膜正常细胞GES-1作为对照组,RT-PCR检测人胃癌SGC-7901、MNK-28、BGC-823细胞中TROP2 mRNA表达,结果显示,TROP2 mRNA在人胃癌SGC-7901、MNK-28、BGC-823细胞中表达均显著高于GES-1(P<0.01)(见图1)。TROP2基因在SGC-7901细胞中的表达最高,选择作为后续的研究对象。
2.2转染TROP2-siRNA的SGC-7901细胞中TROP2蛋白表达TROP2-siRNA转染SGC-7901细胞48 h后,Western blotting检测细胞中TROP2的蛋白表达,结果显示,Control-siRNA组细胞中TROP2蛋白表达与空白对照组比较,差异无统计学意义(P>0.05), TROP2-siRNA组细胞中TROP2的蛋白表达显著低于空白对照组(P<0.01)(见图2)。
注:与GES-1比较,**P<0.01。

注:与空白对照组比较,**P<0.01。
2.3转染TROP2-siRNA降低SGC-7901细胞增殖
TROP2-siRNA转染SGC-7901细胞48 h后,CCK8实验检测细胞的增殖情况,结果显示,与空白对照组及Control-siRNA组比较,TROP2-siRNA组细胞存活率显著降低(P<0.01)(见图3)。
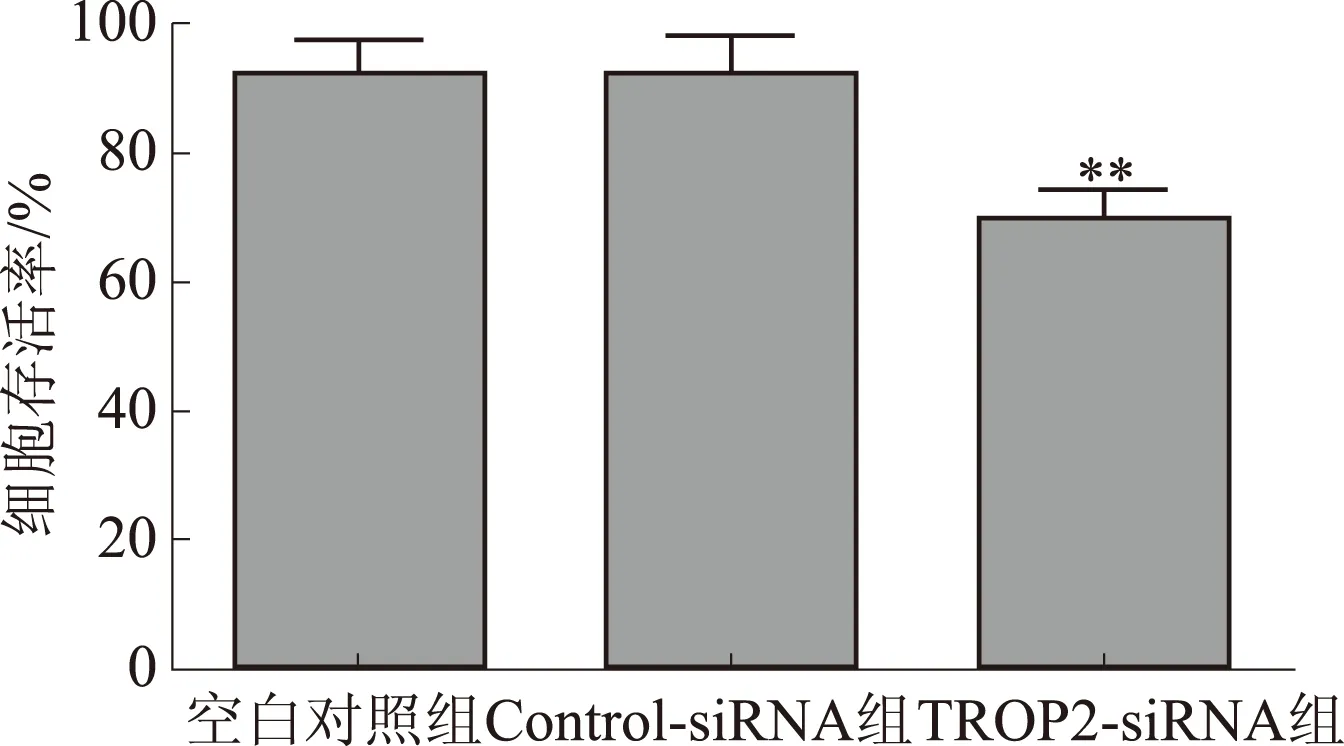
注:与空白对照组比较,**P<0.01。
2.4转染TROP2-siRNA促进SGC-7901细胞凋亡
TROP2-siRNA转染SGC-7901细胞48 h后,流式细胞仪检测各组细胞的凋亡情况,结果显示,与空白对照组及Control-siRNA组比较,TROP2-siRNA组细胞凋亡率显著升高(P<0.01)(见图4)。
2.5转染TROP2-siRNA对Ki67、Cleavedcaspase3、β-catenin、CyclinD1蛋白表达的影响TROP2-siRNA转染SGC-7901细胞48 h后,Western blotting检测增殖相关蛋白Ki67、凋亡相关蛋白Cleaved caspase3、Wnt/β-catenin信号通路相关蛋白β-catenin和Cyclin D1的蛋白表达,结果显示,与空白对照组及Control-siRNA组比较,TROP2-siRNA组Ki67、β-catenin、Cyclin D1蛋白表达显著下调,Cleaved caspase3蛋白表达显著上调(P<0.01)(见图5)。

注:与空白对照组比较,**P<0.01。

注:与空白对照组比较,**P<0.01。
3 讨论
肿瘤的发生是一个多阶段、多因素逐渐演进的过程,包括DNA损伤修复基因、抑癌基因、原癌基因等的表观遗传学改变或突变。已有研究[6]显示,表观遗传学修饰是影响癌症发生及发展的原因之一。TROP2由323个氨基酸组成,是一种单层的Ⅰ型跨膜磷酸化糖蛋白。近些年的研究[7-9]显示,在胃癌、胶质瘤等多种恶性肿瘤中有TROP2基因的高表达,而在正常组织中TROP2基因呈现低表达或不表达,其表达与肿瘤的侵袭和迁移及预后不良相关。研究[10]显示,TROP2基因在宫颈癌中高表达,其表达与淋巴结转移、临床分期、组织学分化程度、浸润深度密切相关;RNA干扰肺癌细胞中TROP2基因的表达可降低癌细胞的增殖及侵袭能力[11];胃癌细胞中抑制TROP2基因的表达降低细胞的侵袭及迁移能力[12]。但关于TROP2基因对胃癌细胞增殖及凋亡的影响及机制尚不明确。
本研究通过RNAi技术沉默胃癌细胞中TROP2基因的表达,研究细胞的增殖及凋亡情况,结果显示,细胞的增殖显著降低,凋亡显著增加。细胞增殖与凋亡的平衡是维持机体正常生长发育所必需,平衡被打破将导致肿瘤的发生。Ki67是一种与增殖细胞相关的核抗原,是目前公认的检测细胞增殖活性比较可靠、准确和理想的抗原,已在胃癌、乳腺癌等多种肿瘤的研究和探讨中广泛应用[13-14]。Caspase家族与细胞的凋亡密切相关,Caspase3是该家族的关键酶,也是凋亡过程中的效应蛋白,处在Caspase级联反应的下游,正常情况下无活性,受到凋亡刺激信号后被激活,其活化是凋亡进入不可逆阶段的标志[15-16]。本研究中沉默胃癌细胞TROP2基因的表达后检测Ki67及Cleaved caspase3蛋白的表达,结果显示,沉默TROP2基因的表达后Ki67蛋白表达显著下调,Cleaved caspase3蛋白表达显著上调。
Wnt信号通路是一条在进化上相对保守的信号传导途径,具有广泛的生物学效应, 参与细胞凋亡、分化、个体发育等过程,对大多数生命现象均有调控作用。Wnt/β-catenin信号通路是一条经典的Wnt信号通路,参与调控细胞增殖、分化、胚胎的正常发育等过程,是近年来的研究热点[17]。在多种肿瘤细胞中有Wnt/β-catenin信号通路的异常表达,如胃癌、肺癌等,其表达加速了肿瘤的进展。也有研究[18-20]显示,Wnt/β-catenin信号通路的表达抑制可降低肿瘤的发生、发展。β-catenin是Wnt/β-catenin信号通路的关键分子,可通过一系列过程激活Cyclin D1、c-myc等靶基因,从而调控细胞的生物学特性。本研究中沉默TROP2基因的表达后检测β-catenin、Cyclin D1蛋白表达,结果显示,β-catenin、Cyclin D1蛋白均显著下调表达。
综上所述,抑制胃癌细胞中TROP2基因的表达可降低癌细胞的增殖及诱导细胞的凋亡,其机制与下调Wnt/β-catenin信号通路有关。该研究为临床上胃癌的分子诊断及靶向治疗提供了理论基础。
[1] LI Z, LEI H, LUO M, et al. DNA methylation downregulated mir-10b acts as a tumor suppressor in gastric cancer [J]. Gastric Cancer, 2015, 18(1): 43-54.
[2] WANG X, LONG M, DONG K, et al. Chemotherapy agents-induced immunoresistance in lung cancer cells could be reversed by trop-2 inhibition in vitro and in vivo by interaction with MAPK signaling pathway [J]. Cancer Biol Ther, 2013, 14(12): 1123-1132.
[3] LIN H, ZHANG H, WANG J, et al. A novel human Fab antibody for Trop2 inhibits breast cancer growth in vitro and in vivo [J]. Int J Cancer, 2014, 134(5): 1239-1249.
[4] ZHANG L H, YANG G L, JIANG H F, et al. TROP2 is associated with the recurrence of patients with non-muscle invasive bladder cancer [J]. Int J Clin Exp Med, 2017, 10(1): 1643-1650.
[5] CASTEL S E, MARTIENSSEN R A. RNA interference in the nucleus: roles for small RNAs in transcription, epigenetics and beyond [J]. Nat Rev Genet, 2013, 14(2): 100-112.
[6] DING J, ZHANG Z M, XIA Y, et al. LSD1-mediated epigenetic modification contributes to proliferation and metastasis of colon cancer [J]. Br J Cancer, 2013, 109(4): 994-1003.
[7] CARDILLO T M, GOVINDAN S V, SHARKEY R M, et al. Sacituzumab govitecan (Immu-132), an anti-Trop-2/Sn-38 antibody-drug conjugate: characterization and efficacy in pancreatic, gastric, and other cancers [J]. Bioconjug Chem, 2015, 26(5): 919-931.
[8] NING S, LIANG N, LIU B, et al. TROP2 expression and its correlation with tumor proliferation and angiogenesis in human gliomas [J]. Neurol Sci, 2013, 34(10): 1745-1750.
[9] 常敏, 张久聪, 周琴, 等. 胃癌流行病学研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(9): 966-969.
CHANG M, ZHANG J C, ZHOU Q, et al. Research progress of clinical epidemiology of gastric cancer [J]. Chin J Gastroenterol Hepatol, 2017, 26(9): 966-969.
[10] WANG X D, WANG Q, CHEN X L, et al. Trop2 inhibition suppresses the proliferation and invasion of laryngeal carcinoma cells via the extracellular signal-regulated kinase/mitogen-activated protein kinase pathway [J]. Mol Med Rep, 2015, 12(1): 865-870.
[11] ZHENG Z, DONG X J. Clinical value of serum trophoblast cell surface protein 2 (TROP2) antibody in non-small-cell lung cancer patients [J]. Biomarkers, 2016, 21(8): 739-742.
[12] CHANG C H, WANG Y, ZALATH M, et al. Combining ABCG2 inhibitors with IMMU-132, an anti-Trop-2 antibody conjugate of SN-38, overcomes resistance to SN-38 in breast and gastric cancers [J]. Mol Cancer Ther, 2016, 15(8): 1910-1919.
[13] WU A, JIA Y, DONG B, et al. Apoptosis and KI 67 index correlate with preoperative chemotherapy efficacy and better predict the survival of gastric cancer patients with combined therapy [J]. Cancer Chemother Pharmacol, 2014, 73(5): 885-893.
[14] GANDINI S, GUERRIERI-GONZAGA A, PRUNERI G, et al. Association of molecular subtypes with Ki-67 changes in untreated breast cancer patients undergoing pre-surgical trials [J]. Ann Oncol, 2014, 25(3): 618-623.
[15] 韦家俊, 李浩, 廖小明, 等. 肢体缺血后处理对局灶性脑缺血再灌注大鼠 Caspase-3 和细胞凋亡的影响[J]. 中国老年学杂志, 2017, 37(4): 804-806.
[16] LU X, BOORA U, SEABRA L, et al. Knockdown of Slingshot 2 (SSH2) serine phosphatase induces Caspase3 activation in human carcinoma cell lines with the loss of the Birt-Hogg-Dubé tumour suppressor gene (FLCN) [J]. Oncogene, 2014, 33(8): 956-965.
[17] LIAN X, ZHANG J, AZARIN S M, et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions [J]. Nat Protoc, 2013, 8(1): 162-175.
[18] CONG N, DU P, ZHANG A, et al. Downregulated microRNA-200a promotes EMT and tumor growth through the wnt/β-catenin pathway by targeting the E-cadherin repressors ZEB1/ZEB2 in gastric adenocarcinoma [J]. Oncol Rep, 2013, 29(4): 1579-1587.
[19] LI L, WANG Q F, ZOU M L, et al. Overexpressed lncRNA ZEB1-AS1 promotes cell invasion and angiogenesis through Wnt/β-catenin signaling in non-small cell lung cancer [J]. Int J Clin Exp Pathol, 2017, 10(3): 3990-3997.
[20] AREND R C, LONDONO-JOSHI A I, SAMANT R S, et al. Inhibition of Wnt/β-catenin pathway by niclosamide: A therapeutic target for ovarian cancer [J]. Gynecol Oncol, 2014, 134(1): 112-120.
TheeffectoftargetinginhibitionofTROP2geneexpressionontheproliferationandapoptosisofgastriccancercells
LUO Wenjie1, LIU Minghua2
1.Department of Gastroenterology, Ya’an People’s Hospital, Ya’an 625000; 2.Department of Pharmacology, Southwest Medical University, China
ObjectiveTo investigate the effect and mechanism of RNA interference TROP2 on the proliferation and apoptosis of gastric cancer cell lines.MethodsWith human gastric mucosa normal GES-1 cells as control, the expression of TROP2 mRNA in human gastric cancer SGC-7901, MNK-28, BGC-823 cells was detected by RT-PCR; TROP2 siRNA, Control siRNA were transfected into SGC-7901 cells, and the cells without any treatment were as the control group, the expressions of TROP2, Ki67, Cleaved caspase3, β-catenin, Cyclin D1 protein after 48 hours were detected by Western blotting, CCK8 experiment and flow cytometry were used to detect the proliferation and apoptosis of cells.ResultsThe expression of TROP2 mRNA in human gastric cancer SGC-7901, MNK-28 and BGC-823 cells was significantly higher than that in GES-1 cells (P<0.01), the highest expression of TROP2 gene in SGC-7901 cells was selected as a follow-up study; the expression of TROP2 protein after TROP2 siRNA transfected was significantly decreased (P<0.01); compared with control group and Control-siRNA group, the cell survival rate and expressions of Ki67, β-catenin, Cyclin D1 protein in TROP2-siRNA group were significantly decreased, cell apoptosis rate and the expression of Cleaved caspase3 protein were significantly increased (P<0.01).ConclusionInhibition of TROP2 gene by RNA interference can decrease the proliferation and induce apoptosis of gastric cancer cells, the mechanism is to downregulate the Wnt/β-catenin signaling pathway.
Gastric cancer; TROP2 gene; Proliferation; Apoptosis; Wnt/β-catenin signaling pathway
罗文杰,硕士研究生,副主任医师,研究方向:胆胰疾病,尤其胰腺炎、胆道结石、胆道肿瘤的诊治。E-mail: 632352056@qq.com
10.3969/j.issn.1006-5709.2017.12.007
R735.2
A
1006-5709(2017)12-1345-05
2017-05-17
马 军)

