过表达N-cadherin基因慢病毒表达载体的构建及稳定细胞株的建立
李 想,秦雪柳,丁 梅,曲德伟
1.徐州医科大学,江苏 徐州 221000; 2.徐州医科大学神经生物实验室
过表达N-cadherin基因慢病毒表达载体的构建及稳定细胞株的建立
李 想1,秦雪柳1,丁 梅1,曲德伟2
1.徐州医科大学,江苏 徐州 221000; 2.徐州医科大学神经生物实验室
目的建立稳定过表达N-cadherin的人类胃癌MGC-803细胞系。方法从含有N-cadherin的质粒中利用PCR技术克隆N-cadherin基因编码序列。制备并浓缩慢病毒颗粒,将构建好的过表达N-cadherin慢病毒载体感染MGC-803细胞,并稳定遗传,嘌呤霉素筛选的阳性克隆传代培养5代后鉴定细胞内N-cadherin的表达。结果荧光显微镜下过表达N-cadherin组细胞有绿色荧光表达;PCR扩增得到含N-cadherin基因编码序列的特异性条带;重组的过表达N-cadherin载体中,过表达N-cadherin编码序列与目标序列几乎一致;Western blotting结果显示,在分子量为98 kD处有相应条带。结论成功建立稳定过表达N-cadherin的人类胃癌MGC-803细胞,此研究为进一步探讨N-cadherin基因的功能提供了良好的研究基础。
人类胃癌MGC-803细胞;N-cadherin;过表达
胃癌是人类常见的恶性肿瘤之一,据国际癌症研究中心(International Agency for Research on Cancer,IARC)公布的最新统计结果显示,胃癌是全世界第四大恶性肿瘤[1-2]。胃癌是最常见的消化道恶性肿瘤,治疗方法很多,但预后仍然不佳[2],在世界范围内,其致死率长期稳居癌症死因的前列[3]。由于中国人饮食复杂,胃癌发病率居各大肿瘤首位。随着医疗科技和诊疗技术的提高,胃癌死亡率呈下降趋势。但是每年仍有24万人左右死于胃癌[4-5]。尽管晚期或进展期胃癌已探索出很多治疗方法,但总体5年生存率仍不乐观,新的治疗方法效果也有待长期观察。神经型钙黏素(N-cadherin)是一种肿瘤进展的启动子[6]和生物标志物[7]。大部分钙黏蛋白成员是跨膜蛋白,N-端位于细胞外,C-端位于细胞内,胞外段由数目不等高度同源的结构单元组成,每个结构单元又由约110个氨基酸构成,在多数正常组织细胞中均有钙黏蛋白的表达,N-cadherin主要集中在神经元[8]。现在,它作为肿瘤治疗的靶点已经引起了相关科研工作者及药物研发人员的关注。鉴于此,本课题组旨在构建N-cadherin过表达,利用基因转染技术,建立N-cadherin过表达的胃癌细胞MGC-803,观察N-cadherin基因和蛋白表达变化,并探讨其可能作用的细胞信号通路,为临床靶向治疗胃癌提供一定的实验室依据。本研究成功构建N-cadherin过表达的慢病毒,并筛选出过表达N-cadherin基因的稳定MGC-803细胞株,为后续实验奠定基础。
1 材料与方法
1.1质粒、菌株、细胞株目的基因:N-cadherin,载体质粒为pCDH-CMV-MCS-EF1-GreenPuro-CD513B-1,由南京卓亿生物科技公司提供。人类胃癌MGC-803细胞由本实验室保存。RNA提取试剂盒、脂糖凝胶回收试剂盒、DNA Marker均购自徐州博立达生物科技有限公司。
1.2试剂1640培养基购自Keygentec公司,胎牛血清FBS购自四季青公司。胰蛋白酶、彩虹Marker购自Vicmed公司。细胞培养所用培养基为含质量浓度为100 g/L FBS的1640培养基,于37 ℃体积分数为5%的CO2培养箱中培养。BCA蛋白检测试剂盒、Western blotting试剂盒均购自Keygentec公司。N-cadherin抗体购自Proteintech公司。
1.3方法
1.3.1 N-cadherin过表达载体的构建:由南京卓亿生物科技公司包装构建过表达N-cadherin慢病毒质粒,从含有N-cadherin的质粒中利用PCR技术克隆N-cadherin基因编码序列。制备并浓缩慢病毒颗粒,将构建好的过表达N-cadherin的慢病毒转染MGC-803细胞(N-Cad组),并稳定遗传。
1.3.2 过表达N-cadherin MGC-803细胞株的感染及筛选:将MGC-803细胞用含质量浓度为100 g/L FBS的1640培养基进行培养,待细胞密度生长50%~60%时,加入携带N-cadherin基因的慢病毒转染,形成N-cadherin过表达的MGC-803细胞株。因为包装的病毒中含绿色荧光蛋白(GFP),所以在实验过程中,同样的实验条件下,我们同时包装了携带GFP基因的Control组,以此慢病毒来测定病毒的滴度,验证病毒感染成功与否。
1.3.3 RT-PCR检测N-cadherin mRNA的表达:收集细胞,以TRIzol试剂提取细胞总RNA,紫外分光光度计定量RNA,琼脂糖凝胶电泳验证RNA完整性。以基因特异性引物进行PCR扩增,以β-actin作为内参。N-cadherin引物序列:Forward:5′-ATGTGCCGGATAGCGGGA-3′;Reverse:5′-TCAGTCATCACCACCACCAT-3′。扩增片段长度为240 bp。PCR扩增产物电泳结果显示,PCR产物大小正确,无杂带说明无非特异性扩增。实验重复3次。反应条件:95 ℃变性3 min;95 ℃ 12 s,62 ℃ 40 s,共40个循环。实验重复3次。
1.3.4 蛋白免疫印迹法(Western blotting):用含有终浓度为1.5 μg/ml嘌呤霉素的培养基传代筛选能够稳定表达N-cadherin的细胞株,继续传代稳定细胞株,收集细胞,对照组的稳定细胞株处理好之后置于Odyssey仪器扫描观察结果。Western blotting方法检测过表达N-cadherin蛋白的表达。
1.4统计学分析采用SPSS 16.0统计软件进行分析,计数资料采用多因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1成功构建慢病毒pCDNA3.1Myc-HisA—N-cadherin质粒琼脂糖凝胶电泳鉴定 RT-PCR 结果,发现在约 3 000 bp处有明显的基因片段,将上述酶切鉴定正确的重组克隆进行测序验证,测序结果经 Blast 验证,发现基因克隆完全正确,无点突变和缺失(见图1)。
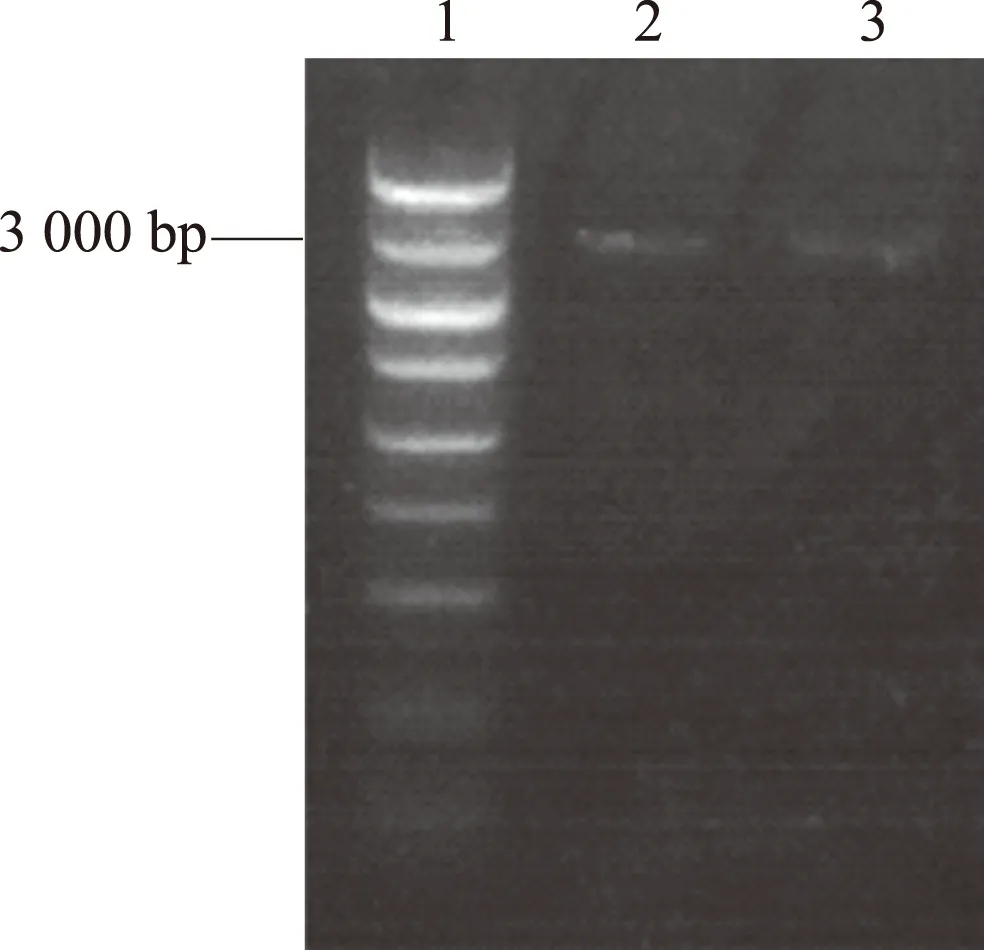
图1 琼脂糖凝胶电泳鉴定 RT-PCR 结果 1:Marker;2:PCR扩增产物;3:目的条带Fig 1 Identification of RT-PCR results by agarose gel electro-phoresis 1: Marker; 2: product amplified by PCR; C: target strip
2.2慢病毒过表达N-cadherin对靶细胞的感染及稳定细胞株的制备细胞转染48 h后,可见绿色荧光表达,感染72 h后,绿色荧光表达明显,细胞用含有嘌呤霉素的培养基传代培养,传代最初发现细胞死亡比较多,待传3代以后细胞几乎无死亡现象,表明剩余的细胞均是含有嘌呤抗性的细胞,稳定表达N-cadherin的MGC-803细胞株已经被成功筛选。结果显示,过表达N-cadherin组与Control组细胞均有绿色荧光表达(见图2)。
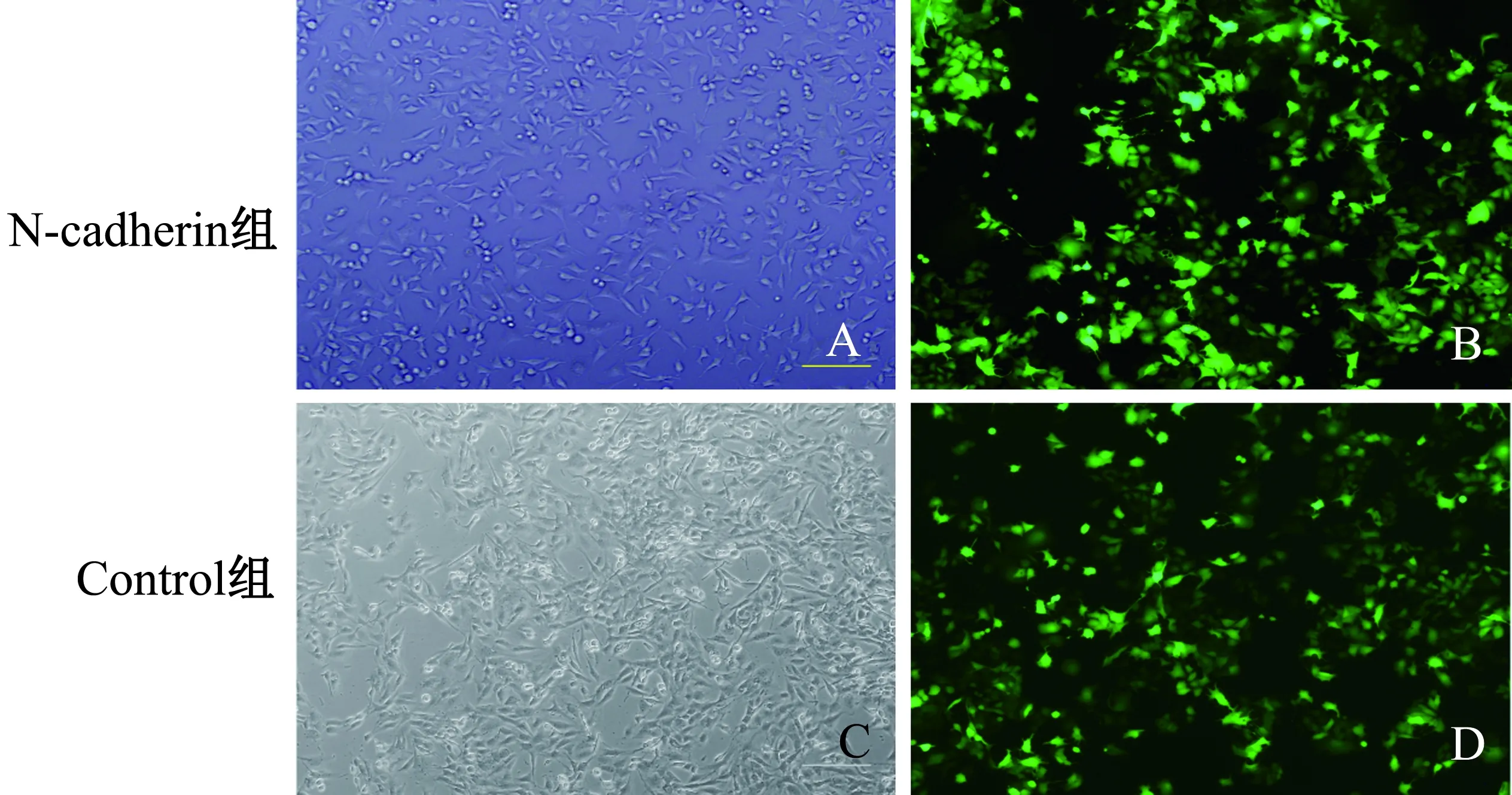
图2 通过荧光显微镜检测到72 h后,过表达N-cadherin组细胞与Control组慢病毒转染的荧光表达(100×)
Fig2ThefluorescenceexpressionoflentivirustransfectedwithN-cadheringroupandcontrolgroupdetectedbyfluores-
cencemicroscopyafter72hours
2.3RT-PCR检测N-cadherinmRNA的表达收集培养稳定的过表达N-cadherin基因的细胞、Control组及Mark组MGC-803细胞,RT-PCR结果鉴定N-cadherin mRNA的表达较高,过表达细胞株中的N-cadherin表达显著高于Control组。Mark组、Control组与过表达N-cadherin组比较,N-cadherin mRNA含量差异有统计学意义(P<0.05,见图3)。
2.4Westernblotting检测N-cadherin的表达成功包装制备慢病毒过表达N-cadherin细胞后,培养并提取细胞总蛋白,Western blotting结果显示,过表达N-cadherin组N-cadherin蛋白的表达显著高于Control组(见图4)。荧光与Western blotting结果显示,成功构建了过N-cadherin慢病毒表达载体。Mark组及Control组与过表达N-cadherin组比较,N-cadherin蛋白表达含量差异有统计学意义(P<0.05)。
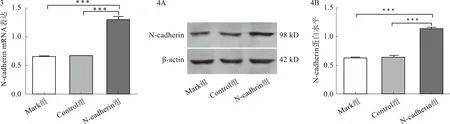
注:***P<0.05。 注:N-cadherin多克隆抗体为一抗,β-actin为内参。***P<0.05。图3 RT-PCR检测细胞中N-cadherin mRNA的表达; 图4 Western blotting检测各组细胞内N-cadherin的表达量Fig 3 Expression of N-cadherin mRNA in cells by RT-PCR; Fig 4 Expression of N-cadherin protein in each group detected by Western blotting
3 讨论
胃癌是严重危害人类健康的一种消化道常见恶性肿瘤,在世界范围内,其致死率长期稳居癌症死因的前列。N-cadherin最初被鉴定为神经组织内表达的细胞黏附分子,其在许多肿瘤如黑色素瘤、乳腺癌及前列腺癌等中的含量与成年正常组织相比明显增高。近来研究[8]发现,在某些肿瘤中如黑色素瘤、乳腺癌、前列腺癌、膀胱癌、胰腺癌、结肠癌及上皮鳞状细胞癌中常伴随着N-cadherin的表达上调,这种现象也被称为“钙黏蛋白转换”。在多种肿瘤中重新表达或上调表达,且与肿瘤侵袭性增强相关,引起了人们的关注。进一步研究[9-10]发现,N-cadherin蛋白过表达后可诱导肿瘤细胞移动,从而促进肿瘤细胞迁移和侵袭。高表达量的N-cadherin可以通过激活PI3K/Akt信号通路抑制肿瘤细胞的凋亡,促进肿瘤细胞的存活、浸润及转移。N-cadherin作为肿瘤治疗的靶点已经引起了相关科研工作者及药物研发人员的关注[11]。但N-cadherin在胃癌中是否表达及其作用机制目前尚不明确,因为目前国内外对N-cadherin与胃癌关系的研究较少。随着肿瘤的恶化程度增加,N-cadherin表达增强,这可能预示N-cadherin参与了肿瘤细胞的侵袭和增殖等活动,为了研究N-cadherin在胃癌分化中的作用,我们将包装好的慢病毒N-cadherin实现在MGC-803细胞内的过表达。本实验通过慢病毒介导的方法成功建立了过表达N-cadherin的MGC-803细胞,并能够稳定遗传。另一方面,也为研究MGC-803细胞在N-cadherin诱导下,为进一步完善后续实验提供了良好的平台,进一步探索N-cadherin在胃癌侵袭和转移过程中可能发挥的重要作用。此后,我们将通过慢病毒介导的方法建立干扰N-cadherin的MGC-803细胞,研究其在胃癌细胞中的影响和表达,为进一步探讨N-cadherin基因的功能提供了良好的研究基础,也为寻找可能存在的肿瘤治疗靶点和药物提供理论基础。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012 [J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[2] 蒋继文, 戎亚雄, 陈飞, 等. 影响胃癌患者预后的相关因素分析[J]. 江苏医药, 2014, 40(13): 1542-1545.
JIANG J W, RONG Y X, CHEN F, et al. An analysis of factors influencing prognosis of patients with gastric carcinoma [J]. Jiangsu Medical Journal, 2014, 40(13): 1542-1545.
[3] 孙秀娣, 牧人, 周有尚, 等. 中国胃癌死亡率20年变化情况分析及其发展趋势预测[J]. 中华肿瘤杂志, 2004, 26(1): 4-9.
SUN X D, MU R, ZHOU Y S, et al. Analysis of mortality rate of stomach cancer and its trend in twenty years in China [J]. Chin J Oncol, 2004, 26(1): 4-9.
[4] 陈万青, 张思维, 郑荣寿, 等. 中国肿瘤登记地区2007年肿瘤发病和死亡分析[J]. 中国肿瘤, 2011, 20(3): 162-169.
CHEN W Q, ZHANG S W, ZHENG R S, et al. A report of cancer incidence and mortality from 38 cancer registries in China, 2007 [J]. China Cancer, 2011, 20(3): 162-169.
[5] 郑荣寿, 张思维, 吴良有, 等. 中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2012, 21(1): 1-12.
ZHENG R S, ZHANG S W, WU L Y, et al. Report of incidence and mortality from China cancer registries in 2008 [J]. China Cancer, 2012, 21(1): 1-12.
[6] MOSNIER J F, KANDEL C, CAZALS-HATEM D, et al. N-cadherin serves as diagnostic biomarker in intrahepatic and perihilar cholangiocarcinomas [J]. Mod Pathol, 2009, 22(2): 182-190.
[7] CAVALLARO U. N-cadherin as an invasion promoter: a novel target for antitumor therapy? [J]. Curr Opin Investig Drugs, 2004, 5(12): 1274-1278.
[8] 占大钱. N-cadherin在肝癌侵袭转移中的作用及其机制研究[D]. 武汉: 华中科技大学, 2011.
ZHAN D Q. The role of N-cadherin in human hepatocellular carcinoma invasion and metastasis and its mechanism [D]. Wuhan: Huazhong University of Science and Technology, 2011.
[9] MRIOTTI A, PEROTTI A, SESSA C, et al. N-cadherin as a therapeutic target in cancer [J]. Expert Opin Investig Drugs, 2007, 16(4): 451-465.
[10] GIUSSANI P, BRIOSCHI L, BASSI R, et al. Phosphatidylinositol 3-kinase/AKT pathway regulates the endoplasmic reticulum to golgi traffic of ceramide in glioma cells: a link between lipid signaling pathways involved in the control of cell survival [J]. J Biol Chem, 2009, 284(8): 5088-5096.
[11] PEROTTI A, SESSA C, MANCUSO A, et al. Clinical and pharmacological phase I evaluation of Exherin (ADH-1), a selective anti-N-cadherin peptide in patients with N-cadherin-expressing solid tumours [J]. Ann Oncol, 2009, 20(4): 741-745.
OverexpressionofN-cadheringeneinlentiviralexpressionvectorandestablishmentofstablecelllines
LI Xiang1, QIN Xueliu1, DING Mei1, QU Dewei2
1.Xuzhou Medical University, Xuzhou 221000; 2.Laboratory of Neurobiology, Xuzhou Medical University, China
ObjectiveTo establish a stable human gastric cancer MGC-803 cell line overexpressing N-cadherin.MethodsN-cadherin gene coding sequences were cloned from plasmids containing N-cadherin by PCR. Lentiviral particles were preparated and concentrated, overexpression of N-cadherin lentiviral vectors transfected MGC-803 cells. The positive clones screened by puromycin were subcultured for 5 generations, the expression of N-cadherin in cells was identified.ResultsOverexpression of N-cadherin group under fluorescence microscope showed green fluorescence. Specific bands containing N-cadherin gene coding sequence were amplificated by PCR. In overexpression of recombinant N-cadherin, overexpression of N-cadherin coding sequence was almost coincident with the target sequence. Western blotting showed that the molecular weight was 98 kD with a corresponding strip.ConclusionStable overexpression of N-cadherin human gastric cancer MGC-803 cells are established successfully, this study provides a good basis for further research on the function of N-cadherin gene.
Human gastric cancer MGC-803 cells; N-cadherin; Overexpression
李想,硕士,研究方向:消化系统肿瘤的基础与临床研究。E-mail:464240796@qq.com
曲德伟,博士,副教授,硕士研究生导师。E-mail:1427429923@qq.com
10.3969/j.issn.1006-5709.2017.12.012
R735.2
A
1006-5709(2017)12-1370-03
2016-12-19
马 军)

