苷苔岩藻聚糖硫酸酯分离纯化及结构研究
张雪迪,宋悦凡,汪秋宽,何云海,刘舒,任丹丹,武龙,丛海花
苷苔岩藻聚糖硫酸酯分离纯化及结构研究
张雪迪,宋悦凡,汪秋宽,何云海,刘舒,任丹丹,武龙,丛海花
(大连海洋大学食品科学与工程学院,国家海藻加工技术研发分中心,辽宁水产品加工及综合利用重点实验室,辽宁 大连116023)
为探究苷苔Ecklonia cava岩藻聚糖硫酸酯粗品 (EC-FUC)的组成结构,以产自韩国济州岛海岸的苷苔Ecklonia cava中提取的EC-FUC为原料,利用DEAE-Sepharose fast flow阴离子交换层析和Sephacryl S-300、S-400凝胶柱层析对EC-FUC进行分离纯化及分子量的测定,采用苯酚-硫酸法和明胶-BaCl2法分别测定纯化各组分的总糖含量及硫酸根含量,采用高效液相色谱法、红外光谱法、核磁共振波谱法分别测定各个纯化组分的单糖组成并分析多糖结构。结果表明:EC-FUC纯化后得到ECF-1、ECF-2和ECF-3组分,其总糖含量分别为41.7%、57.79%、75.78%,硫酸根含量分别为3.68%、3.41%、18.03%,回收率分别为6.27%、8.77%、16.19%,其相对分子质量分别为16 430、16 430、222 460;ECF-1单糖组成主要为葡萄糖,ECF-2单糖组成主要为甘露糖醛酸、葡萄糖醛酸和岩藻糖,ECF-3单糖组成主要为岩藻糖和葡萄糖醛酸;红外光谱分析显示,ECF-1、ECF-2和ECF-3硫酸基主要连接在岩藻糖的C2、C3位置;13C核磁共振分析显示,ECF-2中存在甘露糖醛酸,ECF-3在17.97×10-6处出现α-L-吡喃岩藻糖C6信号峰。本研究结果可为苷苔藻聚糖硫酸酯组成结构提供丰富的信息。
苷苔;岩藻聚糖硫酸酯;分离纯化;结构分析
岩藻聚糖硫酸酯具有抗肿瘤、抗病毒、抗衰老、降血压、调节血脂、增强机体免疫力和体液免疫力等多种生物活性[1]。岩藻聚糖硫酸酯广泛存在于褐藻细胞壁基质中,其基本成分为L-岩藻糖和硫酸基团,另外还含有半乳糖、甘露糖、葡萄糖醛酸、葡萄糖、木糖、鼠李糖等。其结构复杂多样化,相对分子质量跨度范围较大,不同的褐藻种类、生长环境、生长季节等均会对岩藻聚糖硫酸酯的结构产生影响[2]。因此,探究不同褐藻中岩藻聚糖硫酸酯的结构组成和生理活性具有深远意义。
苷苔Ecklonia cava隶属于褐藻门、海带目、巨藻科、昆布属[3],主要生长于韩国济州岛沿岸潮下带区域,可作为传统食品及民间草药[4],每年的2月和5月为其收获期[5]。研究表明,苷苔岩藻聚糖硫酸酯单糖组成包含岩藻糖、半乳糖、甘露糖、葡萄糖和木糖等[6],其相对分子质量从几万至几十万不等,具有抗肿瘤、抗凝血[7]、抗氧化[8]、抗炎[5]等生物活性。Kang等[5]研究表明,苷苔岩藻聚糖硫酸酯通过抑制iNOS和COX-2的表达降低NO的生成,同时降低炎性细胞因子TNF-α、 IL-6、 IL-1的分泌, 以共同达到抗炎的作用。Wijesinghe等[7]研究表明,苷苔岩藻聚糖硫酸酯在体外试验中能够明显地延长活化部分凝血活酶时间 (APTT)、凝血酶时间 (TT)、凝血酶原时间 (PT),起到抗凝血作用。
目前,国外对苷苔多糖活性方面的研究较多[5-6,9],而对多糖的组成及结构分析较少。本研究中,以从国家海藻加工技术研发分中心提取的苷苔岩藻聚糖硫酸酯粗品 (EC-FUC)为原料,利用阴离子交换柱层析、凝胶柱层析法进行多糖的纯化工作,采用高效液相色谱法、红外光谱法、核磁共振波谱法进行多糖的结构探究,旨在丰富岩藻聚糖硫酸酯组成结构信息,为促进中国海藻多糖产业发展提供参考。
1 材料与方法
1.1 材料
试验用苷苔产自韩国济州岛海岸,苷苔岩藻聚糖硫酸酯粗品 (EC-FUC)由大连海洋大学国家海藻加工技术研发分中心提供;DEAE-Sepharose fast flow填料、Sephacryl S-300、S-400填料为 Pharmacia进口分装;葡聚糖标准品 (Dextran) (相对分子 质 量 11 000、 35 000、 45 000、 64 000、76 000、150 000)购自美国Sigma公司;蓝色葡聚糖 (Blue Dextran,type 2000)购自上海伯奥生物科技有限公司;单糖标准品 (岩藻糖、半乳糖、甘露糖、葡萄糖、木糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸)购自美国Sigma公司;乙腈、甲醇 (色谱纯)购自美国Muskegon公司;其余试剂均为国产分析纯。
主要仪器:SBS-100型数控计滴自动部分收集器 (上海沪西分析仪器厂)、721型紫外分光光度计 (上海光谱仪器有限公司)、ScientZ-30D型真空冷冻干燥机 (宁波新芝生物科技有限公司)、1260型高效液相色谱仪 (美国 Agilent公司)、Nicolet-470型红外光谱仪 (美国Nicolet公司)。
1.2 方法
1.2.1 EC-FUC的提取 准确称取粉末状苷苔样品,加入15倍体积的水混匀,通过复合酶解法提取EC-FUC,98℃下水浴3 h,冷却至室温,离心取上清液。经由四步醇沉法[10],制得EC-FUC。
1.2.2 DEAE-Sepharose fast flow阴离子交换柱分离纯化 称取0.4 g EC-FUC溶解于20 mL 0.02 mol/L的磷酸盐缓冲溶液 (pH 7.4)中,加载至DEAE-Sepharose fast flow阴离子交换柱 (300 mm×26 mm)进行粗多糖的分离纯化。利用0~2.5 mol/L的NaCl溶液进行梯度洗脱,洗脱流速为0.75 mL/min。利用自动部分收集器进行多糖收集,每管收集3 mL。通过苯酚-硫酸法监测每管中总糖含量,于490 nm波长处比色并绘制吸收曲线,多次收集并合并各个峰的多糖样品,透析、冷冻干燥、密封、避光保存。
1.2.3 总糖含量的测定 采用苯酚硫酸法[11-12],称取待测样品,用去离子水溶解配制成一定浓度的多糖溶液。配制L-岩藻糖和D-半乳糖 (3∶1)标准品溶液和葡萄糖标准品溶液,以标准品糖含量(mg)为横坐标,吸光值为纵坐标,通过苯酚硫酸法绘制L-岩藻糖和D-半乳糖 (3∶1)标准曲线和葡萄糖标准曲线。按照标准曲线的测定方法测定待测样品的吸光值,依据标准曲线计算样品中总糖含量。
1.2.4 硫酸根含量的测定 采用明胶 BaCl2法[11-12],称取待测样品,利用盐酸进行酸解,经活性炭脱色处理后收集滤液,调节pH,定容于50 mL容量瓶中。配制一定浓度的K2SO4标准溶液,绘制硫酸根标准曲线,按照标准曲线测定待测样品的吸光值,依据标准曲线计算样品中硫酸根含量。
1.2.5 岩藻聚糖硫酸酯纯度的测定 因岩藻聚糖硫酸酯单糖组成中的岩藻糖携带有一定质量的硫酸基团,故以总糖质量百分数与硫酸基质量百分数之和定义为岩藻聚糖硫酸酯纯度,其计算公式为
1.2.6 Sephacryl S-300、 S-400 凝胶柱层析分离纯化[11-12]装填 Sephacryl S-300、 S-400 凝胶柱(1.6 cm×100 cm), 用 15 mmol/L Tris-HCl缓冲溶液 (pH 7.4)平衡32 h。利用蓝葡聚糖 (相对分子质量为2 000 000)测定凝胶柱的外水体积,用相对分子质量为11 000、35 000、76 000的葡聚糖标准品绘制Sephacryl S-300 lgM-Kav分子量标准曲线;用相对分子质量为45 000、64 000、150 000的葡聚糖标准品绘制Sephacryl S-400 lgM-Kav分子量标准曲线。
称取20 mg经过DEAE-Sepharose fast flow分离纯化后的多糖组分,溶于1 mL 15 mmol/L的Tris-HCl缓冲溶液 (pH 7.4)中,分别加载于凝胶柱中进行分离纯化,根据标准曲线估算各纯化多糖组分的分子量。分配系数 (Kav)的计算公式为

其中:Ve为洗脱体积 (mL);Vo为外水体积(mL);Vt为总体积 (mL)。
1.2.7 用高效液相色谱法分析单糖组成 称取干燥至恒重的单糖标准品 (甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸)共20 mg,定容至10 mL。称取待测样品20 mg溶解于超纯水中,润涨过夜。利用三氟乙酸(TFA)溶液酸解,水解后的样品进行柱前1-苯基-3-甲基-5-吡唑啉酮 (PMP)衍生化反应,衍生化反应终止后利用三氯甲烷反复萃取,除去溶液中的有机相,将剩余的水相经过0.45 μm的水系膜过滤,进行高效液相色谱分析。
分析条件:色谱柱,Agilent ZORBAX Eclipse XDB C-18(5 μm, 4.6 mm×250 mm), 柱温 30℃;流动相 A,15%乙腈 (体积分数)+50 mmol/L磷酸盐缓冲溶液 (pH 6.0);流动相 B,40%乙腈+50 mmol/L磷酸盐缓冲溶液 (pH 6.0);时间设为0、10、55、65 min;对应的缓冲液浓度设为100%、85%、50%、100%;流速为1 mL/min,紫外检测波长为250 nm,进样体积为20 μL。
1.2.8 傅里叶红外光谱分析 取待测样品2 mg,加入适量干燥后的溴化钾反复研磨均匀,压制成透明均匀的薄片。利用Nicolet-Nexus 470傅里叶变换红外光谱仪,扫描400~4000 cm-1波长范围内的光谱吸收值。
1.2.913C核磁共振波谱分析 将纯化后的样品利用Bruker AVANCE III核磁共振波谱仪进行分析,在工作频率为500 MHz、温度为25℃的条件下,进行13C NMR核磁共振分析。
2 结果与分析
2.1 DEAE-Sepharose fast flow阴离子交换柱分离 EC-FUC
由DEAE-Sepharose fast flow阴离子交换柱分离EC-FUC的结果如图1所示,EC-FUC经纯化后得3个组分,分别命名为ECF-1、ECF-2、ECF-3。从图1可见:ECF-1为流出峰,ECF-2、ECF-3为盐梯度洗脱峰;ECF-1、ECF-2两个峰无拖尾现象,分离效果较好,ECF-3有拖尾现象发生。

图1 岩藻聚糖硫酸酯梯度洗脱曲线Fig.1 Gradient elution curve of fucoidan
ECF-1、 ECF-2、 ECF-3的组成特性如表1所示。ECF-1总糖含量通过葡萄糖标准曲线计算,ECF-2、ECF-3总糖含量通过L-岩藻糖和D-半乳糖标准曲线计算。从表1可见:纯化得到的ECF-1、ECF-2组分均为低硫组分,硫酸基含量分别为3.68%、3.41%,ECF-3中硫酸基含量最高,为18.03%;纯化组分ECF-3中总糖含量也最高,为75.78%,ECF-1中总糖含量最低,为41.7%。其中,ECF-3中总糖含量、硫酸基含量均较高,岩藻聚糖硫酸酯纯度为93.81%。

表1 各组分理化性质分析Tab.1 Physical and chemical properties of each fraction %
2.2 Sephacryl S-300、 S-400 凝胶柱层析
由DEAE-Sepharose fast flow阴离子交换柱分离的 ECF-1、 ECF-2、 ECF-3进一步由 Sephacryl S-300、S-400凝胶柱层析进行纯化。由于ECF-3经过Sephacryl S-300纯化后的洗脱体积与外水体积一致,根据其相对分子质量分布情况,通过Sephacryl S-400估算ECF-3的相对分子质量,通过 Sephacryl S-300估算 ECF-1、 ECF-2的相对分子质量,结果如图2所示。由图2-A、图2-B可见, ECF-1、 ECF-2经过 Sephacryl S-300分离纯化后均为单一峰,说明组成成分单一;由图2-C可见,ECF-3经过Sephacryl S-400分离纯化后峰形单一,说明分离纯化效果较好,相对分子质量组成单一。依据lgM-Kav葡聚糖相对分子质量标准曲线计算ECF-1、ECF-2和ECF-3各组分的相对分子质量分别为16 430、16 430、222 460。

图2 Sephacryl S-300、 S-400层析色谱图Fig.2 Elution of Sephacryl S-300 and S-400 column chromatography
2.3 单糖组成分析
标准品单糖液相色谱图如图3所示。EC-FUC经过分离纯化后进行高效液相色谱分析,结果如图4所示。从图4可见:ECF-1单糖组成主要为葡萄糖 (Glu),ECF-2单糖组成主要为甘露糖醛酸(Man-UA)、葡萄糖醛酸 (Glu-UA)和岩藻糖(Fuc),ECF-3单糖组成主要为岩藻糖 (Fuc)、葡萄糖醛酸 (Glu-UA)。从表2可见:ECF-1中葡萄糖 (Glu)含量高达84.69%,岩藻糖 (Fuc)含量较低,为2.61%,分析该组分为褐藻淀粉;ECF-2的高效液相色谱图中在甘露糖左侧附近出现强烈的吸收峰,估计为甘露糖醛酸所致[13],该组分结构复杂,有待进一步分析;ECF-3中岩藻糖(Fuc)、葡萄糖醛酸 (Glu-UA)、甘露糖 (Man)和半乳糖 (Gal)含量较高,分别为 37.47%、22.64%、14.14%和12.83%,该组分为富含岩藻糖的岩藻聚糖硫酸酯。

图3 标准品单糖液相色谱图Fig.3 High performance liquid chromatography(HPLC)of mixed standard of monosaccharides
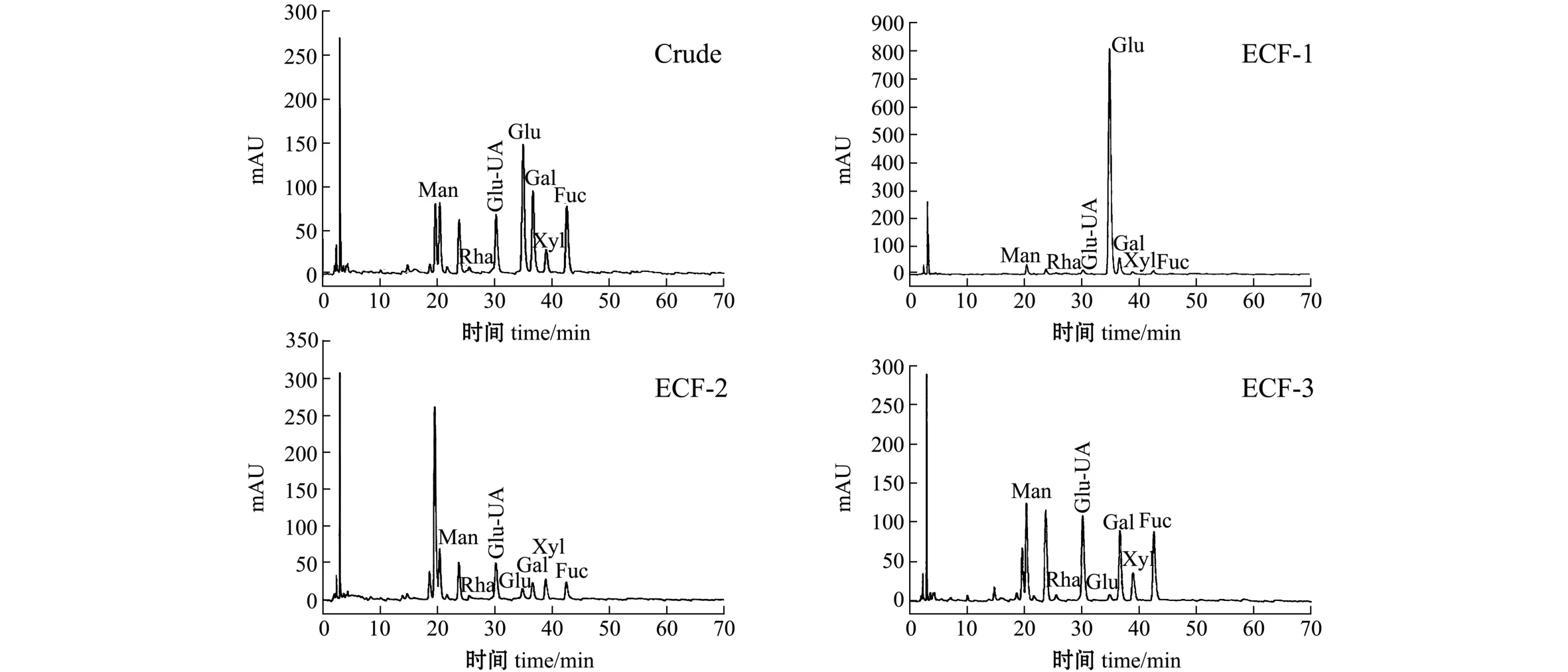
图4 ECF-1、 ECF-2、 ECF-3高效液相色谱图Fig.4 High performance liquid chromatography(HPLC)of fractions ECF-1, ECF-2 and ECF-3
2.4 红外光谱分析
经过纯化后对EC-FUC各组分进行红外光谱分析,结果如图5所示。ECF-1、ECF-2、ECF-3在3600~3300 cm-1处出现吸收峰,为O-H伸缩振动峰和糖类红外光谱的特征吸收峰。ECF-1、ECF-2、 ECF-3 分别在 2933 cm-1、 2935 cm-1和2942 cm-1附近出现吸收峰,为C-H伸缩振动峰和岩藻糖中甲基的特征吸收峰。ECF-2、ECF-3均在1610 cm-1和1417 cm-1附近出现明显的吸收峰,这是由于C=O非对称和对称伸缩振动引起的[2,14],说明ECF-2和ECF-3中均含有糖醛酸组分,与ECF-2、ECF-3单糖组成中含有葡萄糖醛酸一致,ECF-2相比ECF-3的吸收峰强烈,但葡萄糖醛酸含量低于ECF-3,说明EFC-2中不仅含有葡萄糖醛酸,还有其他糖醛酸存在。由于高效液相色谱无法分析甘露糖醛酸组分,因此,推断ECF-2高效液相色谱图甘露糖左侧的强烈吸收峰为甘露糖醛酸所致。 ECF-1、 ECF-2、 ECF-3均在 1072~1033 cm-1附近出现明显的吸收峰,为C-O的伸缩振动峰[15-16]。 ECF-3 在 1253 cm-1附近出现 S=O 强吸收峰。 ECF-1、 ECF-2、 ECF-3 均在 820 cm-1附近出现吸收峰,为C-O-S伸缩振动 (赤道配位),说明硫酸基连接在岩藻糖的C2、C3位置上,是平伏键上的硫酸根[2]。

表2 各组分单糖组成比例Tab.2 Composition ratios of neutral monosaccharide in each fraction %
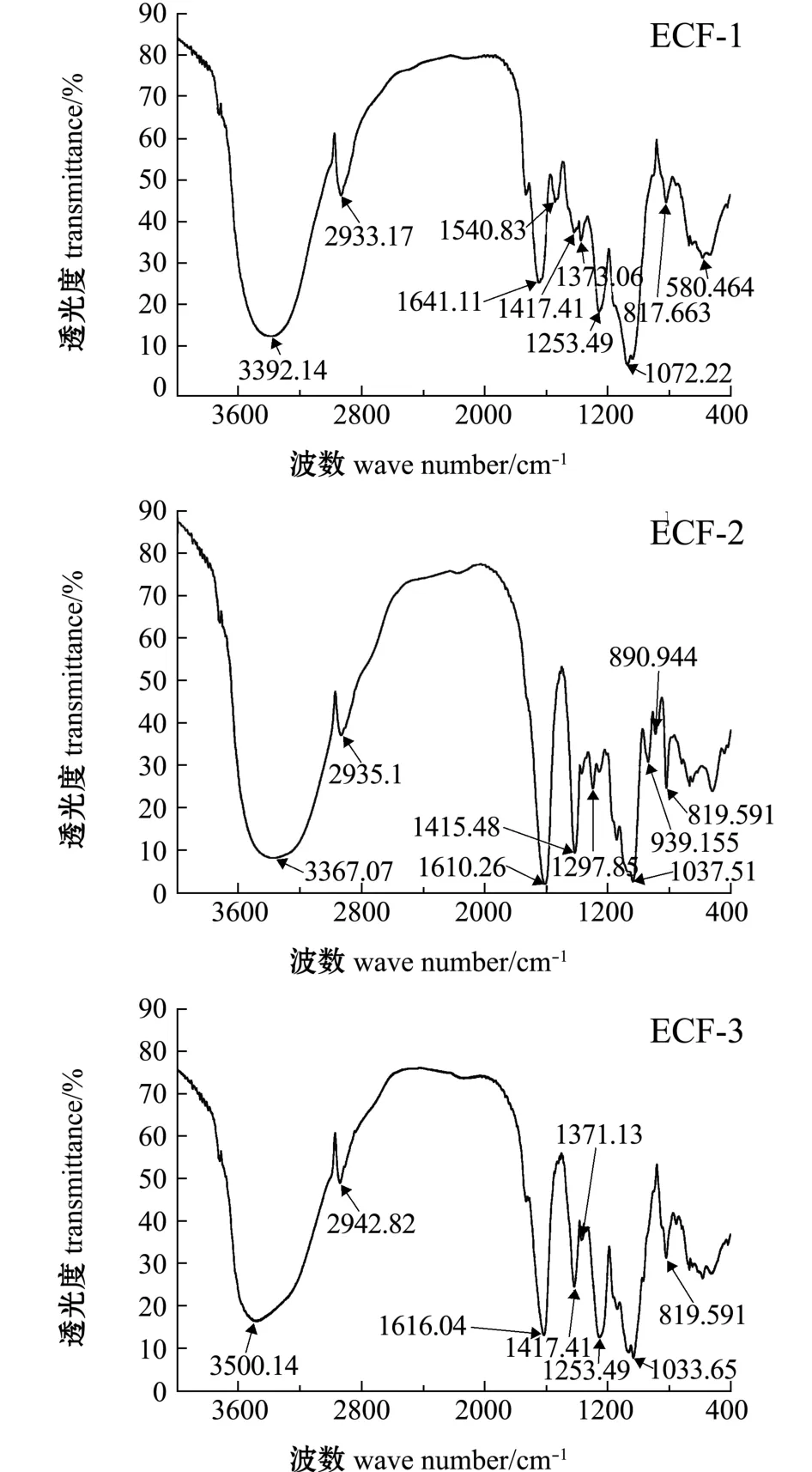
图5 ECF-1、 ECF-2、 ECF-3红外光谱图Fig.5 Infrared spectra of fractions ECF-1, ECF-2 and ECF-3

图6 ECF-1、 ECF-2、 ECF-313C 核磁共振谱图Fig.6 13C NMR spectra of fractions ECF-1, ECF-2 and ECF-3
2.5 核磁共振碳谱分析
经过分离纯化后对EC-FUC各个组分的13C核磁共振波谱分析,结果如图6所示。从图6可见:ECF-3在 (16~18) ×10-6附近出现明显的岩藻糖C6信号峰,而 ECF-1、ECF-2在高场区无信号峰,说明ECF-3中岩藻糖含量最高,与液相色谱分析的单糖组成结果一致;ECF-2、ECF-3在(175~185) ×10-6附近出现明显的信号峰,为羰基碳的信号峰, 且ECF-3在 (22~23) ×10-6处出现信号峰,为乙酰基甲基碳的信号峰,说明ECF-2、ECF-3中糖醛酸含量较高。ECF-2的13C NMR图谱与Zvyagintseva等[17]研究中翅藻Alariamarginata甘露糖醛酸的13C NMR图谱一致,推断ECF-2单糖组成中含有甘露糖醛酸,与红外光谱分析结果一致。ECF-1异头碳 C1化学位移为105.21×10-6,说明多糖通过β型糖苷键连接,与褐藻淀粉糖苷键结构一致。ECF-3在 (65~80) ×10-6区域呈现较多的信号峰,与ECF-3具有较高的硫酸根含量相关,说明该区域的取代基较多,也可能是较高的乙酰基取代基导致的。
3 讨论
3.1 EC-FUC的单糖组成
岩藻聚糖硫酸酯具有多种生物活性,这与其结构的复杂多样性密切相关,目前,关于岩藻聚糖硫酸酯的组成及结构研究较多。张海霞等[18]利用DEAE-Sepharose fast flow阴离子交换柱分离纯化马尾藻褐藻多糖硫酸酯,得到 F0、F1两个组分。F0、F1单糖组成为甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、岩藻糖。于龙等[19]从北大西洋瓜参体壁中提取岩藻聚糖硫酸酯,其单糖组成为岩藻糖、半乳糖、氨基葡萄糖、氨基半乳糖,物质的量比为1∶0.22∶0.07∶0.07。李国莹等[20]采用高压均质和复合酶结合的方法提取海带岩藻聚糖硫酸酯,利用IC-PAD检测岩藻聚糖硫酸酯单糖组成,主要为岩藻糖、半乳糖、甘露糖,其中,岩藻糖含量最高,为42.81%。卢茳虹[21]对海带多糖LJPA-P进行分离纯化,得到 LJPA-P1、LJPAP2、 LJPA-P3 3个组分, LJPA-P1、 LJPA-P2单糖组成主要为鼠李糖、岩藻糖、木糖、甘露糖、葡萄糖、半乳糖,LJPA-P3的单糖组成为半乳糖、岩藻糖、甘露糖。本研究中,苷苔岩藻聚糖硫酸酯纯化得到 ECF-1、ECF-2、ECF-3 3个组分,ECF-1单糖组成主要为葡萄糖,分析该组分为褐藻淀粉;ECF-2单糖组成主要为甘露糖醛酸、葡萄糖醛酸和岩藻糖,分析该组分可能为聚甘露糖醛酸片段与岩藻聚糖硫酸酯的混合物,或者为聚甘露糖醛酸片段与岩藻糖片段通过糖苷键连接的多糖大分子;ECF-3单糖组成主要为葡萄糖醛酸和岩藻糖,该组分为岩藻聚糖硫酸酯。说明不同藻种中岩藻聚糖硫酸酯纯化组分及单糖组成存在一定差异。
3.2 EC-FUC的红外光谱
郭峰君等[2]通过离子交换柱法对海带岩藻聚糖硫酸酯粗糖进行纯化,对纯化组分F3、F4、F5进行红外光谱分析,3个组分均在1259 cm-1附近出现S=O强吸收峰,在818 cm-1附近出现C-O-S赤道配位伸缩振动。硫酸根与多糖的连接位置与C-O-S伸缩振动位置相关,851 cm-1附近的吸收峰由连接在岩藻糖C4位置的直立键硫酸根形成,820 cm-1附近的吸收峰由连接在岩藻糖C2、C3位置的平伏键硫酸根形成。姜龙等[13]通过红外光谱分析纯化组分表明:SPF1在820 cm-1处出现吸收峰,说明硫酸基团连接在岩藻糖C2、C3位置;SPF2、 SPF3、 SPF4 分别在 860、 855、 848 cm-1处出现吸收峰,说明硫酸基团主要连接在岩藻糖C4位置。 本研究中, ECF-1、 ECF-2、 ECF-3均在820 cm-1附近出现吸收峰,说明硫酸基连接在岩藻糖的C2、C3位置上。这与Wijesinghe等[7]监测的硫酸基连接位置一致。
3.3 EC-FUC的核磁共振碳谱
盛家荣等[22]在多糖提取、分离和结构分析中提及糖苷键构型分析,在13C核磁共振分析中,α型糖苷键连接的C1化学位移为(97~101)×10-6,β型糖苷键连接的C1化学位移为(103~105)×10-6,对甘露聚糖不能通过此方法判断糖苷键构型。李丽迪[12]通过核磁共振分析厚叶海带岩藻聚糖硫酸酯纯化组分,13C谱图分析表明,(96~105)×10-6为 C1 信号峰, (16~18)× 10-6为岩藻糖C6信号峰, (68~84)×10-6为硫酸基取代信号峰。本研究中,ECF-1异头碳C1化学位移为105.21×10-6, 说明糖苷键为 β 型。 ECF-2、 ECF-3均在177×10-6附近出现信号峰,表明纯化组分中糖醛酸含量较高; ECF-3在17.97×10-6附近出现明显的信号峰,其为α-L-型吡喃岩藻糖C6信号峰。
[1] 王亚芳,张海霞,汪秋宽,等.几种褐藻多糖硫酸酯粗提物的降血脂作用[J].食品科技,2015(2):247-253.
[2] 郭峰君,胡靖,赵雪.海带岩藻聚糖硫酸酯降解及基本结构分析[J].食品工业科技,2014,35(18):93-97.
[3] Serisawa Y,Akino H,Matsuyama K,et al.Morphometric study of Ecklonia cava(Laminariales,Phaeophyta)sporophytes in two localities with different temperature conditions[J].Poycological Research,2002,50(3):193-199.
[4] Shim S Y,Le Q T,Lee S H,et al.Ecklonia cava extract suppresses the high - affinity IgE receptor,FcεRI expression[J].Food and Chemical Toxicology,2009,47(3):555-560.
[5] Kang S M,Kim K N,Lee S H,et al.Anti-inflammatory activity of polysaccharide purified from AMG-assistant extract of Ecklonia ca-va in LPS-stimulated RAW 264.7 macrophages[J].Carbohydrate Polymers,2011,85(1):80-85.
[6] Ahn G,Bing S J,Kang S M,et al.The JNK/NFκB pathway is required to activate murine lymphocytes induced by a sulfated polysaccharide from Ecklonia cava[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2013,1830(3):2820-2829.
[7] Wijesinghe W A J P,Athukorala Y,Jeon Y J,et al.Effect of anticoagulative sulfated polysaccharide purified from enzyme-assistant extract of a brown seaweed Ecklonia cava on Wistar rats[J].Carbohydrate Polymers,2011,86(2):917-921.
[8] Lee S H,Ko S C,Kang S M,et al.Antioxidative effect of Ecklonia cava dried by far infrared radiation drying[J].Food Science and Biotechnology,2010,19(1):129-135.
[9] Lee W,Ahn G,Oh J Y,et al.A prebiotic effect of Ecklonia cava on the growth and mortality of olive flounder infected with pathogenic bacteria[J].Fish & Shellfish Immunology,2016,51:313-320.
[10] 何云海,汪秋宽,刘红丹.用复合酶酶解提取海带岩藻聚糖硫酸酯的工艺研究[J].大连水产学院学报,2006,21(1):55-58.
[11] 刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
[12] 李丽迪.大连海域厚叶海带岩藻聚糖硫酸酯的纯化及其结构分析[D].大连:大连海洋大学,2014.
[13] 姜龙,宋悦凡,罗宣,等.树皮藻岩藻聚糖硫酸酯的纯化及其化学结构研究[D].大连海洋大学学报,2017,32(1):73-78.
[14] 冯以明.四种绿藻多糖的提取分离及其结构与抗凝活性研究[D].青岛:中国海洋大学,2012.
[15] 黄雅婷.薄盖灵芝多糖的分离纯化、结构鉴定及抗肿瘤活性研究[D].广州:广东药科大学,2016.
[16] 赵小亮,王姗姗,张晓,等.不同生长期养殖萱藻(Scytosiphon lomentarius)中褐藻胶和褐藻糖胶的结构分析[J].中国海洋药物,2016,35(5):7-13.
[17] Zvyagintseva T N,Shevchenko N M,Nazarenko E L,et al.Watersoluble polysaccharides of some brown algae of the Russian Far-East.Structure and biological action of low-molecular mass polyuronans[J].Journal of Experimental Marine Biology and Ecology,2005,320(2):123-131.
[18] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
[19] 于龙,薛长湖,宿玮,等.北大西洋瓜参岩藻聚糖硫酸酯分离纯化及结构分析[J].食品科学,2012,33(19):83-87.
[20] 李国莹,袁方,罗玮,等.海带岩藻多糖的提取工艺优化及初步结构分析[J].食品工业科技,2014,35(20):312-316,321.
[21] 卢茳虹.海带多糖的分离纯化、结构特性及在卷烟中应用研究[D].广州:华南理工大学,2013.
[22] 盛家荣,曾令辉,翟春,等.多糖的提取、分离及结构分析[J].广西师院学报:自然科学版,1999,16(4):49-54.
Purification and characterization of fucoidan extracted from brown seaweed Ecklonia cava
ZHANG Xue-di, SONG Yue-fan, WANG Qiu-kuan, HE Yun-hai,LIU Shu, REN Dan-dan, WU Long, CONG Hai-hua
(College of Food Science and Engineering,Nation R & D Branch Center For Seaweed Processing,Key and Open Laboratory of Aquatic Product Processing and Utilization of Liaoning Province, Dalian Ocean University, Dalian 116023, China)
Crude polysaccharide was separated from fucoidan(EC-FUC)extracted from brwn seaweed Ecklonia cava sampled from coast of Cheju Island in R.O.Korea by DEAE-Sepharose fast flow anion exchange chromatography, and future purified by Sephacryl S-300, S-400 gel column chromatography.The molecular weight and content of polysaccharide and sulfate of the EC-FUC were determined by phenol sulfuric acid method and BaCl2gelatin method, respectively.High performance liquid chromatography, infrared spectroscopy and nuclear magnetic resonance spectroscopy were used to analyze the structural characterization of purified components.The results showed that the purified EC-FUC was comprised of three peaks including ECF-1 with total polysaccharide of 41.7%and sulfate content of 3.68%,ECF-2 with total polysaccharide of 57.79%and sulfate content of 3.41%,and ECF-3 with total polysaccharide of 75.78%,and sulfate content of 18.03%.The yields were 6.27%in ECF-1,8.77%in ECF-2 and 16.19%in ECF-3, with molecular weight of 16 430 in ECF-1, 16 430 in ECF-2 and 222 460 in ECF-3.The primary monosaccharide was shown to be glucose in ECF-1, mannuronic acid, glucuronic acid and fucose in ECF-2, and glucuronic acid and fucose in ECF-3.Infrared spectrum analysis revealed that the sulfated group was combined to C2 or C3 in the three fractions and13C nuclear magnetic resonance(NMR)analysis indicated that there was mannuronic acid in ECF-2 and that 17.97×10-6regions of ECF-3 was assigned to C6 α-L-fucopyranose.
Ecklonia cava; fucoidan; isolation and purification; structural analysis
Q954.4
A
10.16535/j.cnki.dlhyxb.2017.06.016
2095-1388(2017)06-0740-07
2017-04-18
国家自然科学基金资助项目 (31471610);国家海洋公益性行业科研专项 (201405040)
张雪迪 (1993—),女,硕士研究生。E-mail:1071359444@qq.com
汪秋宽 (1962—),女,教授。E-mail:wqk320@dlou.edu.cn
——α-葡萄糖醛酸酶的研究进展*

