CD63在戊型肝炎病毒感染中的作用机制
张黎,温智恒,田亚宾,黄维金,王佑春
中国食品药品检定研究院,北京 102629
CD63在戊型肝炎病毒感染中的作用机制
张黎,温智恒,田亚宾,黄维金,王佑春
中国食品药品检定研究院,北京 102629
本研究旨在寻找戊型肝炎病毒(hepatitis E virus,HEV)衣壳蛋白ORF2的相互作用蛋白,探讨其在HEV感染中的作用。采用酵母双杂交方法从人肝细胞文库中筛选与HEV ORF2相互作用的蛋白,结果显示CD63与HEV ORF2相互作用。Pull-down实验提示原核表达的ORF2与CD63结合较弱,而免疫共沉淀实验提示真核表达的ORF2能与CD63结合。流式细胞术检测结果显示,HEV易感细胞PLC/PRF/5细胞膜表面的CD63表达水平普遍低于HEV非易感细胞。过表达CD63抑制PLC/PRF/5细胞的HEV感染,而小干扰RNA(small interfering RNA,siRNA)干扰CD63表达则促进HEV感染。结果提示,CD63能与HEV ORF2相互作用,可能抑制HEV感染肝细胞。
戊型肝炎病毒;ORF2;CD63
近年来,戊型肝炎在我国许多地区已超过甲型肝炎,成为发病率最高的急性病毒性肝炎。戊型肝炎病毒(hepatitis E virus,HEV)主要经粪-口途径传播,也可经输血传播和母婴垂直传播。虽然大多数戊型肝炎为急性感染,并具有自愈性,但一些免疫力低下的特殊人群,如器官移植、艾滋病等患者[1]感染HEV后会发展为慢性肝炎、急性重症肝炎(暴发性肝炎),甚至死亡。妊娠晚期妇女感染HEV的病死率也高达20%[2-4]。
HEV为单链正向RNA病毒。虽然HEV一直被认为是无包膜病毒,但近来一些研究认为其产生过程中可能存在带有包膜的形式。经胆汁处理后的HEV在粪便内呈无包膜状态。HEV基因组全长7.2 kb,编码3个开放读码框(open reading frame,ORF)。ORF1编码病毒转录和复制相关病毒,ORF2编码长度为660个氨基酸(amino acid,aa)的病毒衣壳蛋白,ORF3编码与病毒释放有关的小分子磷蛋白。昆虫细胞表达的ORF2(112~608位氨基酸)可在体外自主装配成病毒样颗粒(virus like particle,VLP)。针对ORF2的抗体可中和病毒感染,以重组ORF2(p239, 368~606位氨基酸)为基础的HEV疫苗已上市[5]。这些证据表明ORF2是介导HEV感染宿主的关键蛋白。为探讨HEV感染细胞的机制,本研究利用酵母双杂交方法,以HEV ORF2作为诱饵蛋白,筛选人肝cDNA文库,发现CD63能与ORF2相互作用。
CD63为4次跨膜蛋白超家族成员之一,主要定位于细胞膜、晚期内体及溶酶体。它能与整合素等多种细胞膜蛋白相互作用,参与多条细胞信号传递通路,调节细胞活化、黏附、分化等过程。它可能是活化血小板的标记,并与肿瘤侵袭相关[6]。此外,CD63还参与调节人类免疫缺陷病毒 (human immunodeficiency virus,HIV)的感染和释放[7]、丙型肝炎病毒 (hepatitis C virus,HCV)感染的早期过程[8]、人乳头瘤病毒16型(human papillomavirus type 16,HPV16)进入细胞的过程[9]及人单纯疱疹病毒6型(human herpesvirus type 6,HHV-6)释放的过程[10]。CD63被发现与HEV共定位于晚期内体[11],但是否参与并影响HEV感染细胞过程尚未有报道。
本研究通过多种方法检测CD63与HEV衣壳蛋白ORF2的相互作用,分析HEV易感和非易感细胞表面CD63表达水平,并利用小干扰RNA(small interfering RNA,siRNA)和过表达方法,调节PLC/PRF/5细胞中CD63表达,研究其在HEV感染细胞过程中的作用。
1 材料与方法
1.1 细胞及毒株
293FT、 HeLa、 A549、 CaCo-2、HepG2及PLC/PRF/5细胞均来自中国食品药品检定研究院细胞资源保藏研究中心。用含10%胎牛血清(fetal bovine serum,FBS)+1%青/链霉素的DMEM培养基,于37 ℃、5%CO2孵育箱中培养。用0.25%胰酶+乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)消化细胞,传代,维持细胞指数生长。HEV来自PLC/PRF/5细胞攻毒40 d后的细胞培养上清液(GenBank No:AJ272108)。
1.2 主要试剂
酵母双杂交试剂盒(DUALhunter Starter Kit)和人肝 cDNA 文库购自Dualsystems Biotech公司,pull-down检测试剂盒购自Pierce公司,细胞裂解液、免疫共沉淀检测相关试剂和抗体购自Clonetech公司,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/藻红蛋白(phycoerythrin,PE)标记的抗CD63抗体购自MACS和eBioscience公司,蛋白转染试剂Lipofectamine 2000及siRNA转染试剂RNAiMAX购自Life公司,M199及DMEM培养基购自Gibco公司和吉诺公司,胎牛血清购自Hyclone公司,HEV抗原检测试剂盒(酶联免疫法)购自北京万泰生物药业股份有限公司。
1.3 酵母双杂交实验
双杂交实验参照DUALhunter Starter Kit说明书操作。构建pDHB1-ORF2全长(1~660位氨基酸)和pDHB1-ORF2诱饵(12~660位氨基酸)质粒,验证功能性表达并排除自激活效应。将诱饵质粒与pPR3-N空质粒共转化酵母NMY51感受态细胞,选择筛选压力,确定最优筛选压力为(SD/-Leu/-Trp/-His,1 mmol/L 3-AT)。将诱饵质粒pDHB1-ORF2和人肝cDNA文库共转染酵母,在上述筛选压力培养板上 30 ℃培养 3~4 d,挑选阳性克隆进行聚合酶链反应(polymerase chain reaction,PCR)鉴定和测序分析。通过诱饵质粒与阳性质粒的酵母共转染实验及β-半乳糖苷酶分析实验验证筛选结果,排除假阳性。
1.4 Pull-down实验
His-ORF2(112~660位氨基酸)合成于军事医学科学院。Myc-CD63蛋白来自293FT转染pCMV5-CD63质粒后48 h收获的细胞裂解液。按pull-down试剂盒说明书操作,简要步骤如下:Tris 缓冲液(Tris buffered saline,TBS)与Cell Lysis Buffer按1∶1混匀,加入终浓度为10 mmol/L的咪唑,配制洗液,并用洗液平衡柱料(HisPur Cobalt Resin)。向柱料中加入诱饵蛋白(His-ORF2)150 g,对照组加入相应量洗液,4 ℃摇床翻转孵育1 h,离心留取流过液。用洗液洗涤柱料5次,加入捕获蛋白(Myc-CD63),4 ℃摇床翻转孵育1 h,离心留取流过液。用洗液洗柱料5次,加入50 μL 2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,同时向上述两步流过液中加入SDS上样缓冲液,分别煮沸变性,进行免疫印迹分析。
1.5 免疫共沉淀实验
将293FT细胞单独或同时转染pCMV-Myc-CD63和pCMV-His-ORF2。转染48 h后提取总蛋白。将细胞裂解液定量并稀释至1 mg/mL,与1 μg抗His抗体混合, 4 ℃孵育过夜。向预清除后的Protein G柱料中加入过夜孵育的抗体蛋白混合液,4 ℃孵育2 h。用洗液洗涤柱料5次,加入30 μL 2×SDS上样缓冲液,煮沸变性后进行免疫印迹分析。
1.6 流式细胞染色
将单层培养细胞用磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,加入消化液(含0.2% EDTA的PBS ),于37 ℃消化成单细胞悬液。以含有2% FBS的PBS作为封闭液,FITC或PE标记的抗CD63抗体(1∶100)为检测抗体,用流式细胞仪进行检测分析。
1.7 PLC/PRF/5细胞病毒感染实验
将PLC/PRF/5细胞铺于24孔板中(密度50%),次日进行CD63过表达或siRNA转染,转染后12 h换液,弃转染试剂、质粒或siRNA。转染后48 h(密度80%~90%)加入HEV毒种(RNA浓度106拷贝/mL),并换含2% FBS的DMEM/M199维持培养基。攻毒24 h后,用无血清DMEM/M199培养基洗5次,加入新鲜维持培养基。以后每3 d换一次液,于攻毒后19 d收取上清液,用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测上清液中ORF2含量。
1.8 HEV抗原(ORF2)检测
按HEV抗原检测试剂盒说明书操作,步骤如下:在预包被96孔板中,加入100 μL/孔待测样品和阴、阳性对照,于37 ℃孵育1 h;用含吐温20的PBS(PBS with Tween 20,PBST)洗板5次,加入100 μL/孔酶标试剂,于37 ℃孵育30 min;再次洗板5次后,加入显色液A和B(各50 μL/孔),混匀后于37 ℃孵育15 min;加入终止液(50 μL/孔),混匀后用酶标仪读数(OD450)。计算S/CO值,即待测样品OD值/阴性对照OD平均值。
2 结果
2.1 酵母双杂交实验提示CD63与HEV ORF2相互作用
利用分裂泛素化酵母双杂交系统,以HEV ORF2为诱饵,对人肝cDNA文库进行筛选,寻找相互作用蛋白。以ORF2去掉N端111个氨基酸之后的部分(112~660位氨基酸)构建诱饵质粒。排除自激活作用后,对人肝cDNA文库进行3次双杂交筛选,酵母共转染实验(图1A)及β-半乳糖苷酶分析实验(图1B)显示CD63能与ORF2相互作用。

图1酵母共转染和β-半乳糖苷酶分析
Fig.1Co-transfectionofbaitandpreytoyeastandβ-galactosidaseactivityanalysis
2.2 Pull-down实验提示CD63与原核表达的ORF2有弱相互作用
将去掉N端的ORF2构建至原核表达载体,在大肠埃希菌中诱导表达并纯化,获得His-ORF2(112~660位氨基酸)。以该蛋白为诱饵蛋白,真核细胞293FT中过表达的Myc-CD63为捕获蛋白,蛋白免疫印迹法结果显示Myc-CD63及His-ORF2正确表达,CD63蛋白量很高时ORF2能结合CD63,但反应较弱。对照组为阴性,无非特异反应(图2)。

S: sample group, His-ORF2 as bait, Myc-CD63 as prey. C: control group, no bait protein, Myc-CD63 as prey. 1: cell lysate of 293T cells with overexpressed CD63. 2, 3: pull-down results. 4, 5: the fluids through column after bait protein incubated with beads. 6, 7: the fluids through column after prey protein incubated with beads.
图2Pull-down实验提示HEVORF2与CD63有弱相互作用
Fig.2Pull-downexperimentindicatedtheweakinteractionofHEVORF2withCD63
2.3 免疫共沉淀实验提示真核表达的CD63与ORF2相互作用
图3免疫共沉淀实验显示HEVORF2与CD63相互作用
Fig.3Co-immunoprecipitationofHEVORF2andCD63
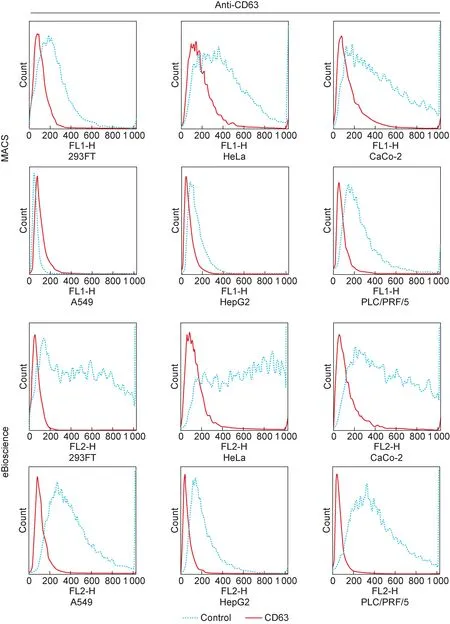
Control indicates the isotype control, which is from the same source as anti-CD63 antibody.
图4各细胞系膜表面CD63表达水平
Fig.4TheexpressionsofCD63indifferentcelllines
在真核293FT中同时过表达Myc-CD63和His-ORF2(112~660位氨基酸)后,进行免疫共沉淀检测。结果显示,结合有His抗体的柱料可沉淀His-ORF2蛋白,同时共沉淀Myc-CD63(图3)。结果提示,在真核共表达系统中HEV ORF2能与Myc-CD63相互作用。
2.4 细胞膜表面CD63表达水平
进一步检测HEV易感细胞系(A549、HepG2和PLC/PRF/5)及非易感细胞系(293FT、HeLa和CaCo-2)中内源性CD63的表达水平[12]。用两株荧光标记的CD63抗体,通过细胞膜表面的免疫荧光染色及流式细胞术对CD63表达进行分析。结果显示,CD63在各细胞系中均有表达,但HEV易感细胞系中CD63表达量普遍低于非易感细胞系。两株抗体虽然阳性强度有差异,但总体趋势一致(图4)。
2.5 CD63表达水平变化对HEV感染PLC/PRF/5细胞的影响
利用外源过表达和siRNA技术,对PLC/PRF/5细胞中CD63的表达水平进行调节,并进行病毒感染分析。共设计3条针对CD63的siRNA,利用膜表面抗原染色和流式细胞术对其效率进行确认。如图5所示,3条siRNA均能较明显抑制CD63表达,其中siCD63-2作用最明显。为取得更加客观的研究结果,选取低剂量的3条siRNA混合作用组进行后续实验。
将细胞先进行过表达或siRNA处理,使CD63过表达或被抑制,然后接种病毒,检测上清液中的病毒抗原。结果显示,抑制CD63表达有利于PLC/PRF/5细胞分泌HEV,而增加CD63表达则抑制细胞分泌HEV(图6)。然而,如果先将HEV感染PLC/PRF/5细胞,再将该细胞转染siRNA干扰CD63表达,其作用并不明显(图7)。以上结果均提示,CD63可能参与HEV感染过程,发挥负调节作用。
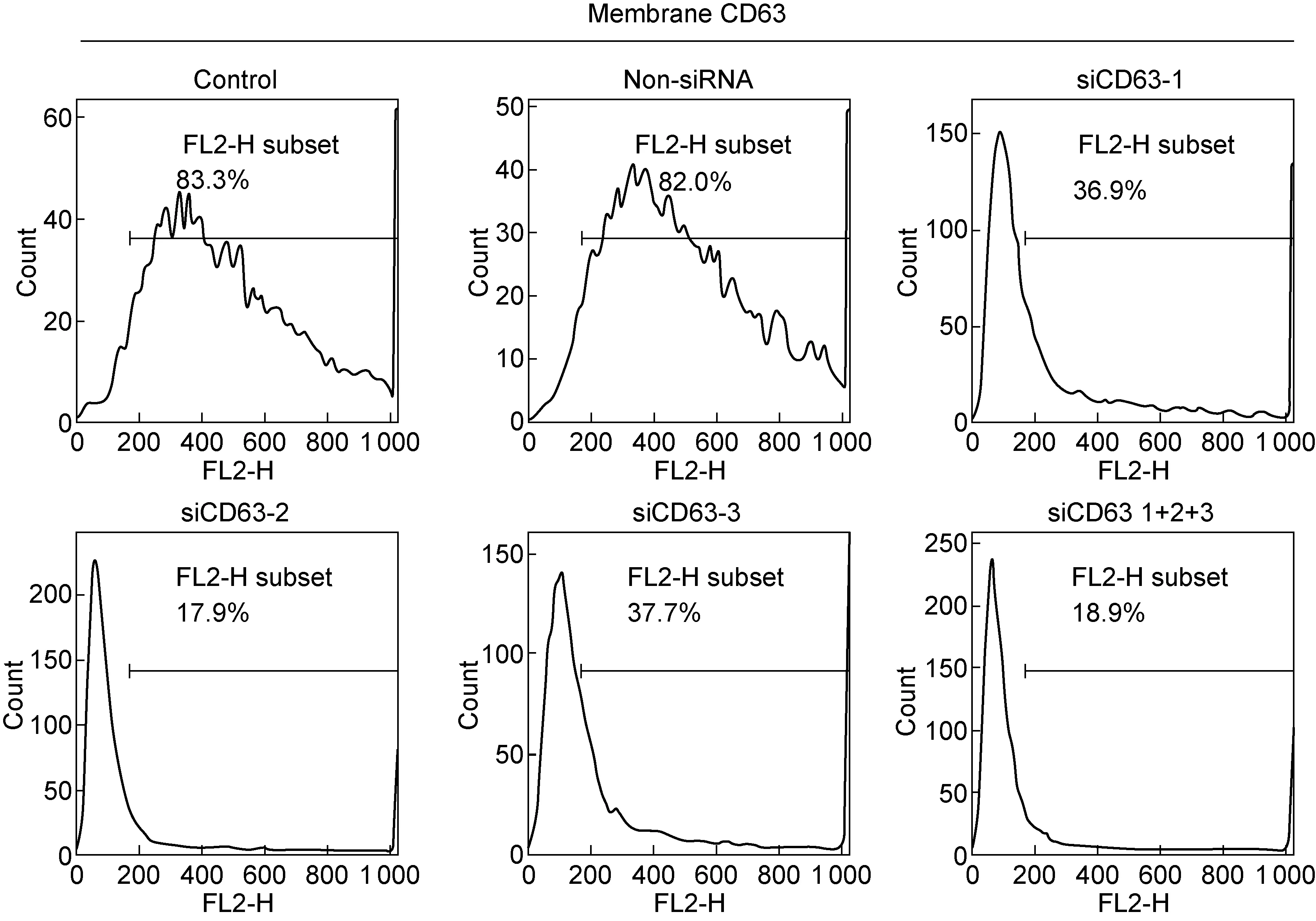
图5PLC/PRF/5细胞中CD63siRNA抑制效率检测
Fig.5InhibitionofCD63expressioninPLC/PRF/5cellsbysiRNA
3 讨论
自20世纪80年代HEV被发现以来,科学家们经过不懈努力,逐渐明确了其动物宿主、传播途径及世界各地流行情况,针对HEV的诊断试剂和疫苗也已陆续上市[2]。然而,HEV天然构象、感染机制和致病原理仍是困扰科学界的难题。本研究通过筛选与HEV衣壳蛋白ORF2相互作用的宿主蛋白,分析其在HEV感染中的作用,初步探索了HEV与宿主相互作用的机制。
酵母双杂交技术是一种广泛应用的筛选蛋白相互作用的方法。传统的酵母双杂交技术检测的生物分子必须同时定位于亲水性的核基质中并具有功能结构,限制了对定位于其他亚细胞结构中蛋白的相互作用研究。本研究采用近年来经优化的分裂泛素化双杂交系统,将诱饵蛋白铆于膜上,可筛选获得大量膜相关蛋白,有助于发现与病毒相互作用的宿主膜蛋白[13]。筛选前,首先检测诱饵蛋白的表达及自激活性,结果提示ORF2蛋白全长具有自激活作用,不适用于酵母双杂交实验。分析其蛋白结构后,发现ORF2蛋白N端的111个氨基酸为信号肽区域,能与质膜融合,可能发生自激活,而去掉N端的ORF2蛋白(如VLP)仍能形成完整的病毒衣壳,因此选用去除信号肽的ORF2蛋白进行后续研究。

*P<0.05,**P<0.01.
图6HEV感染能力与CD63表达水平的关系
Fig.6TherelationofHEVinfectivitywithCD63expression
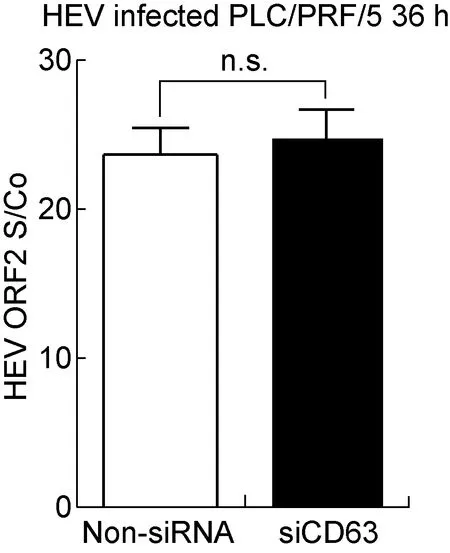
n.s., no significant difference.
图7siCD63对已感染HEV的PLC/PRF/5细胞的作用
Fig.7TheeffectofsiCD63onHEV-infectedPLC/PRF/5cells
近年来,已知的HEV ORF2结合蛋白包括硫酸肝素糖蛋白(heparan sulfate proteoglycan,HSPG)、Grp78/Bip、α管蛋白(α-tublin)、热休克蛋白90(heat shock protein 90,HSP 90)、CYP2A6、CYP4502C8等,这些蛋白参与HEV与细胞的结合、细胞内的转运及代谢等生理过程[14-18]。本研究利用酵母双杂交、pull-down及免疫共沉淀等方法,首次发现4次跨膜蛋白超家族成员CD63也能与HEV ORF2相互作用。Pull-down实验显示信号较弱,而酵母双杂交和免疫共沉淀实验均显示信号较强,原因可能为原核系统表达的蛋白缺乏糖基化等翻译后修饰而造成结合活性较弱。但CD63与ORF2的结合是否与其修饰相关,还需更多实验来证明。
4次跨膜蛋白超家族由具有4个结构和序列高度保守的跨膜区多个蛋白组成。该家族成员胞外区的半胱氨酸残基能被棕榈酰化,进而形成4次跨膜蛋白高度聚集的膜表面微结构域。这些结构域常包含受体、整合素和胆固醇等成分,发挥着介导细胞内吞转运的作用。CD63除聚集于细胞膜表面外,还大量聚集于晚期内体〔又名多泡体(multivesicular body,MVB)〕和溶酶体,是MVB的标记分子之一[6]。近年来,很多文献报道CD63参与某些病毒进入细胞的过程,如HCV、HPV和HIV等,并同时调节某些病毒的细胞间传递及病毒释放过程,如HIV[7-8]。Okamoto课题组也发现HEV ORF2和ORF3可与MVB标记的CD63共定位[11,19],在一定程度上支持本研究发现的ORF2与CD63的相互作用,但他们未对CD63在HEV感染中的作用进一步研究。
本研究结果显示,改变细胞内CD63表达水平后再感染HEV,能改变细胞分泌HEV的水平;但如果先将HEV感染细胞,然后抑制CD63表达,则对细胞分泌HEV的能力无影响。因此,CD63的作用更有可能是调节HEV进入或复制环节,而非影响HEV分泌出胞环节。此外,由于细胞膜表面CD63表达水平与HEV的感染性呈负相关,而CD63大量存在于晚期内体和溶酶体这些介导蛋白降解的细胞器,推测CD63可能与HEV内吞后的降解过程相关。
综上所述,本研究发现CD63为HEV ORF2新的相互作用蛋白,初步探讨了其在HEV感染中的作用,为HEV感染和致病机制的研究提供了新的线索和方向。
[1] 黄维金, 宋爱京, 许四宏, 聂建辉, 刘强, 赵晨燕, 张黎, 王佑春.不同人类免疫缺陷病毒感染途径群体中戊型肝炎病毒的流行情况 [J].微生物与感染, 2016, 11(4): 212-216.
[2] Marano G, Vaglio S, Pupella S, Facco G, Bianchi M, Calizzani G, Candura F, Catalano L, Farina B, Lanzoni M, Piccinini V, Liumbruno GM, Grazzini G. Hepatitis E: an old infection with new implications [J]. Blood Transfus, 2015, 13(1): 6-17.
[3] 张黎, 王佑春.警惕输血引起的慢性戊型肝炎 [J].传染病信息, 2013, 26(6): 327-330, 342.
[4] Aggarwal R. Hepatitis E:Historical, contemporary and future perspectives [J]. J Gastroenterol Hepatol, 2011, 26(Suppl 1): 72-82.
[5] Gu Y, Tang X, Zhang X, Song C, Zheng M, Wang K, Zhang J, Ng MH, Hew CL, Li S, Xia N, Sivaraman J. Structural basis for the neutralization of hepatitis E virus by a cross-genotype antibody [J]. Cell Res, 2015, 25(5): 604-620.
[6] Pols MS, Klumperman J. Trafficking and function of the tetraspanin CD63 [J]. Exp Cell Res, 2009, 315(9): 1584-1592.
[7] Li G, Endsley MA, Somasunderam A, Gbota SL, Mbaka MI, Murray JL, Ferguson MR. The dual role of tetraspanin CD63 in HIV-1 replication [J]. Virol J, 2014, 11: 23. doi: 10.1371/journal.pone.0060333.
[8] Park JH, Park S, Yang JS, Kwon OS, Kim S, Jang SK. Discovery of cellular proteins required for the early steps of HCV infection using integrative genomics [J]. PLoS One, 2013, 8(4): e60333.
[9] Spoden G, Freitag K, Husmann M, Boller K, Sapp M, Lambert C, Florin L. Clathrin- and caveolin-independent entry of human papillomavirus type 16—involvement of tetraspanin-enriched microdomains (TEMs) [J]. PLoS One, 2008, 3(10): e3313.
[10] Mori Y, Koike M, Moriishi E, Kawabata A, Tang H, Oyaizu H, Uchiyama Y, Yamanishi K. Human herpesvirus-6 induces MVB formation, and virus egress occurs by an exosomal release pathway [J]. Traffic, 2008, 9(10): 1728-1742.
[11] Nagashima S, Jirintai S, Takahashi M, Kobayashi T, Tanggis, Nishizawa T, Kouki T, Yashiro T, Okamoto H. Hepatitis E virus egress depends on the exosomal pathway, with secretory exosomes derived from multivesicular bodies [J]. J Gen Virol, 2014, 95(Pt 10): 2166-2175.
[12] Tanaka T, Takahashi M, Kusano E, Okamoto H. Development and evaluation of an efficient cell-culture system for hepatitis E virus [J]. J Gen Virol, 2007, 88(Pt 3): 903-911.
[13] Petschnigg J, Wong V, Snider J, Stagljar I. Investigation of membrane protein interactions using the split-ubiquitin membrane yeast two-hybrid system [J]. Methods Mol Biol, 2012, 812: 225-244.
[14] Shen Q, Zhang W, Kang Y, Chen Y, Cui L, Yang Z, Hua X. HEV-capsid protein interacts with cytochrome P4502C8 and retinol-binding protein 4 [J]. Hepat Mon, 2011, 11(11): 913-917.
[15] 唐明, 郑子峥, 孙媛媛,何水珍, 赵敏, 黄慧, 苗季, 张军, 夏宁邵.戊型肝炎病毒衣壳蛋白结合CYP 2A6并降低其底物催化能力 [J].病毒学报, 2009, 25(1): 1-8.
[16] Zheng ZZ, Miao J, Zhao M, Tang M, Yeo AE, Yu H, Zhang J, Xia NS. Role of heat-shock protein 90 in hepatitis E virus capsid trafficking [J]. J Gen Virol, 2010, 91(Pt 7): 1728-1736.
[17] 吴小成, 苗季, 郑子峥, 何水珍, 孙媛媛, 唐明, 张军, 夏宁邵.Grp78/Bip介导戊型肝炎病毒衣壳蛋白对宿主细胞的吸附 [J].微生物与感染, 2007, 2(2): 83-87.
[18] Kalia M, Chandra V, Rahman SA, Sehgal D, Jameel S. Heparan sulfate proteoglycans are required for cellular binding of the hepatitis E virus ORF2 capsid protein and for viral infection [J]. J Virol, 2009, 83(24): 12714-12724.
[19] Nagashima S, Takahashi M, Jirintai S, Nishizawa T, Yasuda J, Okamoto H. Tumour susceptibility gene 101 and the vacuolar protein sorting pathway are required for the release of hepatitis E virions [J]. J Gen Virol, 2011, 92(Pt 12): 2838-2848.
s. HUANG Weijin, E-mail: huangweijin@nifdc.org.cn; WANG Youchun, E-mail: wangyc@nifdc.org.cn
RoleofCD63inhepatitisEvirusinfection
ZHANG Li, WEN Zhiheng, TIAN Yabin, HUANG Weijin, WANG Youchun
NationalInstitutesofFoodandDrugControl,Beijing102629,China
The present paper aimed to find out the interacting protein of hepatitis E virus (HEV) capsid protein ORF2 and explore its role in HEV infection. CD63 was identified as a potential HEV ORF2-interacting protein by screening a human liver cDNA library for yeast two-hybrid method. Co-immunoprecipitation and pull-down assays were used to verify the interaction. The expression of cell surface CD63 was detected by flow cytometry in HEV susceptible, non-susceptible and overexpressed cells (PLC/PRF/5) respectively. HEV infectivity was measured through virus infection assay. The results indicated that expression level of CD63 on the cell membrane of HEV susceptible cell lines was lower than that of HEV non-susceptible cell lines. Overexpression of CD63 inhibited the HEV infection of PLC/PRF/5 cells, while siRNA interference of CD63 promoted the HEV infection. The results indicated that CD63 could interact with HEV ORF2, and may inhibit HEV infection in hepatocytes.
Hepatitis E virus; ORF2; CD63
国家自然科学基金(81371830)
黄维金,王佑春
2017-05-05)

