上海市某三甲医院幽门螺杆菌耐药性和毒力与其生物膜形成能力的相关性研究
赵付菊,胡玢婕,王小飞,孙启娟,项平,张艳梅,瞿涤,赵虎
1. 复旦大学附属华东医院检验科,上海 200040; 2. 复旦大学基础医学院医学分子病毒学教育部/卫生部重点实验室,上海 200032; 3. 复旦大学附属华东医院胃镜室,上海 200040
上海市某三甲医院幽门螺杆菌耐药性和毒力与其生物膜形成能力的相关性研究
赵付菊1,胡玢婕1,王小飞2,孙启娟1,项平3,张艳梅1,瞿涤2,赵虎1
1. 复旦大学附属华东医院检验科,上海 200040; 2. 复旦大学基础医学院医学分子病毒学教育部/卫生部重点实验室,上海 200032; 3. 复旦大学附属华东医院胃镜室,上海 200040
为探讨复旦大学附属华东医院(以下简称本院)分离培养的幽门螺杆菌(Helicobacterpylori,H.pylori)的耐药性、毒力和感染特征与其生物膜形成能力的相关性,收集2014年12月—2015年6月于本院消化内镜中心的胃活检组织标本及相应临床病例资料,分离培养获得幽门螺杆菌,分析菌株的耐药性、毒力基因型、临床病例特征。结果显示,从胃活检组织样本中共分离培养28株幽门螺杆菌,对左氧氟沙星(levofloxacin,LEV)、甲硝唑(metronidazole,MTZ)和克拉霉素(clarithromycin,CLA)的耐药率分别为32%、75%和11%,未发现阿莫西林(amoxicillin,AMX)耐药。单一药物耐药17株(17/28,61%),双重耐药10株(10/28,36%)。毒力基因cagA、oipA和vacAs1检出率为100%,未检出vacAs2。基因型vacAs1m1占39%(11/28),vacAs1m2占61%(17/28);iceA1占54%(15/28),iceA2占21%(6/28),iceA1A2占25%(7/28);dupA+占36%(10/28)。28株菌株均能形成生物膜,但能力不尽相同。单因素及独立样本t检验分析显示,45~59岁、iceA1+dupA-基因型和甲硝唑敏感菌株形成生物膜的能力较强。结果提示,本院分离的幽门螺杆菌对甲硝唑耐药率最高,双重耐药不容忽视。菌株主要毒力基因型为cagA、oipA、vacAs1m2。幽门螺杆菌的生物膜形成能力与患者年龄有关,45~59岁组较强;携带毒力基因iceA1的菌株生物膜形成能力强;dupA基因型及甲硝唑耐药与菌株生物膜形成呈负相关。
幽门螺杆菌;生物膜形成;耐药;毒力基因
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种革兰阴性微需氧菌,感染后能长期定植于胃肠道,与慢性活动性胃炎、消化性溃疡、胃癌和胃黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤的发生密切相关[1-3]。1994年世界卫生组织(World Health Organization,WHO) /国际癌症研究机构(International Agency for Research on Cancer,IARC)将幽门螺杆菌定为Ⅰ类致癌原[4]。全世界近一半人口感染幽门螺杆菌,其中发展中国家占80%,我国感染率为40%~80%[5-7]。感染者中只有部分发病,且患病类型及转归不尽相同。除宿主和饮食因素外,重要原因之一是菌株携带的毒力因子不同。目前发现的主要毒力基因包括细胞毒素相关基因A(cytotoxin-associated gene A,cagA)、空泡细胞毒素A基因(vacuolating cytotoxin A,vacA)、外膜炎性蛋白A基因(outer inflammatory protein A,oipA)、十二指肠溃疡基因启动因子A(duodenal ulcer promoting gene A,dupA)、上皮细胞接触诱导基因(induced by contact with epithelium,iceA)等,它们不同程度地与胃萎缩、肠上皮化生及其他严重病变有关,成为预测感染后临床风险的重要因素[8-9]。另一原因是幽门螺杆菌耐药现象日趋严峻,根除失败引起持续感染或反复感染,研究证实其生物膜形成在很大程度上导致了耐药菌株增加[10-11]。本研究收集复旦大学附属华东医院(以下简称本院)消化内镜中心的胃活检组织标本,培养获得28株幽门螺杆菌,对其耐药性、毒力基因型及感染病例特征进行分析,进一步探讨与菌株生物膜形成相关的可能因素,以辅助临床进行及时有效的幽门螺杆菌根除治疗及预防控制耐药菌株的传播和流行。
1 材料与方法
1.1 材料
标准菌株:幽门螺杆菌ATCC 43504购自上海北连生物科技有限公司。M-H血琼脂培养基为上海科玛嘉微生物技术有限公司产品,E-test 纸条购自法国生物梅里埃生物诊断公司,抗菌药物(万古霉素、三甲氧氨苄嘧啶、多黏菌素B、两性霉素B)购自美国Amresco公司,12孔细胞培养板购自美国Costar公司,细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司,快速琼脂糖凝胶DNA回收试剂盒购自北京康为世纪生物科技有限公司。
1.2 方法
1.2.1细菌的分离、鉴定与药敏分析收集2014年12月—2015年6月本院消化内镜中心的胃活检组织标本,经研磨后接种于含万古霉素、三甲氧氨苄嘧啶、多黏菌素B、两性霉素B的选择性培养基中,37 ℃微需氧环境培养,3~5 d后观察菌落形态。经革兰染色镜检,氧化酶、尿酶及触酶试验,16S RNA和ureC基因测序,证实为幽门螺杆菌。
用无菌棉签刮取平板中培养3 d后的适量菌落,用0.45% NaCl 溶液调成2.0麦氏单位的菌悬液,均匀涂布于M-H血琼脂培养基中,无菌镊子取克拉霉素(clarithromycin,CLA)、甲硝唑(metronidazole,MTZ)、阿莫西林(amoxicillin,AMX)和左氧氟沙星(levofloxacin,LEV)的E-test 纸条(法国生物梅尼埃生物诊断公司),分别贴于平板中央。将平板置于37 ℃微需氧环境(10% CO2,5% O2,85% N2)孵育3 d。根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)2013年版及有关文献的判读标准[12]:克拉霉素≥1 μg/mL,阿莫西林≥0.5 μg/mL,甲硝唑≥8 μg/mL,左氧氟沙星≥1 μg/mL 判定为耐药。
1.2.2幽门螺杆菌生物膜形成能力检测参照Yonezawa等的方法并加以改进[13]。取-80 ℃保存的28株菌株,经复苏传代后,挑取平板中的菌落,置于新鲜配制的含7%胎牛血清的布氏培养基中,37 ℃,80~100 r/min振荡微需氧培养24 h,调至OD600为1.0备用。用无菌镊子取18 mm×18 mm的盖玻片,以一定角度置于12微孔板中,每孔加入2 mL含7%胎牛血清的布氏培养液。取上述调制好的预培养菌悬液加入微孔板中,置于37 ℃微需氧环境,80~100 r/min振荡培养3 d。取出盖玻片清洗2次,干燥后置于1%结晶紫中染色30 s,用水洗去多余结晶紫。室温干燥后,用10%乙酸溶解脱色,所得溶液取200 μL用酶标仪测OD595。以不加预培养液的微孔作为空白对照,重复3次。
1.2.3幽门螺杆菌毒力基因检测细菌基因组DNA提取按试剂盒说明书操作,引物合成(cagA、vacA、iceA、dupA、oipA)参照文献[14],采用基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)软件对基因的保守区及突变位点相应片段进行引物设计,引物由上海桑尼生物科技有限公司合成(表1)。聚合酶链反应(polymerase chain reaction,PCR)扩增:扩增体系总体积25 μL,每个反应体系DNA模板1 μL。扩增条件:热循环参数为94 ℃预变性 3 min;94 ℃30 s,55~60 ℃退火30 s,72 ℃延伸 60 s,共35个循环;72 ℃延伸10 min。PCR产物行1.5%琼脂糖凝胶电泳后,用紫外凝胶成像系统观察条带,割胶回收PCR产物并纯化,送上海桑尼生物科技有限公司测序。
表1幽门螺杆菌的鉴定及毒力基因引物序列
Tab.1PrimersequencesforH.pyloriidentificationandvirulencegenes

GeneSequence(5′⁃3′)Size(bp)16SrRNAFTCTAACGAATAAGCACCGGCTA576RGTGCAGCACCTGTTTTCAAGGureCFTCGGCAGTGCTAAAAGGATAGA500RAAACTTATCCCCAATCGCGCAcagAFAATACACCAACGCCTCCAAG400RTTGTTGCCGCTTTTGCTCTCvacAs1FATGGAAATACAACAAACACAC258RCTGCTTGAATGCGCCAAACvacAs2FATGGAAATACAACAAACACAC286RCTGCTTGAATGCGCCAAACvacAm1FCAATCTGTCCAATCAAGCGAG567RGCGTCAAAATAATTCCAAGGvacAm2FCAATCTGTCCAATCAAGCGAG642RGCGTCAAAATAATTCCAAGGiceA1FGTGTTTTTAACCAAAGTATC247RCTATAGCCASTYTCTTTGCAiceA2FGTTGGGTATATCACAATTTAT229/334RTTRCCCTATTTTCTAGTAGGTdupAFATGAGTTCTATTAACAG1839RTTAAATACTCTTCCTTATAAGoipAFCGCGGAAAGGAACGGGTTTT519RTTAGCGTCTAGCGTTCTGCC
1.3 统计分析
采用SPSS 22.0 软件进行数据分析,独立样本t检验分析患者性别、年龄,以及菌株毒力、耐药类型与生物膜形成能力之间的相关性,单因素方差分析比较不同疾病类型与菌株生物膜形成能力之间的关系,P<0.05为差异有统计学意义。
2 结果
2.1 菌株及临床病例特征
28株幽门螺杆菌对应的临床病例中,男性15例、女性13例;平均年龄(50.04±14.7)岁,≥60岁8例、45~59岁11例、<45岁9例。其中慢性浅表性胃炎8例、慢性萎缩性胃炎14例、消化性溃疡6例。快速尿素酶试验(rapid urease test,RUT)阳性14例、阴性14例。
2.2 幽门螺杆菌药敏试验结果
28株幽门螺杆菌对4种抗菌药物的耐药率分别是:左氧氟沙星32%(9/28),甲硝唑75%(21/28),克拉霉素11%(3/28),阿莫西林0。对两种药物均耐药10株(10/28,36%),其中对甲硝唑和克拉霉素同时耐药1株,对甲硝唑和左氧氟沙星同时耐药8株,对左氧氟沙星和克拉霉素同时耐药1株(表2)。
表2E-test检测幽门螺杆菌对4种抗菌药物的敏感度
Tab.2SusceptibilityratesofH.pyloritofourantimicrobialagentswithE-test(n, %)
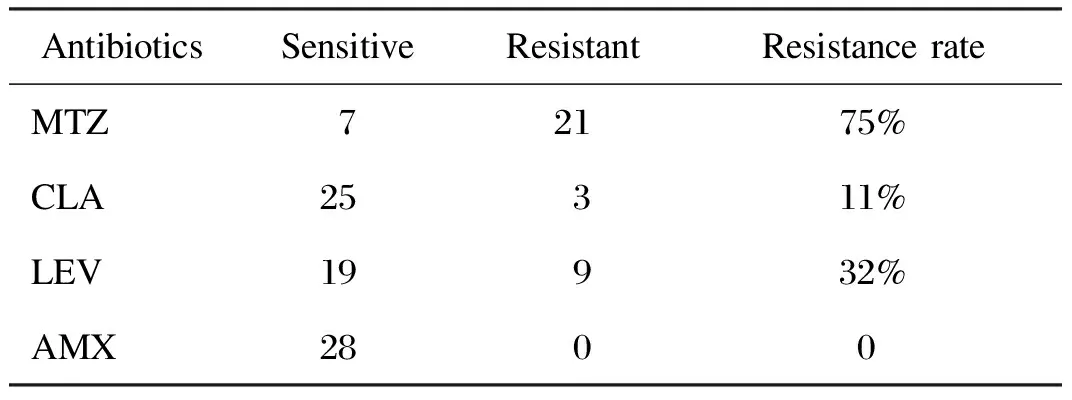
AntibioticsSensitiveResistantResistancerateMTZ72175%CLA25311%LEV19932%AMX2800
2.3 幽门螺杆菌毒力基因检测
检测幽门螺杆菌的主要毒力相关基因cagA、vacA(m1/m2、s1/s2)、iceA、oipA和dupA,28株菌株均检出cagA和oipA,基因型vacAs1检出率为100%,未发现vacAs2。基因型vacAs1m1占39%(11/28),基因型vacAs1m2占比最高,为61%(17/28)。iceA1阳性率为54%(15/28),iceA2为21%(6/28),iceA1A2为25%(7/28)。dupA阳性率为36%(10/28)(表3)。
表3幽门螺杆菌携带的毒力基因型分布
Tab.3PrevalenceofgenotypesdetectedinH.pylori
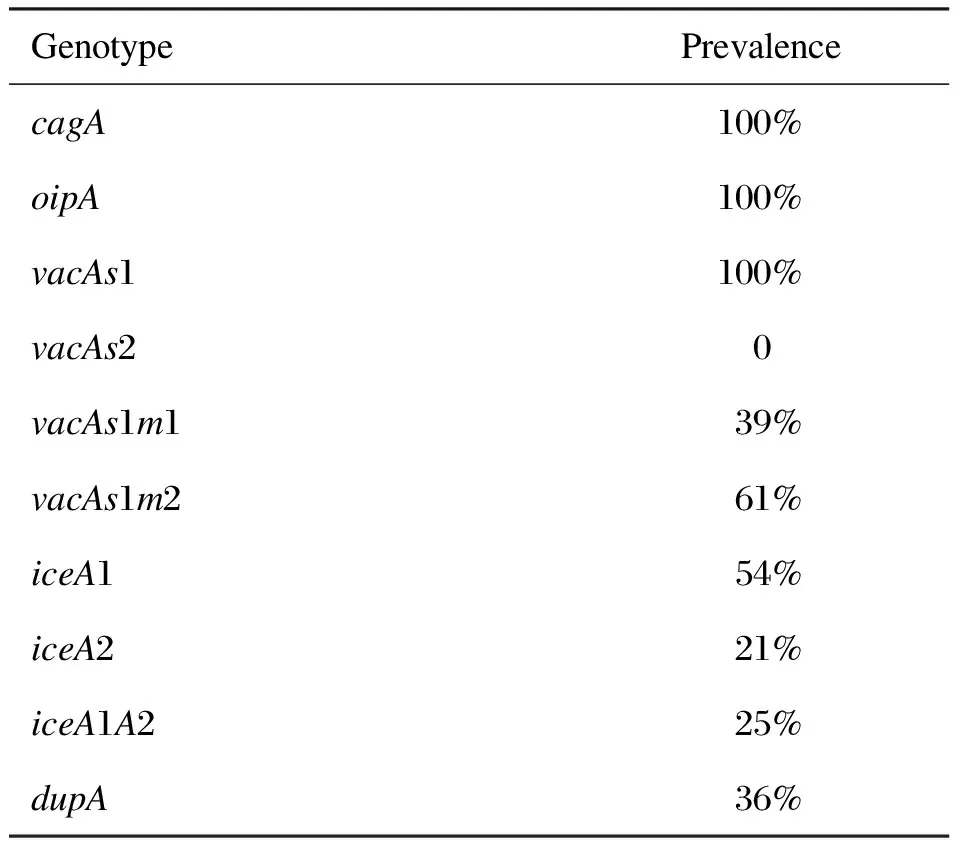
GenotypePrevalencecagA100%oipA100%vacAs1100%vacAs20vacAs1m139%vacAs1m261%iceA154%iceA221%iceA1A225%dupA36%
2.4 幽门螺杆菌生物膜形成能力与毒力、耐药及临床特征的相关性分析
根据参考文献建立12微孔板/玻片法,对28株幽门螺杆菌的生物膜形成能力进行检测。结果显示,28株菌株均能形成生物膜,检出率为100%,但形成生物膜的能力有差异。OD595为 0.091~0.86,平均0.257±0.196。阴性对照无生物膜生长(图1)。比较患者性别、年龄,以及菌株毒力、耐药类型与生物膜形成能力的关系。结果显示,3个年龄组中,45~59岁组形成生物膜的能力最强,其次是<45岁组,而≥60岁组生物膜形成能力最弱。患者不同性别之间生物膜形成能力无显著差异。不同毒力基因型中,分别比较iceA1组与iceA2组及iceA1A2组(P=0.014,P=0.018),均有统计学差异,以iceA1组生物膜形成能力较强。dupA+与dupA-组之间也有统计学差异(P=0.010),dupA-组生物膜形成能力较强。vacAs1/m1与vacAs1/m2组之间无显著差异。比较不同耐药类型,克拉霉素和左氧氟沙星耐药组与敏感组之间无差异;甲硝唑耐药组与敏感组之间有显著差异(P=0.004),甲硝唑敏感组生物膜形成能力较强(表4)。慢性胃炎(group 1)、慢性萎缩性胃炎(group 2)及消化性溃疡 (group 3) 对应菌株形成生物膜能力的组间(F=1.061,P=0.361)及组内两两比较均无显著差异(P1,2=0.195,P1,3=0.241,P2,3=0.906)。
表4不同组之间幽门螺杆菌生物膜形成能力的差异
Tab.4DifferencesintheabilityofbiofilmformationofH.pyloriindifferentgroups

GroupnIndependent⁃samplet⁃testMeanStandarddeviationFvaluePvalueGender Malesvs.females15/130.287/0.2220.221/0.1651.3810.251Age ≥60vs.45⁃598/110.184/0.3670.034/0.27914.0440.001∗ ≥60vs.<458/90.184/0.1890.034/0.0655.3210.036∗ <45vs.45⁃599/110.189/0.3670.065/0.27912.9340.002∗Antibiotics Rvs.S MTZ21/70.228/0.3440.141/0.30810.2420.004∗ CLA3/250.155/0.2700.037/0.2041.6280.213 LEV9/190.268/0.2520.197/0.2010.0040.953RUT Pvs.N14/140.262/0.2470.229/0.1700.5210.477Virulencegenes vacA s1/m1vs.s1/m211/170.235/0.2720.186/0.2070.0860.772 iceA A1vs.A215/60.327/0.1440.246/0.0277.3400.014∗ A1vs.A1A215/70.327/0.2050.246/0.0526.6610.018∗ A2vs.A1A26/70.144/0.2050.027/0.0522.6850.130 dupA Pvs.N10/180.187/0.2960.053/0.2357.6420.010∗
R, resistance; S, sensitive; MTZ, metronidazole; CLA, clarithromycin; LEV, levofloxacin; RUT, rapid urease test; P, positive; N, negative. *P<0.05.

The graph shows the quantification of biofilms formed after 3-day culture in Brucella broth containing 7% FCS. The biofilms of 28 strains are shown as shadow bars and the lines depict theOD595value of these strains. The number of individual bacteria is indicated below the column and the last bar is negative control. All of the results were expressed as the mean±SD from three independent experiments.
图128株幽门螺杆菌生物膜形成能力的分析
Fig.1Biofilmformationof28H.pyloriisolates
3 讨论
幽门螺杆菌是常定植于胃黏膜上皮细胞表面的一种微需氧菌,为引起胃及十二指肠疾病的重要病原菌。然而,其高感染率与临床发病率并不相符,患病后的疾病类型及转归也有明显差异。有研究者提出,这可能与宿主、环境及菌株的遗传特征有关,其中菌株携带的毒力因子类型与其致病性关系密切[9,13]。随着抗感染药物的广泛使用,幽门螺杆菌的耐药率逐渐升高,而其感染的根除治疗一直以经验治疗为主,采用统一推荐的治疗方案进行,部分因耐药菌株而根治失败。因此,了解当地幽门螺杆菌耐药情况及其毒力基因型,对指导临床用药有良好的社会效益和经济效益。
目前,幽门螺杆菌对其感染治疗常用药物如克拉霉素、喹诺酮类、甲硝唑和阿莫西林等均产生不同程度的耐药,不同国家和地区的耐药率不尽相同[15-16]。根除治疗幽门螺杆菌的一线方案采用的是含有质子泵抑制剂(proton pump inhibitor,PPI)和两种抗菌药物(克拉霉素、阿莫西林及甲硝唑)的三联疗法,但仍有至少30%的患者根除治疗失败。因此,采用该疗法时应结合当地幽门螺杆菌的耐药率及体外药敏试验结果进行[15-17]。本研究中,28株幽门螺杆菌对常见4种抗菌药物的总体耐药率分别是:甲硝唑75%,左氧氟沙星32%,克拉霉素11%,阿莫西林0,与Vianna等[15]及牛占岳等[18]的报道类似。甲硝唑耐药率最高的可能原因是其价格低廉而广泛用于厌氧菌感染。提示本院临床医师应首选阿莫西林,慎用甲硝唑,若要使用则需增加用药剂量或频率以加强根除效果。双重耐药菌占36%,以对甲硝唑和左氧氟沙星同时耐药为主,这可能与这两种药物被广泛推荐用于二线补救方案根除幽门螺杆菌有关[15]。
幽门螺杆菌的毒力基因型与患者感染后的疾病类型及转归、菌株耐药关系密切,具有地域和人群差异,不同毒力因子组合的致病性也迥异[9]。CagA是目前研究最多的毒力因子,与消化性溃疡、萎缩性胃炎和胃癌密切相关,在西方人群中最为突出。东亚地区人群几乎100%携带cagA基因,其中只有血清CagA 抗体阳性者与胃癌有关[9]。vacA编码VacA,能诱导膜通道形成和线粒体中细胞色素C释放,从而引发细胞凋亡和炎性因子释放。目前对vacA的研究仅次于cagA,其s区和m区各有2个等位基因,vacAs1m1菌株较vacAs1m2具有更强的细胞毒性,而vacAs2m2菌株无细胞毒性,vacAs2m1菌株极为少见[9,19]。iceA有iceA1和iceA2两个等位基因,其中iceA1与胃溃疡发生关系密切[9]。OipA是与菌株黏附有关的一类外膜蛋白,与十二指肠溃疡及胃癌相关[9,20]。上述毒力因子之间相互协同,共同引发疾病[21]。dupA被视为疾病特异性毒力标志基因,与十二指肠溃疡发生有关,尤其在东亚地区关系更为密切[22]。本研究共检测28株幽门螺杆菌,基因型cagA、oipA和vacAs1检出率为100%,未发现vacAs2,与文献报道一致[9]。vacA以基因型vacAs1m2为主,占61%,vacAs1m1占39%,与东南亚主要流行基因型一致[9],与国内浙江、贵州及河西走廊地区报道接近[23-25]。iceA1阳性率为54%,iceA2为21%,符合文献有关iceA基因在不同地区分布的报道[26]。iceA1检出率明显高于iceA2,与国内浙江、内蒙古及贵州地区一致[23-24,27]。dupA阳性率为36%(10/28),与亚洲国家报道的31%相似[9,22]。
生物膜是细菌为在不利环境中存活,而将自身包裹在自分泌的由多糖、胞外DNA、脂质和蛋白构成的胞外聚合物中的一种结构复杂的细菌生态系统[28-29],通过延缓或阻滞抗菌药物渗透及减弱细菌代谢和生长速率,以降低细菌对抗菌药物的敏感度,还能抵抗宿主自身防御系统的免疫效应,引起组织持续炎症反应及损伤,被认为是引发或加重慢性感染的原因[30]。研究表明,幽门螺杆菌在体外和体内均能形成生物膜,生物膜形成后更有利于不同基因之间的交换,从而生成毒力和生存力更强的菌株[31-32]。不同菌株形成生物膜的能力也有差异,相关报道不多。有研究表明,幽门螺杆菌形成生物膜的能力与群体感应基因luxS及cagE4型分泌基因突变有关,ArsS蛋白参与菌株生物膜形成的调控,外膜囊泡中的外膜蛋白AlpB 也起重要作用[33-35]。本研究采用玻片法检测菌株生物膜,发现28株幽门螺杆菌均能在玻片的气液交界面形成生物膜,但形成生物膜的能力不尽相同,与以前报道一致[10,13]。本研究幽门螺杆菌感染病例中,男性感染率略高于女性,患者年龄集中在45~59岁,以慢性萎缩性胃炎为主。进一步分析患者性别、年龄,以及疾病类型、药敏结果、毒力因子等,发现不同年龄组之间生物膜形成能力有差异(P=0.001、0.036、0.002),以45~59岁组最强,其次是<45岁组,≥60岁组最弱,这可能与患者胃内微环境有关。不同性别、疾病类型之间无差异。RUT阳性组与阴性组之间无显著差异。毒力基因型vacAs1/m1与vacAs1/m2之间无统计学差异;iceA1与iceA2及iceA1A2(P=0.014、0.018)之间差异显著,以iceA1生物膜形成能力较强;dupA+与dupA-之间有显著差异(P=0.010),dupA-形成能力较强。克拉霉素和左氧氟沙星耐药组与敏感组之间无差异,但甲硝唑耐药组与敏感组之间有显著差异(P=0.004),甲硝唑敏感组生物膜形成能力较强。因本次入组的实验菌株较少,幽门螺杆菌生物膜形成能力与患者性别、疾病类型等因素的相关性有待进一步研究。
综上所述,本院分离的幽门螺杆菌毒力基因型以cagA、oipA、iceAs1及vacAs1/m2 为主,甲硝唑耐药形势严峻;45~59岁、iceA1+dupA-基因型及对甲硝唑敏感的菌株形成生物膜的能力较强,其可能调控机制有待进一步研究。
[1] Vega AE, Cortias TI, Puig ON, Silva HJ. Molecular characterization and susceptibility testing of Helicobacter pylori strains isolated in western Argentina [J]. Int J Infect Dis, 2010, 14(Suppl 3): e85-e92.
[2] Shanks AM, El-Omar EM. Helicobacter pylori infection,host genetics and gastric cancer [J]. J Dig Dis, 2009, 10(3): 157-164.
[3] Chey WD, Wong BC;Practice Parameters Committee of the American College of Gastroenterology.American College of Gastroenterology guideline on the management of Helicobacter pylori infection[J]. Am J Gastroenterol, 2007, 102(8): 1808-1825.
[4] Teng LJ, Hsueh PR, Huang YH, Tsai JC. Identification of bacteroides thetaiotaomicron on the basis of an unexpected specific amplicon of universal 16S ribosomal DNA PCR [J]. J Clin Microbiol, 2004, 42(4): 1727-1730.
[5] Hooi JK, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, Malfertheiner P, Graham DY, Wong VWS, Wu JCY, Chan FKL, Sung JJY, Kaplan GG, Ng SC. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis [J]. Gastroenterology, 2017, 153(2): 420-429.
[6] Segal I, Otley A, Issenman R, Armstrong D, Espinosa V, Cawdron R, Morshed MG, Jacobson K. Low prevalence of Helicobacter pylori infection in Canadian children: A cross-sectional analysis [J]. Can J Gastroenterol, 2008, 22(5): 485-489.
[7] 张万岱,胡伏莲,萧树东,徐智民.中国自然人群幽门螺杆菌感染的流行病学调查 [J].现代消化及介入诊疗,2010,15(5):265-270.
[8] Suzuki R, Shiota S, Yamaoka Y. Molecular epidemiology, population genetics, and pathogenic role of Helicobacter pylori [J]. Infect Genet Evol, 2012, 12(2): 203-213.
[9] Shiota S, Suzuki R, Yamaoka Y. The significance of virulence factors in Helicobacter pylori [J]. J Dig Dis, 2013, 14(7): 341-349.
[10] Cammarota G, Sanguinetti M, Gallo A, Posteraro B. Review article: biofilm formation by Helicobacter pylori as a target for eradication of resistant infection [J]. Aliment Pharmacol Ther, 2012, 36(3): 222-230.
[11] Percival SL, Suleman L. Biofilms and Helicobacter pylori:dissemination and persistence within the environment and host [J]. World J Gastrointest Pathophysiol, 2014, 5(3): 122-132.
[12] Mégraud F, Lehours P. Helicobacter pylori detection and antimicrobial susceptibility testing [J]. Clin Microbio Rev, 2007, 20(2): 280-322.
[13] Yonezawa H, Osaki T, Kurata S, Fukuda M, Kawakami H, Ochiai K, Hanawa T, Kamiya S. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation [J]. BMC Microbiol, 2009, 9: 197.doi:10.1186/1471-2180-9-197.
[14] Yamaoka Y, Kodama Y, Gutierrez O, Kim JG, Kashima K, Graham DY. Relationship between Helicobacter pylori iceA, cagA, and vacA status and clinical outcome: Studies in four different countries [J]. J Clin Microbiol, 1999, 37(7): 2274-2279.
[15] Vianna JS, Ramis IB, Ramos DF, von Groll A, Silva PE. Drug resistance in Helicobacter pylori [J]. Arq Gastroenterol, 2016, 53(4): 215-223.
[16] Thung I, Aramin H, Vavinskaya V, Gupta S, Park JY, Crowe SE, Valasek MA. Review article: the global emergence of Helicobacter pylori antibiotic resistance [J]. Aliment Pharmacol Ther, 2016, 43(4): 514-533.
[17] Malfertheiner P. Megraud F, O’morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T,El-Omar EM, Kuipers EJ; European Helicobacter Study Group. Management of Helicobacter pylori infection—the Maastricht IV/Florence consensus report [J]. Gut, 2012, 61(5): 646-664.
[18] 牛占岳,宋志强,周丽雅.中国大陆地区成人幽门螺杆菌耐药情况及变迁 [J].中华内科杂志,2016,55(9):734-736.
[19] Atherton JC, Cao P, Peek RM Jr, Tummuru MK, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration [J]. J Biol Chem, 1995, 270(30): 17771-17777.
[20] Yamaoka Y, Ojo O, Fujimoto S, Odenbreit S, Haas R, Gutierrez O, El-Zimaity HM, Reddy R, Arnqvist A, Graham DY. Helicobacter pylori outer membrane proteins and gastroduodenal disease [J]. Gut, 2006, 55(6): 775-781.
[21] Yamaoka Y. Mechanisms of disease: Helicobacter pylori virulence factors [J]. Nat Rev Gastroenterol Hepatol, 2010, 7(11): 629-641.
[22] Shiota S, Matsunari O, Watada M, Hanada K, Yamaoka Y. Systematic review and meta-analysis: the relationship between the Helicobacter pylori dupA gene and clinical outcomes [J]. Gut Pathog, 2010, 2(1): 13.doi: 10.1186/1757-4749-2-13.
[23] 尤建飞.浙江地区幽门螺杆菌临床分离株中cagA、vacA、iceA基因的分布及分析 [D/OL].杭州:浙江大学,2003.http://d.g.wanfangdata.com.cn/Thesis_Y508792.aspx.
[24] 王菲,康沛萍,吴晓娟,陈峥宏.贵阳地区幽门螺杆菌临床分离株中ureA、cagA、vacA、iceA基因的分布及分析 [J].中国人兽共患病学报,2011,27(10):918-920.
[25] 吴戌年,周伟,王猛,甘云飞,景涛,韩俭.河西走廊地域幽门螺杆菌vacA和cagA基因型分布研究 [J].临床消化病杂志,2016,28(4):212-215.
[26] Shiota S, Watada M, Matsunari O, Iwatani S, Suzuki R, Yamaoka Y. Helicobacter pylori iceA,clinical outcomes,and correlation with cagA:a meta-analysis [J]. PLoS One, 2012, 7(1): e30354.
[27] 刘彦琦,苏秉忠,宋建忠.内蒙古地区幽门螺杆菌iceA基因型的分布 [J].内蒙古医学杂志,2008,40(12):1426-1429.
[28] Cammarota G, Branca G, Ardito F, Sanguinetti M, Ianiro G, Cianci R, Torelli R, Masala G, Gasbarrini A, Fadda G, Landolfi R, Gasbarrini G. Biofilm demolition and antibiotic treatment to eradicate resistant Helicobacter pylori:a clinical trial [J]. Clin Gastroenterol Hepatol, 2010, 8(9): 817-820.
[29] Tsuneda S, Aikawa H, Hayashi H, Yuasa A, Hirata A. Extracellular polymeric substances responsible for bacterial adhesion onto solid surface [J]. FEMS Microbiol Lett, 2003, 223(2): 287-292.
[30] Hall-Stoodley L, Stoodley P. Evolving concepts in biofilm infections [J]. Cell Microbiol, 2009, 11(7): 1034-1043.
[31] Stark RM, Gerwig GJ, Pitman RS, Potts LF, Williams NA, Greenman J, Weinzweig IP, Hirst TR, Millar MR. Biofilm formation by Helicobacter pylori [J]. Lett Appl Microbiol, 1999, 28(2): 121-126.
[32] Ehrlich GD, Ahmed A, Earl J, Hiller NL, Costerton JW, Stoodley P, Post JC, Demeo P, Hu FZ. The distributed genome hypothesis as a rubric for understanding evolution in situ during chronic bacterial biofilm infectious processes [J]. FEMS Immunol Med Microbiol, 2010, 59(3): 269-279.
[33] Cole SP, Harwood J, Lee R, She R, Guiney DG. Characterization of monospecies biofilm formation by Helicobacter pylori [J]. J Bacteriol, 2004, 186(10): 3124-3132.
[34] Yonezawa H, Osaki T, Fukutomi T, Hanawa T, Kurata S, Zaman C, Hojo F, Kamiya S. Diversification of the AlpB outer membrane protein of Helicobacter pylori affects biofilm formation and cellular adhesion [J]. J Bacteriol, 2017, 199(6): e00729-16.doi:10.1128/JB.00729-16.
[35] Servetas SL, Carpenter BM, Haley KP, Gilbreath JJ,Gaddy JA, Merrell DS. Characterization of key Helicobacter pylori regulators identifies a role for ArsRS in biofilm formation [J]. J Bacteriol, 2016, 198(18): 2536-2548.
. ZHAO Hu, E-mail:hubertzhao@163.com
RelationshipbetweendrugresistanceandvirulenceofHelicobacterpylorianditsbiofilmformationability
ZHAO Fuju1, HU Binjie1, WANG Xiaofei2, SUN Qijuan1, XIANG Ping3, ZHANG Yanmei1, QU Di2, ZHAO Hu1
1.DepartmentofClinicalLaboratory,HuadongHospitalAffiliatedtoFudanUniversity,Shanghai200040,China; 2.KeyLaboratoryofMedicalMolecularVirologyofMinistriesofEducationandHealth,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China; 3.DepartmentofEndoscopy,HuadongHospitalAffiliatedtoFudanUniversity,Shanghai200040,China
To investigate the drug resistance and virulence ofHelicobacterpylori(H.pylori) strains, and explore their relationship with the infection characteristics and biofilm formation ability, gastric mucosa biopsy samples and related clinical data were collected from Huadong Hospital Affiliated to Fudan University between December 2014 and June 2015.H.pyloristrains isolated from these clinical samples were subjected to drug resistance assay, virulence gene assay and biofilm-forming assay. Twenty-eightH.pyloristrains were acquired. The resistance rates to levofloxacin (LEV), metronidazole (MTZ), clarithromycin (CLA) and amoxicillin (AMX) were 32%, 75%, 11% and 0, respectively. The single and double resistance rates were 61% (17/28) and 36% (10/28), respectively. The detection rates of virulence genescagA,oipAandvacAs1 were 100%, and novacAs2 was detected.vacAs1m2 genotype accounted for 61% (17/28), followed byvacAs1m1(11/28, 39%). The prevalence rates oficeA1,iceA2 andiceA1iceA2 were 54% (15/28), 21% (6/28), 25% (7/28), respectively. The detection rate ofdupAwas 36% (10/28). The biofilm-forming ability of 28 strains varied. Single factor and independent samplettest analysis showed that strains isolated from 45-59 years old patients,iceA1+dupA-genotype, metronidazole-sensitive strains could form stronger biofilm. In conclusion, the resistance rate ofH.pylorito metronidazole was highest in single resistance, and the double resistance should not be neglected. The main genotypes ofH.pyloriisolates werecagA,oipA,vacAs1m2. TheH.pyloribiofilm-forming ability is related to the age of patients. Specifically, strains isolated from the age 45-59 group have stronger biofilm-forming ability than those obtained from other age groups. In addition, isolates carrying the virulence geneiceA1 have strong biofilm-forming ability. And there is a negative correlation betweendupAgenotype or metronidazole resistance and the biofilm-forming ability of theH.pyloriisolates.
Helicobacterpylori; Biofilm formation; Drug resistance; Virulence gene
上海市科学技术委员会科研计划项目(14ZR1413100、14411962800、 16411968000),上海申康医院发展中心市级医院临床辅助科室能力建设项目(SHDC22014003)
赵虎
2017-05-05)
《微生物与感染》2018年征订启事
《微生物与感染》重点介绍国内外微生物学基础研究与临床相结合的研究成果和新进展,内容涉及与人类、动物和植物感染有关的微生物,如病毒、细菌、真菌、立克次体、螺旋体、支原体等的生物学及分子生物学特性、抗感染免疫、实验室诊断技术以及临床感染等方面的研究。主要栏目有特约专稿、论著、病例分析、综述等。可供从事微生物与感染的教学、科研、医疗等工作者参考。欢迎广大读者到当地邮局订阅。

双月25日出版 统一刊号:ISSN 1673-6184 CN 31-1966/R 邮发代号:4-341
定价:20.00元/册 全年定价:120.00元
《微生物与感染》编辑部

