固定化脂肪酶催化花生油转酯化特性研究
成 磊,李 泉,葛保胜,于道永
(中国石油大学(华东)化学工程学院 生物工程与技术中心,山东 青岛 266580)
固定化脂肪酶催化花生油转酯化特性研究
成 磊,李 泉,葛保胜,于道永*
(中国石油大学(华东)化学工程学院 生物工程与技术中心,山东 青岛 266580)
利用固定化洋葱假单胞菌脂肪酶催化花生油与甲醇进行酯交换反应,考察了反应时间、反应温度、酶用量、醇油比、含水量等因素对转酯化率的影响,研究了花生油中主要脂肪酸的酶催化转酯化特性。通过正交实验确定最优转酯化条件为:花生油用量3 g、反应时间48 h、反应温度35 ℃、酶用量450 mg、醇油比3∶1、含水量8%,在此条件下,花生油转酯化率达到90.58%。花生油中主要脂肪酸转酯化的影响因素显著性以及转酯化的最优反应条件并不相同,表明花生油中不同脂肪酸的固定化洋葱假单胞菌脂肪酶催化转酯化特性有所不同。
固定化脂肪酶;转酯化;花生油;甲醇
随着化石资源的日益枯竭以及生态意识的不断增强,人们正不断开发可再生能源,如太阳能、水能、风能、重力能和生物质能等[1]。生物柴油已成为全球新能源领域的研究热点[2]。生物柴油是以植物油脂、动物油脂、废弃油脂等为原料,与醇经过酯交换反应和酯化反应生成的脂肪酸烷基酯,以脂肪酸甲酯(FAME)为主。生物柴油的制备工艺条件因原料不同而有所差异[3];对于工艺条件的优化,多采用正交法[4]和响应面法[5]。生物柴油制备技术主要有混合法、微乳液法、热解法、酯交换法等[6-7],其中酸碱催化剂催化的酯交换法存在工艺复杂、环境污染严重、产品不易回收等缺点,所以研究人员将目光转移到生物催化剂——生物酶上。用于制备生物柴油的生物酶大多是真菌类脂肪酶,通过吸附、交联、包埋等方法对酶进行固定化,可方便酶从反应体系中分离和重复利用,降低生产成本[8]。固定化洋葱假单胞菌脂肪酶催化效率相对较高,是目前在生物柴油制备中应用最广泛的脂肪酶之一[9],对甲醇具有很好的抗性[10],可以一次性加入反应所需的甲醇。Shah等[11]利用洋葱假单胞菌脂肪酶催化麻风树油,转化率达到了98%。
基于Kaieda等[10]、Noureddini等[12]、Li等[13]的单因素实验结果,作者以精制花生油为原料在固定化洋葱假单胞菌脂肪酶的催化下与甲醇进行酯交换反应,采用正交实验优化转酯化条件;并通过比较转酯化条件对花生油中不同脂肪酸转酯化率的影响,探究了花生油中主要脂肪酸的酶催化转酯化特性,以期为花生油中各脂肪酸组分的高效利用提供帮助。
1 实验
1.1 材料与试剂
花生油(鲁花5S压榨一级);固定化洋葱假单胞菌脂肪酶(lipase immobilized on Immobead 150 fromPseudomonascepacia54327-10G)、十七烷酸甲酯(≥99%),Sigma公司;脂肪酸甲酯标样(FAME Mix C8~C24),Supelco公司。
正己烷、无水甲醇等均为分析纯国药试剂。
1.2 转酯化条件优化
在前期单因素实验的基础上,参照文献[8,12-13],以反应时间(12 h 、24 h、36 h、48 h、60 h)、反应温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)、酶用量(90 mg、180 mg、270 mg、360 mg、450 mg)、醇油比(3∶1、4∶1、5∶1、6∶1、7∶1)、含水量(相对于油的质量百分比,4%、6%、8%、10%、12%)为考察因素,通过5因素5水平正交实验优化转酯化条件。
1.3 内标液的配制
取100 mg十七烷酸甲酯于100 mL容量瓶中,加入正己烷溶解,定容,得到1 mg·mL-1的十七烷酸甲酯溶液。
1.4 气相色谱条件
采用Agilent 7890B 型气相色谱仪进行气相色谱分析。FID检测器;HP-5毛细管色谱柱;进样口温度280 ℃;检测器温度300 ℃;升温程序:初始柱温50 ℃,保持2 min,10 ℃·min-1升温至280 ℃,保持10 min;氮载气流速2.3 mL·min-1;分流比30∶1;进样量1 μL。
1.5 转酯化率的测定
将所得样品多次水洗、离心,取上清液10 mg于2 mL离心管中,加入1 mL内标液,混合均匀,进行气相色谱分析。依据脂肪酸甲酯标样中各组分的相对保留时间定性,选择样品中不含的十七烷酸甲酯作为内标物,以峰面积法定量。按下式计算脂肪酸转酯化率:
十七烷酸甲酯的质量上清液的质量
1.6 花生油中脂肪酸的酶催化转酯化特性分析
花生油中的脂肪酸主要有棕榈酸(C16:0)、油酸(C18:1)、亚油酸(C18:2),少量的硬脂酸(C18:0)、花生酸(C20:0)、山嵛酸(C22:0)[14]及微量的亚麻酸(C18∶3)[15]。采用脂肪酸甲酯标样相对保留时间对各色谱峰所代表的脂肪酸进行定性、相对峰面积定量,分析花生油中脂肪酸的酶催化转酯化特性。
2 结果与讨论
2.1 正交实验结果与分析
以脂肪酸转酯化率为评价指标,设计5因素5水平正交实验优化转酯化条件,结果与分析见表1,方差分析见表2。
从表1、2可知,转酯化率随酶用量的增加而升高;醇油比不能太大,即醇用量不能过多,因为过量的甲醇对脂肪酶有一定的毒害作用[1]。各因素对脂肪酸转酯化率的影响大小依次为:含水量>酶用量>反应温度>醇油比>反应时间。固定化脂肪酶催化花生油转酯化的最优条件为:反应时间48 h、反应温度35 ℃、酶用量450 mg、醇油比3∶1、含水量8%,在此条件下,花生油转酯化率可达90.58%。
2.2 花生油中脂肪酸的酶催化转酯化特性
在醇油比为6∶1、反应时间为3 h、反应温度为60 ℃、KOH用量为1%的条件下进行碱催化反应,并通过气相色谱分析内标法定量确认转酯化率达到了100%,获得的花生油中主要脂肪酸组成及含量如下:棕榈酸 11.33%、亚油酸 30.26%、油酸 46.00%、硬脂酸 3.81%,与Carrín等[16]和郑畅等[17]所报道的一致。
花生油中主要脂肪酸在不同反应条件(表1所列25组实验条件)下的转酯化率如图1所示。
从图1可以看出,棕榈酸在第9组实验条件下的转酯化率最高,为91.85%;亚油酸、油酸、硬脂酸均在第12组实验条件下的转酯化率最高,分别为80.31%、85.30%、82.76%。在最优转酯化条件(反应时间48 h、反应温度35 ℃、酶用量450 mg、醇油比3∶1、含水量8%)下,亚油酸、油酸、硬脂酸的转酯化率均有所提升,分别为89.33%、89.13%、88.69%;而棕榈酸的转酯化率变化不大,为91.71%。表明,低碳数的棕榈酸在固定化脂肪酶催化下更易于转酯化。
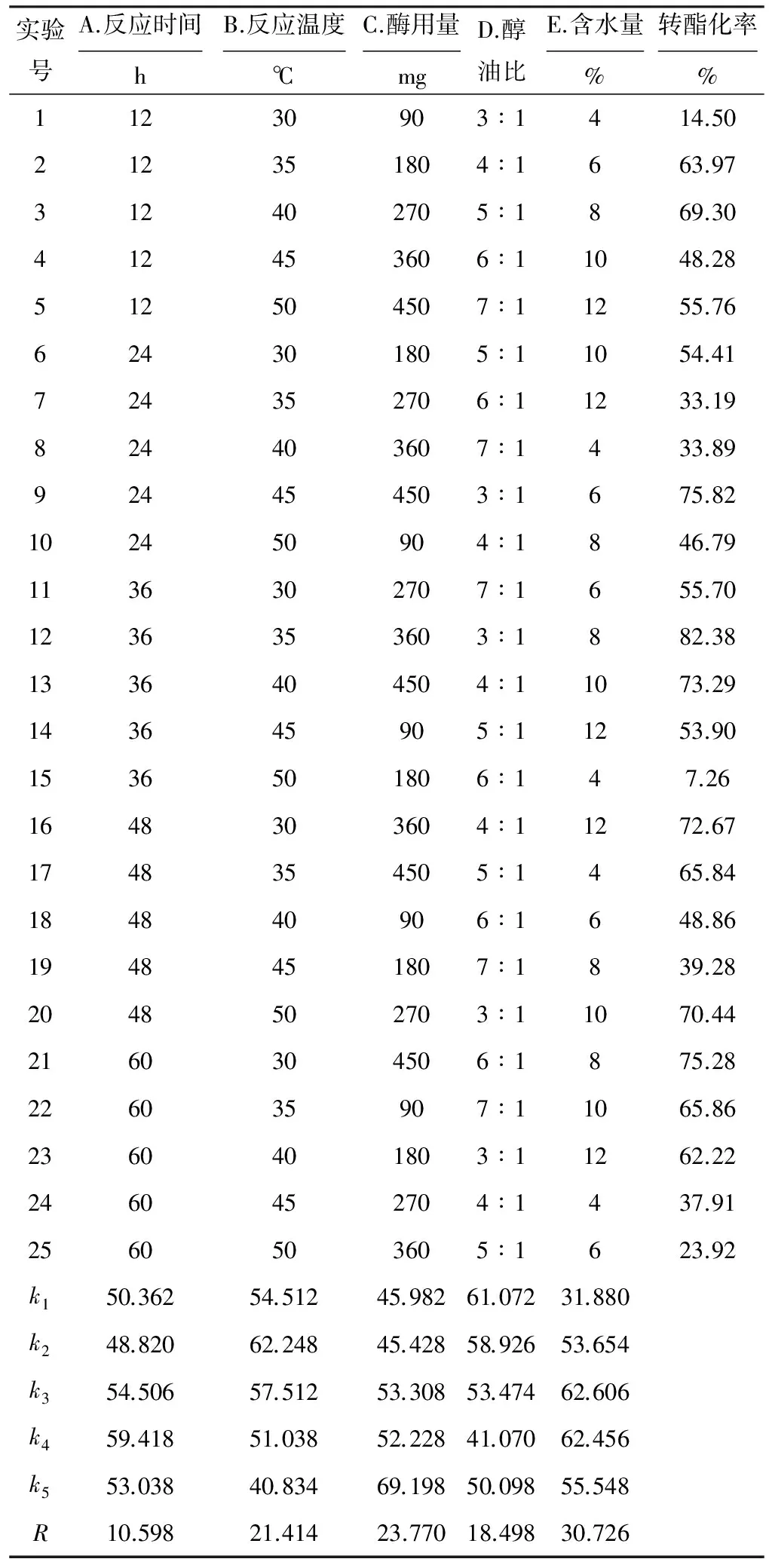
表1 正交实验结果与分析
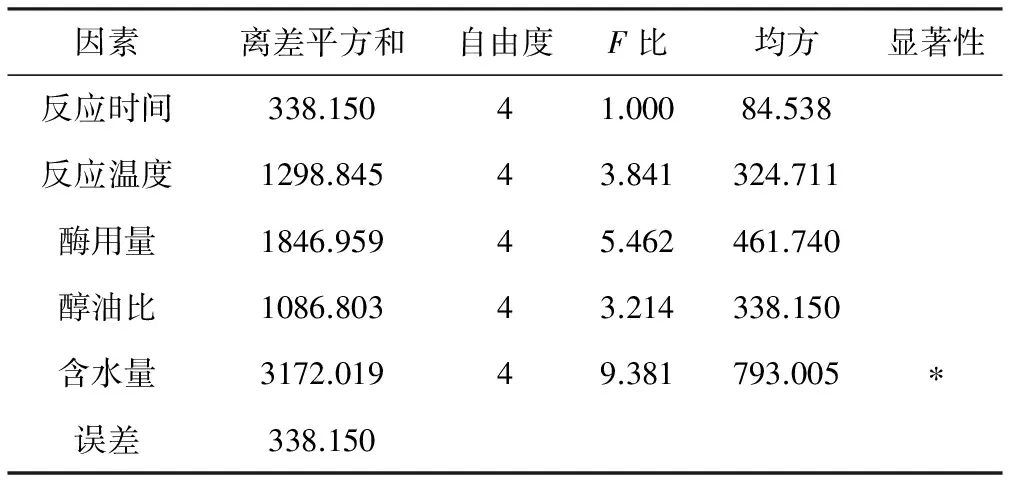
表2 方差分析
由于花生油中主要脂肪酸的转酯化率在不同实验条件下有所差异,因此,采用正交实验分析花生油中主要脂肪酸转酯化影响因素的显著性以及最优转酯化条件,结果见表3。
从表3可以看出,花生油中各主要脂肪酸转酯化影响因素的显著性并不相同;硬脂酸的影响因素显著性与正交实验得到的花生油脂肪酸转酯化影响因素显著性相同;C18总脂肪酸(硬脂酸、亚油酸、油酸、亚麻酸)含量占花生油的80%,其最优转酯化条件与花生油脂肪酸最优转酯化条件相同,但影响因素显著性有所差异。表明,花生油中不同脂肪酸的固定化洋葱假单胞菌脂肪酶催化转酯化特性有所不同。
3 结论
以催化效率较高且无污染的固定化洋葱假单胞菌脂肪酶替代环境破坏性较大的酸碱催化剂催化花生油与甲醇的酯交换反应,在确保较高转酯化率、较少能耗的情况下,通过正交实验得到最优转酯化条件:反应时间48 h、反应温度35 ℃、酶用量450 mg、醇油比3∶1、含水量8%,在此条件下,花生油转酯化率为90.58%。花生油中各主要脂肪酸的转酯化率与实验条件密切相关,影响因素的显著性并不相同,最优转酯化条件也有所差异。表明,花生油中不同脂肪酸的固定化洋葱假单胞菌脂肪酶催化转酯化特性有所不同,低碳数的棕榈酸在固定化脂肪酶催化下更易于转酯化。该研究为生物法制备生物柴油工艺参数的优化以及花生油中脂肪酸组分的经济、高效利用提供了帮助。
[1] SZCAESNA-ANTCZAK M,KUBIAK A,ANTCZAK T,et al.Enzymatic biodiesel synthesis-key factors affecting efficiency of the process[J].Renewable Energy,2009,34(5):1185-1194.
[2] 徐汉生.可再生能源——生物燃料[J].化学与生物工程,2005,22(11):1-4.
[3] EEVERA T,RAJENDRAN K,SARADHA S.Biodiesel production process optimization and characterization to assess the suitability of the product for varied environmental conditions[J].Renewable Energy,2009,34(3):762-765.
[4] 陶站华,张搏.非均相催化剂两步法催化潲水油制备生物柴油[J].化学与生物工程,2010,27(7):69-72.
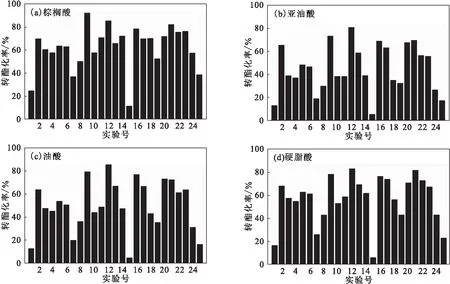
图1 花生油中主要脂肪酸在不同反应条件下的转酯化率Fig.1 Transesterification rates of major fatty acids in peanut oil under different reaction conditions

表3花生油中主要脂肪酸转酯化的影响因素显著性及最优条件
[5] 陆继源,王小三,金青哲,等.响应面优化酶法酯交换催化合成中长链结构甘三酯[J].中国油脂,2017,42(5):15-19.
[6] 王一平,翟怡,张金利,等.生物柴油制备方法研究进展[J].化工进展,2003,22(1):8-12.
[7] 赖红星,万霞,江木兰.生物柴油生产技术的研究进展[J].化学与生物工程,2010,27(5):11-15.
[8] 夏亚穆,焦斌.非均相催化法生产生物柴油的研究进展[J].化学与生物工程,2012,29(3):6-8.
[9] 舒正玉,杨江科,黄瑛,等.生物柴油生产用脂肪酶资源及研发现状[J].湖北农业科学,2007,46(6):1027-1031.
[10] KAIEDA M,SAMUKAWA T,KONDO A,et al.Effect of methanol and water contents on production of biodiesel fuel from plant oil catalyzed by various lipases in a solvent-free system[J].Journal of Bioscience and Bioengineering,2001,91(1):12-15.
[11] SHAH S,GUPTA M N.Lipase catalyzed preparation of biodiesel fromJatrophaoil in a solvent free system[J].Process Biochemistry,2007,42(3):409-414.
[12] NOUREDDINI H,GAO X,PHILKANA R S.ImmobilizedPseudomonascepacialipase for biodiesel fuel production from soybean oil[J].Bioresource Technology,2005,96(7):769-777.
[13] LI Q,YAN Y J.Production of biodiesel catalyzed by immobilizedPseudomonascepacialipase fromSapiumsebiferumoil in micro-aqueous phase[J].Applied Energy,2010,87(10):3148-3154.
[14] AKHTAR S,KHALID N,AHMED I,et al.Physicochemical characteristics,functional properties,and nutritional benefits of peanut oil:a review[J].Critical Reviews in Food Science and Nutrition,2014,54(12):1562-1575.
[15] CASINI C,DARDANELLI J L,MARTNEZ M J,et al.Oil quality and sugar content of peanuts(Arachishypogaea) grown in Argentina:their relationship with climatic variables and seed yield[J].Journal of Agricultural and Food Chemistry,2003,51(21):6309-6313.
[17] 郑畅,杨湄,周琦,等.高油酸花生油与普通油酸花生油的脂肪酸、微量成分含量和氧化稳定性[J].中国油脂,2014,39(11):40-43.
TransesterificationofPeanutOilCatalyzedbyImmobilizedLipase
CHENG Lei,LI Quan,GE Bao-sheng,YU Dao-yong*
(CenterforBioengineeringandBiotechnology,CollegeofChemicalEngineering,ChinaUniversityofPetroleum(EastChina),Qingdao266580,China)
We studied transesterification of peanut oil with methanol catalyzed by immobilizedPseudomonascepacialipase,investigated the effects of reaction time,reaction temperature,enzyme dosage,methanol-oil ratio,and water content on transesterification rate,and discussed transesterification characteristics of major fatty acids in peanut oil.The optimal transesterification conditions were obtained by an orthogonal experiment as follows:peanut oil dosage of 3 g,reaction time of 48 h,reaction temperature of 35 ℃,enzyme dosage of 450 mg,methanol-oil ratio of 3∶1,and water content of 8%.Under above conditions,the transesterification rate of peanut oil reached 90.58%.The significance of influencing factors and the optimal reaction conditions for transesterification of major fatty acids in peanut oil were not identical,which indicated that different fatty acids in peanut oil had different transesterification characteristics catalyzed by immobilizedPseudomonascepacialipase.
immobilized lipase;transesterification;peanut oil;methanol
国家重点研发计划国际科技创新合作重点专项(2016YFE0106700),山东省自然科学基金项目(ZR2014BM013),中央高校基本科研业务费专项资金项目(17CX05013)
2017-08-12
成磊(1993-),男,山东临朐人,硕士研究生,研究方向:生物能源,E-mail:chenglei4372@163.com;通讯作者:于道永,博士,副教授,E-mail:daoyong@upc.edu.cn。
10.3969/j.issn.1672-5425.2017.12.003
成磊,李泉,葛保胜,等.固定化脂肪酶催化花生油转酯化特性研究[J].化学与生物工程,2017,34(12):10-13.
TQ646 Q556
A
1672-5425(2017)12-0010-04

