恒温热隔绝式PCR技术的原理与应用
王 娟,卞国志,王贵平,袁建丰*
(1.广东海洋大学畜牧兽医研究院有限公司,广东广州 511400;2.华南农业大学兽医学院,广东广州 510642)
恒温热隔绝式PCR技术的原理与应用
王 娟1△,卞国志1,2△,王贵平1,袁建丰1*
(1.广东海洋大学畜牧兽医研究院有限公司,广东广州 511400;2.华南农业大学兽医学院,广东广州 510642)
由于常规PCR所使用的加热机制为热传导的热循环仪,需要一个精密的数字控制器来快速加热和冷却样品。近年来,越来越多的研究致力于开发一种快速、便携式的核酸检测PCR平台。而自然对流作为另一种热转换方式,能促进液体自发反复循环以提供工作所需的变性、退火和延伸温度,在核酸检测领域有很大的应用前景。恒温热隔绝式PCR(insulated isothermal PCR,iiPCR)就是采用Rayleigh-Be′nard自然对流原理,利用仪器底部单一热源对特殊聚碳酸酯毛细反应管底部的紫铜圈接触加热,毛细管上部置入隔热挡板,上下的温度差从而使毛细管内部流体对流自发形成可供PCR扩增反应的连续的温度梯度,LED屏上直接显示检测结果。与传统的PCR检测方法相比,具有操作简便、快速高效、特异性强、仪器成本低等优点,已开始运用于临床各种病原体的检测。
聚合酶链反应;瑞利-本纳德对流;恒温热隔绝式PCR
聚合酶链反应(PCR)是用于扩增特异性核酸序列的技术[1],由于其高特异性和敏感性,成为动植物及人类病原检测的重要工具之一[2-5]。常规PCR过程需要使用一个精密的热控制器反复加热和冷却样品,通常为25~50个循环,整个反应需2 h~3 h,其中大部分时间消耗于DNA变性加热和退火及延伸的冷却过程,难以实现高效和高通量。在早期发展阶段,由于常规PCR热循环仪的尺寸较大,价格偏高和加热时间较长等原因限制了其在医院和实验室的使用。近年来,开发的新平台致力于缩短扩增时间,一种方法是通过高电力珀尔帖元件的使用来提高温度斜坡变化的速率[6-9],使PCR总体扩增时间从2 h~3 h缩短到30 min~40 min,但这种提高温度斜坡变化效率的方法需要比传统的热循环仪更精密且更昂贵的热控制器。另一种方法是用一个专门设计的微流控芯片全部更换的热循环仪,该平台将试剂在微通道内通过3个区域在不同的固定温度下循环,虽然微机电系统(MEMS)制造生物芯片的方法可以显著缩小这种系统的尺寸,但是此种系统需要额外的泵源、复杂的微通道设计以及同时运行两个或3个温度控制器[10-12]。
封闭体系内流体自动对流可以形成稳定的温度梯度,可以应用于DNA的扩增[13],当样品中的试剂反复通过自然对流驱动的不同温度区循环时,样品在单循环中同时进行PCR循环的3个步骤—核酸变性、退火和延伸,而且对流PCR平台不需要常规PCR仪中最昂贵的组件——精密的热控制器,就能将扩增时间从数小时缩短至30 min~40 min[14-15]。然而,目前对流PCR系统使用2个或2个以上的独立的温度控制器和复杂的设计,需要特定形状的塑料管或额外的腔室进行流体循环[16-18]。此外,很少有研究检验传统和对流PCR之间引物和扩增片段的设计的差异,限制了对流PCR的多功能应用。
本文介绍了一种应用对流的新平台——恒温热隔绝式PCR(iiPCR),利用仪器底部单一热源加热,使毛细管内部液体自然对流形成PCR各步骤反应所需温度,达到扩增的目的。iiPCR作为一种快速、便捷、低廉的检测平台具有非常广阔的应用前景。
1 瑞利-本纳德对流PCR
1.1 原理
Krishnan M等[13]在Science上首次报道了利用圆盘腔体内自然对流Rayleigh-Be′nard (瑞利-本纳德)原理(图1)进行PCR扩增的方法,即将PCR反应液置于一个封闭的柱形反应腔内,反应腔的上下表面分别进行恒温控制(上端温度为61℃,下端温度为97℃),并通过数值模拟研究了几何尺寸对自然对流稳定性的影响以及腔体内不同位置处流体温度随时间的变化,通过上下表面的温差驱动液体经过不同的温区自发形成自然对流,达到PCR各步骤所需的热循环实现PCR扩增。
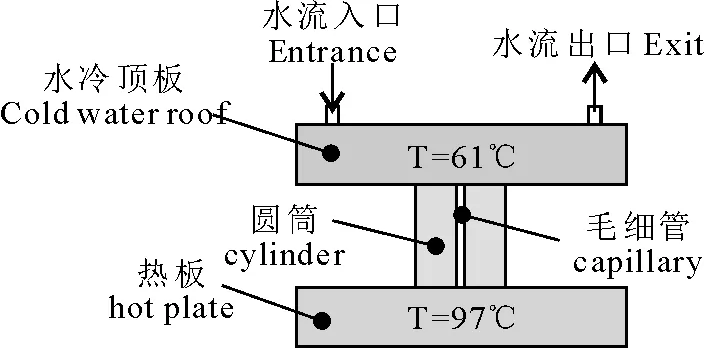
图1 瑞利-本纳德PCR原理图
1.2 优缺点
1.2.1 优点 RB系统简单,利用自然对流来形成PCR所需要的热循环温度,大幅缩短了反应时间,提高了反应效率。另外,该方法不需要改变器件的温度,也不需要外加驱动来实现样品的流动,只需要一个反应腔,并控制其上下两端的温度为恒温,就可以实现PCR扩增,因此容易装置,加工成本降低。更高层次的流体力学装置及优化流体系统的研究也许可进一步改善和提高此系统潜在的多功能用途。
1.2.2 缺点 反应利用几何学浮力驱动原理,衡量自然对流的无量纲数是Ra=gα(T2-T1)h3/vk,α是流体热膨胀系数,g是重力加速度,T1和T2分别是腔体的上下表面温度,h是腔体的高度,v和k分别是运动粘度和热扩散率。对于封闭腔内的RB对流,Ra流动越不稳定,流动由层流变成湍流的Ra是104数量级,而Krishnan等文献中的模型瑞利系数太大,容易导致对流不稳定,所以反应重复性差,反应效率低且对环境温度敏感。
1.3 应用
2003年Braun D等[19]建立分层对流模型能在25 min内使DNA片段达到100 000倍的扩增。具体方法是将样品置于薄圆腔体内,腔体中央红外光加热器在中心聚焦加热,腔体中心达到95℃,而腔体的周壁保持在52℃,这样圆盘内就产生了由恒定水平温度方向形成的对流,实现PCR所需的热循环。此种方法瑞利系数小,对流稳定,但由于需要引入外源的加热器,且形成的对流体系中,高温和底温的恒温区位于中心和外侧壁,使流体停留在95℃的时间较短,不利于PCR充分进行。
由于RB-PCR系统非常简单,可以很容易地在任何实验室组装。可以通过改善在高纵横比腔的对流特征和优化流动系统PCR的研究,来优化和进一步提高该系统的潜在的多功能性。
2 毛细管对流PCR
2.1 原理
参考Rayleigh-Be′nard对流PCR的原理, 毛细管对流PCR(capillary convective PCR,CCPCR)检测平台无需复杂的微流控芯片设计、特殊的管道或容器,将毛细管安装在固定温度为95℃的加热器上,被连续加热的毛细管底部通过对流驱动最底部分的样品上升,同时变性模板,由于毛细管上部与空气接触,上升的这部分样品的温度迅速被周围空气冷却,当样品到达管的顶部附近的冷却区域时已经退火和延伸,然后DNA模板下沉,并再次加热,PCR循环以自然对流这种方式得以实现。
CCPCR反应前需要把包含样品的整个毛细管置于装置右端的加热器加热10 min热启动Taq酶,再转移至左端塑料架上,由单一热源加热底部引起自然对流从而进行PCR扩增反应30 min[20]。
2.2 优缺点
2.2.1 优点 仪器设备和操作简单,不需要任何复杂的硬件设施,只需要一个简单的加热装置,因此电蚊香也可以用来进行PCR;扩增时间大大缩短,从原来的2 h~3 h缩减到30 min~40 min。
2.2.2 缺点 由于毛细管除底部外全暴露在空气中,所以环境温度及风速的变化都对CCPCR反应有影响,另外CCPCR要求重新设计并优化引物及扩增片段,当扩增片段小于500 bp、引物溶解温度较高、变性温度较低时,试验结果更佳。
2.3 应用
Chou W P 等[20]建立了毛细管对流PCR平台,成功扩增出3个病毒的基因组,研究中此方法的敏感性和扩增的效率性均高于普通PCR方法,通过试验验证发现CCPCR适合室内(4℃~33℃)除特别炎热的区域外操作。
由于CCPCR除大大缩短反应时间外所需仪器设备简单,价格低廉,实验操作方便,适用于临床及基层室内的核酸快速诊断,具有较大的应用前景。
3 恒温热隔绝式PCR
3.1 原理
恒温热隔绝式PCR(insulated isothermal PCR, iiPCR)仍沿用Rayleigh-Be′nard对流的原理,利用仪器底部单一热源对特殊聚碳酸酯毛细反应管底部上方2 mm处覆盖一圈2.5 mm厚的紫铜圈进行接触加热,使毛细管底部维持恒定95℃,毛细管上部置入隔热挡板,上下部的温度差从而使毛细管内部流体自发对流,形成可供PCR扩增反应的连续的温度梯度。 iiPCR是对CCPCR装置继续改造优化,显著降低了环境温度波动对PCR扩增的影响,使反应可在风洞以及室温较低条件下进行。具体优化隔热装置体现在装置中铝合金可隔离管周围水平和垂直空气对流,隔绝毛细管外部的影响,仪器底部的单一加热装置覆盖聚碳酸酯以减少热辐射,毛细管底部上方加入的隔热板,减少环境温度影响,使毛细管内部形成的对流更加稳定[21]。另外,操作系统中加入荧光收集装置、滤波器、集成电路及液晶显示屏幕等,使iiPCR装置不仅可以检测DNA,还可以检测RNA,若反应加入特异性探针,只需将含反应试剂的毛细管置于装置中反应,任何检测结果在1 h内可在仪器的液晶显示屏上直接读取,显示为阴性(-)、阳性(+)或者可疑(?)[22]。
3.2 优缺点
3.2.1 优点 操作简单、反应时间短,1 h内便可检测出结果。隔热效果好,可在风洞以及室温较低条件下进行试验,方便携带,实现在室外快速进行PCR扩增操作;仪器成本低,仅需上千元;并有着与普通PCR相适应的高特异性及高敏感性。
3.2.2 缺点 由于iiPCR的高敏感性,所需引物特异性较高,因此iiPCR引物设计要求较高,如引物长度推荐在18 bp~22 bp,扩增目的片段在70 bp~150 bp为佳(100 bp内更好),GC含量45%~60%,引物Tm值在56℃~60℃之间。另外,探针的合成费用较高,且探针的设计也应遵循说明书原则,如引物长度应大于13 bp (增强特异性)且小于30 bp(保持最佳猝火效果)。
3.3 应用
有研究改造发明此装置,分别测试了环境温度分别为38℃、45℃以及不稳定空气流速的环境下iiPCR扩增结果,试验证明加入隔热装置可显著降低环境温度波动对PCR的影响,当环境温度从10℃升到28℃时,毛细管温度仅升高1.5℃,温度波动降低到0.11℃~0.14℃。此外,在风洞中试验毛细管温度仅下降1.8℃;并且在模板同样拷贝数的条件下,隔热装置对流PCR扩增条带比CCPCR明亮清晰[23]。同年Tsai Y L 等[21]成功建立了白斑综合征病毒iiPCR检测方法,该方法特异性、敏感性均良好。
由于扩增产物需要通过琼脂糖凝胶电泳来检测反应结果这一后续步骤,限制了iiPCR的应用。2012年Tsai Y L等[22]在iiPCR装置的基础上继续优化改造,加入由集成控制电路、LED、滤光器以及荧光收集装置等构成的光学系统,只需在反应时加入具有水解性探针,即可直接在仪器上通过荧光显示系数判断扩增结果。研究者通过数次实验找出阴性结果与阳性结果荧光阈值,发现S/N(反应后与反应前荧光信号强度的比值)小于1.34时,表示扩增结果为阴性。此方法敏感性可比普通PCR,在只要有模板DNA含量的情况下,30 min内即可检测出扩增的目的条带,但此方法中要求探针只有在扩增出目的片段时才能发出荧光,且探针引物设计长度尽可能短。
最新研制的pockit智能型手提式核酸分析仪,可荧光定性检测DNA及RNA,检测的准确度和敏感性极高,整体操作极为简单,PCR反应总反应时间仅需58 min,包括前10 min的反转录过程和48 min的核酸扩增时间,反应结束后检验结果直接显示在LED屏幕上(阴性或者阳性,问号表示结果可疑),并存储在机器的SD卡上。由于此仪器方便易携,操作简便快捷,迅速运用于临床实验室检测[24-31]。
4 展望
恒温热隔绝式PCR由于其高效性,扩增时间小于1 h;高敏感性,最低检测限度一般在30个拷贝数以下;方便快捷性,可直接观察检测结果;操作简单,无需训练精良的实验操作人员及复杂精密的仪器;成本低,仪器价格远远低于普通PCR仪等优点,已经在临床核酸快速检测方向显示其优势,该检测手段将作为分子生物学一种快速检测技术广泛运用于各种病原体核酸的快速诊断领域,为及时控制传染病和临床快速诊断疾病提供技术支撑。
[1] Saiki R K,Scharf S,Faloona F,et al.Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia[J].Science,1985,230(4732):1350-1354.
[2] Dwivedi H P,Jaykus L A.Detection of pathogens in foods:the current state-of-the-art and future directions[J].Crit Rev Microbiol,2011,37(1):40-63.
[3] Alvarez A M.Integrated approaches for detection of plant pathogenic bacteria and diagnosis of bacterial diseases[J].Annu Rev Phytopathol,2004,42:339-366.
[4] Briese T,Palacios G,Kokoris M,et al.Diagnostic system for rapid and sensitive differential detection of pathogens[J].Emerg Infect Dis,2005,11(2):310-313.
[5] Mahony J B.Nucleic acid amplification-based diagnosis of respiratory virus infections[J].Expert Rev Anti Infect Ther,2010,8(11):1273-1292.
[6] Belgrader P,Benett W,Hadley D,et al.PCR detection of bacteria in seven minutes[J].Science,1999,284(5413):449-450.
[7] Feldkotter M,Schwarzer V,Wirth R,et al.Quantitative analyses of SMN1 and SMN2 based on real-time light cycler PCR:fast and highly reliable carrier testing and prediction of severity of spinal muscular atrophy[J].Am J Hum Genet,2002,70(2):358-368.
[8] Emanuel P A,Bell R,Dang J L,et al.Detection of Francisella tularensis within infected mouse tissues by using a hand-held PCR thermocycler[J].J Clin Microbiol,2003,41(2):689-693.
[9] Tafe L J,Belloni D R,Tsongalis G J.Detection of the C282Y and H63D polymorphisms associated with hereditary hemochromatosis using the ABI 7500 fast real time PCR platform[J].Diagn Mol Pathol,2007,16(2):112-115.
[10] Kopp M U,Mello A J,Manz A.Chemical amplification:continuous-flow PCR on a chip[J].Science,1998,280(5366):1046-1048.
[11] Oh K W.World-to-chip microfluidic interface with built-in valves for multichamber chip-based PCR assays[J].Lab Chip,2005,5(8):845-850.
[12] Lien K Y,Lee W C,Lei H Y,et al.Integrated reverse transcription polymerase chain reaction systems for virus detection[J].Biosens Bioelectron,2007,22(8):1739-1748.
[13] Krishnan M,Ugaz V M, Burns M A.PCR in a Rayleigh-Be′nard convection cell[J].Science,2002,298(5594):793.
[14] Braun D,Goddard N L, Libchaber A.Exponential DNA replication by laminar convection[J].Phys Rev Lett,2003,91(15):158103.
[15] Chen Z,Qian S,Abrams W R,et al.Thermosiphon-based PCR reactor:experiment and modeling[J].Anal Chem,2004,76(13):3707-3715.
[16] Krishnan M,Agrawal N,Burns M A,et al.Reactions and fluidics in miniaturized natural convection systems[J].Anal Chem,2004,76(21):6254-6265.
[17] Zhang C, Xing D.Parallel DNA amplification by convective polymerase chain reaction with various annealing temperatures on a thermal gradient device[J].Anal Biochem,2009,387(1):102-112.
[18] Chung K H,Park S H, Choi Y H.A palmtop PCR system with a disposable polymer chip operated by the thermosiphon effect[J].Lab Chip,2010,10(2):202-210.
[19] Braun D,Goddard N L, Libchaber A.Exponential DNA replication by laminar convection[J].Phys Rev Lett,2003,91(15):158103.
[20] Chou W P,Chen P H,Miao M J,et al.Rapid DNA amplification in a capillary tube by natural convection with a single isothermal heater[J].Biotechniques,2011, 50 (1) :52.
[21] Tsai Y L,Wang H T,Chang H F,et al.Development of TaqMan probe-based insulated isothermal PCR (iiPCR) for sensitive and specific on-site pathogen detection[J].PLoS One,2012,7(9):e45278.
[22] Tsai Y L,Lin Y C,Chou P H,et al.Detection of white spot syndrome virus by polymerase chain reaction performed under insulated isothermal conditions[J].J Virol Meth,2012.181(1):134-137.
[23] Chang H G,Tsai Y L,Tsai C F,et al.A thermally baffled device for highly stabilized convective PCR[J].Biotechnol J,2012.7(5):662-666.
[24] Wilkes R P,Tsai Y L,Lee P Y,et al.Rapid and sensitive detection of canine distemper virus by one-tube reverse transcription-insulated isothermal polymerase chain reaction[J].BMC Vet Res,2014, 10 (1) :1-8.
[25] Lung O,Pasick J,Fisher M,et al.Insulated isothermal reverse transcriptase PCR (iiRT-PCR) for rapid and sensitive detection of classical swine fever virus[J].Transbound Emerg Dis,2016,63(5):e395-402.
[26] Balasuriya U B,Lee P A,Tsai Y L,et al.Translation of a laboratory-validated equine herpesvirus-1 specific real-time PCR assay into an insulated isothermal polymerase chain reaction (iiPCR) assay for point-of-need diagnosis using POCKIT nucleic acid analyzer[J].J Virol Meth,2017.241:58-63.
[27] Kuo H C,Lo D Y,Chen C L,et al. Rapid and sensitive detection of Mycoplasma synoviae by an insulated isothermal polymerase chain reaction-based assay on a field-deployable device[J].Poult Sci,2017,96(1):35-41.
[28] Ambagala A,Fisher M,Goolia M,et al.Field-deployable reverse transcription-insulated isothermal PCR (RT-iiPCR) assay for rapid and sensitive detection of foot-and-mouth disease virus[J].Transbound Emerg Dis,2016.
[29] Carossino M,Lee P Y,Nam B,et al. Development and evaluation of a reverse transcription-insulated isothermal polymerase chain reaction (RT-iiPCR) assay for detection of equine arteritis virus in equine semen and tissue samples using the POCKIT system[J].J Virol Meth,2016,234:7-15.
[30] Go Y Y,Rajapakse R P,Kularatne S A,et al.A pan-Dengue virus reverse transcription-insulated isothermal PCR assay intended for point-of-need diagnosis of Dengue virus infection by use of the POCKIT nucleic acid analyzer[J].J Clin Microbiol,2016,54(6):1528-1535.
[31] Wilkes R P,Kania S A,Tsai Y L,et al.Rapid and sensitive detection of feline immunodeficiency virus using an insulated isothermal PCR-based assay with a point-of-need PCR detection platform[J].J Vet Diagn Invest,2015,27(4):510-515.
InducedMethodforDifferenationofPancreaticStemCellsintoIstetCells
DUAN Jia-hui,ZHAO Dong-dong,LI Kai-xin,ZHAO Xiao-yan,ZUO Wen-jun,LIN Shu-mei
(CollegeofAnimalHusbandryandVeterinaryMedicine,ShenyangAgriculturalUniversity,Shenyang,Liaoning,110866,China)
As a common metabolic disease worldwide,diabetes cause serious damage to human and animal health. Conventional drug and insulin injections are not enough to cure diabetes.In recent years,with the deepening of the stem cell research,use of pancreatic stem cells to differentiate into islet cells to treat diabetes become a research hotspot.The key point for stem cells to treat diabetes is clarifying the source of stem cells and the method of directional differentiation.The paper simply reviewed the research progress on pancreatic stem cells to differentiate into islet cells to treat diabetes.
pancreatic stem cell; diabetes; directed differentiation; insulin
PrincipleandApplicationofInsulatedIsothermalPCR
WANG Juan1,BIAN Guo-zhi1,2,WANG Gui-ping1,YUAN Jian-feng1
(1.GuangdongHaidInstituteofanimalHusbandry&Veterinary,Guangzhou,Guangdong,511400,China; 2.CollegeofVeterinaryMedicineSouthChinaAgriculturalUniversity,Guangzhou,Guangdong,510642,China)
S852.4
A
1007-5038(2017)12-0114-05
2017-03-21
广东省科技计划项目(2014A020208052);广州市科技计划项目(201510010250)
王 娟(1991-),女,湖南岳阳人,硕士,主要从事预防兽医学研究。△同等贡献作者。*
Abstract:Because the heating mechanism used in convention PCR based on thermal conductivity still require a delicate digital controller to rapidly heat and cool the sample,in recent years,a growing number of studies have focused on developing a fast and portable PCR platform for nucleic acid testing.Natural convection,another mode of heat transfer,promotes spontaneous and repeated liquid circulation to provide working temperatures for denaturation,annealing and extension.Insulated isothermal PCR (iiPCR),a rapid nucleic acid detection method,based on Rayleigh-Be′nard convection principle,amplification is carried in an iiPCR device in which a special polycarbonate capillary tube(R-tubeTM) is heated isothermally by a copper ring attached to tis bottom and shielded by a thermal baffle around its upper half,spontaneous fluid convection in a R-tube is driven by temperature gradients for PCR reaction.The results show directly on LED display.Compared with the traditional PCR; iiPCR assay shows its advantages in the rapid detection of clinical nucleic acid,and has begun to use in the field of clinical diagnosis of various pathogens for its low cost,simple and easy operation,high specificity,high sensibility and high amplification efficiency.Here we proceeded a review for insulated isothermal PCR covering its introduction,research progress and application prospect.
Keywords:PCR; rayleigh-Be′nard convection; insulated isothermal PCR

