以优化凝血为导向个体化治疗阿司匹林相关性脑出血
冯金周,曹德乾,刘发健,刘齐东,丁少川,杨陈
以优化凝血为导向个体化治疗阿司匹林相关性脑出血
冯金周,曹德乾,刘发健,刘齐东,丁少川,杨陈
目的探讨阿司匹林相关性脑出血患者的临床特点及个体化治疗策略。方法回顾性分析83例阿司匹林相关性脑出血患者和55例未服用阿司匹林的脑出血患者的临床资料。将阿司匹林相关脑出血患者以是否进行血栓弹力图检测,分为以优化凝血功能的个体化治疗组(41例)和普通治疗组(42例)。比较各组患者血栓弹力图、手术方式、再出血、3个月时的GOS评分。结果入院时血栓弹力图检测血小板功能,个体化治疗组的MA值为(30.85±10.49)mm,AA抑制率(67.50±5.16)%;普通治疗组的MA值为(54.83±8.34)mm,AA抑制率(34.64±6.73)%;两组比较差异均有统计学意义(均P<0.05)。个体化治疗组中有36例患者系血小板功能障碍,予以血小板输注;输入前后的MA值与AA抑制率指标比较,差异均有统计学意义(均P<0.05)。3组患者在3个月时GOS评分分类中恢复好与死亡率比较,个体化治疗组与普通治疗组的差异无统计学意义(P>0.05),但均优于常规化治疗组(均P<0.05)。结论长期口服阿司匹林的脑出血患者,再出血发生率高于未服用阿司匹林脑的出血患者。通过血栓弹力图检测,根据患者的血小板功能与凝血状态进行针对性处理,选择合适的手术方式与时机,可以降低再出血率,改善临床预后。
阿司匹林; 脑出血;血小板抑制率;血栓弹力图
阿司匹林已被广泛用于心脑血管疾病的一、二级预防,尤其在脑卒中防治方面使患者获利大于弊[1]。但长期口服阿司匹林的患者,无论何种致病原因,一旦发生出血性脑卒中,其病程发展将不同于未服用阿司匹林的脑出血患者;主要表现为出血后血肿容易扩大、手术操作止血困难及术后再出血发生率增高,明显增加致死率与致残率[2-3]。对这类阿司匹林相关脑出血患者如何减少再出血,提高临床疗效值得研究。四川省医学科学院·四川省人民医院城东病区神经外科2010年1月~2016年11月对41例阿司匹林相关脑出血患者,采用血栓弹力图(thromboela-stogram,TEG)检测凝血状态与血小板功能,进行以优化凝血功能为导向的个体化治疗,取得了较好的临床效果。现报告如下。
1 资料与方法
1.1 一般资料 符合纳入标准的阿司匹林相关脑出血患者83例,按是否进行TEG检测,分为以优化凝血功能为导向的个体化治疗组(41例)及常规化治疗组(42例)。另将同期收治的符合纳入与排除标准,但未服用阿司匹林的55例脑出血患者设为普通脑出血组。纳入标准:(1)年龄50~80岁,长期口服阿司匹林,100~300 mg/d,持续时间>6个月;(2)发病24 h内入院;(3)符合全国第四届脑血管病学术会议修订的脑出血诊断标准,并经头颅CT检查证实;(4)格拉斯哥昏迷量表(GCS)评分6~15分。排除标准:(1)入院时GCS评分3~5分,瞳孔双侧不等大,病情危重,3 d内放弃治疗;(2)出血原因明确为血液病、肾功能衰竭凝血障碍、动脉瘤破裂、瘤卒中;(3)合并严重心血管病、肝肾功能不全的患者。各组患者的年龄、GCS评分、脑出血量、血小板计数、凝血指标比较,差异均无统计学意义(均P>0.05)。见表1。
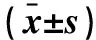
表1 3组患者的年龄、GCS评分、脑出血量、血小板计数、凝血指标比较
1.2 临床及影像学表现 患者均以头痛、意识障碍、肢体不同程度瘫痪、肌张力变化为主要临床表现。头部CT检查示,基底节区血肿64例,丘脑血肿23例,额颞枕叶区幕上血肿42例,小脑血肿18例;血肿破入脑室37例;急性梗阻性脑积水31例。血肿量根据CT扫描软件测算,≤30 ml者26例,31~50 ml者74例,>50 ml者38例。见图1。
1.3 实验室检查
1.3.1 普通实验室检查 所有患者入院后均完成血常规、凝血四项检查。
1.3.2 TEG检测 在个体化治疗组患者入院时、输入新鲜血小板后1 h内,以及普通脑出血组患者入院时采血进行TEG检测。检测采用©5000型血栓弹力图仪(Haemonetics公司,SN:20102253421)及配套高怜土试剂(Kaolin©),花生四烯酸(arachidonic acid,AA)激活剂,TEG血小板检测图试剂盒。检测指标:(1) R值、K值,代表凝血启动时间与血凝块生成速率,R值正常范围5~10 min,K值正常范围1~3 min;(2)MA(mm),正常范围50~70 mm,<50 mm为血小板聚集功能不良,>70 mm提示血小板聚集功能强;(3)AA抑制率,<50%提示血小板高反应性,警惕缺血性风险;≥50%提示血小板被抑制,不能发挥聚集功能,警惕出血性风险。根据TEG普通检测与血小板图判断凝血状态:(1)R值、K值增高,MA降低提示处于低凝状态,相反处于高凝状态;(2)R值、K值增高,MA正常或降低提示低纤维蛋白原水平或凝血因子活性低;(3)R值、K值正常,MA降低,AA抑制率≥50%提示血小板功能低下,反之MA增加,AA抑制率<50%提示血小板功能亢进;对服用阿司匹林的患者可判断为阿司匹林抵抗[4]。
1.4 治疗方法 常规化治疗组患者停服阿司匹林,治疗措施同普通脑出血组。个体化治疗组患者在普通脑出血治疗的基础上,结合TEG检测指标,注重以优化血小板功能为导向来指导成分输血、手术时机。主要措施包括:(1)采用TEG监测血小板功能与凝血状态;(2)对R值、K值正常、AA抑制率≥50%、MA<50 mm的低血小板功能患者,输注新鲜血小板1~2 U;待其MA值与AA抑制率恢复到正常范围,再考虑手术治疗。对需要急诊手术者,则尽量选择显微镜下血肿清除或定向穿刺置管血肿溶解引流等创伤小的手术方式,并尽早输入新鲜血小板,减少再次出血;(3)对R值、K值明显增高,MA值降低,AA抑制率<50%的低纤维蛋白原水平的低凝状态患者,尽早输入冷沉淀或新鲜冰冻血浆,待R值、K值恢复正常水平再行相关手术;(4)对暂无手术指征的患者,通过TEG判断凝血状态与血小板功能,并采取措施进行改善,减少血肿进行性增大。
1.5 观察、评判指标 (1)再出血发生率,通过头部CT检查并用自带软件测定出血量。保守治疗再出血判断标准:出血量增加超过原有量的1/3;手术后术区再出血判断标准:出血量恢复到术前同等量或超过原有量的1/3;(2)TEG检测指标:R值,K值,AA抑制率(AA inhibit%),MA(mm);(3)各组患者治疗方法(急诊手术,择期手术,保守治疗)的分布;(4)预后,出血后3个月时给患者进行格拉斯哥预后量表(GOS)评分评判。GOS评分标准:5分为恢复良好,恢复正常生活,可能有轻度缺陷;4分轻度残疾,残疾可独立生活,能在保护下工作; 3分重度残疾,清醒、残疾,日常生活需要照料; 2分植物生存,仅有最小反应; 1分死亡。GOS评分5分、4分的患者为恢复好,3分、2分患者为恢复差。住院期间或出院后死亡的患者纳入GOS评分1分组。
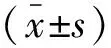
2 结 果
2.1 个体化治疗组与普通脑出血组TEG指标比较 两组患者入院时的R值、K值比较,差异无统计学意义(均P>0.05)。与普通脑出血组比较,个体化治疗组的MA降低、AA抑制率增高,血小板功能受到明显抑制,差异有统计学意义(均P<0.001)。见表2。
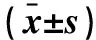
表2 个体化治疗组与普通脑出血组入院时TEG指标比较
2.2 个体化治疗组输血小板前后TEG指标的改变 普通脑出血组和常规化治疗组根据血小板功能指标,均无输入血小板指征者。个体化治疗组根据TEG的血小板图检测,对其中AA抑制率≥50%、MA<50 mm的36例低血板功能患者,输入新鲜血小板1~2 U。与输入血小板前比较,36例患者输入后的MA与AA抑制率均有明显改善,差异有统计学意义(均P<0.001);而R值、K值的差异无统计学意义(均P>0.05)。另外5例患者为低纤维蛋白原所致的低凝状态,予以输入冷沉淀3例、新鲜冰冻血浆2例;输入后的R值与K值比输入前均有明显改善。见表3。
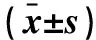
表3 个体化治疗组输入血小板前、后TEG指标的比较
2.3 各组患者治疗方法与再出血发生率的比较 3组患者采用急诊手术、择期手术、保守治疗的比率比较,差异无统计学意义(均P>0.05)。但是再出血发生率两两比较,常规化治疗组明显高于其他两组,差异有统计学意义(均P<0.001);而个体化治疗组与普通脑出血组比较,差异无统计学意义(P>0.05)。见表4。
2.4 各组患者的预后比较 住院期间各组共死亡患者20例,死亡原因为血栓形成脱落致心、肺、脑栓塞或营养不良、肺部感染;其中个体化治疗组4例,常规化治疗组10例,普通脑出血组6例。 出血后3个月时3组GOS评分预后分类比较,个体化治疗组恢复好的比率与普通脑出血组的差异无统计学意义(P>0.05),但两组恢复好的比率均明显高于常规化治疗组,差异有统计学意义(均P<0.001);并且两组死亡的比率明显低于常规化治疗组(均P<0.05)。3组之间恢复差的比率比较,差异无统计学意义(P>0.05)。见表4。患者术后CT改变见图1。

表4 3组患者治疗方法、再出血发生率及预后的比较(例,%)
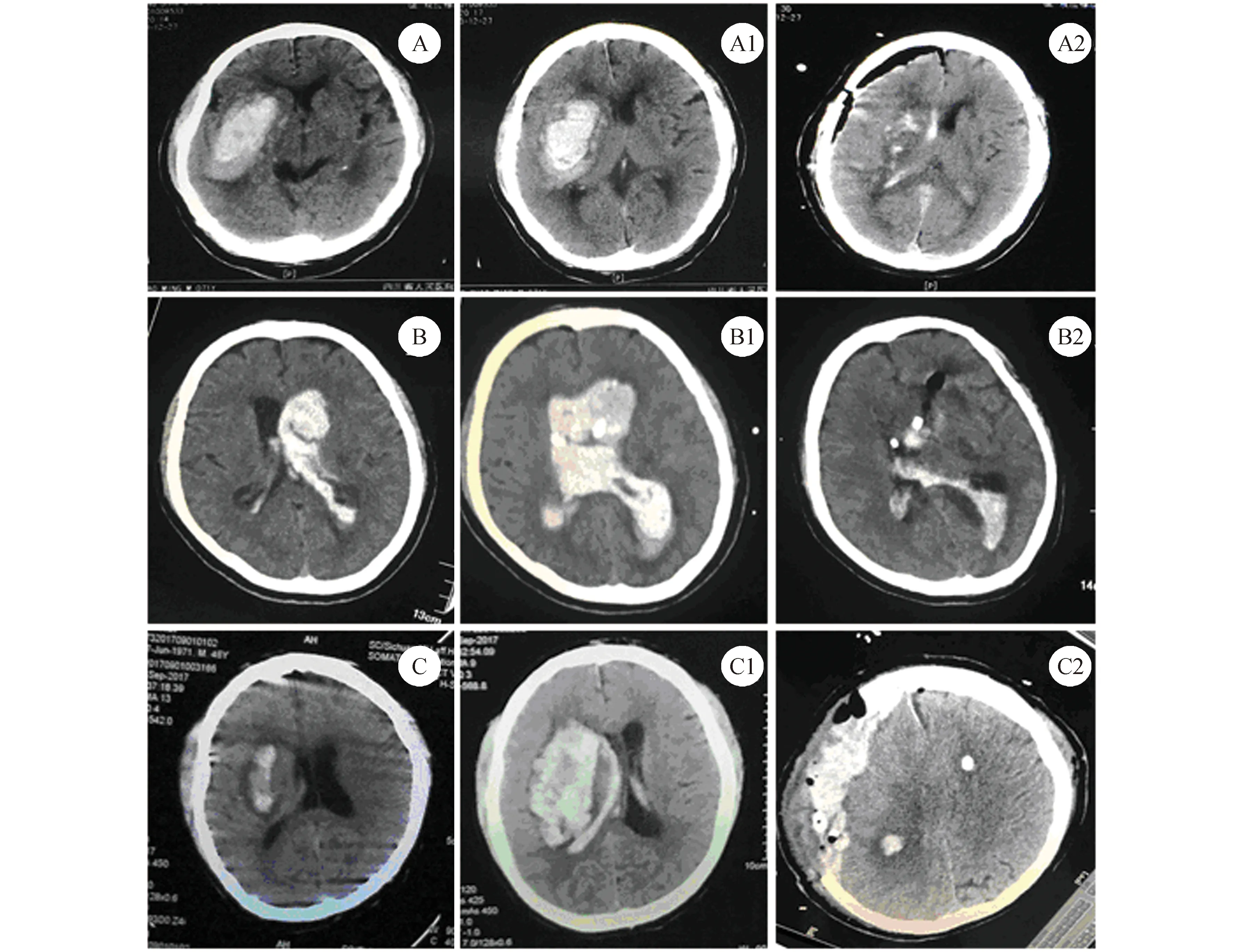
A:基底节血肿择期手术前,A1:输入血小板后,A2:手术后;B:脑室出血并脑积水手术前,B1:引流术后,B2:尿激酶灌注后;C:基底节血肿增大患者入院时,C1:手术前,C2:开颅手术后图1 脑出血、脑室出血并脑积水和基底节血肿增大患者手术前后的头颅CT改变
3 讨 论
我国脑血管疾病发病率逐年递增,严重威胁国民的生命与健康[5]。目前研究认为,高血压、脑血管淀粉样变、抗凝与抗血小板药物是自发性脑出血最为常见的致病因素[6]。2009年美国预防署特别工作组(USPSTF)修订的阿司匹林使用指南指出,阿司匹林有导致出血的潜在风险[7]。自发性脑出血后可导致机体凝血及纤溶系统被激活,且出血量越大,凝血纤溶系统越活跃,导致纤维蛋白原大量消耗,生成血栓并继发纤溶亢进易于形成血肿[8]。但血肿的演变又取决于诸多因素, 如责任血管破裂口大小、 血管粥样硬化程度、机体凝血功能及医源性脱水恰当与否等。阿司匹林相关脑出血患者的特殊之处在于,血小板聚集功能受到抑制,凝血功能障碍,破损责任血管不断出血,且不易形成坚固的血凝块,出血很快扩大漫延;手术操作中出现止血困难、渗血明显,术后发生再出血与致残几率高[9-10]。本研究结果显示,常规化治疗组的阿司匹林相关脑出血患者与普通脑出血组比较,再出血的发生率明显增高(P<0.001)。
阿司匹林是一种环氧化酶-1(COX-1)抑制剂,抑制血栓素A2(TXA2)的合成,阻止血小板聚集与释放,还通过其他途径影响纤溶活性和纤维蛋白的形成,抑制血栓形成[11]。阿司匹林的抗血小板聚集作用贯穿于血小板整个生存周期,直到骨髓产生新的血小板进入血液循环。因此,口服一次阿司匹林后的抗血小板作用时间能持续5~7 d;这也是临床外科手术前7 d要求患者停止服用阿司匹林的理论基础。正常血液循环的血小板平均每天约有10%进行更新,且不受前1天服用的阿司匹林的影响。要避免阿司匹林相关脑出血患者的出血扩大,只需要输入约20%新鲜血小板就足以维持正常的凝血过程[12];这给此患者如何改善凝血功能指明了处理方法。
临床检验中常用的凝血4项指标并不能真实反映出患者的血小板功能与凝血状态[13]。TEG可反映机体凝血与纤溶的全过程,能直观准确地反映血液凝固状态,同时通过血小板图准确检测血小板聚集功能并指导临床治疗[14-17]。TEG对血小板聚集率的检测,能够快速真实反映出患者的凝血状态。由于机体差异性的存在,部分服用阿司匹林的患者也不一定能达到有效的抗血小板作用,甚至发生抗血小板药物抵抗[18]。因此,TEG能够通过AA抑制率与MA值的检测,真实反映机体血小板聚集度,有利于指导个体化治疗,并减少发生血栓与出血性事件的风险[19]。本研究对服用和未服用阿司匹林的脑出血患者进行TEG检测,结果显示阿司匹林对血小板聚集功能有很大的影响,其AA抑制率及MA值与未服用阿司匹林者比较,差异均有统计学意义(均P<0.001);而两组患者的R值、K值比较,差异无统计学意义(均P>0.05)。
根据TEG检测的指标,可快速明确阿司匹林相关脑出血患者的凝血状态与血小板聚集功能程度,尽早采取针对性治疗措施;其中最为重要的措施就是改善患者凝血状态与血小板功能。目前,我国血源紧张,临床上多无法输入新鲜血小板,相反冷沉淀容易储存,因此早期输入凝血因子Ⅰ、Ⅴ、Ⅷ和纤维结合蛋白的冷沉淀,能同时加快内源与外源性凝血,并促进血小板的粘附聚集[20]。对于低纤维蛋白原的低凝状态患者,输入新鲜冰冻血浆或冷沉淀,补充凝血因子与纤维蛋白原针对性改善,而不是非要输入血小板。相反对于血小板聚集功能明显受抑制的患者,尽早输入血小板才是治疗的关键所在。另一方面,通过TEG检测血小板AA抑制率,可以预测手术最佳时机。对于服用阿司匹林的脑出血患者,若不是危及生命的血肿需要急诊开颅手术清除时,建议待凝血与血小板功能改善后再进行相关手术操作;手术方式应采用创伤小的术式,如显微镜下血肿清除或血肿定向穿刺置管引流等。神经外科显微手术技术的普及,大部分医院基本能进行显微镜下脑内血肿清除术;其明显优于传统开颅血肿清除术,能减少损伤,利于患者恢复。但是我国血源采集远不能满足临床需要,大型医疗中心对临床用血限制较多,尤其对服用阿司匹林的脑出血患者,常规检查血小板数基本在正常范围,对申请血小板输注有一定困难,这对阿司匹林相关出血疾病的治疗效果大打折扣。TEG在临床的广泛应用,对血小板功能的检测及时准确,对于需要手术的患者,且有家属愿意以献血为一定条件替换患者所需要的血小板输入,为治疗用血小板带来便利。本研究的个体化治疗组中,有36例患者在治疗期间成功输入血小板,这与家属踊跃献血和血站对本病的认识是分不开的。血小板输注可直接改善机体的血小板聚集功能。36例患者的TEG检测指标显示,血小板输入后MA值与AA抑制率比输入前均有明显改善,差异有统计学意义(均P<0.001)。本研究个体化治疗组的再出血率与普通脑出血组相似(P>0.05),而两组的再出血率明显低于常规化治疗组(均P<0.001)。
本研究系回顾性研究,对前期收治的阿司匹林相关脑出血患者多采取与普通脑出血相同的治疗;随着TEG在重症监护室广泛应用,对后期收治的阿司匹林相关脑出血患者进行凝血与血小板功能检测,进行个体化治疗。将同病种采用不同治疗方法的患者进行比较,结果显示,个体化治疗的阿司匹林相关脑出血患者的再出血发生率、预后恢复好及死亡率,均显著优于常规化治疗的患者;并与未服用阿司匹林的普通脑出血患者的疗效相近。
综上所述,对阿司匹林相关脑出血患者要重视血小板功能的检测,并根据凝血状态、血小板功能进行针对性的个体化治疗措施。如何快速恢复血小板聚集功能与机体凝血状态,是治疗的关键所在。但仅靠输入血小板,在目前或者以后都将是一大难题;研究替代阿司匹林的具有停服后能快速恢复血小板聚集功能的抗血小板药物,才是解决阿司匹林相关脑出血的关键。
[1] Kernan WN,Ovbiagele B,Black HR,etal. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke,2014,45:2160.
[2] Park JH,Ko Y,Kim WJ,etal. Is asymptomatic hemorrhagic transformation really innocuous?[J]. Neurology,2012,78:421.
[3] Nanba T,Ogasawara K,Nishimoto H,etal. Postoperative cerebral white mater damage asociated with cere-bralhyperperfusion and cognitive impairment after carotid endarterectomy:a difusion tensor magnetic resonance imaging study[J]. Cerebrovasc Dis,2012,34:358.
[4] Yang HC,Li YX,Jiang YH,etal. Thromboelastography for monitoring platelet function in unruptured intracranial aneurysm patients undergoing stent placement[J]. Int Neuroradiol,2015,21:61.
[5] Jiao L,Chu C,Zhou S. Prognostic value of copeptin in patients with acute stroke[J]. Expert Rev Neurother,2015,15:563.
[6] Towfighi A,Greenberg SM,Rosand J. Treatment and prevention of primary intracerebral hemorrhage[J]. Semin Neurol,2005,25:445.
[7] U.S. Preventive Services Task Force. Aspirin for the prevention of cardiovascular disease:U.S. preventive services task force recommendation statement[J]. Ann Intern Med,2009,150:396.
[8] Kim CY,Le JS,Kim HD,etal. Lower extremity muscle activation and function in progresive task-oriented training on the supplementary tilt table during stepping-like movements in patients with acute stroke hemiparesis[J]. J Electromyogr Kinesiol,2015,31:66.
[9] Takeuchi S,Nawashiro H,Wada K,etal. Ventriculomegaly after decompresive craniectomy with hematoma evacuation for large hemispheric hypertensive intracerebral hemorhage[J]. Clin Neurol Neurosurg,2013,115:317.
[10] Ziai W,Moullaali T,Nekoovaght-Tak S,etal. No exacerbation of perihematomal edema with intraventricular tissue plasminogen activator in patients with spontaneous intraventricular hemorrhage[J]. Neurocrit Care,2013,18:354.
[11] Prugger C,Luc G,Haas B,etal. Multiple biomarkers for the prediction of ischemic stroke the PRIME study[J]. Arterioscler Thromb Vasc Biol,2013,33:659.
[12] Falcone GJ,Rosand J. Aspirin should be discontinued after lobar intracerebral hemorrhage[J]. Stroke,2014,45:3151.
[13] Helbok R,Schiefecker AJ, Beer R,etal. Early brain injury after aneurysmal subarachnoid hemorrhage:a multimodal neuromo-nitoring study[J]. Crit Care,2015,19:809.
[14] Seino H,Wu Y,Morohashi S,etal. Basic helix-loop-helix transcription factor DEC1 regulates the cisplatin-induced apoptotic pathway of human esophageal cancer cells[J]. Biomed Res,2015,36:89.
[15] Sato F,Muragaki Y,Zhang Y. DEC1 negatively regulates AMPK activity via LKB1[J]. Biochem Biophys Res Commun,2015,467:711.
[16] Nomura S,Endo-Umeda K,Aoyama A,etal. Styrylpheny-lphthalimides as novel transrepresion selective liver X receptor(LXR) modulators[J]. ACS Med Chem Let,2015,6:902.
[17] Nian S,Gan X,Tan X,etal. Discovery and synthesis of a novel series of liver X receptor antagonists[J]. Chem Pharm Bull (Tokyo),2015,63:628.
[18] Kuzniatsova N,Shantsila E,Blann A,etal. A contemporary view-point on “aspirin resistance”[J]. Ann Med,2012,44:773.
[19] Sambu N,Radhakrishnan A,Dent H,etal. Personalised antiplatelet therapy in stent thrombosis:observations from the Clopidogrel Resistance in Stent Thrombosis (CREST) registry[J]. Heart,2012,98:706.
[20] Chen T,Xu G,Tan D,etal. Effects of platelet infusion,anticoagulant and other risk factors on the rehaemorrhagia after surgery of hypertensive cerebral hemorrhage[J]. Eur Rev Med Pharmacol Sci,2015,19:795.
Individualizedtreatmentofaspirinrelatedintracerebralhemorrhageforoptimizedcoagulation
FENGJin-zhou,CAODe-qian,LIUFa-jian,etal.
DepartmentofNeurosurgery,EastWard,ThePeople’sHospitalofSichuanProvince&SichuanAcademyofMedicalSciences,Chengdu610110,China
ObjectiveTo investigate the clinical characteristics and individualized treatment strategy of patients with aspirin related intracerebral hemorrhage.MethodsThe clinical data of 83 patients with aspirin associated intracerebral hemorrhage and 55 without aspirin were analyzed retrospectively.Whether or not the patients with aspirin related intracerebral hemorrhage were examined with a rebound,41 patients in the individualized treatment group were optimized,and 42 patients in the general treatment group.Compared each group in the elasticity,operation mode,rebleeding and GOS score 3 months after the bleeding.ResultsAt the time of admission thrombela-stogram detection of platelet function,individual treatment group MA was(30.85±10.49) mm,AA inhibition rate was(67.50±5.16)%,normal cerebral hemorrhage group MA was (54.83±8.34) mm,AA inhibition rate was (34.64±6.73)%,there was significant difference between two groups (allP<0.05);In the individualized treatment group,there were 36 cases with platelet dysfunction and platelet transfusion.The MA value and AA inhibitory rate index changed significantly before and after the input,and the difference was statistically significant (allP<0.05).In the three groups,the GOS score was better in March than in the group with normal cerebral hemorrhage (P>0.05),but they were better than those in the conventional group (allP<0.05).ConclusionPatients with long-term oral aspirin cerebral hemorrhage and rebleeding rate is higher than that of aspirin in patients with non cerebral hemorrhage,but by thrombela-stogram detection can be carried out targeted treatment,select the appropriate surgical approach and timing based on coagulation and platelet function,can reduce bleeding,improve clinical prognosis.
aspirin;cerebral hemorrhage;platelet inhibition rate;thromboela-stogram
四川省卫生厅科研资助项目(110212,16PJ447)
610000 成都,四川省医学科学院·四川省人民医院城东病区神经外科(冯金周,曹德乾,刘发健,刘齐东),检验科(丁少川),神经重症监护室(杨陈)
10.3969/j.issn.1672-7770.2017.06.006
R651.1
A
1672-7770(2017)06-0431-06
(收稿2017-10-22 修回2017-11-04)

