复杂脊髓拴系综合征的手术疗效分析
袁帅,袁治,张景龙,鄢琦,张赫,潘亚文
·论著·
复杂脊髓拴系综合征的手术疗效分析
袁帅,袁治,张景龙,鄢琦,张赫,潘亚文
目的探讨不同类型复杂脊髓拴系综合征的手术时机、方式和疗效。方法回顾性分析兰州大学第二医院自2011年1月~2017年4月收治的154例复杂脊髓拴系综合征患者的资料。按照患者性别、年龄、拴系发生部位及病理表现进行分类。所有患者均接受电生理神经功能监测辅助下的显微外科手术,术中拴系松解程度采用Kirollos和Van-Hille分级;术后依据Hoffman神经功能分级评判疗效。结果手术无死亡病例,术中完全松解率97%。对其中126例患者随访3个月~3.8年。依据Hoffman神经功能分级,术前分级0~3级的患者术后症状改善率显著高于4~5级患者;有1例术后症状加重,其余患者症状或体征均有不同程度改善。结论复杂脊髓拴系综合征的诊断和治疗非常复杂和困难,手术难度较大,传统手术后神经功能障碍的发生率高。对于该病患者,确诊后应尽早行手术治疗。在术中应用手术显微镜及电生理神经功能监测,可以有效降低脊髓及神经损害,提高手术的效果和安全性。
脊髓拴系综合征;显微外科;神经电生理监测
现代脊髓拴系综合征(tethered cord syndrome,TCS)的定义是指,由遗传性因素、生长发育或后天疾病等导致的脊髓和(或)神经根在颈、胸、腰、骶等任一节段被非弹性结构长期固定、压迫、牵拉下发生移位,其供血发生改变,造成牵拉部位神经细胞线粒体功能受损,由此产生一系列以肢体畸形和各种神经功能障碍为代表的临床综合征[1]。而复杂脊髓拴系综合征(complex tethered cord syndrome,cTCS)是在脊髓拴系基础上还存在需要外科处理的神经系统并发的病理性改变,包括由异常骨性或纤维膜性结构造成的脊髓纵裂畸形、脊髓脊膜膨出、脊柱裂、椎管内各类肿瘤,以及由此引起的大小便功能障碍和(或)肢体畸形、无力、疼痛、感觉减退等[2]。复杂脊髓拴系综合征的手术难度大,传统手术后神经功能障碍发生率高,因此其治疗面临很大的挑战[3]。本研究回顾性分析兰州大学第二医院2011年1月~2017年4月收治经临床影像确诊并手术治疗的脊髓拴系综合征患者177例,排除仅由增粗的终丝牵拉造成低位圆锥的单纯脊髓拴系患者23例,纳入符合标准的复杂脊髓拴系综合征154例(87%)患者的资料,以探讨复杂脊髓拴系综合征的临床特点、治疗方法及术后疗效。
1 资料与方法
1.1 一般资料 纳入标准:(1)经MRI检查证实[4],除脊髓圆锥低位(>14岁儿童和成人低于L2椎体以下,≤14岁的儿童、婴幼儿、新生儿低于L3椎体以下)之外,还合并有各类神经管畸形、椎管内外肿瘤等;(2)脊髓圆锥位置正常,但在颈、胸段存在异常骨性结构、异行神经根、纤维结构、肿瘤等非弹性因素引起的脊髓压迫、牵拉发生移位;(3)已经表现有脊髓功能损害症状或具有潜在损害可能者。本组患者中,男83例,女71例;年龄1 d~54岁;平均年龄(6.65±4.12)岁。按患者性别、年龄、拴系发生部位及病理表现进行分类(表1),其中“复合型”是指同时存在两个及以上节段的脊髓拴系。另外,本组病例中有2例手术后再拴系患者。一例为3岁男性患儿,生后1岁时因腰段脊髓脊膜膨出于外院行脊膜膨出修补术并拴系松解术,术后1年出现右足内翻畸形,但无排便障碍;二次手术前Hoffman分级1级,MRI检查证实为腰段脊髓拴系。另一例为20岁男性患者,2岁时因骶尾段脊髓脊膜膨出在当地医院行脊膜膨出修补术,术后1年出现大小便失禁至今,且右下肢较左侧短小、无力;MRI检查证实为脊髓拴系,术前Hoffman分级3级。

表1 本组患者的性别、年龄、拴系发生部位及病理表现(例)
1.2 影像学及其他辅助检查 本组所有患者术前均行脊柱MRI、X线片、CT检查;>1岁患者行下肢诱发电位及B超残余尿及尿流动力学测定。各部位脊髓拴系患者均有典型的脊髓拴系MRI表现,见图1。图1A示,颈段脊髓拴系;图1B示,脊髓圆锥虽然位于正常椎体水平,但存在胸段脊髓拴系;两者拴系部位的脊髓均明显受牵拉而向背侧移位。图1C、1D分别为腰段、骶尾段脊髓拴系;图1E示同时存在胸段和腰段脊髓拴系,为复合型脊髓拴系。
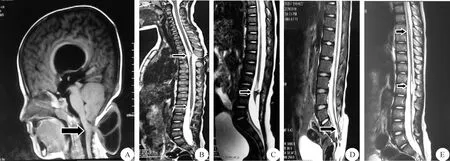
A:颈段脊髓拴系; B:胸段脊髓拴系; C:腰段脊髓拴系; D:骶段脊髓拴系; E:胸、腰段复合型脊髓拴系图1 各部位脊髓拴系的MRI表现
1.3 手术方法 患者在全身麻醉下经口气管插管,俯卧位,统一采用后正中直切口,对有脊膜膨出、皮下脂肪瘤或皮肤窦道者可行纵向梭形切口。复合型脊髓拴系患者原则上采用分期手术,先行上位节段脊髓松解,术后1~3个月二期手术行下位拴系节段松解。依据拴系所在部位,暴露范围包括脊柱上下相邻节段棘突和椎板。二次手术者需要尽量切除原有瘢痕组织。神经外科专用显微镜下切开硬脊膜,对于脊膜膨出,需要仔细辨别分离残存脊膜以便于缝合修补。合并骨性、纤维膜性拴系带及脊髓-硬脊膜粘连者,去除异常拴系结构,钝锐性结合分离脊髓与硬脊膜粘连,离断拴系带,松解脊髓牵拉,降低脊髓张力,使其回归硬膜腔内正常位置。合并皮样囊肿、畸胎瘤、神经纤维瘤者,要尽量全切除肿瘤。合并脂肪瘤或肿瘤包膜与脊髓难以完全区分剥离者,严格在连续电生理神经功能监测(intraoperative neuromonitoring,IONM)下,要以松解拴系为首要目标,而不强求切除病灶,以免造成脊髓神经功能损伤。在腰骶段复杂脊髓拴系者,除外离断拴系结构外,还要分离切断终丝,以求拴系松解更加彻底。合并有皮肤窦道者,也应一并切除。硬脊膜用5-0无损伤缝合线在显微镜下连续缝合或以人工硬脊膜修补,重建硬脊膜囊。此外筋膜层的严密缝合对减少术后脑脊液漏,预防术后感染粘连再拴系的发生也能起到很重要的作用。最后修剪多余皮肤,对齐后间断缝合。对切口长度大于7 cm或硬脊膜缺损严重,并在术中加以人工硬膜修补的患者,常规放置硬脊膜外引流管,术后24~48 h依据引流量适时拔除引流管。手术全程均在连续电生理神经功能监测下进行,通过实时肌电图、体感神经诱发电位和运动神经诱发电位的刺激结果,帮助术者决定脊髓及神经根粘连松解、分离、保留、切除的范围和程度。锐性分离脊髓粘连带前,应用电刺激器协助分辨脊髓或神经根的边界或区别纤维束带与神经纤维。当电生理神经功能监测仪提示刺激电位异常改变时,要高度关注操作部位,不可强行剥离脊髓神经,以免造成术后不可逆性的功能损伤。术后要求所有患者尽可能保持俯卧或侧卧位至少两周,部分患者切口施加500~1 000 g 盐袋压迫,以利于切口愈合、预防脑脊液漏及皮下积液产生。术后第12~14 d拆除皮肤缝合线。
1.4 手术效果评定及术后随访 术中脊髓拴系松解程度采用Kirollos和Van-Hille分级[5],即在电生理神经功能监测下,按照去除所有引起脊髓拴系的异常结构,脊髓及神经根张力下降,可在椎管内自由摆动漂浮视为彻底松解;引起脊髓拴系的异常组织结构未完全去除,但不限制脊髓神经根在椎管内的摆动漂浮为部分松解;不论造成拴系的结构是否去除,脊髓神经根仍存在一定张力,且受限不能自由漂浮为无法松解。术后依据Hoffman分级[6]对患者手术效果进行评定(表2)。依据患者病情,在术后1周内、术后3个月或术后1~3个月内、术后1年时复查脊柱MRI、B超残余尿量;有23例患者完成术后尿流动力学测定。此后,通过电话或门诊对其中126例患者随访3个月~3.8年。

表2 Hoffman神经功能分级
2 结 果
2.1 手术结果 本组患者中无手术死亡病例。按Kirollos和Van-Hille分级,本组患者中彻底松解者149例(97%);有3例患者术中仅部分切除拴系结构,而脊髓神经松解不充分,有再拴系可能;另有2例患者因脂肪瘤包裹脊髓圆锥及多条马尾神经,电生理神经功能监测下分离极为困难,故无法有效松解(表3)。

表3 术中脊髓拴系松解Kirollos和Van-Hille分级
2.2 术后疗效 依据Hoffman分级[6]对得到随访的126例患者进行疗效评定。患者手术前后Hoffman神经功能分级对比,见图2。术前Hoffman分级在0~3级的患者在手术后症状得到改善的病例数显著多于4~5级的患者。有1例2岁男性患儿,术前Hoffman分级2级,尿潴留症状在术后6个月未改善,并且出现足内翻畸形及局部神经源性皮肤溃疡等神经损害加重的表现,术后分级降至5级。有23例患者完成了术后尿流动力学检测,通过对比手术前后的尿流率(UF)、膀胱压力容积和排尿时压力/尿流率测定值,有16例患者显著改善,7例患者无明显改变。
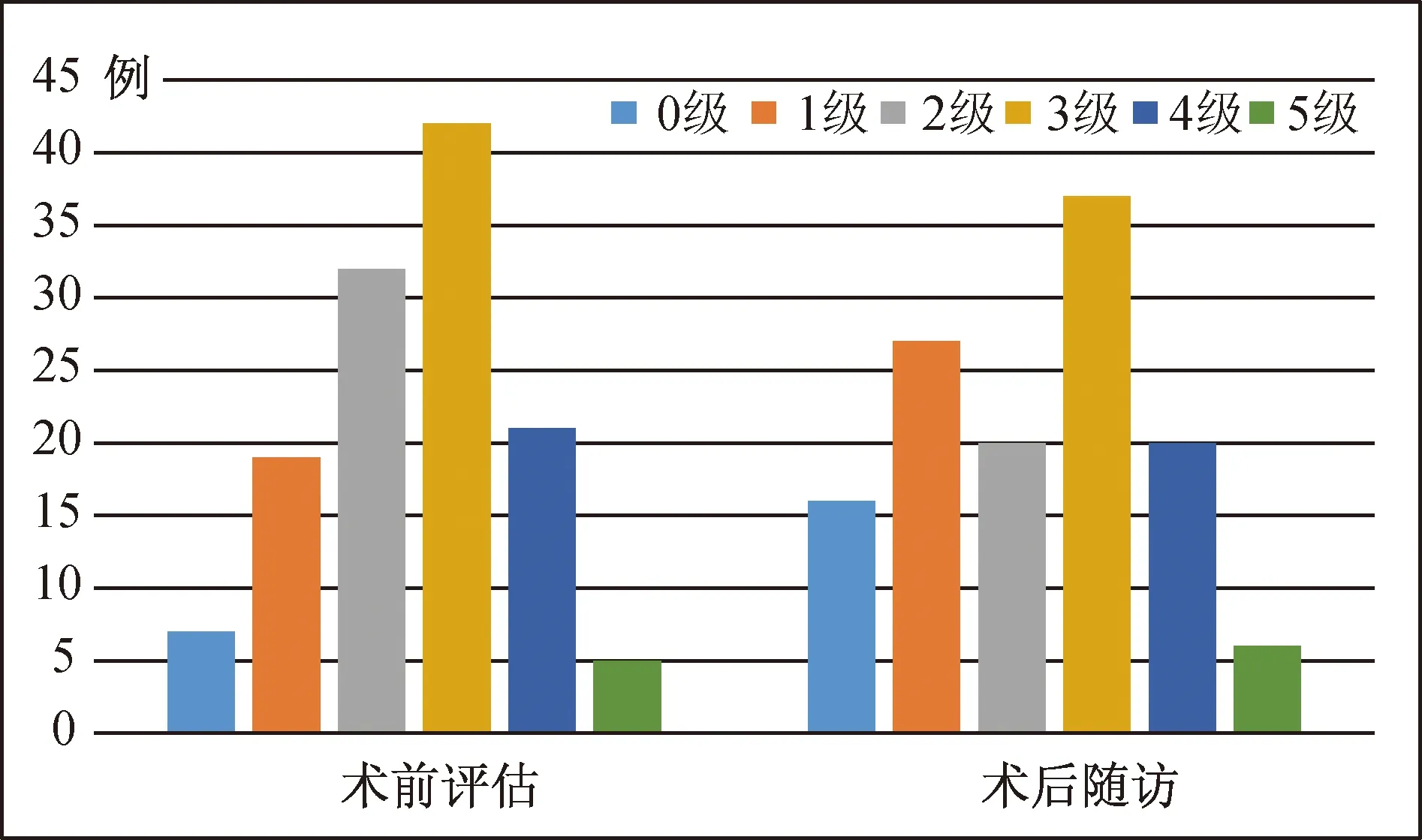
图2 126例复杂脊髓拴系患者手术前、后的Hoffman神经功能分级对比
3 讨 论
3.1 脊髓拴系综合征概念的演变 脊髓拴系综合征曾经是被人们忽视的一类疾病。其实早在1886年,Von Reeklinghausen[7]在1例骶尾部多毛症伴发脊柱裂的尸检结果中,描述了由于骶尾部存在的脂肪瘤而对圆锥造成明显地牵拉移位。1921年,Clute[8]通过观察患有尿潴留的患者,发现其尿潴留是与马尾神经被骶管内异常的脂肪组织牵拉有关;从而首次提出脊髓发育不良、神经缺陷可能是由于脊髓被牵拉所引起的。1952年,George[9]对脊髓拴系综合征作了详细的论述。1953年,Garceau[10]描述“终丝综合征”就怀疑形成张力的终丝牵拉脊髓可以引起神经功能缺陷或症状。1976年,Hoffman等[11]报道31例患者在接受切断终丝手术后,相应的神经功能得到改善;提出“脊髓拴系综合征”的概念来特指脊髓圆锥张力增高引起的神经功能障碍。而到1981年,由Yamada等[12]总结这类病例的临床资料,从细胞学层面提出现代“脊髓拴系综合征”的概念,指出脊髓长期处于高张力状态下,脊髓供血不足使神经细胞线粒体缺氧、代谢异常,最终引起功能障碍。
传统脊髓拴系综合征的定义是将拴系的部位仅仅局限于脊髓末端的圆锥被异常结构牵拉,使其位置低于正常所在的L1-2水平节段。随着现代科学技术和神经科学的不断发展应用,脊髓拴系综合征的最新概念不仅包括了脊髓圆锥低位,也扩展为虽然脊髓圆锥位置正常,但存在有脊髓其他节段的神经根被非弹性结构固定,受水平或垂直牵拉力下移位形成的拴系(隐匿性脊髓拴系综合征[13])。2008年,Aufschnaiter等[14]强调脊髓圆锥的位置并不是判断脊髓拴系的唯一标准,更进一步完善了现代脊髓拴系综合征的概念。并发有其他各种病理改变的复杂型脊髓拴系综合征,相比较仅仅存在增粗的终丝牵拉脊髓,造成圆锥位置低于正常水平的单纯型脊髓拴系更加多见,而且在治疗上更加困难。本组患者中,复杂脊髓拴系患者占87%。
3.2 影像学及实验室检查 复杂脊髓拴系综合征的诊断主要凭借影像学检查确诊,包括B超、X线片、CT和MRI等。其中MRI是诊断脊髓拴系综合征的首选方法,其可以清晰显示脊髓各个节段的形态、位置,并能发现合并的肿瘤病变或组织结构异常,为制订手术方案提供重要参考依据[15]。本研究所有患者术前及术后均行MRI检查。低龄的低位圆锥患者在术后MRI对比显示,圆锥位置较术前有明显的升高。但对于脊髓圆锥低位的成人患者,术后MRI显示圆锥位置较术前大多无明显改变。如本组1例男性24岁患者,术前腰椎MRI显示脊髓圆锥末端位于L4椎体下缘水平,确诊脊髓拴系,且伴有同节段椎管内肿瘤性占位病变;手术中将肿瘤全切除,并行脊髓拴系松解术;术后患者原有症状消失,肿瘤病理学检查证实为肠源性囊肿。患者分别于术后3个月及1年时复查腰椎MRI,术后3个月MRI与术前对比,肿瘤切除完全,无复发,脊髓圆锥位置略有升高,但改变不显著;术后1年复查MRI示,脊髓圆锥位置无改变,肿瘤无复发。患者手术前后的Hoffman分级均为0级。所以除术后常规MRI复查及详细询问患者症状缓解程度之外,还需结合肌电图、B超残余尿及尿流动力学测定,以判断术后效果。尤其是用于检测膀胱舒张和收缩功能的尿流动力学检查,可以较为客观地反映神经源性膀胱尿道功能障碍的类型、性质及病变程度,已成为判断脊髓拴系综合征手术后疗效的重要检测手段[16]。本组患者中有23例患者完成手术前、后尿流动力学测定,术后16例患者显著改善,7例患者无明显改变;可较为客观地反映了术后疗效。
3.3 治疗方法 未经治疗的脊髓拴系综合征患者大多在一定时间内症状进行性加重,出现下肢畸形、肌肉萎缩、行走困难,甚至瘫痪而失去生活自理能力。排便障碍的患者由于长期尿潴留,引发肾盂积水、逆行性感染,最终发展为肾功能衰竭、尿毒症等危及生命[17]。
手术松解是目前治疗复杂脊髓拴系综合征的唯一有效方法[18-19]。尽管对于无症状型脊髓拴系的手术治疗时机还存在争议[20],但大多数学者认为只要患者一般身体情况允许,脊髓拴系一经确诊,应尽早手术[21];伴发其他病理改变的复杂型脊髓拴系更应如此。虽然本组患者中,术前Hoffman分级0~3级的患者术后症状改善的病例数显著多于4~5级的患者(图2);但几乎所有4~5级患者的术前症状,在术后都无法完全恢复正常,只是有所改善,甚至有部分患者经过手术治疗依然无法缓解[22]。这提示,术前Hoffman分级低的患者在术后症状改善更显著。本组1例2岁男性患儿,术前已伴发尿潴留,术中拴系完全松解;但术后6个月时患儿的尿潴留症状仍持续存在,并且出现双足内翻畸形及局部皮肤神经源性溃疡,Hoffman分级由2级降至5级。表明有的患者虽经手术治疗,但脊髓神经功能损害仍然不可逆性发展[23]。所以一旦错过最佳手术时期,会极大降低治疗效果[24]。Yamada和Lonse[25]在2000年报道了70例成人脊髓拴系综合征患者,按病程长短及接受手术时间早晚分为两组进行对比,发现尽早接受手术患者的预后显著好于另一组。Cui等[26]报道611例的大宗脂肪瘤型脊髓拴系综合征病例手术结果分析,同样发现早期手术可以取得更好的疗效。
复杂脊髓拴系综合征手术的方法是保护原有神经功能的前提下去除造成脊髓被牵拉的病因,松解对脊髓的拴系,恢复正常的脊髓或神经周围空间结构,使局部脊髓恢复正常的血液供应,目的是让受损的神经功能逐步得以恢复或预防症状进一步加重[27]。对合并的脊髓脊膜膨出、脊髓纵裂畸形要适当修补[28],保证脊膜腔完整性。对伴发皮样囊肿、畸胎瘤、神经纤维瘤等尽可能切除,但对于和脊髓界限不清且粘连紧密的脂肪瘤或皮样囊肿囊壁等难以完全与脊髓剥离的包膜,要在电生理神经功能监测下,尽量保护脊髓及神经功能,不要强行切除,以松解拴系为目的,可术后严密随访,定期复查[29]。在腰段和骶尾段手术中,除切除造成拴系的肿瘤、骨性、纤维束带等结构外,还应分辨终丝后予以一并切断,以保证松解更加彻底。本组患者中有1例复杂脊髓拴系综合征的12岁女性患儿,术前MRI示脊髓低位圆锥,同时合并有脊髓中央管囊性扩张及骶管囊肿和L4-5椎间盘突出症(图3A、B)。手术中可见异常增粗脂肪变的终丝,脊髓末端位于L5水平,并且呈囊性扩张,内含清亮脑脊液(图4C);先予以电凝切断终丝,脊髓明显向头端回升移位(图4D);而后对脊髓末端扩张形成的囊肿造瘘并释放囊液减压;最后探查明确后以自体脂肪组织填塞封闭骶管囊肿瘘口(图4E)。术后第2 d复查MRI示扩张的脊髓末端闭合,骶神经根囊肿消失。虽然术前影像学提示有L4-5椎间盘突出,但鉴于该患儿年仅12岁,且上下椎体间隙未有缩窄,所以术中突出的椎间盘没有处理。

图3 A,B,C分别为术前MRI;D,E,F分别为术后3个月复查MRI;G,H为术后1年复查MRI
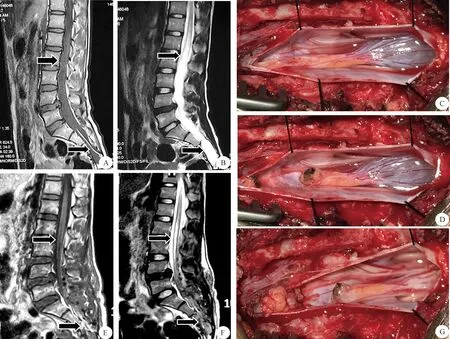
图4 复杂脊髓拴系综合征患者术前(A,B)与术后(E,F)脊柱MRI检查及术中所见(C,D,G)
通过本研究的分析,特别要指出的是对于同时存在两个不同节段复合型脊髓拴系患者的手术,应依据患者的年龄、体质等行一期或分期手术。顺序上为了避免低位脊髓和神经松解后张力降低,脊髓会不同程度地向头端移位,将增加高位节段被拴系脊髓的局部牵张力,有可能加重神经功能损害,故而应先行高位节段脊髓松解术,再松解低位节段。
对术前硬脊膜完整的患者水密缝合硬膜,对存在缺损的硬脊膜要进行人工硬膜修补[30];并通过严密缝合筋膜层、放置硬脊膜外引流管,以及术后适当的体位管理等措施,可有效防止术后脑脊液漏引起的感染及术区脊髓粘连再拴系等并发症[31]。本组所有患者术后均被要求保持持续的俯卧或侧卧位至少2周以上;并且部分患者在俯卧位的同时,切口施加以500~1 000 g盐袋略加压,以防止皮下积液产生,利于切口愈合。
显微手术技术是在显微镜的帮助下使术者清晰辨别分离并切除拴系结构,特别在复杂脊髓拴系手术治疗过程中,既要去除各种压迫、牵拉拴系脊髓的病理结构和组织,又要最大程度地保护脊髓及神经结构和功能的完整性,为术后神经功能恢复创造有利条件;而使用神经外科专用显微镜的优势尤为突出[32]。另外,还需要借助于术中实时的连续电生理神经功能监测,可以更加准确地指导术者完成手术,有效提高手术安全性[33]。通常在术中监测实时肌电图、体感诱发电位及运动诱发电位。通过电位变化提示,术者可以尽量减少对脊髓和神经根不必要的推挤、牵拉操作,也可在电刺激器协助下分离脊髓神经与硬脊膜粘连,辨认脊髓与肿瘤界限或分辨神经根与纤维束带、区分马尾和终丝,提高手术精确性,减少损伤。若术中电生理神经功能监测显示在切除拴系结构或分离脊髓和神经根粘连时,相应刺激电位波幅显著改变,则提示该操作有可能会对脊髓神经造成损害。以此为指导,本组患者中的149例患者达到完全松解;但为了保护原有神经功能,有3例患者术中部分松解,2例患者无法松解。现代神经外科,特别是在脊髓脊柱神经外科手术当中,应用电生理神经功能监测的优势已经成为不可争论的事实[34],可显著降低术中脊髓及神经损害和术后脑脊液漏的发生率,提升手术的总有效率。
另有报道应用脊柱截骨术(vertebral column subtraction osteotomy,VCSO)[35],以及与之类似的脊柱均匀缩短脊髓轴性减压术(homogeneous spinal-shortening axial decomposition procedure,HSAD)[36]等,通过手术缩短脊柱长度达到间接降低脊髓及神经根在纵向的牵张力,可以在一定程度上改善脊髓功能障碍[37]。此外,得益于脊柱内镜技术的迅猛发展,近来也有使用内镜辅助技术治疗成人单纯终丝增粗型脊髓拴系的成功个案[38]。但是这些方法因其适用范围所限,仅作为成年单纯低位圆锥或多次拴系松解手术失败患者的一种补充治疗手段,对于合并其他病理改变的复杂型脊髓拴系,还是应以针对病因的显微镜下脊髓及神经根松解术为首选[39]。
综上所述,复杂脊髓拴系综合征患者一旦出现大小便功能障碍或下肢严重畸形,虽经手术治疗松解脊髓牵拉后,但原有症状难以完全恢复正常;所以该病一经确诊,只要患者身体条件符合手术要求,就应及早接受手术治疗,以免造成神经功能的不可逆性损害。对于合并先天性神经管畸形、各类肿瘤等复杂脊髓拴系综合征的治疗存在很多困难,传统手术难度大,术后神经功能障碍发生率高。但若在手术中使用神经外科显微镜及电生理神经功能监测,就可以有效提高手术疗效和安全性。
因本研究纳入病例时未对新生儿、婴幼儿、儿童、青少年及成人细致分组对比,且缺乏对术后并发症详细记载,术后随访中能配合完成尿流动力学测定的病例数较少;故下一步计划按照不同年龄阶段细致区分,完善术后随访检查及并发症统计。并在继续收集总结新发病例的同时,进行5~10年的远期随访,以明确复杂脊髓拴系综合征的病程特点,更好地指导临床治疗。
[1] Yamada S,Lonser RR.Adult tethered syndrome[J].Spinal Disord,2000,13:319.
[2] Lew SM,Kothbauer KF.Tethered cord syndrome:an updated review[J].Pediatr Neurosurg,2007,43:236.
[3] Lad SP,Patil CG,Ho C,etal.Tethered cord syndrome:nationwide inpatient complications and out-comes[J].Neurosurg Focus,2007,23:E3.
[4] 周庆九,刘波,阿不都如苏里,等.脊髓栓系综合征的MRI分型及临床意义[J].中华神经外科杂志,2007,23:868.
[5] Kirolles RW,Van-Hille PF.Evouluntion of surgery for the tethered cord syndrome using anew grading system[J].Br J Necrerury,1996,10:253.
[6] Jun G,Xiangyi K,Zhimin L,etal.Surgical treatments on adult tethered cord syndrome[J].Medicine,2016,95:46.
[7] Garg K,Tandon V,Kumar R,etal.Management of adult tethered cord syndrome:our experience and review of literature[J].Neurol India,2014,62:137.
[8] Romagna A,Suchorska B,Schwartz C,etal.Detethering of a congenital tethered cord in adult patients:an outcome analysis[J].Acta Neurochir (Wien),2013,155:793.
[10] Garceau GJ.The filum terminale syndrome (the cord-traction syndrome)[J].Bone Joint Surg Am,1953,35-A:711.
[11] Hoffman HJ,Hendrick EB,Humphreys RP.The tethered spinal cord:its protean manifestations,diagnosis and surgical correction[J].Childs Brain,1976,2:145.
[12] Yamada S,Zinke DE,Sanders D.Pathophysiology of “tethered cord syndrome”[J].J Neurosurg,1981,54:494.
[13] Tu A,Steinbok P.Occult tethered cord syndrome:a review[J].Childs Nerv Syst,2013,29:1635.
[14] Aufschnaiter K,Fellner F,Wurm G.Surgery in adult onset tethered cord syndrome(atcs):review of literature on occasion of an excep-tional case[J].Neurosurgical Review,2008,31:371.
[15] Bulsara KR,Zomorodi AR,Enterline DS,etal.The value of magnetic resonance imaging in the evaluation of fatty filum terminale[J].Neurosurgery,2004,54:375.
[16] Yener S,Thomas DT,Hicdonmez T,etal.The effect of untethering on urologic symptoms and urodynamic parameters in children with primary tethered cord syndrome[J].Urology,2015,85:221.
[17] Hertzler DA,DePowell JJ,Stevenson CB,etal.Tethered cord syndrome:a review of the literature from embryology to adult presentation[J].Neurosurg Focus,2010,29:E1.
[18] Selcuki M,Mete M,Barutcuoglu M,etal.Tethered cord syndrome in adults:experience of 56 patients[J].Turk Neurosurg,2015,25:922.
[19] Solmaz I,Izci Y,Albayrak B,etal.Tethered cord syndrome in childhood:special emphasis on the surgical technique and review of the literature with our experience[J].Turk Neurosurg,2011,21:516.
[20] Talamonti G,D’Aliberti G,Nichelatti M,etal.Asymptomatic lipomas of the medullary conus:surgical treatment versus conservative management[J].J Neurosurg Pediatr,2014,14:1.
[21] Meulen WD,Hoving EW,Staal-Schreinemacher A,etal.Analysis of different treatment modalities of tethered cord syndrome[J].Childs Nerv Systn,2002,18:513.
[22] Gupta SK,Khosla VK,Sharma BS,etal.Tethered cord syndrome in adults[J].Surg Neurol,1999,52:362.
[23] 尚爱加,张远征,程东源,等.儿童脊髓拴系综合征的临床分型、手术治疗及疗效分析[J].中华神经外科杂志,2012,28:606.
[24] Steinbok P,Kariyattil R,MacNeily AE.Comparison of section of filum terminale and non-neurosurgical management for urinary incontinence in patients with normal conus position and possible occult tethered cord syndrome[J].Neurosurgery,2007,61:550.
[25] Yamada S,Lonser RR.Adult tethered cord syndrome[J].J Spinal Disord,2000,13:319.
[26] Cui ZG,Xiu B,Xiao K,etal.Application of microsurgical technique for intraspinal lipoma tethered cord syndrome:report of 611 cases[J].Chin J Neurosurg,2011,27:1128.
[27] Toshitaka S,Kazutoshi H,Shunsuked Y,etal.Surgical outcome of children and adolescents with tethered cord syndrome[J].Asian Spine J,2016,10:940.
[28] Kural C,Solmaz Y,Pusat S,etal.Surgical technique for split cord halformations:pitfalls and solution pathways[J].Gulhane Med J,2013,55:77.
[29] Wykes V,Desai D,Thompson DN.Asymptomatic lumbosacral lipomas:a natural history study[J].Childs Nerv Syst,2012,28:1731.
[30] Huang SL,Shi W,Zhang LG.Surgical treatment for lipomyelomeningocele in children[J].World J Pediatr,2010,6:361.
[31] Trammell TR,Rapp G,Maxwell KM,etal.Luque interpe-duncular segmental fixation of the lumbosacral spine[J].Orthop Rev,1991,20:57.
[32] Lee GY,Paradiso G,Tator CH,etal.Surgical management of tethered cord syndrome in adults:indications,techniques,and long-term outcomes in 60 patients[J].J Neurosurg Spine,2006,4:123.
[33] Khealani B,Husain AM.Neurophysiologic intraoperative monitoring during surgery for tethered cord syndrome[J].J Clin Neurophysiol,2009,26:76.
[34] Paradiso G,Lee GY,Sarjeant R,etal.Multi-modality neurophysiological monitoring during surgery for adult tethered cord syndrome[J].J Clin Neurosci,2005,12:934.
[35] Nakashima H,Imagamas,Matsui H,etal.Comparative study of untethering and spine-shortening surgery for tethered cord syndrome in adults[J].Global Spine J,2016,6:535.
[36] 史建刚,袁文.脊柱外科手术解剖图解[M].上海:科学技术出版社,2015:279.
[37] Buchowski JM,Bridwell KH,Lenke LG,etal.Neurologic complications of lumbar pedicle subtraction osteotomy:a 10-year assessment[J].Spine,2007,32:2245.
[38] Mehmet S,Salih A,Deniz B.Fully endoscopic interlaminar detethering of spinal cord in tethered cord syndrome:a case report and technical description[J].Korean J Spine,2015,12:287.
[39] Fehlings MG,Arvin B.Recurrent tethered cord syndrome:a novel approach for a difficult surgical condition[J].J Neurosurg Spine,2009,10:275.
Analysisofsurgicalefficacyofcomplextetheredcordsyndrome
YUANShuai,YUANZhi,ZHANGJing-long,etal.
DepartmentofNeurosurgery,LanzhouUniversitySecondHospital,Lanzhou730030,China
Correspondingauther:YUANZhi
ObjectiveDifferent types of surgery for complex tethered cord syndrome(TCS) were summarized and analyzed to explore the surgical time,method and efficacy,so as to improve the outcome of this disease.MethodsThe clinical data of 154 patients with complex TCS admitted in our department from January 2011 to April 2017 were analyzed retrospectively,and were classified based on gender,age,the sites of tethered cord and the pathological manifestations.All patients
intraoperative neuromonitoring assisted microsurgery,and the intraoperative release degree of tethering was classified using Kirollos and Van-Hille.During postoperative follow-up,clinical efficacy was evaluated based on Hoffman nerve function classification.ResultsThere was no operative death.Intraoperative complete release rate was 97%.Of 154 patients,126 were followed up from 3 months to 3.8 years.According to Hoffman nerve function classification,the symptom of patients who were classified into class 0-3 before operation was markedly improved after operation than those in class 4-5.One of the patients had disease progression after operation,while the rest had symptoms or signs improved to different extent.ConclusionsThe diagnosis and treatment of complex TCS is a complicated and challenging task with great surgical difficulty,and the occurrence rate of dysneuria is relatively high after regular surgery.As to this disease,surgery should be conducted immediately after it is diagnosed.The intraoperative application of microsurgery and neuromonitoring can effectively reduce the damage to spinal cord and nerve,and improve surgical outcomes.
tethered cord syndrome; microsurgery; intraoperative neuromonitoring
730030兰州,兰州大学第二医院神经外科(袁帅,袁治,张景龙,张赫,潘亚文),神经内科(鄢琦)
袁治
10.3969/j.issn.1672-7770.2017.06.005
R681.5
A
1672-7770(2017)06-0423-08
(收稿2017-08-24 修回2017-10-25)

