负载抗菌药物骨水泥的药物释放实验研究
吕静叶盛英王昊郝建华满淑丽谢宝钢*
负载抗菌药物骨水泥的药物释放实验研究
吕静1叶盛英2王昊3郝建华3满淑丽4谢宝钢3*
目的揭示负载抗菌药物骨水泥的药物释放浓度、持续时间、药物残留程度及低于最小有效抑菌浓度的释放时间,为合理应用抗菌药物提供理论依据。方法通过对负载盐酸万古霉素和亚胺培南西司他丁钠的骨水泥进行体外洗提实验,采用高效液相色谱法检测分析两种负载抗菌药物的骨水泥的药物释放浓度、释放持续时间和药物残留程度。结果负载抗菌药物的骨水泥第一天药物释放量最大,后逐渐持平,且释放时间较长,释放浓度较低;截止到第7周盐酸万古霉素、亚胺培南西司他丁释放量分别只占总负载量的15%、25%;盐酸万古霉素第1周后释放浓度低于最小有效抑菌浓度,亚胺培南西司他丁钠第7周后释放浓度低于最小有效抑菌浓度。结论载抗菌药物骨水泥存在长时间药物残留现象,是导致持续低于最小有效抑菌浓度的主要原因。此种现象不但对细菌起不到抑菌作用,而且是诱导细菌耐药性的危险因素。
骨水泥;药物控释;抗菌药物残留
负载抗菌药物的骨水泥已被广泛应用于关节置换、骨组织感染和骨缺损的防治,并获得良好的临床效果。而近年来在临床实践中,不规范使用广谱抗菌药物,导致细菌对多数抗菌药物耐药性不断上升[1,2],使高耐药菌感染和低耐药菌感染病例逐年增加[3],与存在抗菌药物的负载不能通过细菌培养选择高敏感抗菌药物的缺陷有关[4],另外是否还存在抗菌药物残留及持续低于最小有效抑菌浓度释放的缺陷,需我们进一步探讨。
本研究拟通过对负载抗菌药物骨水泥 (Polymethyl methacrylate;PMMA)药物释放量和残留量进行体外实验研究,探讨负载抗菌药物骨水泥的药物释放浓度、持续时间、药物残留程度及低于最小有效抑菌浓度释放时间。为临床合理应用负载抗菌药物骨水泥预防和治疗骨组织感染提供理论依据。
1 材料和方法
1.1 材料
聚甲基丙烯酸甲酯骨水泥(PMMA,天津合成材料工业研究所),亚胺培南西司他丁钠注射液(Merck Sharp&Dohme Corp生产)、盐酸万古霉素注射液(礼来苏州制药有限公司生产),亚胺培南(Solarbio)、万古霉素(Vancomycin)标准品(中国食品药品鉴定研究所),高效液相色谱仪Agilent 1200 HPLC(美国安捷伦科技公司),电子天平 AL104(上海梅特勒—托利多仪器公司),精确到0.1 mg。
1.2 实验方法
1.2.1 实验分2组
盐酸万古霉素PMMA骨水泥组;亚胺培南西司他丁钠PMMA骨水泥组。
1.2.2 实验样品制作
抗菌药物与 PMMA按1:20(w/w)比例配制,每组9个样品。在(23±1)℃和相对湿度不低于40%的无菌条件下,将亚胺培南西司他丁钠或盐酸万古霉素与骨水泥固相按比例混合后搅拌均匀,加入骨水泥液相,搅拌成糊状,制成直径(6±0.1)mm,高(12±0.1)mm负载抗菌药物的骨水泥样品[4]。
1.2.3 样品抗菌药物加载量测定
将已制备的负载抗菌药物PMMA样品每组各3枚研磨后加入10 mL PBS(pH 7.4)缓冲液浸泡24 h后收集上清液,所取样品冷冻保存于-20℃的冰箱内待测。
1.2.4 抗菌药物体外洗提实验[4]
分别取已制备的负载抗菌药物PMMA样品各6枚,分别置入40mL烧杯并加入10mLPBS(pH7.4)缓冲液浸泡,保持温度在(37±1)℃。于1天、3天、1周、2周、3周、4周、5周、6周、7周时间点吸取浸出液放入试管内。取样时,先以顺时针和逆时针方向搅动浸泡液各10次,收集上清液。再更换10mL新的缓冲液浸没。负载抗菌药物PMMA洗提7周后,分别研磨并加入10 mL缓冲液浸泡24 h后收集上清液,所取样品冷冻保存于-20℃的冰箱内待测。
色谱柱:Agilent ZORBAX SB-C18(250 mm×4.6 mm i.d.,5 m;Agilent,Palo Alto,CA,USA);流动相为0.1%醋酸铵缓冲液-乙腈 (90:10),柱温35°C,流速1.0mL/min,检测波长230 nm,进样量10 L,分析样品。
Agilent ZORBAX SB-C18(250 mm×4.6 mmi.d.,5 m;Agilent,PaloAlto,CA,USA);流动相为0.1%醋酸铵缓冲液-乙腈(98:2),柱温35°C,流速1.0mL/min,检测波长300 nm,进样量10 L,分析样品。
精密称取标准品万古霉素、亚胺培南各20 mg,分别溶于10mL容量瓶中,加8mL磷酸二氢钠缓冲液溶解后,再加该缓冲液稀释至10 mL,摇匀,作为对照品溶液。线性关系考察
取万古霉素、亚胺培南标准品各10mg,精密称定,用磷酸二氢钾缓冲液溶解制备成1.0mg/mL,再依次稀释成0.4 mg/mL、0.2 mg/mL、0.1 mg/mL、0.05 mg/mL系列浓度溶液,按上述色谱条件,进行标准曲线的测定。
1.2.6 抑菌实验
在90mmM-H上接种标准金黄色葡萄球菌ATCC25923 0.5麦氏,贴入3个直径6mm的无菌滤纸,每片滤纸加入抗菌药物洗提液10 L,每个时间段提取液6个样品,37℃下培养24小时,然后用游标卡尺测量抑菌环的直径。
1.3 数据统计
本研究中计量数据均以Means±SD表示,采用SPSS 17.0统计程序包(SPSS公司,美国)以双因素方差分析方法进行统计分析和组间比较,<0.05为有统计学差异。
2 实验结果
2.1 高效液相色谱法(High Performance Liquid Chromatography,HPLC)检测数据分析
2.1.1 标准品线性关系考察
以峰面积 (y)对溶液质量(x)进行线性回归,得回归方程y=1387x-48.8(r=0.9989),结果表明:在0.05 mg/mL~1.0 mg/mL范围内,万古霉素浓度与峰面积的线性关系良好(见图1)。

图1 万古霉素标准品线性关系
以峰面积 (y)对溶液质量(x)进行线性回归,得回归方程y=92.3x-10.6(r=0.9975),结果表明:在0.05 mg/mL~1.0 mg/mL范围内,亚胺培南浓度与峰面积的线性关系良好(见图2)。
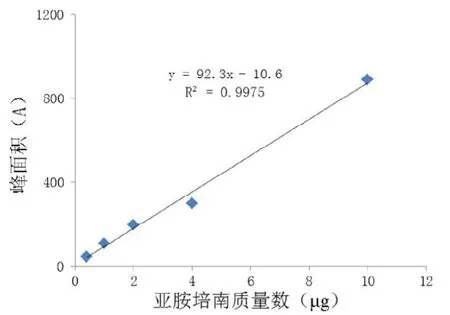
图2 亚胺培南标准品线性关系
通过HPLC分析:盐酸万古霉素PMMA,第一天释放量最大,后逐渐持平,但释放时间较长。盐酸万古霉素PMMA截止到第7周释放盐酸万古霉素约占加载总量的15%(见图3)。

图3 抗菌药物PMMA洗提释放浓度与时间曲线
HPLC分析显示:亚胺培南PMMA第一天释放量最大,后面逐渐持平,但释放时间较长。亚胺培南PMMA截止到第7周释放亚胺培南约占加载总量的25%(见图3)。
通过PMMA负载不同抗菌药物释放与残留研究,发现第七周万古霉素、亚胺培南在PMMA载体内分别残余85.2%、74.6%(见图4、图5)。

图4 抗菌药物PMMA洗提残留量与时间曲线注:*<0.05,不同抗生素在相同时间比较存在统计学差异。
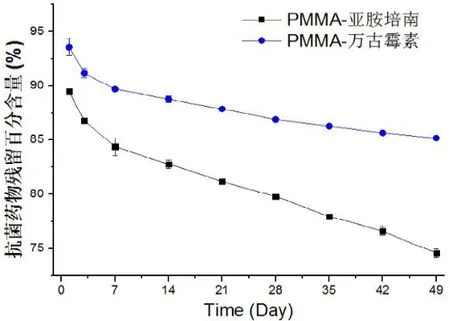
图5 载体内两种抗菌药物残留与时间曲线
2.2 抑菌性能
体外洗脱液抑菌环变化:应用抗菌药物骨水泥进行体外洗脱,观察其对标准金黄色葡萄球菌 ATCC 25923抑菌环变化(如图6)。结果显示,骨水泥(PMMA)搭载抗菌素亚胺培南的抑菌环均明显大于搭载万古霉素组(<0.05)。
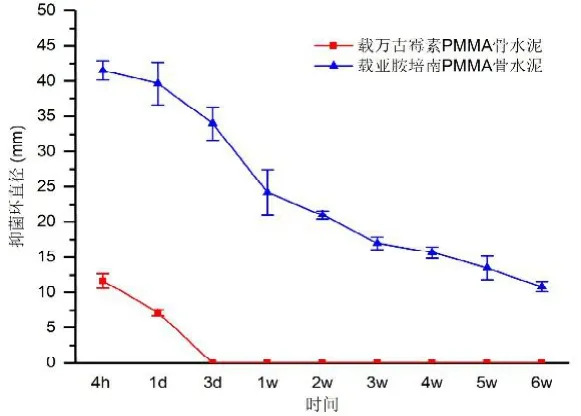
图6 不同抗菌药物PMMA体外释放对金葡菌抑菌环直径时间曲线
最小有效抑菌浓度抑菌环变化:在最小有效抑菌浓度下有抑菌环出现,在低于最小有效抑菌浓度下无抑菌环出现(见图7)。

图7 亚胺培南骨水泥洗提液中抗菌药物在 A最小有效抑菌浓度与B低于最小抑菌浓度下的抑菌圈(彩图见插页)
3 讨论
自70年代由 Buchholz等[7]提出的以骨水泥为载体混合抗菌药物局部释放的方法以来,这项技术在开放性骨折感染防治、骨髓炎、骨缺损和关节假体周围感染的治疗方面得到了非常广泛的应用[8-11]。但是在对这些诊断明确的病例进行分期治疗的过程中,通常需要首先使用带有高剂量抗菌药物的骨水泥串珠或占位器以利于抗菌药物的局部释放[12]。McLaren等[13]证实为达到局部药物浓度和持续时间必须增加抗菌药物剂量,但是随着时间药物释放浓度逐渐减小,可降低至抗菌药物最小有效抑菌浓度以下。有报道称抗菌药物骨水泥可持续释放药物50年[14]。
在细菌耐药性方面,如果细菌不能被高浓度的抗菌药物杀灭,则由于细菌与亚最小有效抑菌浓度的抗菌药物接触后,诱导细菌逐渐产生可遗传的和非遗传的耐药性,进而加剧治疗难度。敏感细菌在亚最小有效抑菌浓度的抗菌药物压力选择下,能够诱导成为耐药细菌,且其诱导程度比高剂量抗菌药物浓度时还要高。所以在低于抗菌药物最小有效抑菌浓度时,不但起不到预防和治疗感染的作用,而且无法获得清除生物膜上的残留细菌所需要的足够浓度,而且是诱导细菌产生耐药性的危险因素[3,14]。
本文通过PMMA作为载体负载盐酸万古霉素和亚胺培南西司他丁钠,在加载相同剂量抗菌药物的前提下,对其体外抗菌药物洗提液:
⑵进行抑菌实验发现:两种不同抗菌药物骨水泥其抑菌程度及持续时间存在明显差异,且洗提液中抗菌药物浓度在最小抑菌浓度时对金黄色葡萄球菌有抑菌环出现,在低于最小有效抑菌浓度时无抑菌环出现。进一步证实抗菌药物浓度在低于最小抑菌浓度时对细菌无抑菌作用,反而为诱导细菌产生耐药性提供条件。
通过对两种不同类别的抗菌药物PMMA体外洗提实验,从药物的释放、持续时间和药物残留方面进行对比研究发现:PMMA骨水泥作为抗菌药物载体存在药物残留和持续低浓度释放等缺陷,且两种不同抗菌药物在药物释放和残留上也存在显著差异。由于PMMA骨水泥作为抗菌药物载体存在药物残留和持续低浓度释放的缺陷,在临床应用中不仅达不到临床合理应用抗菌药物的要求,还是诱导细菌产生耐药性的危险因素。所以,笔者将进一步研究减少药物残留和增加药物浓度释放的方法,加强抗感染治疗效果和减少细菌耐药性方面的研究。
[1] 孔双红,彭玉华,黄丽燕,等.外科住院患者医院感染病原菌种类与耐药性分析[J].中华医院感染学杂志,2016,26(5):1162-1164.
[2] 李继红,赵建宏,时东彦,等.2014年住院患者临床分离细菌的耐药性研究[J].中华医院感染学杂志,2016,26(1):56-58.
[3] 陈代杰.细菌耐药性与抗生素增效剂开发.上海应用技术学院学报[J].自然科学版,2016,16(1):1-9.
[4] Xie B G,Wang X D,Wang H,et al.Releasing profile of antibiotics from a novel mineralized collagen putty with quantifiable drug loading.Materials Technology,2015,30(sup8):B216-B222.
[5] 王佳庆,赵志刚,梅升辉.HPLC法测定人血浆中万古霉素浓度的不确定度评定[J].中国医药导报,2016,(10):30-34.
[6] 郭楠,詹莹,邵华,等.高效液相色谱法测定重症患者的亚胺培南血药浓度[J].中国临床药理学杂志,2015,(08):645-647.
[7] Buchholz HW, Elson RA, Engelbrecht E, et al. Management of deep infection of total hip replacement[J]. J Bone Joint Surg Br, 1981, 63-B(3):342-353.
[8] Bertazzoni ME, Benini A, Samaila E, et al. Antimicrobial activity of gentamicin and vancomycin combination in joint fluids after antibiotic-loaded cement spacer implantation in two-stage revision surgery[J]. J Chemother, 2015, 27(1): 17-24.
[9] 吴宏日,贾硕,傅景曙,等.En bloc切除结合膜诱导技术分期治疗长骨 Cierny-MaderⅣ型创伤后骨感染[J].中华创伤杂志,2017,(33)2:147-152.
[10]范少地,刘志恒,吴国忠,等.抗生素骨水泥结合膜诱导技术治疗胫骨骨髓炎的临床研究[J].生物骨科材料与临床研究,2017,14(4):54-57.
[11]Masquelet AC, Fitoussi F, Begue T, et al. Reconstruction of the long bones by the induced membrane and spongy autograft[J]. Ann Chir Plast Esthet, 2000, 45(3): 346-353.
[12]Giannoudis PV, Faour O, Goff T, et al. Masquelet technique for the treatment of bone defects: tips-tricks and future directions[J]. Injury,2011, 42(6): 591-598.
[13]McLaren A, Giers MB, Fraser J, et al. Antimicrobial distribution from local delivery depends on dose : a pilot study with MRI[J]. Clin Orthop Relat Res, 2014, 472(11): 3324-3329.
[14]康文磊,孙铁铮,牛慧云,等.抗生素骨水泥治疗骨科感染的利与弊[J].中华关节外科杂志(电子版),2012(5):782-784.
[15]Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Susceptibility Testing:Twenty-fifth Informational Supplement M100-S25[S].CLSI,Wayne,PA,USA,2015.
[16]万古霉素临床应用中国专家共识(2011版).中国新药与临床杂志[J].2011,30(8):561-572.
[17]公衍文,李晓娣,袁著忻.亚胺培南对医院感染常见革兰阴性杆菌的体外抗菌活性[J].中华医院感染学杂志,2000,10(2):143-149.
The drug release characteristics of antibiotic-loaded polymethyl methacrylate cements
Lv Jing1, Ye Shengying2, Wang Hao3, et al. 1 Department of Nephrology;2 Department of Pharmacy;3 Department of Orthopaedics, the 254 Hospital of PLA, Tianjin, 300142; 4 College of Biotechnology, Tianjin University of Science&Technology,Tianjin,300457,China
Objective The effects of the drug concentration, release period, the residue concentration, and releasing time that under the minimal inhibitory concentration from polymethyl methacrylate (PMMA) cement will be studied, in order to lay down a theoretical basis for rational use of antibacterial drugs. Methods Imipenem or vancomycin loaded in the PMMA cement samples was eluted in vitro. High performance liquid chromatography (HPLC) was used to quantitatively determine the releasing profile and residue of imipenem or vancomycin in the antibiotic-loaded PMMA samples.ResultsAntibiotics rapidly released from the PMMA samples on the first day, and slowly released at a low concentration afterwards;Only 15% of vancomycin and 25% of imipenem were separately released from the antibiotic-loaded PMMA samples after elution for seven weeks. Therefore, there were a large amount of antibiotics remained in the PMMA;The drug releasing concentration from vancomycin-loaded PMMA was lower than the minimal inhibitory concentration after one week, while that from imipenem-loaded PMMA was lower than the minimal inhibitory concentration after seven weeks. Conclusion The drug releasing concentration from antibiotic-loaded PMMA samples was lower than the minimum bacteriostatic concentration, due to a large amount of residues in the PMMA, which likely results in antibiotics resistance for bacteria.
Polymethyl methacrylate cement;Drug controlled release;Antibiotic residues
R318.08
A
10.3969/j.issn.1672-5972.2017.06.002
swgk2017-08-00173
天津解放军第254医院1肾内科;2药剂科;3骨科,天津 300142;4天津科技大学生物工程学院,天津 300457
吕静(1965-)女,本科,副主任护士。研究方向:护理。
*[通讯作者]谢宝钢(1962-)男,硕士,主任医师。研究方向:骨科。
2017-08-01)

