载药硼酸盐骨水泥的制备及其体外生物活性和抗菌性能的研究*
崔旭黄程程张朦杨鸿生阮长顺黄文旵潘浩波*
论著·实验研究
载药硼酸盐骨水泥的制备及其体外生物活性和抗菌性能的研究*
崔旭1,2黄程程1张朦1杨鸿生1阮长顺1黄文旵3潘浩波1,2*
目的以硼酸盐生物活性玻璃和改性壳聚糖液相制备了新型的硼酸盐骨水泥,同时负载骨髓炎治疗药物硫酸庆大霉素,考察其体外抗菌性能,以探讨其治疗骨髓炎的可能性。方法以硼酸盐骨水泥为载体,制备了负载硫酸庆大霉素(GS)的骨水泥。探究负载GS对骨水泥的可注射性能、初凝时间的影响;将负载GS且预固化的硼酸盐骨水泥浸泡于磷酸盐缓冲溶液(PBS)中,考察其体外生物活性、生物降解性和药物释放;利用抑菌圈实验评估了负载 GS的硼酸盐骨水泥的体外抗菌性能。结果制备的载药硼酸盐骨水泥能够被完全注射,初凝时间约6 min;在体外的磷酸盐缓冲溶液(PBS)中浸泡时,GS能够持续稳定的释放,药物释放长达26天;负载GS的硼酸盐骨水泥能够很好地抑制金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)的生长。结论制备的负载GS的硼酸盐骨水泥具有优异的可注射性,合适的原位自固化时间,长期持续的药物释放和抗菌性能,可以用于骨髓炎治疗的进一步研究。
可注射;硼酸盐生物玻璃;骨水泥;药物载体;抗菌性能
肿瘤切除、外伤、感染和先天畸形等疾病,造成大量需要接受骨组织缺损修复的病患。传统的骨组织缺损修复主要通过自体骨移植和同种异体骨移植实现。上述传统修复方法虽然具有很好的疗效,但前者以牺牲自体健康组织为代价,是一种“以伤治伤”的办法;后者常常会带来疾病传播和免疫排斥等问题。此外,二者的来源有限[1]。因此,越来越多人工合成的生物材料被用于动物实验和临床研究,以考察替代自体骨移植的可行性途径[2]。
得益于骨水泥良好的可加工性能,近年来,能够自行固化的骨水泥已经被广泛研究并应用于骨组织工程领域。骨水泥通常包括固相粉末组份和液体组份,室温下将其按一定比例混合后,骨水泥能够通过注射器植入形状复杂、不规整的骨缺损部位,并于骨缺损部位原位固化[1]。可注射性能使得骨水泥能够以微创的方式植入体内,从而最小化手术过程中的组织损伤,减少疤痕的面积,减少患者的痛苦[3-5]。目前,可注射骨水泥主要有:丙烯酸骨水泥、硫酸钙骨水泥、磷酸钙骨水泥及复合骨水泥[6]。而上述四大类可注射骨水泥都因各种各样的不足而使应用受到限制[3,7-12]。聚甲基丙烯酸甲酯(PMMA)骨水泥不能降解,缺乏生物活性,与椎体宿主骨之间的界面结合力低,易形成纤维组织包裹,从而导致无菌性松动或者植入失败;同时PMMA骨水泥刚性过高,长期植入脊柱椎体后容易引起临近椎体再骨折,引发患者的局部疼痛[7]。磷酸钙骨水泥具有生物活性和骨传导性能,但是力学性能差,不能应用于承重部位的骨缺损修复,而且其抗溃散性能差,容易造成渗漏和栓塞,危及患者的生命安全[9,12]。硫酸钙骨水泥也缺乏生物活性,而且硫酸钙材料本身的水溶性使其在植入体内后会被快速的吸收,速度远远快于新骨长入的速度,会在椎体腔内留下孔隙,临床骨修复性能较差[8]。
自从Hench[13]发明硅酸盐生物玻璃,45S5以来,45S5生物玻璃已经广泛的应用于整形外科、牙科和皮肤等组织工程领域,取得了瞩目的成就。生物玻璃具有生物活性,与体液接触后,能够降解成为羟基磷灰石(hydroxyapatile,HA,骨骼的无机组成),从而与骨骼和软组织形成牢固的结合。
硼酸盐生物玻璃作为一种新型的生物材料,已经应用于诸多生物医学领域[14-17]。张等[14,15]以硼酸盐生物玻璃为基体作为负载替考拉宁的药物载体,可以用于炎症治疗和骨缺损部位的修复。硼酸盐生物玻璃支架能够促进细胞增殖,维持细胞正常功能,植入老鼠皮下6周后,硼酸盐生物玻璃支架能支撑组织的长入,表明硼酸盐生物活性玻璃兼具优异的生物活性和降解性,生物相容性,以及骨传导和骨诱导性能[16,17]。但是,以硼酸盐生物玻璃为基体的可注射骨水泥却鲜有研究。
此外,伴随骨创伤治疗的细菌或真菌感染的骨髓炎具有10%~15%的发生率,且治疗较为困难[18]。为到达更好的治疗效果,医务工作者们往往向骨再生材料中加入抗生素。GS是一种广谱的糖肽抗生素,对革兰氏阳性菌和阴性菌具有较强的抑制作用,尤其是治疗和预防大肠柑橘和金黄色葡萄球菌引起的骨骼感染[19]。
本文制备了新型载硫酸庆大霉素的硼酸盐骨水泥药载体系,对载药骨水泥的可注射性、初凝时间、生物活性和降解性、药物释放进行了考察;并以大肠杆菌和金黄色葡萄球菌为模型,评估了其体外的抗菌性能。
1 材料和方法
1.1 载药骨水泥的制备
硼酸盐骨水泥载药体系由固、液两相组成,固相为硼酸盐生物活性玻璃和硫酸庆大霉素(GS)的混合粉末,液相为壳聚糖、甘油磷酸钠、盐酸和去离子水的混合溶胶。
硼酸盐生物玻璃通过传统的熔融法制备获得,其摩尔组成如下:14R2O-30MO-54B2O3-2P2O5,其中R2O为碱金属氧化物,MO为碱土金属氧化物。将各碱金属、碱土金属所对应碳酸盐、磷酸盐和硼酸等(分析纯,国药集团化学试剂有限公司)按照配比充分混合均匀,然后将装有混合药品的白金坩埚置于1200℃~1350℃的硅钼炉中,熔制2~4 h,熔体淬冷后获得块体玻璃,将玻璃块研磨筛分获得粒径位于20 m~40 m范围的粉末,备用。
液相为壳聚糖、甘油磷酸钠、盐酸(分析纯,国药集团化学试剂有限公司)和去离子水的混合溶液。首先,将壳聚糖溶于pH值为4±0.4的盐酸溶液,磁力搅拌1~2 h至溶液澄清,制备20mg/mL的壳聚糖/盐酸溶液,并置于4℃冰箱中冷藏备用。然后将5.6 g甘油磷酸钠溶于10 mL去离子水,磁力搅拌至溶液澄清透明,制备甘油磷酸钠溶液。最后,将制备的壳聚糖/盐酸溶液与甘油磷酸钠溶液按照体积比5:1混合,制备壳聚糖混合溶液,然后置于4℃的冰箱冷藏备用。
马文虽然感到重返冈面有些难为情,但出于对刘少奇的信赖,还是积极以赴。到了厂里一了解,情况果然像刘少奇所分析的一般:广东工人都很高兴,而江西、福建工人都不满意。马文按照刘少奇的交待,重新听取了江西、福建工人的意见,对问题作了新的结论。这一来三方面工人都满意了,问题也就彻底解决了。
为制备载药硼酸盐骨水泥,将硼酸盐生物玻璃粉末与硫酸庆大霉素均匀混合,然后加入壳聚糖混合溶胶,在玛瑙研钵中研磨搅拌,混合1.5 min后,即获得载硫酸庆大霉素硼酸盐骨水泥浆体。硫酸庆大霉素粉末、硼酸盐生物玻璃粉和液相的比例为:30 mg:1 g:0.5 mL。
1.2 载药硼酸盐骨水泥的体外性能研究
1.2.1 载药前后硼酸盐骨水泥的可注射性、初凝时间和抗压强度
可注射性和初凝时间是衡量骨水泥应用的重要指标。本文利用专用的骨水泥枪头(浙江科惠),配合专用注射器(上海康德莱)测试载药前后硼酸盐骨水泥浆体的可注射性。采用20mL医用注射器,骨水泥枪头孔径为2.7mm。将5g的硼酸盐生物玻璃粉和硫酸庆大霉素混合均匀,与壳聚糖混合溶液按照2:1的比例混合1分钟左右,待混合均匀后利用药勺转移至注射器中。注射器(骨水泥枪头向下)被垂直固定后,利用电子万能试验机(CMT6104,MTS中国,上海,中国)加载100N的恒定压力,并以10毫米/分钟的速度匀速向下挤出浆体。挤出前浆体的总重量为M;挤出后,剩余浆体的重量为M1,利用公式 (1)计算载药硼酸盐骨水泥的可注射性,每组实验重复4次,计算算术平均值和标准差。
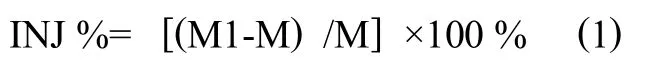
采用通用的吉尔摩双针(ASTMC266)测试载药前后硼酸盐骨水泥的初凝时间。利自制的多孔有机玻璃 (孔尺寸为:宽5mm,高10mm)做模具。将骨水泥浆体填进模具,并置于振荡器震荡20s,以除去浆体可能包裹的空气,然后置于37℃、湿度大于90%湿度的恒温箱中养护,每组实验重复4次,计算算术平均值和标准差。
利用电子万能试验机(CMT6104,MTS中国,上海,中国)评估载药前后硼酸盐骨水泥的抗压强度。电子万能试验机的探头加载速度为0.5 mm/min。硼酸盐骨水泥样品的尺寸为Ø6 mm×12 mm,每组实验重复4次,计算算术平均值和标准差。
1.2.2 载药硼酸盐骨水泥体外生物活性和降解性
分别制备载药和不载药的预成型硼酸盐骨水泥短柱状样品,尺寸为Ø4.7mm×3.5 mm。将4粒骨水泥样品浸泡于10 mL 0.01 M磷酸盐缓冲液 (PBS,pH 7.2~7.4),然后置于湿度大于90%,温度为37℃的恒温箱中,每48 h更换一次浸泡液 PBS。利用天平分析样品的重量变化;利用日产S-2360型扫描电子显微镜(scanning electron microscope,SEM)观察样品浸泡前后表面形貌的变化,同时结合能谱分析(energy dispersive X-rayspectroscopy,EDS)检测其表面成分;利用日本D/max2550VB3+/PC型X射线衍射仪(X-ray diffractometer,XRD)分析样品浸泡后的相组成。将4粒载药骨水泥样品和4粒未载药骨水泥样品各浸泡于10 mL的0.01 M 磷酸盐缓冲液 (PBS,pH 7.2~7.4),然后置于37℃,湿度大于90%的恒温箱中,不更换浸泡液PBS,利用溶液pH计(FE20,Mettler Toledo)检测浸泡液的pH值变化。每组样品重复4次,计算算术平均值和标准差。
1.2.3 载药硼酸盐骨水泥的体外药物释
1.2.4 载药硼酸盐骨水泥体外抗菌活性
采用抑菌圈法定性测试载药硼酸盐骨水泥的体外抗菌性能。实验选用革兰氏阳性菌金黄色葡萄球菌(S.aureus,ATCC 25923)和革兰氏阴性菌大肠杆菌(E.coli,ATCC25922)为细菌模型[20]。以不载药的骨水泥以空白对照组。首先,取100 L菌悬液均匀涂布于LB培养基上,然后将预成型好的载药硼酸盐骨水泥(Ø4.7 mm×3.5 mm,约80 mg)粘附于琼脂培养基,并嵌入些许深度。所有样品在实验之前都经紫外灭菌3 h。预成型的载药骨水泥中,硫酸庆大霉素的含量约为10 mg。分别将涂覆大肠杆菌并粘嵌骨水泥样品和涂覆金黄色葡萄球菌并粘嵌骨水泥样品的琼脂培养基置于37℃培养24 h后,记录样品的抑菌圈照片。
1.3 统计分析
所有的生物学实验(4个样品1组)都重复三次。所有结果都以算术平均值±标准差的形式呈现。以单项方差进行统计分析,统计学水平差异设置为<0.05。
2 结果与讨论
2.1 可注射性、初凝时间和抗压强度
图1是载药前后硼酸盐骨水泥的可注射性(A)、初凝时间(B)和抗压强度(C)。与传统的外科手术相比,采用具有可注射性的骨水泥能够以微创手术植入体内,减少患者的痛苦和费用。载药前后硼酸盐骨水泥均显示出优异的可注射性能。负载硫酸庆大霉素的硼酸盐骨水泥的可注射性能约为97%,而单纯的硼酸盐骨水泥的可注射性能约95%。由于注射器枪头里面不可避免地会有部分骨水泥浆体残留而无法完全注射干净,这意味着本实验制备的硼酸盐骨水泥,无论载药与否,骨水泥浆体都已达到浆体其挤出极限,皆具有理想的可注射性能[21]。由图1(B)可知,载药前,硼酸盐骨水泥的初凝平均时间约为5 min,硫酸庆大霉素的负载稍微增加了硼酸盐骨水泥的初凝时间,约为6 min左右,但仍然是临床的适用范围(6~15)min[22]。图1(C)为负载和未负载硫酸庆大霉素的硼酸盐骨水泥的抗压强度。固化成型的未负载硫酸庆大霉素的硼酸盐骨水泥的抗压强度为(30.3±1.6)MPa;硫酸庆大霉素的负载使得抗压强度有所降低,为(25.6±2.3)MPa。
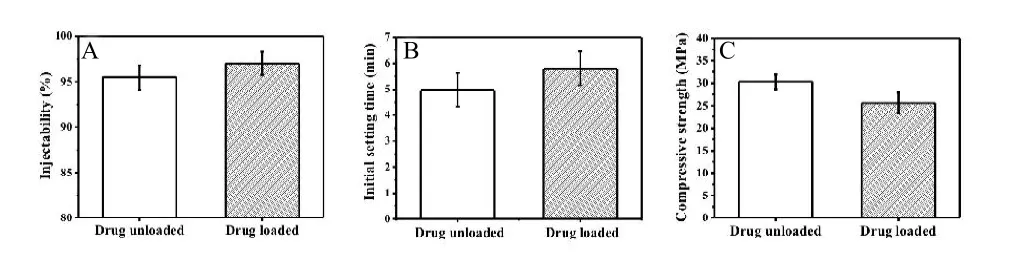
图1 载硫酸庆大霉素前后硼酸盐骨水泥的可注射性能(A)、初凝时间(B)和抗压强度(C)的变化。
骨水泥负载抗生素药物一般是将药物与骨水泥固相粉体混合或者直接与固化液混合,但是无论以何种形式添加,负载药物都会改变骨水泥的理化性质而影响骨水泥的自固化反应[23]。一般来说,抗生素倾向于增加骨水泥的固化时间而降低其力学强度。抗菌药物添加进骨水泥后,与基体材料相互作用的机理主要有三种[24]:物理填充,是指外加抗菌药物在骨水泥浆体结构中仅仅起到固相填料的作用,可以使得骨水泥的结构更加紧密;化学反应,是指由于抗菌药物的反应活性,使其与骨水泥的某一或者某些组分发生化学反应,也可能同骨水泥水化产物再反应;物理化学作用,是指因为外加组分与骨水泥末形成较强的作用力而掩盖了水化反应的活性中心。上述相互作用机理取决于添加药物的物理化学性质。硫酸庆大霉素与壳聚糖/盐酸溶液不发生化学反应,本实验中,硫酸庆大霉素仅仅物理填充。硫酸庆大霉素为水溶性的抗生素,当硼酸盐生物玻璃/硫酸庆大霉素的混合粉体与壳聚糖溶胶液相混合时,硫酸庆大霉素迅速溶解于其中。因此,水溶性的硫酸庆大霉素增加了固化液的体积和基体气孔率,而不是增加固相粉体的量,也就相对地减少了硼酸盐生物玻璃粉和骨水泥液相的比例[22,23]。因此,硫酸庆大霉素的添加增加了硼酸盐骨水泥的可注射性和固化时间,降低了抗压强度。
2.2 生物活性和降解性
在PBS中浸泡后,骨水泥基体中的硼酸盐生物玻璃会析出钠、钾、钙和硼等离子,使得样品逐渐失重,析出的钙与溶液中的磷酸盐[25,26]能够反应形成羟基磷灰石(骨骼的无机组成),从而表现出优异的体外生物活性和降解性。图2分别是负载和未负载硫酸庆大霉素的硼酸盐骨水泥在PBS中浸泡后,试样的累积失重随浸泡的变化以及浸泡液的pH值随时间的变化。负载和未负载硫酸庆大霉素的硼酸盐骨水泥,其累积失重呈现出相似的变化规律(图2 A)。浸泡初期,样品失重较快,重量迅速减少;随着浸泡时间的延长,样品的失重逐渐放缓。硫酸庆大霉素的负载,加速了硼酸盐骨水泥前期的失重,这可能是因为硫酸庆大霉素的水溶性增加了前期骨水泥基体与浸泡液的接触面积,加速了硼酸盐生物玻璃的降解转化[15]。浸泡60天后,未负载GS硼酸盐骨水泥的累积失重率约为36.1%,载药硼酸盐骨水泥的累积失重率约为37.5%,因此硫酸庆大霉素的负载并未显著降低硼酸盐骨水泥的体外降解性。负载和未负载硫酸庆大霉素的硼酸盐骨水泥浸泡液PBS的pH值也呈现出类似的变化规律(图2 B)。浸泡初期,PBS的pH值迅速增加;随着浸泡时间的延长,浸泡液的pH值逐渐下降,并趋于平稳。由于碱金属离子溶出,浸泡初期,pH值迅速升高,但随着反应时间的推移,产物由最初的磷钙化合物向 HA过渡,消耗了OH基团,因此pH值又逐渐降低。在有HA的晶核之后,骨水泥再降解时直接形成HA,所以pH值并趋于平缓。研究发现,单独的硼酸盐生物玻璃颗粒在含磷溶液中浸泡后,浸泡液的pH值最终会达到9.6以上,且维持在此水平。但是过高碱性的局部环境pH值会使得机体产生炎症[27,28]。本实验中,混合溶胶液相的 pH值约为4.6,酸性的溶胶液相在一定程度上能够中和硼酸盐生物玻璃降解形成的过高碱性,使pH值更趋近于生理环境,从而可以避免局部pH过高引起的炎症[29],且体内动态,循环的体液流动也进一步减少了局部环境pH值过高的可能性。

图2 载硫酸庆大霉素的硼酸盐骨水泥在PBS中浸泡后的累积失重(A)和浸泡液PBS的pH值(B)随时间的变化。
硼酸盐生物玻璃降解时析出的钙离子能够与溶液中磷酸根结合,在 pH为碱性的条件,形成最稳定的磷酸钙沉淀,羟基磷灰石[25,26]。图3为负载硫酸庆大霉素的硼酸盐骨水泥在PBS中浸泡前后的表面微观结构和能谱图。浸泡前(图3A),硼酸盐生物玻璃颗粒和硫酸庆大霉素包裹于壳聚糖粘合剂,形成整体,部分表面暴露着硼酸盐生物玻璃颗粒(图3 C)。浸泡60天后(图3 B),表面更加粗糙,骨水泥基体中硼酸盐生物玻璃逐渐降解,形成球形颗粒堆垛的微观结构(图3D),EDS(图3 E)显示表面沉积物为钙磷化合物。骨水泥浸泡前与浸泡60天的表面能谱图差别不大,但是生成钙磷化合物的Ca/P则从1.72降低至1.66,更加的接近于羟基磷灰石的理论化学计算比例,1.67。图4是载硫酸庆大霉素的硼酸盐骨水泥试样在 PBS中浸泡20和60天后以及标准羟基磷灰石(JCDPS72-1243 HA)的XRD图谱。结果表明骨水泥基体中的,硼酸盐生物玻璃组份逐渐转变为HA。但是反应产物的XRD衍射峰出现宽化,说明所获得的HA晶体结构不完全或者其晶体尺寸在纳米尺度范围内。
综合失重曲线,pH变化曲线,XRD,SEM和EDS等试验结果可知,制备的负载硫酸庆大霉素的硼酸盐骨水泥试样具有良好的生物活性和可降解性。

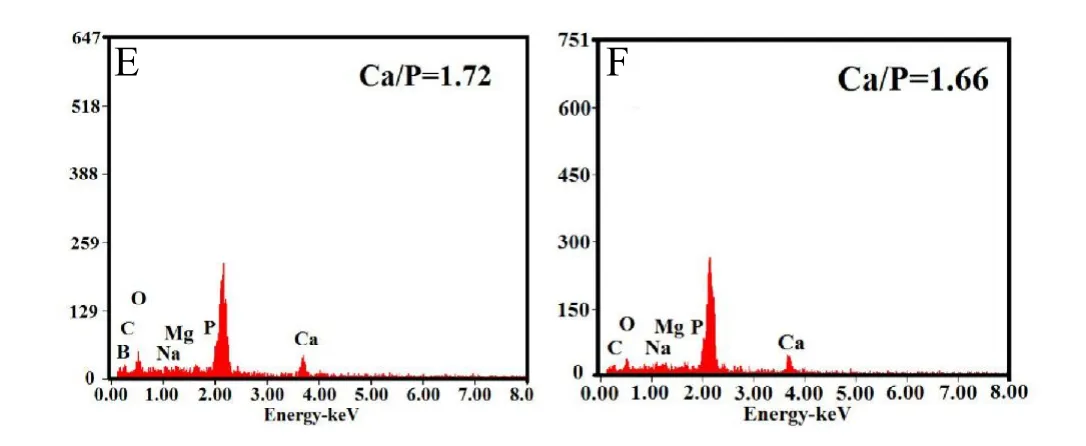
图3 载硫酸庆大霉素硼酸盐骨水泥在PBS中浸泡前和浸泡60天后的SEM观察和EDS分析(A、C浸泡前的SEM观察;B、D浸泡60天后的SEM观察;E、F浸泡前和浸泡60天后的EDS分析)(彩图见插页)。

图4 载硫酸庆大霉素的硼酸盐骨水泥在PBS中浸泡不同天数的XRD(a.20天;b.60天)(彩图见插页)。
2.3 体外药物释放
理想的药物载体不仅要有良好的生物活性,而且要能够持续缓慢地释放药物,以实现骨髓炎症的彻底根治[18]。图5是载药硼酸盐骨水泥在PBS中浸泡后,硫酸庆大霉素的累积释放曲线。缓释初期,存在药物的突释,第一天药物释放量大约为41%,1周后释放量达到74%,随后药物缓慢持续释放,总释放时间长达3~4周,26天时最终药物释放总量为89%。继续延长试验时间,由于药物持续释放的量已经超出仪器的测量极限,因此骨水泥试样在浸泡26天后,表观上显示无药物释出。前期药物的大量释放有助于炎症的控制,后期长期持续释放有助于炎症的根治。
在硼酸盐玻璃粉末固化后,药物就被封装于玻璃粉末之间。由于硫酸庆大霉素是水溶性抗生素,当PBS渗透进入骨水泥基体时,表面或浅层的硫酸庆大霉素迅速原位溶解,因此初期具有较高的药物量,由于生物玻璃粉末的外表面为壳聚糖所包围,以及在PBS浸泡后骨水泥药物载体表面会形成的HA,使药物局限于载体之中。以载体内外的药物浓度差为动力,骨水泥基体内部的硫酸庆大霉素只能通过粉末的间隙逐渐向外释放而实现缓释,从而避免了在浸泡第一天所产生的爆发性释放。随着壳聚糖降解量的增加,玻璃粉末之间的药物也逐步释放。因此,壳聚糖对玻璃体的修饰作用的结果是增长了释放周期,使药物持续均匀地长期释放,最终实现完全释放[15,30]。同时,硼酸盐骨水泥降解形成的碱性环境进一步降低了壳聚糖的溶出度,加之材料表面HA的逐渐形成,从而降低了抗生素早期的爆发性释放,而有利于后期的持续缓慢释放。
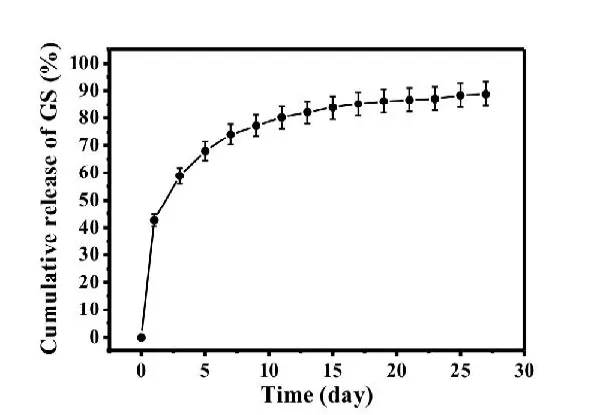
图5 硼酸盐骨水泥药物载体在PBS中浸泡后,硫酸庆大霉素的累积释放曲线。
2.4 体外抗菌活性
图6是载药硼酸盐骨水泥的抗菌实验结果,区域2和区域1分别为负载和未负载硫酸庆大霉素的硼酸盐骨水泥组。由图可知,负载和未负载硫酸庆大霉素的硼酸盐骨水泥均显示对大肠杆菌(E.coli)(图6A)和金黄色葡萄球菌(S.aureus)(图6 B)生长的抑制作用。负载了硫酸庆大霉素的硼酸盐骨水泥对大肠杆菌 (E.coli)的抑菌圈大小约为16 mm,未负载硫酸庆大霉素的骨水泥对大肠杆菌(E.coli)的抑菌圈约为6 mm;而负载了硫酸庆大霉素的硼酸盐骨水泥对金黄色葡萄球菌 (S.aureus)的抑菌圈大小约为14 mm,未负载硫酸庆大霉素的骨水泥对金黄色葡萄球菌 (S.aureus)的抑菌圈约为5 mm;因此与未负载硫酸庆大霉素的硼酸盐骨水泥相比,负载了硫酸庆大霉素的硼酸盐骨水泥对大肠杆菌大肠杆菌 (E.coli)和金黄色葡萄球菌 (S.aureus)的抑菌圈均更大更显著。未负载硫酸庆大霉素的硼酸盐骨水泥的抗菌性能可能是由于在LB琼脂培养基中培养前期,骨水泥高浓度的释放而具有的抑菌作用。
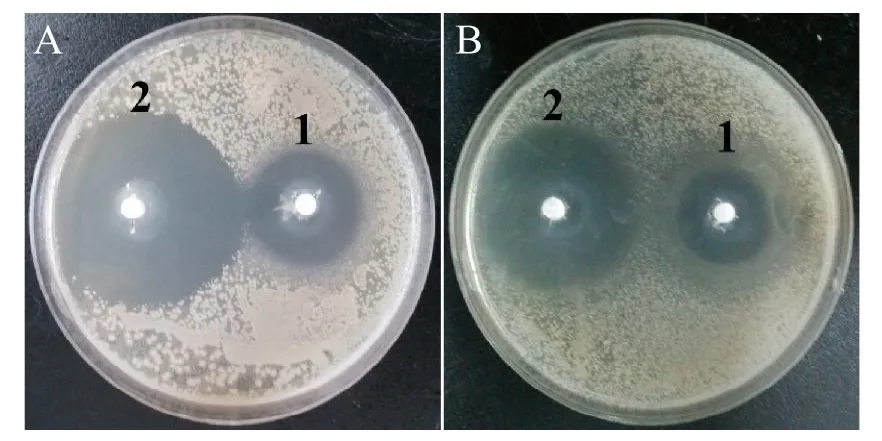
图6 在琼脂培养基培养24h后,载硫酸庆大霉素前后的骨水泥对大肠杆菌(E.coli)(A)和金黄色葡萄球菌(S.aureus)(B)的抑菌圈(彩图见插页)。
4 结论
制备的载硫酸庆大霉素的硼酸盐骨水泥具有良好的降解性和生物活性,能够被完全注射入体内,在合适的时间内能实现自固化。骨水泥在磷酸盐缓冲溶液中浸泡,表面可生成羟基磷灰石,其药物缓释作用可达到持续26天,最终的药物释放率达到86%,而且长期持续的释放药物并有效地抑制大肠杆菌和金黄色葡萄球菌的生长。因此载硫酸庆大霉素的硼酸盐骨水泥可以用于骨髓炎再生修复的进一步研究。
[1] Ryf C, Goldhahn S, Radziejowski M, et al. A new injectable brushite cement: First results in distal radius and proximal tibia fractures[J]. Eur J Trauma Emerg Surg, 2009, 35(4): 389-396.
[2] Schneider G, Blechschmidt K, Linde D, et al. Bone regeneration with glass ceramic implants and calcium phosphate cements in a rabbit cranial defect model [J]. J Mater Sci-Mater M, 2010, 21 (10): 2853-2859.
[3] Ginebra MP, Fernandez E, De Maeyerl EAP, et al. Setting Reaction and Hardening of an Apatitic Calcium Phosphate Cement [J]. J Dent Res, 1997, 76(4): 905-912.
[4] Bohner M. pH variations of a solution after injecting brushite cements [J]. Key Eng Mater, 2001, 192-195: 813-816.
[5] Moseke C, Saratsis V, Gbureck U. Injectability and mechanical properties of magnesium phosphate cements [J]. J Mater Sci-Mater M,2011, 22(12): 2591-2598.
[6] Liu X,Wang XM,Cui FZ,et al.Injectable bone cement based on mineralized collagen[J].J Biomed Mater Res B Appl Biomater,2010,94(1):72-79.
[7] Yamamuro T, Nakamura T, Iida H, et al. Development of bioactive bone cement and its clinical applications [J]. Biomaterials, 1998,19(16): 1479-1482.
[8] Damien CJ, Parsons JR, Benedict J J, et al. Investigation of a hydroxyapatite and calcium sulfate composite supplemented with an osteoinductive factor[J]. J Biomed Mater Res, 1990, 24(6): 639-654.
[9] Doadrio JC, Arcos D, Cabaéas MV, et al. Calcium sulphate-based cements containing cephalexin[J]. Biomaterials, 2004, 25(13): 2629-2635.
[10]Lopez-Heredia MA, Bernard Kamphuis GJ, Jansen J A, et al. An injectable calcium phosphate cement for the local delivery of paclitaxel to bone [J]. Biomaterials, 2011, 32(23): 5411-5416.
[11]Kuang GM, Yau WP, Pan HB, et al. An effective approach by a chelate reaction in optimizing the setting process of strontium-incorporated calcium phosphate bone cement [J]. J Biomed Mater Res B, 2012,100B(3): 778-787.
[12]Mate-Sanchez de Val JE, Calvo-Guirado JL, Delgado-Ruiz RA, et al. New block graft of -TCP with silicon in critical size defects in rabbits: Chemical characterization, histological, histomorphometric and micro-CT study [J]. Ceram Int, 2012, 38(2): 1563-1570.
[13]Domingues ZR, Cortés ME, Gomes TA, et al. Bioactive glass as a drug delivery system of tetracycline and tetracycline associated with -cyclodextrin [J]. Biomaterials, 2004, 25(2): 327-333.
[14]Zhang X, Jia WT, Huang WH, et al. Teicoplanin-loaded borate bioactive glass implants for treating chronic bone infection in a rabbit tibia osteomyelitis model[J]. Biomaterials, 2010, 31(22): 5865-5874.
[15]Cui X, Gu YF, Li L, et al. In vitro bioactivity, cytocompatibility, and antibiotic release profile of gentamicin sulfate-loaded borate bioactive glass/chitosan composites[J]. Journal of Materials Science: Materials in Medicine, 2013, 24(10): 2391-2403.
[16]Fu Q, Rahaman MN, Fu HL, et al. Silicate, borosilicate, and borate bioactive glass scaffolds with controllable degradation rate for bone tissue engineering applications. I. Preparation and in vitro degradation [J]. J Biomed Mater Res A, 2011, 95(1): 164-171.
[17]Fu Q, Rahaman MN, Brown R F, et al. Silicate, borosilicate, and borate bioactive glass scaffolds with controllable degradation rate for bone tissue engineering applications. II. In vitro and in vivo biological evaluation [J]. J Biomed Mater Res A, 2011, 95(1): 172-179.
[18]Jain AK, Panchagnula R. Skeletal drug delivery systems [J]. Int J Pharm, 2000, 206(1-2): 1-12.
[19]Cevhera E, Orhanb Z, Mülaz mo luc L, et al. Characterization of biodegradable chitosan microspheres containing vancomycin and treatment of experimental osteomyelitis caused by methicillin-resistant Staphylococcus aureus with prepared microspheres [J]. Int J Pharm, 2006, 317(2): 127-135.
[20]王会,王德平,黄文旵,等.具有抗菌及骨修复的硼酸盐玻璃支架的性能研究[J].稀有金属材料与工程,2014,43(S1):54-58.
[21]Ginebra MP, Traykova T, Planell JA. Calcium phosphate cements as bone drug delivery systems: A review [J]. J Control Release, 2006, 113(2): 102-110.
[22]ISO 5833:2002,Implants for surgery--Acrylic resin cements
[23]黄粤,刘昌胜,邵慧芳,等.妥布霉素对磷酸钙骨水泥性能的影响[J].中国生物医学工程学报,2002,21(5):417-422.
[24]黄粤.载药磷酸钙骨水泥缓释体系的研究[D].华东理工大学,1999.
[25]Huang WH, Rahaman MN, Day DE, et al. Mechanisms for converting bioactive silicate, borate, and borosilicate glasses to hydroxyapatite in dilute phosphate solutions [J]. Phys Chem Glasses:Eur J Glass Sci Technol B, 2006, 47(6): 647-658.
[26]Huang WH, Day DE, Kittiratanapiboon K, et al. Kinetics and mechanisms of the conversion of silicate (45S5), borate, and borosilicate glasses to hydroxyapatite in dilute phosphate solutions [J]. J Mater Sci-Mater M, 2006, 17(7): 583-596.
[27]张欣,付海罗,黄文旵,等.生物活性硼硅酸盐多孔支架的体外活性及细胞毒性[J].科学通报,2009,54(4):463-468.
[28]宁佳,王德平,黄文旵,等.硅酸盐生物玻璃的制备及其体外生物活性和降解性[J].硅酸盐学报,2006,34(11):1326-1330.
[29]Maeda H, Ishida EH, Kasuga T. Hydrothermal preparation of tobermorite incorporating phosphate species [J]. Mater Lett, 2012,68(10): 382-384.
[30]贾伟涛,张欣,张长青,等.抗生素缓释载体用硼酸盐玻璃/壳聚糖复合材料[J].硅酸盐学报,2010,38(7):1303-1309.
The preparation,bioactivity and antibiotic property of drug loading borate bone cement
CuiXu1,2,Huang Chengcheng1,ZhangMeng1,etal.1 Center for Human Tissues and Organs Degeneration,Shenzhen Institute of Advanced Technology,Chinese Academy of Science,Shenzhen Guangdong,518055;2 Shenzhen HaiYou Kang biological technology Co.,Ltd.Shenzhen Guangdong,518120;3 Institute of Bioengineering and Information Technology Materials,Tongji University,Shanghai,201804,China
Objective The objective of this study was to develop a borate bone cement (BBC) that could serve as a carrier for delivering Gentamycin Sulfate (GS) and evaluate the capacity of antibiotic in vitro. Methods A local drug delivery system, using novel BBC as carrier for GS, was prepared. The effect of drug loading on the injectability, initial setting time of the injectable BBC was tested. The bioactivity, biodegradation and loading/release capacity of the BBC was evaluated by immersing the pre-set BBC samples in phosphate buffered saline, PBS. The in vitro antibiotic property was test by the inhibition zone of the E.coli and S.aureus cultured on the LB agar plates. Results The BBC loaded with GS can be almost completed injected by syringe, and had a proper initial setting time of about 6 min. When immersed in PBS, sustained release of GS occurred over 26 days, while the borate bioactive glass in BBC converted continuously to hydroxyapatite (HA). After loading with GS, the BBC can inhibit the growth of E.coli and S.aureus effectively. Conclusion The results suggest that, GS loaded BBC, had an excellent injectability, proper in-situ self-curing time, long and sustained drug release and the ability to inhibit bacterium growth.
Injectable;Borate bioactive glass;Bone cement;Drug delivery;Anti bacterial property
R318.08
A
10.3969/j.issn.1672-5972.2017.06.001
swgk2017-05-00110
广东省自然科学基金-博士启动纵向协同项目(锶硼协同生物玻璃骨水泥用于骨质疏松性脊柱椎体骨折的修复及其机制),编号(2017A030310318);深圳市科技创新委员会技术攻关项目(骨质疏松性椎体骨折修复新技术研发),编号:(JSGG20150331154931068);深圳市科技创新委员会技术开发项目(海洋源生物活性骨水泥在脊柱压缩性骨折中应用的临床前研究),编号(CXZZ20150401152251209);深圳市大鹏新区产业发展专项资金-科技研发项目(海洋源生物活性骨水泥的前期研究),编号(KY20150110)等。作者单位:1中国科学院深圳先进技术研究院,广东深圳518055;2深圳市海优康生物科技有限公司,广东深圳518120;3同济大学材料科学与工程学院,上海201804
崔旭(1985-)男,博士,助理研究员。研究方向:生物材料。
*[通讯作者]潘浩波(1978-)男,博士,研究员。研究方向:生物材料。
2017-05-15)

