丹参多酚酸盐注射液辅助治疗不稳定型心绞痛疗效及对血清炎症因子、代谢组学变化的影响
宋建江 杨应军 苏腾 赵勤旭
·论著·
丹参多酚酸盐注射液辅助治疗不稳定型心绞痛疗效及对血清炎症因子、代谢组学变化的影响
宋建江1杨应军1苏腾2赵勤旭3
目的观察丹参多酚酸盐注射液辅助治疗冠心病不稳定型心绞痛(UAP)的作用机制。方法收集73例冠心病不稳定心绞痛(UAP)患者随机分为观察组42例和对照组31例,两组均采用常规治疗,观察组在此基础上静脉滴注丹参多酚酸盐注射液,14天为1个疗程。采用硝酸还原酶比色法检测两组患者治疗前后血清一氧化氮(NO)含量,ELISA法检测内皮素-1(ET-1)、饥饿激素(Ghrelin)、白介素-6(IL-6)、白介素-10(IL-10)及内脂素(Visfatin)水平;采用超高效液相色谱仪与成分分析法分析两组患者治疗前后血清代谢差异物,并用EZinfo 2.0软件进行PCA分析潜在差异生物标记物。结果(1)与对照组比较,观察组临床症状、心电图总疗效明显高于对照组(临床症状疗效:83.81%比66.74%,P<0.05;心电图疗效:83.33%比54.84%,P<0.05);(2)对照组治疗后较治疗前血清NO、IL-10、Ghrelin表达升高(P<0.05),ET-1、IL-6及Visfatin表达降低(P<0.05);观察组治疗后较对照组治疗后血清NO、Ghrelin、IL-10表达增高[NO:(66.79±8.11)μmol/L比(60.34±4.86)μmol/L,P<0.05;Ghrelin:(23.64±3.25)μg/L比(15.81±1.87)μg/L,P<0.05;IL-10:(174.18±9.95)pg/mL比(166.39±17.21)pg/mL,P<0.05],ET-1、IL-6及Visfatin降低[ET-1:(55.59±6.37)pg/mL比(69.24±9.37)pg/mL,P<0.05;IL-6:(70.81±5.28)pg/mL比(86.39±6.37)pg/mL,P<0.05;Visfatin:(19.68±3.39)μg/mL比(29.71±3.88)μg/mL,P<0.05];(3)对照组治疗前后血清生物标记物无明显变化,观察组治疗后较治疗前鉴定出5种代谢差异物,其中色氨酸、9'-羧基-γ-生育酚含量升高,溶血磷脂、花生四烯酸及胆汁酸含量下降。结论丹参多酚酸盐注射液可从舒张血管、抗氧化、减轻炎症反应等多个方面起到辅助治疗UAP的作用。
冠心病;丹参多酚酸盐注射液;炎症因子;代谢组学;内皮素-1;一氧化氮
冠心病(coronary artery heart disease,CHD)在我国中老年人中发病率高、致死率高,已成为危害公众健康的主要疾病[1]。不稳定型心绞痛(unstable angina pectoris,UAP)是主要降低患者生活质量、引起患者恐慌情绪的因素之一,其本质是冠状动脉粥样病变而引起的血管狭窄、阻塞,造成心肌缺血、缺氧坏死[2]。临床研究[3]发现,丹参多酚酸盐注射液联合常规西药治疗UAP有较好的临床疗效。本研究观察丹参多酚酸盐注射液治疗UAP临床疗效及对患者血管内皮素-1(ET-1)、一氧化氮(NO)、饥饿激素(Ghrelin)、炎症因子白介素-6(IL-6)、白介素-10(IL-10)及内脂素(Visfatin)表达水平的影响,并检测血清代谢组学变化,旨在为临床应用丹参多酚酸盐注射液治疗UAP提供理论依据。
1 资料与方法
1.1 临床资料收集2016年4月—2017年4月浙江省嘉善县第一人民医院、辽宁省铁岭市中心医院收治的UAP患者73例,男35例,女38例;年龄46~78岁,平均(63.27±10.15)岁。73例患者采用随机数字表法随机分为对照组31例,年龄47~76岁,平均(63.75±11.83)岁。观察组42例,年龄46~78岁,平均(63.01±9.25)岁。两组之间年龄、性别、病程、危险因素差异均无统计学意义(P>0.05)。
1.2 纳入排除标准入组标准:均经256层螺旋CT或冠状动脉造影术检查确诊为CHD,符合2010年中华医学会心血管病学会制定的《不稳定型心绞痛诊断和治疗建议》诊断标准[4]。排除标准:(1)急性心肌梗死或曾做过冠状动脉搭桥术患者;(2)恶性高血压、继发性高血压患者;(3)伴有严重肝肾功能不全患者;(4)伴有主动脉夹层、严重心律失常及心源性休克患者;(5)伴有结缔组织病、恶性肿瘤或自身免疫系统疾病患者。
1.3 仪器设备甲醇、甲酸(Thermo Fisher,美国),去离子纯水仪-Milli-Q(Millipore,美国),超高效液相色谱仪-Acquity UPLC System,色谱柱-Acquity BEH-C18,IL-6、IL-10、CRP及Visfatin ELISA试剂盒(欣博胜,中国),NO试剂盒(晶美生物,中国)。
1.4 治疗方法对照组患者采用常规治疗,口服拜阿司匹林肠溶片,1次100mg,1天1次;阿托伐他汀钙片,1次20mg,1天1次;单硝酸异山梨酯片,1次20mg,1天1次。观察组在常规治疗基础上给予丹参多酚酸盐注射液200mg加入5%葡萄糖250mL中(糖尿病患者加入生理盐水250mL中)静脉滴注,1天1次,14天为1个疗程。应用丹参多酚酸盐注射液静脉滴注期间观察患者有无不良反应。
1.5 观察指标(1)血ET-1、NO、IL-6、IL-10、Visfatin及Ghrelin水平测定:所有受试者均在治疗前及治疗14天后空腹采取静脉血3mL,分离血浆、血清后,高速离心10min,留取血清并保存于-80℃冰箱中,待样本集齐后一次性检测。NO检测采用NO试剂盒硝酸还原酶比色法测定,血清ET-1、IL-6、IL-10、Ghrelin及Visfatin表达均采用酶联免疫吸附法(ELISA)进行检测,经①配置标准品液;②计算标准曲线;③加样;④洗板;⑤孵育;⑥洗板;⑦暗反应;⑧计算吸光值;⑨计算结果等步骤操作,严格按照各种试剂说明书操作[5]。(2)血清代谢组学检测及血清制备方法:将血清与乙腈按1:4混合并震荡30秒混匀,将混合样品与12 000r/min低温离心10min,取上清液用0.22μm滤膜过滤后进行检测。(3)色谱及质谱分析条件:色谱柱柱温40℃,流动相:(A)含0.1%甲酸的水溶液;(B)甲醇流动相梯度组成:1~3min,8~85%流动相B;3~6min,85~100%流动相B;6~8min,100%流动相B;8~9min,100~8%流动相B;9~11min,8%流动相B。流速0.5mL/min;样品进样量10μL。质谱分析条件:ESI离子源,采用正、负离子模式,2.6kV毛细管电压,设定60V锥孔电压,离子源、雾化温度分别为110℃、470℃,壳气流速设定为900L/h;负离子模式:2.6kV毛细管电压,设定锥孔电压为40V,离子源、雾化温度分别为:70℃、160℃,壳气流速:550L/h,亮氨酸脑啡肽做为质谱内标,采用甲酸钠校正质量轴。(4)生物标记物筛选及分析:采用Masslynx V4.1软件进行峰提取、峰对齐及归一化处理,根据VIP值(VIP>1.0)和P值(P<0.05)筛选出治疗前后具有显著性差异的生物标志物。通过HMDB及METLIN等精确质量检索数据库[7],筛选出各组治疗前后及组间血清差异化合物及观察组治疗后与对照组治疗后血清差异物。
1.6 统计学方法全部数据用SPSS17.00统计软件分析,计量资料正态分布以(±s)表示,采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 疗效标准(1)临床症状疗效标准:显效:各种不适症状基本消失;有效:疼痛发作次数、程度及持续时间有明显减轻;无效:症状无任何好转或加重。(2)心电图疗效标准:按照1979年全国中西医结合防治冠心病心绞痛研究座谈会修订标准评定。显效:静息心电图恢复正常;有效:与治疗前相比,静息心电图ST断下降1.5mV以上,或主要导联T波恢复50%以上,或T波低平转直立;无效:静息心电图基本无变化或加重。
2.2 两组UAP患者临床疗效比较观察组临床症状、心电图总有效率明显高于对照组(P<0.05),见表1。
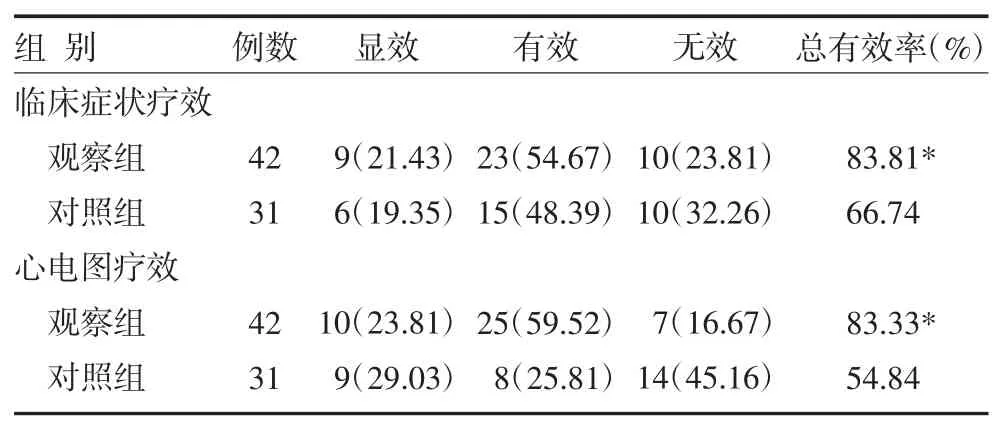
表1 两组UAP患者临床疗效比较[例(%)]
2.3 两组UAP患者治疗前后血清血管舒张、收缩相关因子及炎症因子表达变化两组治疗后较治疗前血清NO、Ghrelin表达升高,ET-1表达降低,有统计学意义(P均<0.05);治疗后观察组较对照组血清NO、Ghrelin表达更高,ET-1更低,差异有统计学意义(P<0.05),见表2。
表2 两组UAP患者治疗前后血清NO、ET-1及Ghrelin水平变化(±s)

表2 两组UAP患者治疗前后血清NO、ET-1及Ghrelin水平变化(±s)
注:与治疗前比较,△P<0.05;与对照组比较,*P<0.05;UAP:不稳定型心绞痛
?
2.4 两组UAP患者治疗前后血清炎症因子水平变化两组治疗后较治疗前血清IL-10表达升高,IL-6及Visfatin表达降低,差异有统计学意义(P均<0.05);与对照组比较,观察组治疗后血清IL-10表达更高,IL-6及Visfatin表达更低,差异有统计学意义(P<0.05),见表3。
表3 两组UAP患者治疗前后血清IL-6、IL-10及Visfatin水平变化(±s)
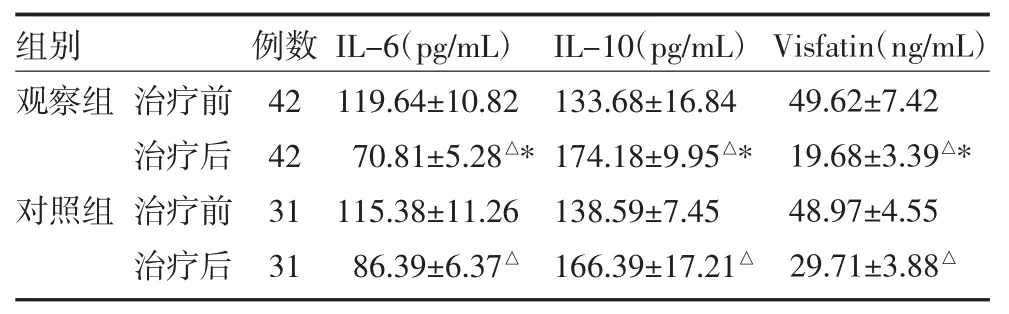
表3 两组UAP患者治疗前后血清IL-6、IL-10及Visfatin水平变化(±s)
注:与治疗前比较,△P<0.05;与对照组比较,*P<0.05;UAP:不稳定型心绞痛
?
2.5 离子色谱模式分析代谢轮廓采用UPLC-QTOF MS正负离子模式对两组患者治疗前后血清进行分析,两组治疗前后血清代谢产物分离良好,峰谷清晰。正离子模式下代谢产物数量及信号强度均大于负离子模式。通过对正、负离子模式下代谢色谱图间进行对比,发现对照组治疗前后血清差异物虽有一定变化,但并不明显,观察组治疗后较治疗前存在明显差异,表明检测结果具有差别意义。见图1。
2.6 PCA法分析主要代谢生物标记物采用PCA分析法分析治疗前后血清代谢物出现变化的有效性。在正离子模式(R2X=0.9239,Q2=0.8541)和负离子模式(R2X=0.9113,Q2=0.8754)下,对照组治疗前后血清主成分无明显差别,观察组治疗前后血清主成分出现差异。图2-3。
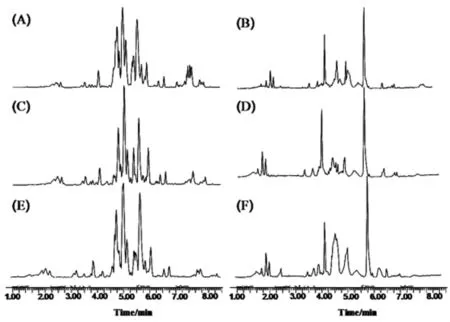
图1 离子色谱模式下正、负离子基峰强度
2.7 质谱仪分析代谢生物标记物通过数据库标准图谱比对或标准品对照验证,对照组治疗前、后血清中代谢生物标记物无明显变化,而观察组治疗后与治疗前相比,共确定5种潜在的生物标记物,分别为溶血磷脂、花生四烯酸、色氨酸、胆汁酸及9’-羧基-γ-生育酚。与治疗前比较,观察组治疗后血清色氨酸、9’-羧基-γ-生育酚含量升高,溶血磷脂、花生四烯酸、胆汁酸含量下降,见表4。
3 讨论
丹参多酚酸盐注射液用于治疗UAP在临床有较好效果,闫奎坡等[8]对临床研究进行Meta分析,结果显示丹参多酚酸盐注射液治疗UPA效果明显,且安全性较高。李彬等[9]通过细胞模型实验证实,丹参多酚酸盐注射液可降低血管平滑肌细胞BMP-2的表达,从而抑制动脉粥样硬化发生。目前,丹参多酚酸盐注射液治疗心血管疾病的研究和报道较多,但大多仅限于临床疗效观察,对分子水平研究报道较少。
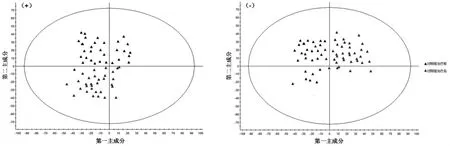
图2 对照组治疗前后血清样本主成分

图3 观察组治疗前后血清样本主成分

表4 观察组治疗前后血清代谢生物标记物
本研究通过临床对比发现应用丹参多酚酸盐联合常规西药治疗UAP在心电图和临床症状上疗效确切,这与庄瑞娟等[10]的研究结果相同。陈少青等[11]报道UAP患者血清IL-6及Visfatin表达升高,其中白脂肪分泌的Visfatin[12]可促进外周血IL-6表达升高,刺激血管内皮产生NF-kB并激活NF-kB/VCAM-1信号通路,招募白细胞聚集,参与早期动脉硬化形成[13]。而IL-6是早期反应动脉硬化的指标,且可介导斑块趋于不稳定,增加心肌梗死发生的危险[14]。IL-10可有效抑制血管平滑肌产生的炎症因子并可促进软斑块硬化,在延缓动脉硬化的同时可有效减少血管不良事件的发生[15]。本研究发现,丹参多酚酸盐注射液联合常规西药降低UAP患者血清IL-6及Visfatin表达的同时,可有效提高血IL-10表达,说明丹参多酚酸盐注射液可起到抗炎作用。
ET-1是目前已知的最强的血管收缩因子,而NO是重要的血管舒张因子之一,二者具有拮抗作用[16]。Ghrelin最早为在胃中发现的可以与生长激素促分泌受体相结合的一种内源性配体[17],研究[18]发现,Ghrelin与心血管疾病密切相关,Ghrelin具有较强的血管舒张作用,尤其是可有效的逆转ET-1所致的血管收缩。Wiley研究显示,Ghrelin的舒张血管作用甚至强于BNP和PGI2,与肾上腺髓质素作用相当[19]。本研究发现,对照组患者外周血NO含量上升,ET-1、EMPs表达下降,这可能是由于硝酸酯类药物有效的释放大量NO,起到扩张冠状动脉的作用,改善了冠脉缺血的症状,从而使ET-1、EMPs表达降低。常规药物联合丹参多酚酸盐注射液治疗可使UAP患者周血NO含量更高,ET-1、EMPs的表达更低。说明丹参多酚酸盐可能加强硝酸酯类药物扩张冠脉、改善冠脉供血,也可能由于丹参多酚酸盐本身具有一定的扩张冠脉、改善心肌供血的作用,减轻缺血对心肌的损伤,进而改善UAP患者临床症状及心电图等指标。
已证实持续而严重的心肌细胞缺氧后,可引起心肌细胞坏死、凋亡和自噬,死亡的心肌细胞破裂后,大量磷脂释放到血液中,在磷脂酶的作用下磷脂裂解成溶血磷脂[20]。本研究在常规治疗方案基础上应用丹参多酚酸盐注射液后,UAP患者血清溶血磷脂减少、色氨酸含量增加。色氨酸是人体必需氨基酸之一,色氨酸/犬尿氨酸代谢途径若过多分解,其中间产物喹啉酸和吡啶羧酸虽可诱导iNOS合成增加,但却使iNOS生成的四氢生物蝶呤表达降低后,精氨酸在iNOS作用下生成NO含量减少[21],从而使血管舒张力降低,诱发心绞痛等症状。本组资料显示,观察组UAP患者血清色氨酸含量升高,提示丹参多酚酸盐注射液可能通过减少色氨酸/犬尿氨酸代谢途径的分解,增加了四氢生物蝶呤的表达,进而使NO含量升高。已有研究报道,剧烈的心绞痛可刺激交感神经系统,使血中儿茶酚胺增高,致使机体合成所需物质效率降低,加快分解脂肪、糖元及脂肪酸,增加花生四烯酸在血液中的含量[22]。本研究发现丹参多酚酸盐注射液可降低UAP患者血清中花生四烯酸含量,分析其原因可能为UAP患者心绞痛等症状缓解后,患者自身应激性降低,使脂代谢趋于正常。9’-羧基-γ-生育酚虽然是维生素E酯化水解的产物,但其抗氧化性可与维生素E相当,是人体内最强天然抗氧化物之一[23]。本研究证实,丹参多酚酸盐注射液可明显提高UAP患者外周血9’-羧基-γ-生育酚的含量,起到较强的抗氧化、抗炎作用。
综上所述,丹参多酚酸盐注射液可能通过影响心肌细胞氨基酸代谢、脂代谢和增加抗氧化性,进而起到扩张血管、减少炎症因、改善心肌供血的作用,从而减轻UAP患者临床症状,提高生存质量。
[1]徐三彬,张华,郑建普,等.同型半胱氨酸对2型糖尿病合并冠心病患者冠状动脉病变的影响[J].临床心血管病杂志,2016,32(5):468-471.
[2]何珊珊,王晓燕,赵英帅,等.冠心病患者冠状动脉病变程度与血清胱抑素C及内皮功能相关性分析[J].重庆医学,2017,46(1):64-71.
[3]孙晓辉.丹参多酚酸盐与丹红注射液治疗老年不稳定心绞痛疗效观察[J].辽宁中医药大学学报,2014,16(9):182-183.
[4]刘红军,王丽华,魏文红.血脂康对不稳定性心绞痛患者炎症因子、内皮功能及颈动脉粥样斑块的影响[J].中国实验方剂学杂志,2013,19(16):323-327.
[5]王伊林,单晓彤,柴花,等.丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左室纤维化的影响[J].山东医药,2016,56(7):34-36.
[6]Bernal-Mizrachi L,Jy W,Jimenez JJ,et al.High levels of circulating endothelial microparticles in patients with acute coronary syndromes[J].Am Heart J,2003,145(6):962-70.
[7]Deng WK,Wang YB,Liu ZX,et al.HemI:A toolkit for Illustrating Heatmaps[J].PLOS One,2014,9(11):e111988.
[8]闫奎坡,朱翠玲,孙彦琴,等.丹参多酚酸盐注射液治疗不稳定型心绞痛的Meta分析[J].中国中医急症,2015,24(5):771-774.
[9]李彬,尹慧君.丹参多酚酸盐对大鼠血管平滑肌细胞钙化的抑制作用[J].武警医学,2013,24(7):580-582.
[10]庄瑞娟,金卫东,陶以嘉.丹参多酚酸盐注射液治疗不稳定心绞痛的疗效[J].江苏医药,2014,40(23):2893-2894.
[11]陈少青,单晓彤,王伊林,等.口服银杏叶软胶囊辅助治疗冠心病患者血清炎症因子、氧化应激标志物及血浆内脂素水平变化[J].山东医药,2016,56(3):44-45.
[12]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat that mimics the effects of in sulin[J].Science,2005,307(5708):426-430.
[13]Galkina E,Ley K.Vascular adhesion molecules in atherosclerosis[J].Arterioscler Thromb Vasc Biol,2007,27(11):2292-2301.
[14]Ognjanovic S,Bryant-Greenwood GD.Pre-B cell colony enhancing fator,a novel cytokine of human fetal mem-branes[J].Am J Obstet Gynecol,2002,187(4):1051-1058.
[15]Zhang DF,Song XT,Chen YD,et al.Prognostic performance of interleukin-10 in patients with chest pain and mild to moderate coronary artery heart lesions-an 8-year followup study[J].J Geriatr Cardiol,2016,13(3):244-251.
[16]韩旭,王高丹.冠心病的发病机制及与内皮素、一氧化氮相关性研究进展[J].中国医药导报,2014,11(11):167-169.
[17]Kojima M,Hosoda H,Date Y,et al.Ghrelin is a growthhormone-releasing acylated peptide from stomath[J].Nature,1999,402(6762):656-660.
[18]Kleinz MJ,Maguire JJ,Skepper JN,et al.Functional and immunocytochemical evidence for a role of ghrelin and desoctonoyl ghrelin in the regulation of vascular tone in man[J].Cardiovase Res,2006,69(1):227-235.
[19]Wiley KE,Davenprot AP.Comparison of vasodilators in human internal mammary artery:Ghrelin is a potent physiological antagonist of endothelin-1[J].Br J Pharmacd,2002,136(8):1146-1152.
[20]王广基,阿基业,严蓓,等.代谢组学研究冠心病中医分型的体内物质基础[J].世界科学技术-中医药现代化,2009,11(1):127-133.
[21]孔红,朱鼎良.色氨酸/犬尿氨酸代谢途径与心血管疾病[J].中华高血压杂志,2012,20(5):433-435.
[22]Jiang M,Kang L,Wang Y,et al.A metabonomic study of cardioprotection of ginsenosides,schizandrin,and ophiopogonin D against acute myocardial infarction in rats[J].BMC Complement Altem Med,2014,23(14):350-360.
[23]蔺娟,闵祺,任丽萍,等.高效液相色谱-荧光检测法同时测定多烯酸乙酯软胶囊中4种生育酚的含量[J].药物分析杂志,2015,35(10):1866-1871.
Effect of Salvia Miltiorrhiza Injection on Unstable Angina Pectoris,Serum Inflammatory Factors and Metabonomics
Song Jianjiang1,Yang Yingjun2,Su Teng2,Zhao Qinxu3.
1 Department of Cardiology,the First People's Hospital of Jiashan,Jiashan(314100),China;2 Department of Cardiology,Tieling Central Hospital,Tieling(112001),China;3 Guangxi University of Traditional Chinese Medicine,Nanning(530200),China
ObjectiveTo investigate the mechanism of intravenous infusion of Salvia miltiorrhiza injection in the treatment of unstable angina pectoris(UAP).MethodsSeventy-three patients with UAP were randomly divided into observation group(n=42)and control group(n=31).The patients in the two groups were treated with conventional therapy.The observation group was given intravenous drip of Salvia miltiorrhiza injection on the basis of the experiment.The course of treatment was 14 days.The ratio of nitrate reductase assay were used to detect serum nitric oxide(NO)content;ELISA method was used to detect endothelin-1(ET-1),Ghrelin,IL-6 and IL-10 expression of peptide and lipid Visfatin;Ultra high performance liquid chromatography(HPLC)and component analysis were used to analyze the differences in serum metabolites between the two groups,and the potential biomarkers were analyzed by EZinfo using principle components analysis.ResultsCompared with control group,observationgroup had higher total efficiency in the clinical symptoms and ECG(the efficiency of clinical symptoms:83.87%vs 66.74%,P<0.05;the efficiency of cECG:88.33%vs 54.84%,P<0.05).After treatment,the serum NO,Ghrelin,IL-10 expression were increased(P<0.05),ET-1,IL-6 and Visfatin expression were decreased in control group(P<0.05);compared with control group,the observation group after treatment had higher expressions of serum NO,IL-10,and Ghrelin[NO:(66.79±8.11)μmol/L vs(60.34±4.86)μmol/L,P<0.05;Ghrelin:(23.64±3.25)μg/L vs(15.81±1.87)μg/L,P<0.05;IL-10:(174.18±9.95)pg/mL vs(166.39±17.21)pg/mL,P<0.05]and lower levels of ET-1 IL-6 and Visfatin[ET-1:(55.59±6.37)pg/mL vs(69.24±9.37)pg/mL,P<0.05;IL-6:(70.81±5.28)pg/mL vs(88.39±6.37)pg/mL,P<0.05;Visfatin:(19.68±3.39)μg/mL vs(29.71±3.88)μg/mL,P<0.05].After treatment in observation group,tryptophan and 9'-carboxy-γ-chromanol were increased,lysophospholipids,arachidonic acid and bile acid content were decreased,while the metabolites in control group remained the same as those before treatment.Conclusion Salvia miltiorrhiza injection may play an important role in adjuvant therapy of UAP,such as relaxing blood vessels,anti-oxidation,reducing inflammation and protecting myocardial cells.
coronary heart disease;Salvia miltiorrhiza injection;inflammatory factor;etabonomics;endothelin-1;nitric oxide
国家自然科学基金(No.816607013)
1浙江省嘉善县第一人民医院心内科(嘉善314100);2辽宁省铁岭市中心医院心内科(铁岭112001);3广西中医药大学(南宁530200)
宋建江,Tel:15157357856;Email:ZJsongjianmin@126.com
(收稿:2017-07-01修回:2017-08-17)

