肝动脉化疗栓塞术治疗原发性肝细胞癌预后影响因素分析
廖玉波,赵 妍,胡鸿涛,郭晨阳,马俊丽,蒋 丽,黎海亮(郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,河南 郑州 450008)
肝动脉化疗栓塞术治疗原发性肝细胞癌预后影响因素分析
廖玉波,赵 妍,胡鸿涛,郭晨阳,马俊丽,蒋 丽,黎海亮*
(郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,河南 郑州 450008)
目的分析肝动脉化疗栓塞术(TACE)治疗原发性肝细胞癌(HCC)的预后影响因素。方法回顾性分析326例接受TACE治疗的HCC患者的资料。采用Kaplan-Meier法计算患者1、2、3年累积生存率,分别以Log-rank检验及Cox比例风险模型进行预后相关单因素及多因素分析。结果患者1、2、3 年累积生存率分别为73.90%、40.20%、22.20%,中位生存期21个月。单因素分析显示,甲胎蛋白(AFP)、γ-谷氨酰转肽酶(GGT)、肿瘤最大径、肿瘤数目、肝功能Child-Pugh分级、巴塞罗那临床肝癌(BCLC)分期、门静脉癌栓、动静脉瘘、远处转移为影响HCC患者预后的相关因素(P均<0.05)。多因素分析显示,AFP、GGT、肿瘤最大径、肿瘤数目、BCLC分期、动静脉瘘为HCC患者预后的独立影响因素(P均<0.05)。结论影响TACE治疗HCC患者预后的独立因素包括AFP、GGT、肿瘤最大径、肿瘤数目、BCLC分期及动静脉瘘。
癌,肝细胞;化学栓塞,治疗性;预后
原发性肝细胞癌(hepatocellular carcinoma, HCC)发病率在男性恶性肿瘤中居第2位、在女性恶性肿瘤中居第3位,我国每年新增肝癌患者约占全球一半以上[1]。肝切除术是HCC的根治性疗法,但临床多数患者合并肝硬化或确诊时已出现远处转移,无法接受根治性手术治疗[2]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是目前非手术治疗HCC的首选疗法,可提高HCC患者的生存率、延长生存期[3]。本研究回顾性分析326例患者的资料,探讨TACE治疗HCC的预后因素及生存时间,以期为HCC的临床治疗方案选择和预后判断提供更多依据。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月—2014年12月于本院接受TACE治疗的326例HCC患者的资料,其中男267例,女59例,年龄23~87岁,平均(56.4±11.0)岁。患者均符合我国《原发性肝癌诊疗规范(2011年版)》诊断标准[4]。纳入标准:①无法接受肝切除手术;②肝功能Child-Pugh分级为A或B级;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0或1分;④术前1周完善相关影像学及实验室检查;⑤随访资料完整。排除标准:①TACE治疗前曾接受射频、微波、化疗及手术等其他治疗;②影像学或临床实验室检查资料不全;③合并其他恶性肿瘤;④存在心、肺、肾等重要脏器严重病变或意识障碍;⑤无法耐受及配合TACE治疗;⑥随访资料不完整。
1.2 TACE治疗 采用Siemens Zeego DSA系统为引导设备。通过Seldinger技术经皮穿刺股动脉,造影明确肿瘤供血动脉后,将微导管超选至肿瘤供血动脉,依据肿瘤部位、大小、患者肝功能情况,灌注阿霉素30~50 mg、顺铂30~90 mg、丝裂霉素4~10 mg,以10~20 ml超液化碘油混合栓塞,适量使用明胶海绵颗粒。术后观察病情变化及并发症情况,给予保肝、止血及对症治疗。
1.3 随访及疗效评估 TACE治疗后1个月内复查CT或MR平扫+动态增强扫描,如发现肿瘤残留,可再次行TACE治疗,每次治疗间隔4~6周,直至肝脏病灶完全被碘油沉积或患者无法耐受治疗为止。连续2个月复查无肿瘤复发,则改为每隔2~3个月复查1次。记录患者的生存期(自确诊HCC之日至死亡或随访截止),随访截止时间为2017年2月。
末次TACE治疗后1个月,根据实体肿瘤疗效评价标准(mRECIST)[5],进行疗效评价:完全缓解(complete response, CR),靶病灶动脉期强化显影消失;部分缓解(partial response, PR),所有靶病灶存活肿瘤同基线相比,最大径总和缩小≥30%;进展(progressive disease, PD),靶病灶存活肿瘤最大径总和增加≥20%或出现新发病灶;稳定(stable disease, SD):缩小未达PR或增加未达PD。以CR和PR为治疗有效。
1.4 统计学分析 采用SPSS 17.0统计学分析软件,采用Kaplan-Meier法绘制生存曲线并计算患者1、2、3年的累积生存率。以Log-rank检验进行预后因素分析,包括患者性别、年龄、TACE术前1周乙肝表面抗原(hepatitis B surface antigen, HBsAg)、甲胎蛋白(alpha fetoprotein, AFP)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、肿瘤部位、肿瘤数目、肿瘤最大径、TACE治疗次数、巴塞罗那临床肝癌(Barcelona clinic liver cancer, BCLC)分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘、远处转移、肝硬化、腹水、糖尿病;并以Cox比例风险模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 生存分析 326例HCC患者中,至随访结束共死亡267例(267/326,81.90%)、删失59例(59/326,18.10%)。患者生存时间1~59个月,中位生存时间为21个月(图1)。1、2、3年累积生存率分别为73.90%、40.20%、22.20%。

图1 TACE治疗HCC患者的生存曲线
2.2 疗效 每例患者接受1~9次TACE治疗,平均(4.9±1.8)次。326例中,CR共48例(48/326,14.72%),PR共145例(145/326,44.48%;图2),SD共97例(97/326,29.76%),PD共36例(36/326,11.04%),有效率为59.20%(193/326)。
2.3 单因素分析 术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘及远处转移均为影响HCC患者预后的相关因素(P均<0.05,表1)。
2.4 多因素分析 术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、动静脉瘘为影响HCC患者预后的独立因素(P均<0.05,表2)。
2.5 并发症 TACE治疗后,278例患者出现不同程度肝区疼痛、恶心、发热等,经对症治疗后均好转;1例患者出现肝性脑病,给予降酶治疗、静脉输注精氨酸后好转。326例患者均未出现其他严重并发症,无治疗相关性死亡。
3 讨论
近年来,作为非手术治疗HCC的首选疗法,TACE的疗效已获得广泛认可[6]。目前TACE治疗HCC的预后影响因素较多,且结论尚未达成一致。本研究对TACE治疗HCC的预后影响因素进行分析,以期为准确评估病情、判断预后从而延长患者生存期提供有价值的参考依据。本研究通过单因素及多因素分析,发现TACE术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘及远处转移均为HCC预后影响因素(P均<0.05),且其中AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、动静脉瘘为影响HCC患者预后的独立因素(P均<0.05)。
作为HCC的特异性标志物,AFP已被临床广泛应用于HCC的筛查与早期诊断。当肝细胞癌变时,相关基因被激活,HCC患者血清中AFP水平升高。AFP具备促进肝癌细胞增殖和抗凋亡诱导的生物学活性,其在HCC病情发展过程中具有关键作用,与患者预后密切相关[7-8]。本研究结果显示,TACE治疗后不同AFP水平的HCC患者预后差异有统计学意义(χ2=10.705,P=0.001),提示AFP水平对HCC早期诊断及预后评估具有重要意义。
既往研究[9]表明,肿瘤大小和数目是影响HCC患者预后的独立因素。肿瘤大小可反映肿瘤生长的速度,HCC病灶越大,肝脏组织代偿功能越差,TACE治疗时常规剂量越难以完全栓塞肿瘤,因此患者的总体生存率及治疗率均较低[10]。也有学者[11]认为,肝脏肿瘤体积较大且有完整假包膜形成时,由于病灶局限,预后相对较好。本研究结果显示,肿瘤最大径≤5 cm与>5 cm的HCC患者预后差异有统计学意义(P<0.001),肿瘤越小患者的预后越好,其术后生存时间越长。
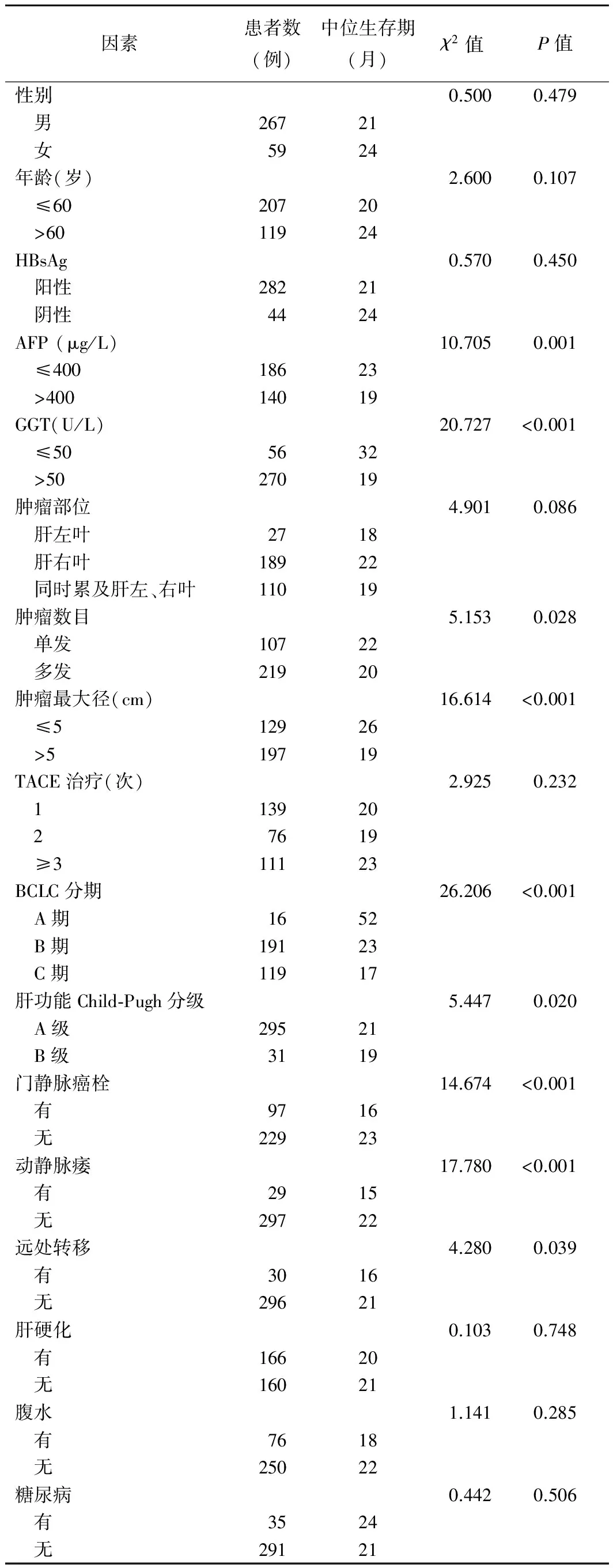
表1 TACE治疗HCC患者预后单因素分析
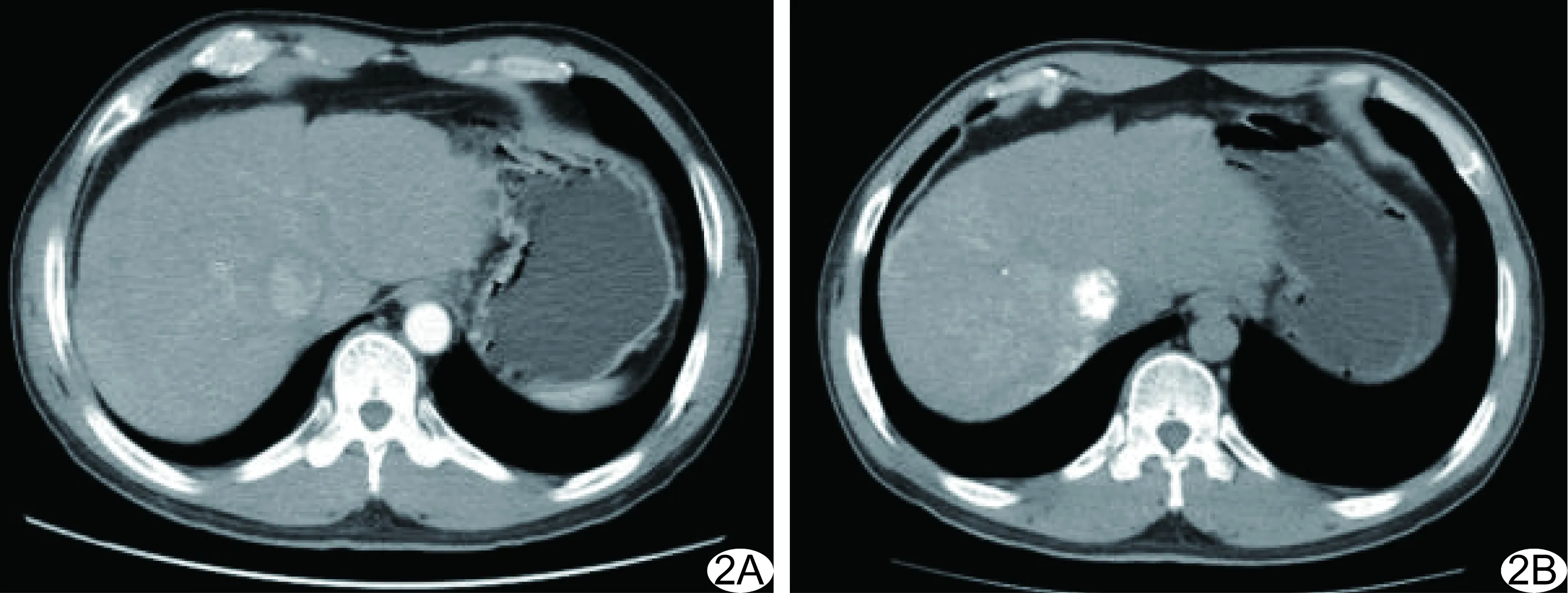
图2 患者男,48岁,原发性HCC A.TACE治疗前增强CT示肝右叶可见约2.9 cm×2.4 cm肿瘤,边界清晰; B.TACE治疗后1个月复查CT示碘油沉积致密,病灶大小约2.1 cm×1.9 cm,较前缩小

表2 TACE治疗HCC患者预后多因素回归分析
肝脏肿瘤数目的增多可增大其侵及血管及复发转移的风险。本研究中,单发与多发肿瘤患者的中位生存期分别为22个月和20个月,且二者预后的差异有统计学意义(P=0.028),提示肿瘤数目是HCC预后的重要因素,单发肿瘤患者TACE治疗预后较好。
BCLC分期是目前临床广泛应用的肝癌分期系统,其根据患者的一般情况、肝功能Child-Pugh分级及肿瘤特性进行分类,有助于较为准确地评估病情,从而进一步制定合理的治疗方案。在BCLC分期系统中,依据肿瘤分期标准提供不同的治疗方案:对肝功能较好的早期HCC患者首选根治性肝切除术,而对中晚期HCC患者则推荐TACE治疗。有研究[12]发现,BCLC分期越晚,患者生存率越低。本研究中,BCLC分期为A、B、C期的患者中位生存时间分别为52、23、17个月,提示BCLC分期越高,预后越差。
GGT主要由肝脏产生,是临床常用的血清标志物之一。有研究[13]认为血清GGT水平与肝功能Child-Pugh分级、肝硬化、肿瘤大小和ALT水平密切相关。Zhang等[14]研究表明,GGT水平是影响HCC患者生存的独立预后因素。本研究结果显示,GGT≤50 U/L与GGT>50 U/L的患者中位生存期分别为32个月和19个月,提示GGT水平是影响HCC患者预后的独立因素,即TACE术前GGT水平越低,预后越好。
有研究[15]表明,肝动静脉瘘在HCC患者中的发生率为28.8%~63.2%。动静脉瘘可影响肝功能,加重门静脉高压,引发上消化道大出血、大量腹腔积液及肝性脑病等。HCC合并动静脉瘘曾被认为是TACE治疗的禁忌证。近年来,随着血管介入治疗水平的进步,TACE治疗HCC合并肝动静脉瘘已成为临床一线治疗方案[16]。本研究结果显示,有、无动静脉瘘的患者中位生存期分别为15个月和22个月,动静脉瘘是HCC患者预后的独立影响因素。
既往研究[17]结果显示,肝功能Child-Pugh分级、门静脉癌栓和远处转移是影响HCC患者预后的独立因素。门静脉癌栓形成时,极易引发肝内扩散及远处转移;且癌栓阻塞门静脉可导致门静脉高压,严重损害肝功能。门脉癌栓越多、肝功能分级越差,术后患者预后越差、生存时间越短。本研究中,虽然单因素分析显示肝功能Child-Pugh分级、门静脉癌栓和远处转移与HCC患者的预后相关,但多因素分析表明其并非影响预后的独立因素。本研究结果与既往研究[17]结果有所不同,原因可能为:①入组标准存在差异;②TACE治疗过程中的操作方法与技术存在差异;③各因素之间存在交互作用。
总之,TACE治疗HCC可有效延长患者的生存期。AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期及动静脉瘘是影响TACE治疗HCC患者预后的独立因素。本研究为非随机性及回顾性研究,结果尚需今后大量前瞻性、随机对照试验进一步证实。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015,65(2):87-108.
[2] Zhang J, Jin H, Liu H, et al. MiRNA-99a directly regulates AGO2 through translational repression in hepatocellular carcinoma. Oncogenesis, 2014,3:e97.
[3] Varga M, Valsamis A, Matia I, et al. Transarterial chemoembolizationin hepatocellular carcinoma. RozhlChir, 2009,88(8):434-438.
[4] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肿瘤学杂志,2011,16(10):929-946.
[5] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) . Eur J Cancer, 2009,45(2):228-247.
[6] ChengX, Sum P, Hu QG, et al. Transarterial (chemo) embolization for curative resection of hepatocellular carcinoma: A systematic review and meta-analyses. J Cancer Res Clin Oncol, 2014,140(7):1159-1170.
[7] Li M, Li H, Li C, et al. Alpha-fetoprotein: A new member of intracellular signal molecules in regulation of the PI3K/AKT signaling in human hepatoma cell lines. Int J Cancer, 2011,128(3):524-532.
[8] Page AJ, Cosgrove DC, Philosophe B, et al. Hepatocellular carcinoma: Diagnosis, management, and prognosis. Surg Oncol Clin N Am, 2014,23(2):289-311.
[9] Takayasu K, Arii S, Ikai I, et al. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology, 2006,131(2):461-469.
[10] 吕嘉玲,杜瑞明,刘鹏程,等.肝动脉化疗栓塞治疗原发性肝癌的预后因素分析.实用放射学杂志,2012,28(1):114-118.
[11] Kudo M. Multistep human hepatocarcinogenesis: Correlation of imaging with pathology. J Gastroenterol, 2009,44(19):112-118.
[12] 鄢毅权,李介秋,周光华.原发性肝癌的分期方法及比较.医学临床研究,2008,25(1):108-112.
[13] Faber W, Sharafi S, Stockmann M, et al. Long-term results of liver resection for hepatocellular carcinoma in noncirrhotic liver. Surgery, 2013,153(4):510-517.
[14] Zhang JB, Chen Y, Zhang B, et al. Prognostic significance of serum gamma-glutamyl transferase in patients with intermediate hepatocellular carcinoma treated with transcatheter arterial chemoembolization. Eur J Gastroenterol Hepatol, 2011,23(9):787-793.
[15] Vogl TJ,Nour-Eldin NE, Emad-Eldin S, et al. Portal vein thrombosis and arterio-portal shunls: Effects on tumor response after chemoembolization of hepatocellular carcinoma. World J Gastroenterol, 2011,17(10):1267-1275.
[16] Kunmar A, Ahuja CK, Vyas S, et al. Hepatic arteriovenous fistulae: Role of interventional radiology. Dig Dis Sci, 2012,57(10):2703-2712.
[17] 余梁,吕维富.经肝动脉化疗栓塞术治疗中晚期肝癌的预后因素分析.中国介入影像与治疗学,2015,12(1):14-17.
Prognosticfactorsoftranscatheterarterialchemoembolizationforprimaryhepatocellularcarcinoma
LIAOYubo,ZHAOYan,HUHongtao,GUOChenyang,MAJunli,JANGLi,LIHailiang*
(DepartmentofInterventionalRadiology,AffiliatedCancerHospitalofZhengzhouUniversity,HenanCancerHospital,Zhengzhou450008,China)
ObjectiveTo investigate the prognostic factors of transcatheter arterial chemoembolization (TACE) in the treatment of primary hepatocellular carcinoma (HCC).MethodsA retrospective analysis was performed on 326 HCC patients treated with TACE.Kaplan-Meiermethod was used to calculate the 1-year, 2-year and 3-year cumulative survival rates.Log-ranktest andCoxproportional hazards model were used to analyze univariate and multivariate prognostic factors, respectively.ResultsThe 1-year, 2- year and 3-year cumulative survival rate of HCC patient was 73.90%, 40.20% and 22.20%, respectively. The median survival time was 21 months. Univariate analysis showed that the alpha-fetoprotein (AFP), gamma-glutamyl transpeptidase (GGT), tumor size, tumor number, Child-Pugh grade, Barcelona clinic liver cancer (BCLC) stage, portal vein thrombosis, arteriovenous fistula and distant metastasis were factors affecting the prognosis of HCC patient (allP<0.05). MultivariateCOXregression analysis showed that AFP, GGT, tumor size, tumor number, BCLC stage, arteriovenous fistula were the independent prognostic factors of HCC patients (allP<0.05).ConclusionAFP, GGT, tumor size, tumor number, BCLC stage and arteriovenous fistula are independent prognostic factors of HCC patients treated with TACE.
Carcinoma, hepatocellular; Chemoembolization, therapeutic; Prognosis
2017年河南省医学科技攻关项目(201701032)。
廖玉波(1993—),女,河南驻马店人,在读硕士。研究方向:影像诊断。E-mail: liaoyb199306@163.com
黎海亮,郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,450008。E-mail: cjr.lihailiang@ vip.163.com
2017-04-27
2017-09-13
10.13929/j.1672-8475.201704027
R735.7; R816
A
1672-8475(2017)12-0729-05