精准医学的临床部署:顶层架构设计及关键信息技术
王 宇,王心慰,刘 爽,杨之辉,朱卫国,弓孟春
·精准医学·
精准医学的临床部署:顶层架构设计及关键信息技术
王 宇,王心慰,刘 爽,杨之辉,朱卫国,弓孟春
随着世界范围内研究者对多维度信息融合分析投入越来越多的关注,精准医学成为一种全新的医学模式。精准医学的核心是通过多维度信息分析患者的个体差异以达到精准预防、精准治疗的目的。精准医学的优势在于借助新的生物学技术及信息技术,将基因组信息整合入临床实践,提供临床决策支持,以实现对疾病的发病机制、分型等进行全新的探索和诠释。精准医学的关键技术包括疾病亚型分组技术、临床决策支持系统、电子病历的改版升级、伦理学挑战及知情同意管理、术语控制与本体开发及全表型组关联分析技术等。作者旨在结合全球范围内精准医学取得的进展对中国精准医学临床部署进行规划,以提高疾病的治愈率,改善患者的预后及生活质量,提升国民健康水平。
精准医学;临床决策支持;基因组学;全表型组关联分析
2016年是精准医学(precision medicine)迅速发展的一年,随着中国、美国以及欧洲各国大规模精准医学研究的立项和开展,人类对于健康和疾病相关的多维度信息的采集、融合、分析、解读等投入了前所未有的关注。表型组(phenome)、暴露组(exposome)、影像组(radiome)等更多的信息维度陆续进入研究及临床应用领域,使得临床医学进入精准医学的时代。多维度的组学数据大大丰富了临床数据的内容,同时也增加了将各种组学数据进行采集、整合、分析及释读的难度[1]。这些科研与临床切实的需求奠定了精准医学相关的医疗信息技术(healthcare informatics technologies,HIT)研究与产业发展的坚实基础。
1 HIT是精准医学临床部署的核心要素
大规模生物数据库和应用计算机技术进行的大数据分析都极大地丰富了精准医学的概念[2]。医疗健康信息技术将信息技术应用于健康及医疗领域,通过信息数字化及数据运算技术的处理,支撑医疗健康信息的管理、整合、分析以及信息交互、共享。
1.1 精准医学知识体系超过个体的知识承载能力范围 当前精准医学研究均以组学信息作为基础。组学信息是指组成生命体结构和功能的多种生物标志物,反映基因组信息经过转录、翻译,最终表达为蛋白质水平的过程[3]。将基因组学、转录组学和蛋白组学的多维度组学信息综合起来,对于解析病理生理过程和后续的临床诊断、风险评估等应用都十分重要[4]。
大量组学信息整合形成庞大和复杂的精准医学知识体系。这样的知识体系拥有多维度的医学知识类别,多层次的医学信息深度,立体的医学知识脉络,以及错综复杂的知识架构,其范畴和复杂程度远超传统医学知识体系对个体知识承载的能力范围。利用健康医疗信息学技术,可以帮助临床医生梳理和管理医学知识体系,使得精准医学真正实现在临床实践中的部署。
1.2 精准医学的知识更新速度超出了传统医学教育的处理能力 精准医学最终目的是在疾病预防、诊断与治疗的过程中为医生提供决策支持,因此对知识的准确性及时效性要求很高,远超传统模式对于医学知识的处理能力。一方面需要持续地对现有研究成果和知识的准确性、可重复性进行评估;另一方面只有保证新知识传递的时效性,才能及时提供更精准的决策支持。面对这些挑战,通过HIT,能够迅速捕获最新的来自数据源的信息,及时汇总成新的知识体系。同时,需要借助HIT建立成熟的评估体系,对知识的准确性和可重复性作出正确评估,为精准医学的临床部署提供支持。
1.3 数据的丰度和广度决定了精准医学发展的高度 测序技术作为HIT的主要手段之一,其迅速发展使得医生可以方便获得基因组、转录组、蛋白组等组学信息,结合代谢组、表型组与暴露组,使得临床数据的广度达到了一个新高度[1]。同时生物技术手段的进步,又在不同的组学范畴内产生了大量的有效信息,极大地提高了数据的丰度。例如Klonoff[3]的研究已经识别出超过50个会增加患1型糖尿病风险的基因位点;而2型糖尿病则受到包括环境、营养、表观遗传修饰、子宫内环境等多因素的影响,以及包含16个染色体上57个基因的136种单核苷酸多态性的基因调控。这样建立在一定丰度和广度的医学数据基础上,才可以进一步针对个体进行医学评估,使精准医学达到更高的水平。
2 精准医学信息学的技术体系
2.1 疾病亚型分组技术 精准医学是为了对患者进行更精准的分型,以达到解释疾病表现及之后的各种变异的目的[1]。对于患者相似性研究这一领域,疾病亚型分组技术进一步的研究方向涵盖计算技术辅助的表型化[5-6],在多个异质性数据源的数据基础上进行生物标志物发掘、评估临床可干预性和可用性的框架体系。相应的,亚表型化的方法学层面继续推进,包括解析高维度数据、整合不同类型数据以及模拟跨越多重时间及空间的疾病发展[7]。通过疾病亚型分组技术,可以利用患者诊断、治疗和健康结果的大量信息来识别疾病诊断和预后相似的患者,然后根据相似患者的现有知识和数据预测每名新患者的治疗及用药计划,以此达到精准医学的个体化目的。
2.2 基于组学数据的临床决策支持系统 随着数据量呈指数增长,数据更新速度持续增加,已超出某一特定领域内人类所掌握常见及罕见的治疗相关分子生物学类型范围,因此精准医学需要依赖计算机驱动的临床决策支持系统(clinical decision support system,CDSS)来满足相关知识迅速及时地传递和使用[8]。这一环节的构建牵扯到很多类型的医疗数据收集、基因型-表型-药物等多重数据对应关系的构建、用于真实情境的临床决策工具的开发等[9]。以此为基础,CDSS与患者个体的数据联系在一起,为诊疗过程的各个环节提供可干预的信息[10],有助于个性化的患者护理及精确医学的实现。
2.3 电子病历的扩展更新 当前电子健康档案/电子病历(electronic health record/electronic medical record,EHR/EMR)的结构不够完善,无法对疾病的信息进行全面提取和研究[11];且存在大量非结构化信息,难以对数据进行融合分析以获得新知识。因此,扩展更新现有的EHR/EMR系统架构刻不容缓。基于标准的编程接口是EHR/EMR系统的必要部分,可以有效整合外部数据及知识库还需要开发一种特定工具,以支持特定工作流程、新的分析、数据可视化以及数据集成汇总。通过EHR/EMR将下一代CDSS与精准医学知识库联系起来,可提供基于基因组的风险预测、预后评估,并可以为特定临床部分的药物剂量提供建议[12]。因此,扩展现有的EHR/EMR系统架构,适当整合和更新多层次数据类型,将有益于各部门和医疗机构实时捕获可共享的数据,为精准医学临床部署铺平道路。
2.4 伦理学挑战及知情同意管理 精准医学为医疗健康领域带来的革新有目共睹,但其带来的挑战也不容忽视。基因检测是精准医学诊断中的重要步骤。为了让精准医学的临床部署顺利落地,需要建立一个完善的、针对组学信息的伦理学架构,即“精准医学伦理学(presision medicine ethics)”[13]。知情同意是支撑精准医学伦理学架构一个重要的核心内容。目前阶段,由于尚未建立一个中文的基础知识库,表型信息与基因信息之间缺乏准确的关系阐述,使得知情同意中“充分的知情”很难考量。因此,为了推进精准医学在临床诊疗中的应用,解决伦理学问题、建立中文的基础知识库进行知情同意管理迫在眉睫[14]。
2.5 术语控制与本体开发 目前,中国的病历基本已实现电子化。但不同医院使用的医院信息系统不尽相同,同一类别的数据展现形式多样化;同时,EHR/EMR的结构化程度很低,大量临床信息以自由文本形式储存,阻碍了医疗信息的互联互通。目前国内医院信息系统主要支持国际疾病分类体系,然而国际疾病分类实质上是疾病分类体系,并不是真正的术语体系。将医学系统命名法-临床术语、观测指标标志符逻辑命名与编码等系统引入国内并进行本地化是精准医学临床部署的核心工作之一。在此基础上,通过建立多种疾病本体,可以促进医疗信息的互联互通,使得数据利用与分析达到最大化。
2.6 全表型组关联分析技术 随着基因检测技术日渐成熟,生物样本量急剧增加,从而使遗传变异与表型的比较分析等研究成为可能。全表型组关联分析(phenome-wide association studies,PheWAS)是一种反向遗传学方法,旨在研究哪些表型可能与给定的遗传变异相关联[15]。PheWAS方法通过数百种已知的基因型-表型相关性进行了验证[16],并且使用PheWAS方法已能够区分真正的基因多效性和临床共病[17-18],能够有助于定义疾病亚型[19]。通过PheWAS还可以帮助重新选定药物治疗方案[20]。收集的大量表型数据与基因数据进行融合分析,利用高效、详细的PheWAS技术创造出丰富的资源,可进一步促进精准医学的发展。
3 精准医学临床部署的顶层设计
近年来精准医学临床部署的生态系统和基础设施日益完善,亟须在一个或几个医疗机构中进行试点工作,以探寻更多的技术难点及方法论,包括伦理法规、测序技术、机器可读的药物基因组学信息翻译、CDSS构建、EHR/EMR改造等过程。在研究体系中纳入成本效益分析、医生及患者教育、基础技术研发等,可为精准医学的临床部署建立可推广的模型,为临床实践指引发展方向,积累相关表型数据,建立相关共享及分析平台,构建相关知识库体系。由于中国精准医学临床部署还在萌芽阶段,所以应当借鉴国外的顶层设计理论和实践经验。
在图1中展示了结合中国精准医学现行状况构建出来的大体框架,框架整体分为基础设施搭建、关键技术应用、数据融合分析、知识库搭建、临床布局及伦理问题几个层次。
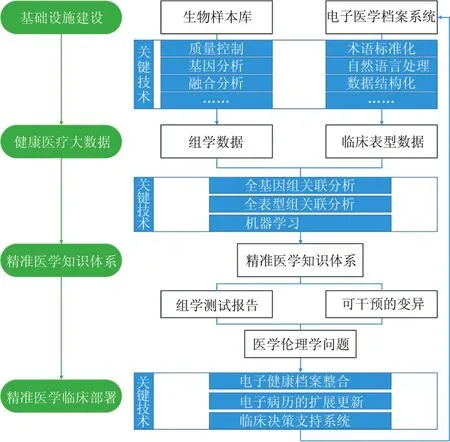
图1 精准医学信息学整体设计框架
生物样本库及电子健康档案的构建是收集患者多层次数据的基础设施,为精准医学提供数据基础。单纯的数据没有重要价值,必须经过专业性大数据分析技术构建相应数据库。在此基础上,通过机器学习等方法将数据集转化为新知识,再结合已有知识形成相互联系的数据字典,搭建精准医学知识库。
完整的精准医学流程最终步骤是提供决策支持。临床医生可以通过CDSS的帮助来融合分析患者的多层次信息,从而作出个性化的、最为恰当的诊疗决策。精准医学将数据集转换为可知信息应该是一个常规的制度化过程。确保数据安全和保护患者权利,同时促进标准化是维护公众支持的关键。精准医学作为全新的医学模式给传统医学伦理的规范提出了重大的挑战,为了更好地实现精准医学,搭建完善的伦理学框架也是重要工作之一。
4 展望
精准医学的临床部署是2017年中国HIT产业值得期待的重大发展方向。遗传因素对罕见病产生的影响十分显著,因此罕见病是进行精准医学临床实践的理想平台,可以利用组学信息有效辅助疾病的诊断和治疗。通过精准医学的临床部署,设计精准医学信息学的整体框架,加强对关键医学信息技术的应用,构建CDSS,为医生提供用药指导、疾病监控等帮助;医生可以更为准确地对疾病进行诊断与治疗,改善患者的预后,提升国民的健康水平。
[1]Gligorijevic′V,Malod-Dognin N,Pržulj N.Integrative methods for analyzing big data in precision medicine[J].Proteomics,2016,16(5):741-758.
[2]Collins FS,Varmus H.A new initiative on precision medicine[J].N Engl J Med,2015,372(9):793-795.
[3]Klonoff DC.Precision medicine for managing diabetes[J].J Diabetes Sci Technol,2015,9(1):3-7.
[4]Kalow W,Tang BK,Endrenyi L.Hypothesis:comparisons of inter-and intra-individual variations can substitute for twin studies in drug research[J].Pharmacogenetics,1998,8(4):283-289.
[5]Pathak J,Bailey KR,Beebe CE,et al.Normalization and standardization of electronic health records for high-throughput phenotyping:the SHARPn consortium[J].J Am Med Inform Assoc,2013,20(e2):e341-e348.
[6]Oniki TA,Zhuo N,Beebe CE,et al.Clinical element models in the SHARPn consortium[J].J Am Med Inform Assoc,2016,23(2):248-256.
[7]McBride WA,Mossey PA,McIntyre GT.Reliability,completeness and accuracy of cleft subphenotyping as recorded on the CLEFTSiS(Cleft Service in Scotland)electronic patient record[J].Surgeon,2013,11(6):313-318.
[8]Castaneda C,Nalley K,Mannion C,et al.Clinical decision support systems for improving diagnostic accuracy and achieving precision medicine[J].J Clin Bioinforma,2015,5:4.
[9]Ohno-Machado L.Data and the clinical decision support loop[J].J Am Med Inform Assoc,2016,23(e1):e1.
[10]Bietz MJ,Bloss CS,Calvert S,et al.Opportunities and challenges in the use of personal health data for health research[J].J Am Med Inform Assoc,2016,23(e1):e42-e48.
[11]Moskow JM,Cook N,Champion-Lippmann C,et al.Identifying opportunities in EHR to improve the quality of antibiotic allergy data[J].J Am Med Inform Assoc,2016,23(e1):e108-e112.
[12]Lang RD.In search of the missing link:data access and the next generation of CDSS[J].J Healthc Inf Manag,2002,16(4):2-4.
[13]Fiore RN,Goodman KW.Precision medicine ethics:selected issues and developments in next-generation sequencing,clinical oncology,and ethics[J].Curr Opin Oncol,2016,28(1):83-87.
[14]Ciardiello F,Adams R,Tabernero J,et al.Awareness,understanding,and adoption of precision medicine to deliver personalized treatment for patients with cancer:a multinational survey comparison of physicians and patients[J].Oncologist,2016,21(3):292-300.
[15]Denny JC,Bastarache L,Roden DM.Phenome-wide association studies as a tool to advance precision medicine[J].Annu Rev Genomics Hum Genet,2016,17:353-373.
[16]Ritchie MD,Denny JC,Crawford DC,et al.Robust replication of genotype-phenotype associations across multiple diseases in an electronic medical record[J].Am J Hum Genet,2010,86(4):560-572.
[17]Denny JC,Bastarache L,Ritchie MD,et al.Systematic comparison of phenome-wide association study of electronic medical record data and genome-wide association study data[J].Nat Biotechnol,2013,31(12):1102-1110.
[18]Denny JC,Crawford DC,Ritchie MD,et al.Variants near FOXE1 are associated with hypothyroidism and other thyroid conditions:using electronic medical records for genomeand phenome-wide studies[J].Am J Hum Genet,2011,89(4):529-542.
[19]Li L,Cheng WY,Glicksberg BS,et al.Identification of type 2 diabetes subgroups through topological analysis of patient similarity[J].Sci Transl Med,2015,7(311):311ra174.
[20]Rastegar-Mojarad M,Ye Z,Kolesar JM,et al.Opportunities for drug repositioning from phenome-wide association studies[J].Nat Biotechnol,2015,33(4):342-345.
The clinical implementation of precision medicine:top-level design and core informatics technology
WANG Yu1,WANG Xinwei1,LIU Shuang2,YANG Zhihui3,ZHU Weiguo4,GONG Mengchun5
(1.Digital China Health Technologies Co.Ltd.,Beijing 100080,China;2.Peking Union Medical College,Beijing 100005,China;3.Peking University Health Science Center,Beijing 100034,China;4.Department of General Internal Medicine,Peking Union Medical College Hospital,Beijing 100730,China;5.Rare Disease Research Center,Chinese Academy of Medical Sciences,Beijing 100730,China)
With the increasing attention of multi-dimensional information associated analysis,precision medicine has become a new medical model in the world.Precision medicine is an approach to disease treatment and prevention that seeks to maximize effectiveness by taking into account individual variability in genes,environment,and lifestyle.The advantage of precision medicine is using the new biological technology and information technology to integrate the genome and phenome,which can provide clinical decision support to study the pathogenesis of disease,classification and other new exploration and interpretation.The core technologies focused by precision medicine include disease subgroup grouping techniques,clinical decision support systems,electronic medical record upgrades,ethical challenges and informed consent management,terminology control and ontology development and phenome-wide association studies.The aim of this paper is to review the progress of precision medicine research worldwide and design the clinical deployment of precision medicine in China,which can promote the cure rate of disease,improve the prognosis and quality of life of patients.
Precision medical;Clinical decision support;Genomics;Phenome-wide association studies(PheWAS)
R-03
A
2095-3097(2017)06-0321-04
10.3969/j.issn.2095-3097.2017.06.001
国家重点研发计划精准医学研究重点专项(2016YFC09 01500);上海市出生缺陷防治重点实验室开放课题(16DZKF1007);国家卫生计生委2016年信息化与统计项目27号课题
100080北京,神州数码医疗科技股份有限公司(王宇,王心慰);100005北京,北京协和医学院(刘 爽);100034北京,北京大学医学部(杨之辉);100730北京,北京协和医院普通内科(朱卫国);100730北京,中国医学科学院罕见病研究中心(弓孟春)
2017-08-08 本文编辑:徐海琴)

