仿刺参补体AjC3部分基因的原核表达及多克隆抗体的制备
张 思,李 明,张建清,卢亚楠,翟 钰,张 峰
( 大连海洋大学 水产与生命学院,辽宁 大连 116023 )
仿刺参补体AjC3部分基因的原核表达及多克隆抗体的制备
张 思,李 明,张建清,卢亚楠,翟 钰,张 峰
( 大连海洋大学 水产与生命学院,辽宁 大连 116023 )
通过制备仿刺参补体C3(AjC3)多克隆抗体,为进一步研究仿刺参补体AjC3免疫机制奠定基础。利用PCR技术扩增AjC3部分基因片段(4556~5110 bp),将该片段与原核表达载体pGS-21a连接。将重组表达质粒转化到Transetta(DE3)中经IPTG诱导表达。表达的重组蛋白经镍柱纯化后,作为抗原免疫小鼠制备AjC3多克隆抗体。分别用间接ELISA,Western blot检测抗体的效价和特异性。结果显示,PCR扩增得到约555 bp的目的片段,重组蛋白分子量大小约56 ku;间接ELISA检测抗体效价达1∶25600,Western blot结果显示,多克隆抗体具有良好的特异性。该试验成功的制备了补体AjC3多克隆抗体,为补体AjC3的进一步研究提供了检测工具。
仿刺参;AjC3;多克隆抗体;原核表达
仿刺参(Apostichopusjaponicus)不仅具有很高的营养价值,而且在制药及医疗保健等方面也得到了广泛应用[1]。近年来随着仿刺参养殖规模的不断壮大,养殖病害问题日趋严重。而在我国大多使用抗生素和消毒剂等方法来解决仿刺参的疾病问题,这些传统方法不仅对环境造成了污染,而且还会带来药物残留等食品安全问题[2-3]。因此有必要更加深入的探索仿刺参的免疫防御机制,从免疫学角度降低病害发生的几率。
研究表明,补体系统是由多种蛋白参与的复杂的级联反应系统,包括补体固有成分、调节因子以及补体受体等,是连接固有免疫和适应性免疫之间的重要桥梁[4-5]。补体系统通过经典途径,凝集素途径,替代途径发挥免疫功能,补体C3分子处于3条激活途径的交汇处[6]。C3分子通过一系列的级联反应,参与免疫防御及免疫调节等多种应答反应。C3分子具有8个保守功能结构域,一个过敏毒素结构域,6个α2巨球蛋白结构域,一个NTR结构域[7]。C3通过水解断裂成不同的活性片段,C3a和C3b,来发挥免疫功能,C3a为过敏毒素,可促进炎症反应,C3b对替代途径中的C3/C5转化酶的形成具有重要作用,并能提高吞噬细胞的吞噬作用[8-10]。α2巨球蛋白功能类似于纤维蛋白溶解抑制剂,很多蛋白酶能与α2巨球蛋白结合形成复合物而被吞噬细胞清除[11]。NTR结构域上包含了许多与神经生长因子相似的物质[7]。
仿刺参主要通过非特异性免疫来完成对病原体的清除,而补体是非特异性免疫系统中重要的组成部分[12]。张峰等[13]证明了仿刺参体内也存在着类似于补体C3的物质。张斯等[14]克隆得到仿刺参补体AjC3的cDNA全长6281 bp,开放阅读框5217 bp,编码1738个氨基酸,蛋白分子量大小约为195 ku。翟钰等[15]筛选出了与仿刺参补体AjC3活性相关的miRNA(spu-miR-133、spu-miR-137、spu-miR-2006),spu-miR-133、spu-miR-137抑制补体AjC3基因表达,spu-miR-2006在免疫反应中对靶基因具有调控作用。多克隆抗体是研究生物免疫机制的一种重要检测工具。马雪云等[16]通过人工合成C3分子的21肽制备了鸡补体C3的多克隆抗体。张玉纯等[17]利用菊糖吸附小鼠血清的方法获得了C3多克隆抗体。马宁[18]通过原核表达技术获得了日本七鳃鳗(Lampetrajaponica)C3的多克隆抗体。而关于仿刺参补体AjC3的多克隆抗体的制备尚未见报道。因此本试验通过克隆仿刺参补体AjC3部分基因序列,经原核表达,镍柱纯化得到重组蛋白,免疫小鼠制备AjC3多克隆抗体。以期为进一步研究仿刺参补体AjC3免疫学机制奠定基础。
1 材料与方法
1.1 材料
Balb/c小鼠购自大连医科大学;pGS-21a菌株由本实验室保存;Trans5K DNA Marker、Trizol、TransTaq DNA聚合酶、反转录试剂盒、胶回收试剂盒、pEASY-T1克隆载体、Trans1-T1克隆感受态、Transetta(DE3)表达感受态、BamHI、XhoI、IPTG、氨苄青霉素、T4 DNA Ligase、Ni柱、AP标记的羊抗鼠IgG、抗HiS标签抗体、BCIP/NBT底物显色试剂盒均购自北京全式金生物技术有限公司;LB、琼脂培养基购自上海生工生物工程有限公司;质粒小提试剂盒购自天根生物科技有限公司。
1.2 方法
1.2.1 PCR引物的设计
根据GenBank(NO.HQ214156)公布的仿刺参补体AjC3全长基因设计2对特异性引物。其中一对引物扩增AjC3基因上的4067~5317 bp(1251 bp)片段。另一对引物扩增AjC3基因上的4556~5110 bp(555 bp),并在上下游引物中分别加入酶切位点BamHI和XhoI(带下划线)。引物由上海生工生物工程有限公司合成。引物如下:
1-F:5′-GAAGAAACTGGTCTCCGCTAT-3′
1-R:5′-TGATACCCAAAATTGTCGAAC-3′
2-F:5′-CGCGGATCCACCATCGAGATTAA
TGCCAG-3′
2-R:5′-CCGCTCGAGTTCAGCACAGAGAC
AGACAC-3′
1.2.2 目的基因的克隆
参照Trizol法提取仿刺参体腔细胞总RNA。利用反转录试剂盒将RNA反转录成cDNA。以cDNA为模板,用引物1-F,1-R扩增长度为1251 bp的片段。PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,共进行35个循环;最后72 ℃再延伸10 min。将PCR产物送至上海生工生物有限公司测序。以测序正确的PCR产物为模板,用引物2-F,2-R扩增长度为555 bp的目的片段。PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1.5 min,共进行30个循环;最后72 ℃再延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,胶回收目的片段,并与pEASY-T1载体连接,转化至Trans1T-1感受态细胞中,涂板,37 ℃培养16 h,挑取单菌落进行PCR鉴定,阳性重组质粒命名为pEASY-T1-AjC3。将阳性质粒送至上海生工生物有限公司测序。
1.2.3 pGS-21a-AjC3重组质粒的构建
提取pEASY-T1-AjC3和表达载体pGS-21a质粒,并进行双酶切。胶回收双酶切产物,T4 DNA Ligase 4 ℃过夜连接。连接产物转化至感受态细胞Trans1T-1中,涂板,37 ℃培养16 h,挑取单菌落进行PCR验证,重组质粒命名为pGS-21a-AjC3。将重组质粒pGS-21a-AjC3送至上海生工生物有限公司测序。将测序正确的重组质粒pGS-21a-AjC3转入到表达感受态Transetta(DE3)中,涂板,37 ℃培养16 h,提取重组质粒进行PCR和双酶切鉴定。
1.2.4 重组菌pGS-21a-AjC3的诱导表达、纯化及Western blot分析
将鉴定正确的重组菌接种于含Amp的LB培养基中,37 ℃,200 r/min摇到OD值为0.8,加入不同浓度的IPTG(0、0.2、0.5、1.0 mmol/L),30 ℃,诱导6 h。超声破碎法裂解菌体,离心后分别收集上清液和沉淀,确定重组蛋白的表达形式。
收集超声破碎后的沉淀,分别用2、3、4、5、6、8 mol/L尿素平衡缓冲液进行处理,摸索平衡缓冲溶液最佳洗涤浓度和最佳溶解浓度。收集尿素处理后的上清液,按全式金镍柱说明书进行纯化。将纯化得到的重组蛋白经SDS-PAGE电泳后转到PVDF膜上,与抗HiS标签抗体反应,加入AP标记的羊抗鼠IgG,BCIP/NBT底物进行显色。
1.2.5 多克隆抗体的制备
第1次免疫每只小鼠100 μg重组蛋白加等体积的弗氏完全佐剂,混合后腹腔注射。首次免疫后的第20 d和第27 d分别进行第2次和第3次免疫,每只小鼠50 μg重组蛋白加等体积的弗氏不完全佐剂。首次免疫后的第34 d进行第4次免疫,不加佐剂直接注射100 μg重组蛋白,7 d后取眼放血,收集血清。分装后于冰箱-80 ℃保存。
1.2.6 间接ELISA检测效价
用包被缓冲液将重组蛋白稀释,包被过夜;加入PBS梯度稀释后的多抗血清和对照血清作为一抗;加入PBS按1∶2000稀释的AP标记的羊抗鼠IgG作为二抗;加入配制好的PNPP-Na显色20 min,加入终止液,酶标仪检测吸光度(A405)值,计算效价。
1.2.7 Western blot检测多抗特异性
将重组蛋白进行SDS-PAGE电泳后转到PVDF膜上,将制备的多克隆抗体按1∶500倍稀释为一抗,以AP标记的羊抗鼠IgG为二抗,BCIP/NBT底物进行显色。
2 结 果
2.1 目的基因的克隆
利用PCR扩增获得约1251 bp的片段。以此PCR产物为模板再次扩增获得约555 bp的目的片段(图1),与预期结果相同。测序后与GenBank中收录的仿刺参AjC3全长基因比对,结果显示全长基因上的第4867位核苷酸由C变成了T,但编码的氨基酸仍是丝氨酸。
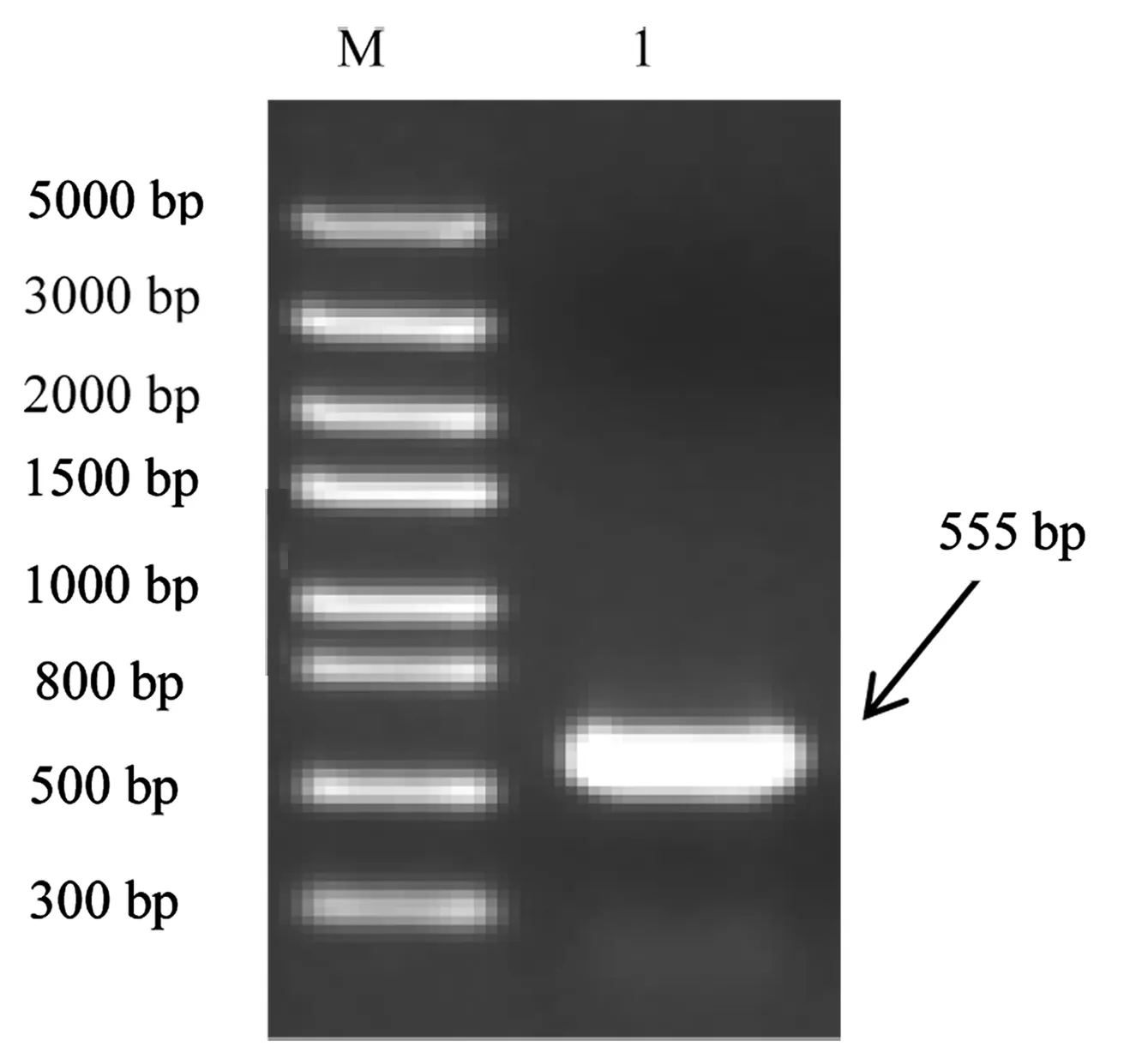
图1 AjC3基因PCR扩增结果M.DNA Marker;1.AjC3基因PCR扩增产物.
2.2 pGS-21a-AjC3重组质粒的构建
胶回收双酶切后的目的片段和pGS-21a,T4 DNA Ligase 连接后转化至感受态细胞Trans1T-1中,测序结果正确。提取重组质粒pGS-21a-AjC3,进行PCR和双酶切鉴定,电泳结果显示双酶切产物大小分别约为555 bp和6000 bp,证明pGS-21a-AjC3重组质粒的构建成功(图2)。
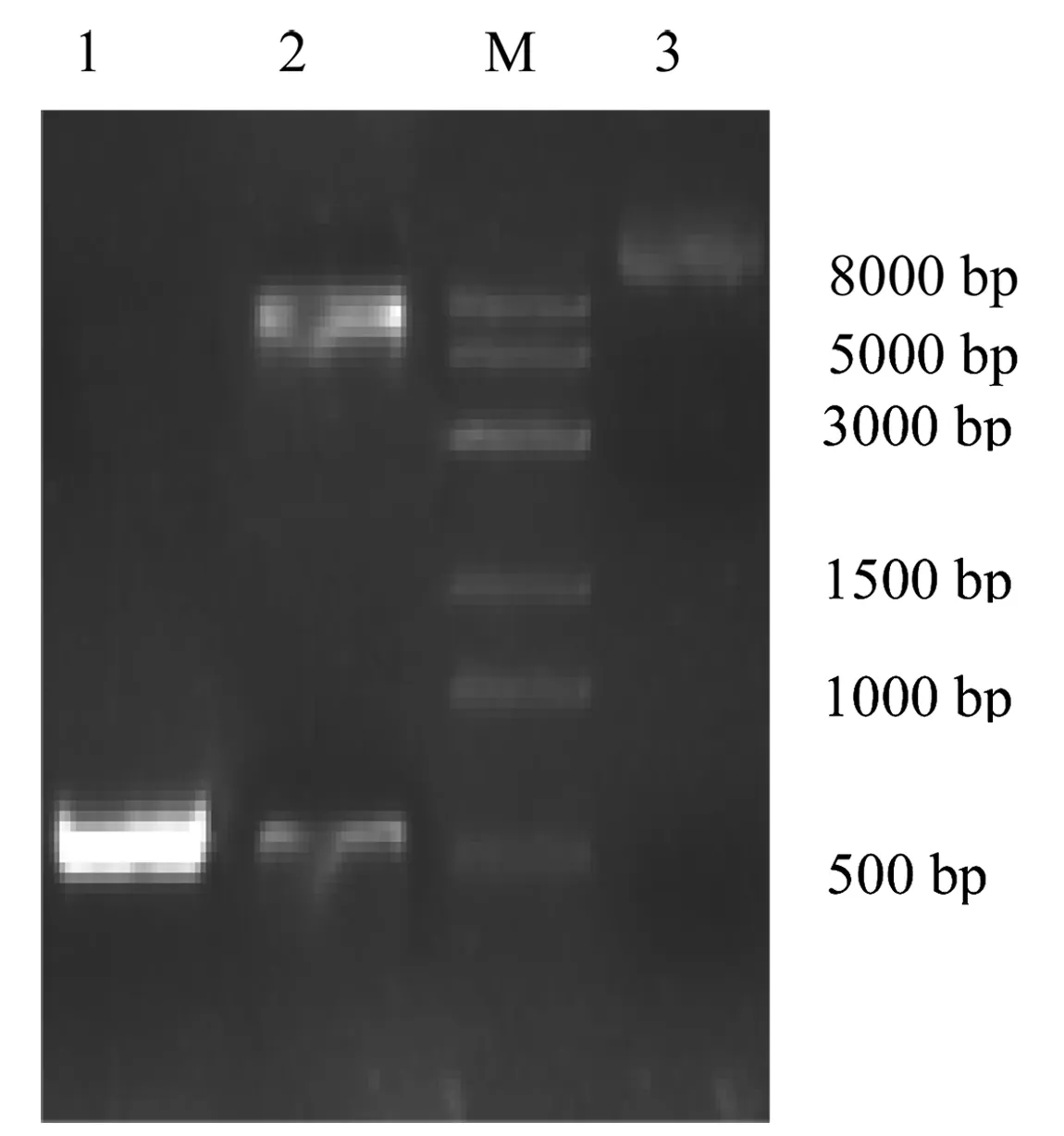
图2 重组质粒pGS-21a-AjC3 PCR和双酶切鉴定1:pGS-21a-AjC3 PCR鉴定;2:BamHI、Xhol双酶切; M:DNA Marker;3:重组质粒pGS-21a-AjC3.
2.3 重组菌的诱导表达、纯化及Western blot分析
收集不同浓度的IPTG诱导的菌液进行SDS-PAGE电泳分析,结果显示在56 ku处出现重组蛋白条带,与预期蛋白分子量一致;IPTG浓度为0.5 mmol/L和0.2 mmol/L时表达量较多。收集超声破碎裂后的上清液与沉淀进行SDS-PAGD电泳分析,结果显示重组蛋白大部分在沉淀中,因此确定重组蛋白主要以包涵体的形式表达。
重组蛋白经3 mol/L尿素平衡缓冲溶液洗涤后可除去大部分杂蛋白,经8 mol/L尿素平衡缓冲溶液处理可使大部分重组蛋白溶于上清液中。上清液经镍柱纯化后,在160 mmol/L的咪唑洗脱下可获得纯度和浓度较高的重组蛋白。Western blot结果显示获得单一条带,且条带位置与重组蛋白一致(图3)。
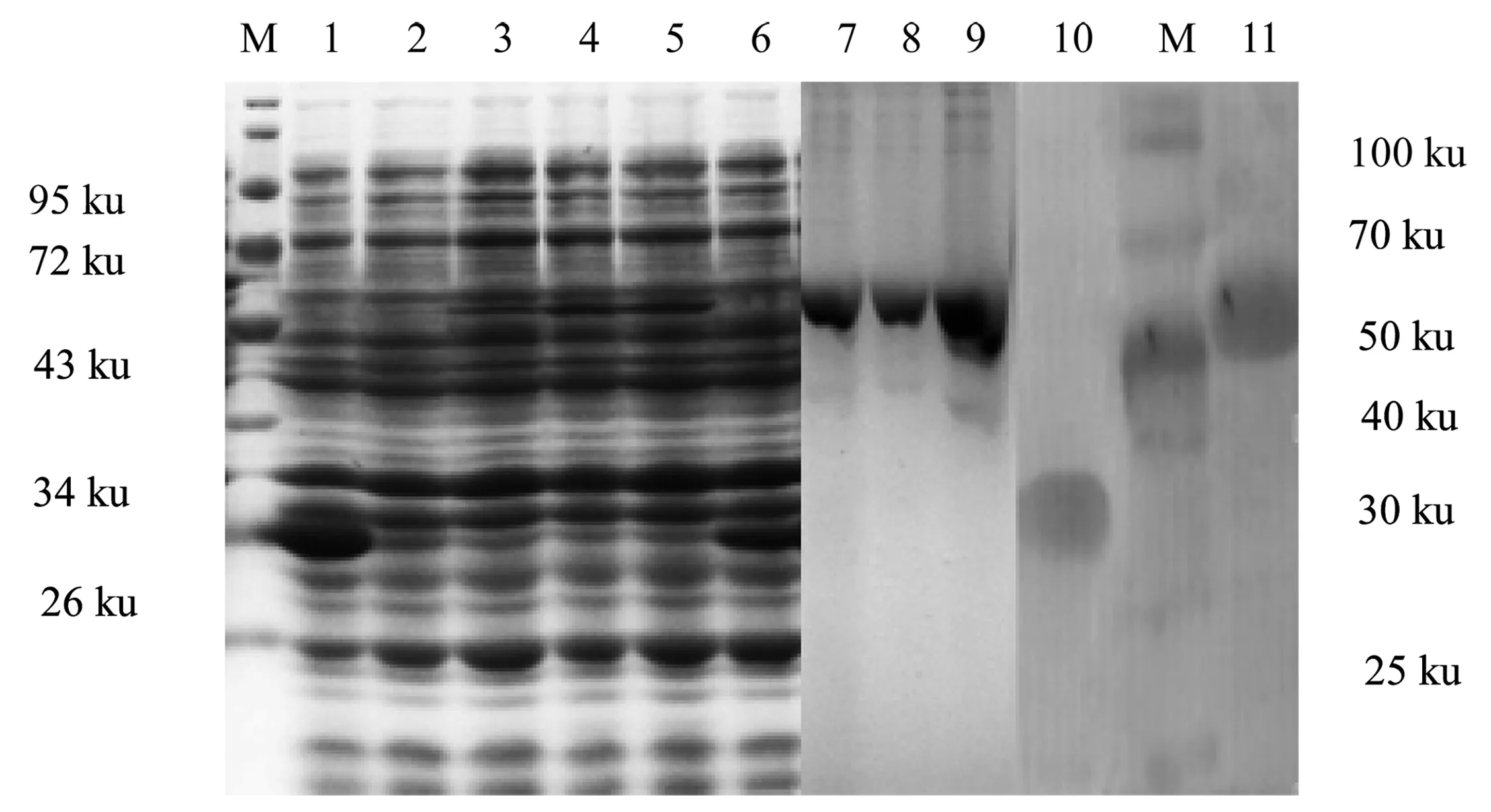
图3 不同浓度的IPTG诱导重组蛋白表达、纯化及Western blot分析
M:蛋白Marker;1:诱导空载体pGS-21a; 2:未诱导的重组表达载体pGS-21a-AjC3;3~5:30 ℃条件下分别以终浓度1.0、0.5、0.2 mmol/L的IPTG诱导6h的重组菌;6:未诱导的空载体pGS-21a;7~9:100、160、160 mmol/L的咪唑洗脱时的重组蛋白; 10:pGS-21a空载体的Western blot分析; M:蛋白Marker; 11:重组蛋白Western blot分析.
2.4 多克隆抗效价的检测
间接ELISA检测结果显示当多克隆抗体稀释到1/25600时P/N比值仍大于2.1,当稀释到1/51200时P/N比值小于2.1,因此判断多克隆抗体效价为1/25600。

表1 间接ELISA检测多克隆抗体效价
2.5多克隆抗体特异性的检测
以重组蛋白为抗原,以制备的多克隆抗体为一抗,在56 ku处出现特异性条带,与预期结果相符(图4)。

图4 多克隆抗体Western blot分析M:蛋白Maker; 1:多克隆抗体检测重组蛋白.
3 讨 论
3.1 目的基因克隆
仿刺参AjC3基因全长6281 bp,蛋白分子大小约195 ku,分子量较大[14]。原核表达系统受原核细胞选择偏性的影响,所以蛋白分子量过大不易表达,然而从免疫学角度可知,蛋白能否产生相应的抗体与蛋白分子量并无直接关系,只有当蛋白表面具有抗原表位时,才能被识别产生相应的抗体[19]。因此,本试验参考文献[20-22]关于分析蛋白抗原表位的方法,截取主要抗原表位区基因进行克隆。用primer 5设计引物时发现在靠近截取目的片段上下游附近并未找到特异性高的引物,但在距离目的片段上下游较远处能找到合适引物,因此本试验先克隆一段包含目的片段在内的长度为1251 bp的片段,以此片段为模板扩增获得目的片段,从而减少了错配的几率,提高了引物的特异性。
3.2 重组菌的诱导表达及纯化
本试验最初选用表达感受态细胞BL21(DE3)pLysS,但重组蛋白未表达。分析原因可能是这段基因含有较多的稀有密码子,改换Transetta(DE3)后重组蛋白大量表达。为了获得可溶性蛋白,试验过程中曾尝试降低温度,更换表达载体等方法,但均未提高上清液中重组蛋白的表达量。分析原因可能是由于存在含硫氨基酸导致二硫键错配,其次原核表达系统缺乏糖基化、酰基化等翻译后加工系统,中间体会大量积累,容易形成包涵体。
3.3 多克隆抗体的制备
本试验共免疫了5只小鼠,其中1只小鼠二次免疫后死亡,有3只小鼠效价达到1∶25600,另1只小鼠效价只有1∶800。分析原因可能是不同的小鼠体质不同或者免疫失败造成的。多克隆抗体在蛋白鉴定和定量检测方面具有广泛的应用价值,如ELISA、western、免疫组化等[23-24]。目前市面上有关补体AjC3商业化抗体和检测试剂盒都是针对哺乳动物的,而且价格昂贵,阻碍了对仿刺参补体AjC3的相关研究。本试验成功的制备了仿刺参补体AjC3的多克隆抗体,为检测仿刺参补体AjC3在各组织中的分布以及病毒侵染下表达含量的变化等研究提供了工具。
4 结 论
本试验通过克隆,原核表达,镍柱纯化等技术获得了AjC3重组蛋白。将获得的重组蛋白作为抗原免疫小鼠制备多克隆抗体。间接ELISA及Wstern blot分析多克隆抗体具有较高的效价及良好的特异性。为今后更进一步的研究AjC3蛋白的功能以及免疫机制奠定了基础。
[1] Jilin L, Peck G. Chinese Dietary Threapy [M]. London, UK: Churchill Livingstone, 1995.
[2] 王淑娴, 叶海斌, 于晓清, 等. 海参的免疫机制研究[J]. 安徽农业科学, 2012, 40(25):12553-12555.
[3] 孙永欣, 王吉桥, 汪婷婷, 等. 海参防御机制的研究进展[J]. 水产科学, 2007, 26(6):358-361.
[4] Lambris J D, Reid K B, Volanakis J E. The evolution, structure, biology, and pathophysiology of complement[J]. Immunol Today, 1999, 20(5):207-211.
[5] Sunyer J O, Zarkadis I K, Lambris J D. Complement diversity: a mechanism for generating immune diversity[J]. Immunol Today, 1998, 19(11):519-523.
[6] Sahu A,Lambris J D. Structure and biology of complement protein C3, a connecting link between innate and acquired immunity[J]. Immunol Rev, 2001, 4(180):35-48.
[7] 昝琦, 刘欣, 逄越, 等. 补体C3结构与功能研究进展[J]. 中国免疫学杂志, 2014, 30(4):549-553.
[8] 马雪云. 鸡补体C3部分生物学特性的研究[D]. 泰安:山东农业大学, 2006.
[9] 王雷雷. 扇贝补体相关分子的结构及功能研究[D]. 北京:中国科学院大学, 2013.
[10] Janssen B J, Huizinga E G,Raaijmakers H C, et al. Structures of complement component C3 provide insights into the function and evolution of immunity[J]. Nature, 2005, 437(22):505-511.
[11] 高丽丽, 白云, 庞秋香. 补体成分C3系统发生[J]. 中国生物化学与分子学报, 2014,30(9):863-869.
[12] 宋志东, 李培玉, 张利民, 等. 棘皮动物补体系统的研究进展[J]. 水产科技情报, 2007, 34(2):62-65.
[13] 张峰, 王海峰, 宫晶, 等. 仿刺参体腔液补体类似物化学发光免疫检测[J]. 核农学报,2007, 21(4):413-416.
[14] 张思. 仿刺参补体AjC3基因克隆及其功能分析[D]. 大连:大连海洋大学, 2011.
[15] 翟钰, 曹雁惠, 张峰, 等. 刺参补体AjC3活性相关miRNA的筛选与初步研究[J]. 大连海洋大学学报, 2015, 30(6):585-591.
[16] 马雪云, 牛钟相. 抗鸡补体C3抗体的抗体的制备及其应用[J]. 中国兽医学报, 2007, 27(3):359-362.
[17] 张玉纯, 赵鄞生, 刘俊龙, 等. 小白鼠补体C3的提取及其抗血清的制备[J]. 免疫学杂志, 1994, 10(1):66.
[18] 马宁. 七鳃鳗补体C3分子的cDNA片段克隆、表达以及多克隆抗体的制备[D]. 大连:辽宁师范大学, 2012.
[19] 唐莲. 猪硒蛋白IDⅡ和SelS基因克隆、原核表达及多克隆抗体制备[D]. 雅安:四川农业大学, 2012.
[20] 吉艺宽, 王雨, 程艺, 等. 伪狂犬病病毒gE基因主要抗原表位区的原核表达及间接ELISA方法的建立[J]. 华南农业大学学报, 2015, 36(4):11-15.
[21] 郑逢梅, 赵军, 霍金耀, 等. PEDV流行株N基因主要抗原表位原核表达及ELISA方法的建立[J]. 中国兽医学报, 2014, 34(3):371-378.
[22] 黄海碧, 郑佳琪, 王仁超, 等. 绵阳肺炎支原体P71蛋白分段表达及其间接ELISA方法的建立[J]. 中国预防兽医学报, 2015, 37(8):623-627.
[23] 刘燕. 绵羊Gfral基因的克隆和多克隆抗体的制备鉴定及应用[D]. 呼和浩特:内蒙古大学, 2012.
[24] Murray P, Edgar D. The regulation of embryonic stem cell differentiation by leukaemia inhibitory factor(LIF)[J]. Differentiation,2001, 68(4/5):227-234.
ProkaryoticExpressionofGeneFragmentsofAjC3andPreparationofPolyclonalAntibodyinSeaCucumberApostichopusjaponicus
ZHANG Si, LI Ming, ZHANG Jianqing, LU Yanan, ZHAI Yu, ZHNAG Feng
( Fisheries and Life College, Dalian Ocean University, Dalian 116023, China )
The polyclonal antibody of complement component C3(AjC3) was prepared to provide references for further research on immunologic mechanism in sea cucumberApostichopusjaponicus. The gene fragments of AjC3 was amplified by PCR and inserted into the prokaryotic expression vector pGS-21a. The recombinant plasmid was transformed into the transetta(DE3) and induced to express by IPTG. The expression products were purified by Ni-NTA. The recombinant protein as antigen was employed to immunize mice to prepare the polyclonal antibody. The title and specificity of the polyclonal antibody were determined by indirect ELISA and Western blot. The results showed that the length of PCR product was 555 bp.The size of recombinant protein was 56 ku. The title was 1∶25600 by indirect ELISA. Western blot proved that the polyclonal antibody had good specificity and was successfull prepared, which provided helpful tools for further researches on AjC3.
Apostichopusjaponicus; AjC3; polyclonal antibody; prokaryotic expression
10.16378/j.cnki.1003-1111.2017.01.016
S968.9
A
1003-1111(2017)01-0094-05
2016-02-01;
2016-04-18.
国家自然科学基金资助项目(30471223).
张思(1990—),女,硕士研究生;研究方向:动物免疫学.E-mail:2441645464@qq.com.通讯作者:张峰(1957—),男,教授,博士;研究方向:动物免疫学.E-mail:zhangfeng@dlou.edu.cn.

