二价金属离子对光棘球海胆免疫相关酶活力的影响
程雨卉,蒋经伟,董 颖,高 杉,陈 仲,周遵春
( 1. 大连海洋大学,辽宁 大连 116023; 2. 辽宁省海洋水产科学研究院,辽宁 大连 116023 )
二价金属离子对光棘球海胆免疫相关酶活力的影响
程雨卉1,蒋经伟2,董 颖2,高 杉2,陈 仲2,周遵春2
( 1. 大连海洋大学,辽宁 大连 116023; 2. 辽宁省海洋水产科学研究院,辽宁 大连 116023 )
二价金属离子在海洋无脊椎动物免疫相关酶的活力调控中发挥重要作用。为了解二价金属离子对光棘球海胆免疫相关酶活力的影响,采用生化方法研究了8种二价金属离子在体外不同浓度下对光棘球海胆体腔液中酸/碱性磷酸酶、过氧化氢酶、超氧化物歧化酶、酚氧化酶和髓过氧化物酶活力的影响。结果显示,Cu2+可明显增强碱性磷酸酶、过氧化氢酶、超氧化物歧化酶和酚氧化酶的活力;Mn2+对酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和髓过氧化物酶有强烈的激活作用;Zn2+对超氧化物歧化酶和酚氧化酶有强烈的抑制作用;Fe2+抑制过氧化氢酶和超氧化物歧化酶的活力;Ca2+对酸性磷酸酶和髓过氧化物酶有抑制作用;Mg2+对碱性磷酸酶有抑制作用;Cd2+对超氧化物歧化酶和酚氧化酶有抑制作用;Pb2+对过氧化氢酶、超氧化物歧化酶和酚氧化酶有抑制作用。试验结果表明,适宜浓度的Mn2+和Cu2+对光棘球海胆的非特异性免疫系统可能有促进作用,而Fe2+、Zn2+、Ca2+、Mg2+、Pb2+和Cd2+可能会削弱光棘球海胆的免疫应答能力。
光棘球海胆;体腔液;二价金属离子;免疫相关酶
棘皮动物体腔液中含有多种与免疫相关的酶,这些酶通过酶促反应参与机体的多种免疫应答过程[1-3]。迄今为止,在棘皮动物体腔液中已发现的免疫相关酶包括酸性磷酸酶、碱性磷酸酶、过氧化氢酶、超氧化物歧化酶、酚氧化酶和髓过氧化物酶等[4-5]。这些酶在无脊椎动物的非特异性免疫系统中承担不同的免疫功能。例如,酸性磷酸酶/碱性磷酸酶对病原磷酸基团的水解作用可以修饰或更改病原表面的分子结构,从而加速免疫细胞对病原的吞噬作用甚至直接杀伤病原[6]。过氧化氢酶和超氧化物歧化酶能够清除机体免疫应答和抗应激等生理过程中产生的过量活性氧(如O2-等),减少活性氧对机体自身的伤害[7-8]。酚氧化酶可催化酚类底物生成对应的醌类物质,醌类物质再通过系列的非酶促反应转化为黑色素,黑色素对病原有凝集作用,而非酶促反应中的一些中间代谢产物对部分病原有显著的杀伤抑制作用和促进吞噬作用[9]。髓过氧化物酶通过催化氯化物生成强效的杀菌物质―次氯酸从而广泛参与病原菌的氧化杀伤过程[7]。免疫相关酶在对底物的催化反应中通常需要金属离子的辅助参与,因此免疫相关酶的活力对二价金属离子非常敏感。例如,在棘皮动物中,Mg2+的浓度为1~30 mmol/L时,可增强仿刺参(Apostichopusjaponicus)碱性磷酸酶的活力[10-11],Cu2+(CuSO4·5H2O)质量浓度为0.05 mg/L时抑制中间球海胆(Strongylocentrotusintermdius)超氧化物歧化酶的活力[12]。在甲壳动物中,Hg2+、Cu2+、Zn2+、Pb2+、Mg2+、Cd2+和Ni2+在浓度为0.1~0.5 mmol/L时,对长毛明对虾(Fenneropenaeuspencinillatus)酸性磷酸酶活力有显著抑制作用,并且抑制作用呈现剂量依赖性[13],Cu2+、Zn2+和Ca2+浓度为10 mmol/L时,强烈抑制日本沼虾(Macrobrachiumnipponense)超氧化物歧化酶的活力[14]。Mg2+、Ca2+和Zn2+浓度为5 mmol/L时对菲律宾蛤仔(Ruditapesphilippinarum)中的酚氧化酶有抑制作用,但对海湾扇贝(Argopectenirradians)中的酚氧化酶有激活作用,并且金属离子对这两个物种中酚氧化酶活力的影响呈现非剂量依赖性[15-16]。上述研究也表明,二价金属离子对免疫相关酶活力的影响具有物种特异性。
光棘球海胆(S.nudus)又称大连紫海胆,属于棘皮动物门、海胆纲,是中国北方近海重要的增养殖经济物种[17],其免疫系统易受海洋环境中各类金属离子的影响。但迄今为止,二价金属离子对光棘球海胆体内不同免疫因子的影响尚不明确。因此,本研究通过生化和酶学手段分析了8种二价金属离子对光棘球海胆体腔液中6种免疫相关酶活力的影响,旨在为了解光棘球海胆的免疫机制和特点积累数据。
1 材料与方法
1.1 材料
1.1.1 试验动物
体质量(23.6±4.4) g的光棘球海胆10只,取自辽宁省海洋水产科学研究院引育种中心,于实验室暂养7 d后使用。暂养时水温17~18 ℃、盐度29、pH 8.6~8.8。
1.1.2 二价金属离子
使用CuSO4、MnCl2、ZnSO4、FeCl2、CaCl2、MgSO4、CdCl2和 Pb(CH3COO)2(上海生工)作为二价金属离子Cu2+、Mn2+、Zn2+、Fe2+、Ca2+、Mg2+、Cd2+、Pb2+的来源,用100 mmol/L Tris-HCl (pH 8.0) 分别配制浓度为5、10、20、30、40、50、60 mmol/L的二价金属离子溶液。
1.2 方法
1.2.1 体腔上清液的制备
用灭菌注射器从光棘球海胆(10只)的围口膜处刺入体腔,抽取体腔液,每只海胆取体腔液2 mL。将10只海胆的体腔液混匀后,离心(4 ℃,3500 r/min,10 min),取上清液作为体腔上清液,-20 ℃保存备用。
1.2.2 二价金属离子与体腔上清液的预孵育
将等体积的体腔上清液分别与等体积的二价金属离子溶液混匀,4 ℃,孵育20 min。对照组中,将二价金属离子溶液替换为等体积的100 mmol/L Tris-HCl(pH 8.0)溶液。
1.2.3 酸性磷酸酶/碱性磷酸酶活力测定
酸性磷酸酶/碱性磷酸酶活力测定采用对硝基苯磷酸酯法[18]。在2.0 mL 2 mmol/LpNPP溶液(测定酸性磷酸酶活力时溶于100 mmol/L NaAc-HAc,pH 4.5;测定碱性磷酸酶时溶于50 mmol/L NaCO3-NaHCO3缓冲液,pH 9.5)中加入100 μL待测样品,37 ℃孵育30 min,然后加入2.9 mL 100 mmol/L NaOH溶液终止反应,并在405 nm波长下测定吸光值。酶活力定义:反应体系中样品在37 ℃与底物作用30 min产生1 mg对硝基苯酚为1个酶活力单位(U)。
1.2.4 过氧化氢酶活力测定
过氧化氢酶活力测定采用过氧化氢底物法[19]。首先,用磷酸盐缓冲液(50 mmol/L,pH 7.5)将过氧化氢溶液(75 mmol/L)调至A240在0.04~0.06范围内,用作底物溶液。然后取100 μL待测样品与2.9 mL底物溶液混匀,立刻在240 nm波长下连续测定吸光值。过氧化氢酶活力定义:反应体系中每秒钟转化1 μmol 过氧化氢定义为一个酶活力单位(U)。
1.2.5 超氧化物歧化酶活力测定
超氧化物歧化酶活力测定采用氯化硝基四氮唑蓝法[20]。3 mL反应混合液(0.75 mmol/L NBT;13 μmol/L甲硫氨酸;20 μmol/L核黄素;0.1 mmol/L乙二胺四乙酸;50 mmol/L磷酸盐缓冲液,pH 7.8)中加入100 μL待测样品,在30 ℃下用4000 lx荧光照射5 min,然后在560 nm波长下测定吸光值。超氧化物歧化酶活力定义:每毫升反应体系中抑制率达50%时所对应的超氧化物歧化酶量为一个酶活力单位(U)。
1.2.6 酚氧化酶活力测定
酚氧化酶活力测定采用多巴络合物生成法[21]。100 μL待测样品与 2.0 mL左旋多巴溶液(20 mmol/L)混合后,在490 nm波长下连续测定吸光值。酚氧化酶活力定义:A490值每分钟增加0.001为一个酶活力单位(U)。
1.2.7 髓过氧化物酶活力测定
髓过氧化物酶活力测定采用四甲基联苯胺法[22]。2.9 mL反应混合液(1.6 mmol/L四甲基联苯胺;0.1 mmol/L 过氧化氢)中加入100 μL待测样品,混匀后立即在650 nm波长下连续测定吸光值。髓过氧化物酶活力定义:反应体系中每分钟降解1 μmol 过氧化氢所需的酶量为一个酶活力单位(U)。
1.2.8 数据分析
酶活检测试验均做4次重复,试验数据使用SPSS 13.0软件分析,结果以平均值±标准差表示。
2 结 果
2.1 二价金属离子对酸性磷酸酶活力的影响
Cu2+在浓度为2.5 mmol/L时抑制酸性磷酸酶活力,在其他测试浓度下增强酸性磷酸酶活力;Mg2+同样在浓度为2.5 mmol/L时抑制酸性磷酸酶活力,但在其他测试浓度下对酸性磷酸酶活力无明显影响;Mn2+、Zn2+、Fe2+、Cd2+、Pb2+在所选浓度下均对酸性磷酸酶有明显激活作用;Ca2+在所选浓度下抑制酸性磷酸酶活力(图1)。

图1 二价金属离子对光棘球海胆体腔液中酸性磷酸酶活力的影响
2.2 二价金属离子对碱性磷酸酶活力的影响
Cu2+、Mn2+、Zn2+、Fe2+、Ca2+和Cd2+在所选浓度下均对碱性磷酸酶活力有明显的激活作用;Mg2+在所有测试浓度下对碱性磷酸酶有抑制作用;Pb2+在浓度为2.5 mmol/L、5 mmol/L和10 mmol/L时抑制碱性磷酸酶活力,而在其他测试浓度下增强碱性磷酸酶活力(图2)。
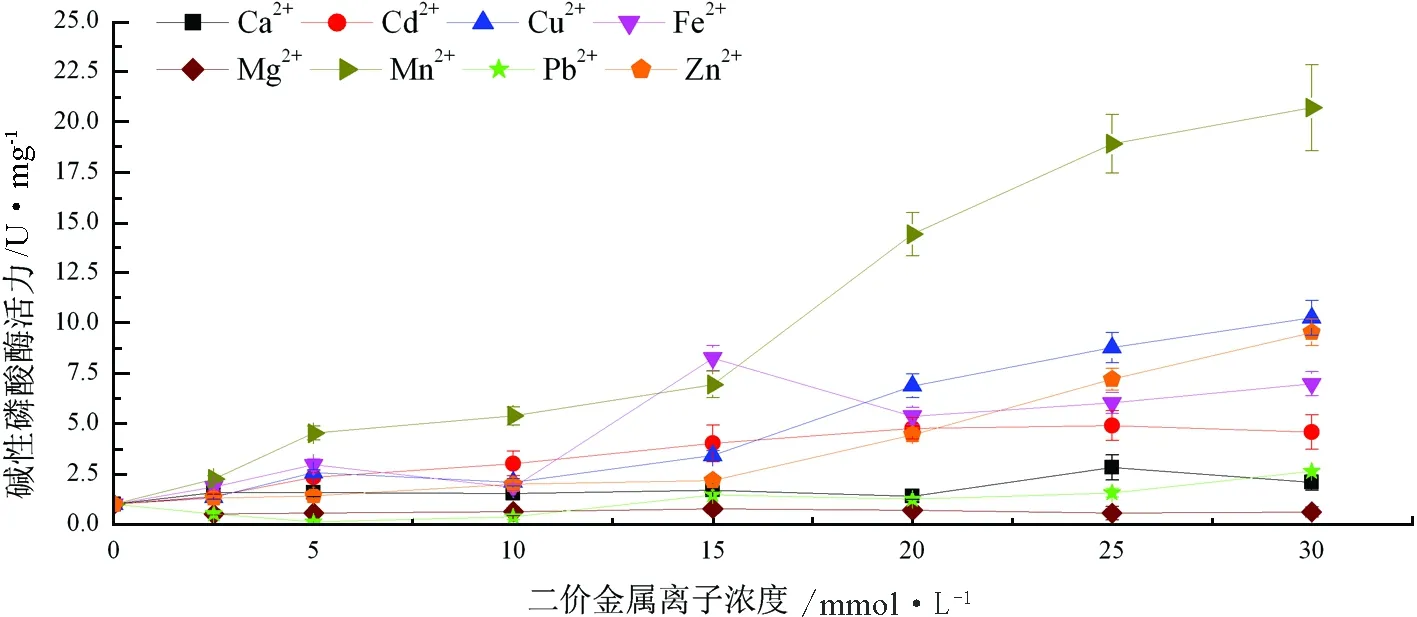
图2 二价金属离子对光棘球海胆体腔液中碱性磷酸酶活力的影响
2.3 二价金属离子对过氧化氢酶活力的影响
Cu2+在所选浓度下对过氧化氢酶有强烈的激活作用;Mn2+、Zn2+和Ca2+在所选浓度下对过氧化氢酶活力无明显影响;Fe2+和Pb2+在测试浓度下抑制过氧化氢酶活力;Mg2+在2.5 mmol/L、10 mmol/L、15 mmol/L时抑制过氧化氢酶活力,在5 mmol/L和25 mmol/L时增强过氧化氢酶活力,而在20 mmol/L和30 mmol/L时对过氧化氢酶活力无明显影响;Cd2+在2.5 mmol/L时抑制过氧化氢酶活力,在5 mmol/L和20 mmol/L时增强过氧化氢酶活力,在其他测试浓度下对过氧化氢酶活力无明显影响(图3)。

图3 二价金属离子对光棘球海胆体腔液中过氧化氢酶活力的影响
2.4 二价金属离子对超氧化物歧化酶活力的影响
Cu2+、Mn2+和Ca2+在所选浓度下对超氧化物歧化酶有明显激活作用;Zn2+、Fe2+、Cd2+和Pb2+对超氧化物歧化酶活力有强烈抑制作用;Mg2+在2.5 mmol/L、5 mmol/L、10 mmol/L时抑制超氧化物歧化酶活力,在15 mmol/L时增强超氧化物歧化酶活力,在20 mmol/L、25 mmol/L和30 mmol/L时对超氧化物歧化酶活力无明显影响(图4)。

图4 二价金属离子对光棘球海胆体腔液中超氧化物歧化酶活力的影响
2.5 二价金属离子对酚氧化酶活力的影响
Cu2+和Fe2+测试浓度下明显增强酚氧化酶活力;Zn2+、Cd2+和Pb2+在测试浓度下抑制酚氧化酶活力;Mn2+和Ca2+在测试浓度下对酚氧化酶活力无明显影响;Mg2+在20 mmol/L时对酚氧化酶活力有抑制作用,在其他测试浓度下对酚氧化酶活力无明显影响(图5)。

图5 二价金属离子对光棘球海胆体腔液中酚氧化酶活力的影响
2.6 二价金属离子对髓过氧化物酶活力的影响
Cu2+在2.5 mmol/L时强烈抑制髓过氧化物酶活力,在其他测试浓度下增强髓过氧化物酶活力;Mn2+、Zn2+、Fe2+、Cd2+和Pb2+在测试浓度下均对髓过氧化物酶有强烈的激活作用;Ca2+在测试浓度下明显抑制髓过氧化物酶活力;Mg2+在2.5 mmol/L时抑制髓过氧化物酶活力,在10 mmol/L时增强髓过氧化物酶活力,在其他测试浓度下对髓过氧化物酶活力无明显影响(图6)。

图6 二价金属离子对光棘球海胆体腔液中髓过氧化物酶活力的影响
3 讨 论
3.1 了解二价金属离子对光棘球海胆免疫相关酶活力影响的意义
光棘球海胆缺乏特异性免疫系统,主要依赖体腔液中的各种免疫相关酶和其他一些活性蛋白来识别、抑制、杀伤和清除病原[1-2,4]。已有研究表明,海洋生物体内的免疫相关酶活力受二价金属离子影响显著[13-15]。在光棘球海胆的育苗、养殖过程中,投喂的饵料、药物等常含有各种二价金属离子,此外,排放到近海的工业、农业和生活污水中也含有大量的二价金属离子[23-24],因此,了解二价金属离子对光棘球海胆体腔液中免疫相关酶活力的影响对海胆的健康养殖具有重要意义。
3.2 二价金属离子对光棘球海胆免疫相关酶活力的非剂量依赖性影响
在仿刺参[10]、海湾扇贝[15]、亚洲玉米螟(Ostriniafurnacalis)[25]等无脊椎动物中的研究表明,二价金属离子浓度为0~30 mmol/L时,可相对完整的反映二价金属离子在不同浓度条件下对免疫相关酶活力的影响。因此,本研究中二价金属离子的浓度为0~30 mmol/L。在本研究中,二价金属离子对光棘球海胆免疫相关酶活力的影响与金属离子浓度相关,但这种影响在多数情况下并不是随着金属离子的浓度增大而增强,而是呈现出非剂量依赖性,与仿刺参[10]、海湾扇贝[15]、菲律宾蛤仔[16]中的报道相似。二价金属离子影响免疫酶活力的机制目前尚不明确,有报道推测二价金属离子是通过结合于酶的活性部位来影响酶的活力[13],也有研究发现二价金属离子是通过改变酶的部分肽段的二级结构来影响酶的活力[25],然而,这些推论和发现不能合理解释本研究和其他研究中报道的二价金属离子对酶活力的非剂量依赖性影响,金属离子影响酶活力的机制仍有待深入研究。
3.3 二价金属离子对光棘球海胆酸性磷酸酶和碱性磷酸酶活力的影响
在光棘球海胆酸性磷酸酶和碱性磷酸酶活力检测试验中,Mn2+、Zn2+、Fe2+、Cd2+对酸性磷酸酶和碱性磷酸酶均有明显的激活作用,表明这几种金属离子可能会增强光棘球海胆体内基于磷酸酶的抑菌和吞噬等免疫应答活动。Cu2+除了在2.5 mmol/L时抑制酸性磷酸酶活力,在其他测试浓度下可增强光棘球海胆磷酸酶活力,表明适当浓度的Cu2+也可能会增强光棘球海胆磷酸酶系统的应答能力。二价金属离子对光棘球海胆磷酸酶的影响与对杂色鲍(Haliotisdiversicolor)和长毛明对虾中的结果差异巨大,而与仿刺参中的结果差异较小。在长毛明对虾中[13],Cu2+、Zn2+、Cd2+、Pb2+均明显抑制酸性磷酸酶活力,在杂色鲍中[26],Cu2+、Zn2+、Cd2+强烈抑制碱性磷酸酶活力,而在仿刺参中[10],Cu2+、Zn2+、Fe2+、Cd2+对酸性磷酸酶和碱性磷酸酶均有明显的激活作用,表明不同物种间二价金属离子对磷酸酶活力的影响特性可能与物种亲缘关系相关。
3.4 二价金属离子对光棘球海胆过氧化氢酶和超氧化物歧化酶活力的影响
在过氧化氢酶和超氧化物歧化酶活力检测中,Cu2+可同时增强光棘球海胆体腔液中过氧化氢酶和超氧化物歧化酶活力, Mn2+和Ca2+可增强超氧化物歧化酶活力而对过氧化氢酶活力无明显影响,表明Cu2+、Mn2+和Ca2+对光棘球海胆的抗氧化保护系统可能有促进作用。Cu2+对抗氧化系统的促进作用在翡翠贻贝(Pernaviridis)[27]和克氏原螯虾(Procambarusclarkii)[28]中也有报道,但在日本沼虾中[14],Cu2+对抗氧化系统起抑制作用。Fe2+和Pb2+对光棘球海胆体腔液中过氧化氢酶和超氧化物歧化酶活力均有抑制作用,Mg2+和Cd2+在多个浓度下抑制过氧化氢酶和超氧化物歧化酶活力,Zn2+对超氧化物歧化酶活力有抑制作用,表明上述几种金属离子可能会削弱光棘球海胆免疫系统的抗氧化能力。
3.5 二价金属离子对光棘球海胆酚氧化酶活力的影响
在酚氧化酶活力测定中,Cu2+和Fe2+对光棘球海胆体腔液中酚氧化酶有明显激活作用,Zn2+、Cd2+、Mg2+和Pb2+对体腔液中酚氧化酶有抑制作用,表明Cu2+和Fe2+可能会增强光棘球海胆体内酚氧化酶诱导的黑化凝集作用、促吞噬包埋作用和氧化杀伤作用,而Zn2+、Cd2+、Mg2+和Pb2+可能是光棘球海胆酚氧化酶应答系统的限制因子。无脊椎动物中的酚氧化酶通常为含铜的金属酶,其对底物的催化活动需要Cu2+的参与[29]。然而,Cu2+对酚氧化酶活力的影响在不同海洋无脊椎动物中并不一致。例如,在光棘球海胆,Cu2+对酚氧化酶有激活作用;在菲律宾蛤仔[16]、日本蟳(Charybdisjaponica)[29]和锯缘青蟹(Scyllaserrata)[30]中,Cu2+对酚氧化酶有抑制作用;在海湾扇贝中[15],Cu2+在低浓度时增强酚氧化酶活力,而在高浓度时抑制酚氧化酶活力。因此,无脊椎动物酚氧化酶的催化机制仍有待于进一步研究。
3.6 二价金属离子对光棘球海胆髓过氧化物酶活力的影响
在髓过氧化物酶活力测定中,Mn2+、Zn2+、Fe2+、Cd2+和Pb2+对光棘球海胆体腔液中的髓过氧化物酶有激活作用,而Ca2+明显抑制髓过氧化物酶活力,表明Mn2+、Zn2+、Fe2+、Cd2+和Pb2+可能会增强光棘球海胆髓过氧化物酶系统的杀菌、抑菌能力,而Ca2+可能会削弱光棘球海胆髓过氧化物酶系统的应答能力。此外,与酸性磷酸酶测试中的结果相似,Cu2+除了在2.5 mmol/L时抑制髓过氧化物酶活力,在其他测试浓度下可增强光棘球海胆磷酸酶活力。本研究结果表明适当浓度的Cu2+对光棘球海胆髓过氧化物酶系统可能会起促进作用。
3.7 小 结
综上所述可以得知,不同二价金属离子对不同免疫酶活力的影响不同。Mn2+可增强酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和髓过氧化物酶的活力,对过氧化氢酶和酚氧化酶活力无明显影响,表明Mn2+对提高光棘球海胆的免疫力可能是有益的;Cu2+可增强碱性磷酸酶、过氧化氢酶、超氧化物歧化酶和酚氧化酶的活力,并且在2.5 mmol/L以外的其他测试浓度下增强酸性磷酸酶和髓过氧化物酶活力,表明适当浓度的Cu2+对光棘球海胆的免疫力可能也有促进作用;Zn2+抑制超氧化物歧化酶和酚氧化酶活力,Fe2+抑制过氧化氢酶和超氧化物歧化酶活力,Ca2+抑制M酚氧化酶活力,Mg2+抑制碱性磷酸酶活力,Cd2+抑制超氧化物歧化酶和酚氧化酶活力,Pb2+抑制过氧化氢酶、超氧化物歧化酶和酚氧化酶活力,表明上述几种金属离子可能会削弱光棘球海胆的免疫应答能力。
[1] Ramírez-Gómez F, García-Arrarás J E. Echinoderm immunity[J]. Invertebrate Survival Journal, 2010, 7(2):211-220.
[2] 孟繁伊, 麦康森, 马洪明, 等. 棘皮动物免疫学研究进展[J]. 生物化学与生物物理进展, 2009, 36(7):803-809.
[3] Wang T T, Sun Y X, Jin L J, et al. Enhancement of non-specific immune response in sea cucumber (Apostichopusjaponicus) byAstragalusmembranaceusand and its polysaccharides[J]. Fish & Shellfish Immunology, 2009, 27(6):757-762.
[4] 刘洪展, 郑风荣, 孙修勤, 等. 亚硒酸钠对刺参免疫反应中体腔液酶活力的影响[J]. 水产学报, 2012, 36(1):98-105.
[5] 王方雨, 杨红生, 高菲, 等. 刺参体腔液几种免疫指标的周年变化[J]. 海洋科学, 2009,33(7):75-80.
[6] Lin T, Xing J, Jiang J, et al. β-glucan-stimulated activation of six enzymes in the haemocytes of the scallopChlamysfarreriat different water temperatures[J]. Aquaculture, 2011, 315(3/4):213-221.
[7] Holmblad T, Soderhall K. Cell adhesion molecules and antioxidative enzymes in a crustacean, possible role in immunity[J]. Aquaculture, 1999, 172(1/2):111-123.
[8] Pipe R K, Porter C, Livingstone D R. Antioxidant enzymes associated with the blood cells and hemolymph of the musselMytilusedulis[J]. Fish & Shellfish Immunology, 1994, 3(3):221-233.
[9] Zhao P C, Li J J, Wang Y, et al. Broad-spectrum antimicrobial activity of the reactive compounds generated in vitro byManducasextaphenoloxidase[J]. Insect Biochemistry and Molecular Biology, 2007, 37(9):952-959.
[10] Jiang J, Zhou Z, Dong Y, et al. The in vitro effects of divalent metal ions on the activities of immune-related enzymes in coelomic fluid from the sea cucumberApostichopusjaponicus[J]. Aquaculture Research, 2016, 47(4):1269-1276.
[11] 程菁恒, 朱蓓薇, 吴海涛, 等. 海参肠碱性磷酸酶的提取及粗酶的特性研究[J]. 大连工业大学学报, 2012, 31(2):83-87.
[12] 丁文君, 丁君, 孟凌峰. Cu(Ⅱ)对海胆免疫相关酶活性的影响及其在壳中蓄积量的研究[J]. 大连海洋大学学报, 2015, 30(2):165-168.
[13] 陈素丽, 陈清西, 丘文杰, 等. 金属离子对长毛对虾酸性磷酸酶的影响[J]. 台湾海峡, 1998, 17(1):96-99.
[14] Yao C L, Wang A L, Wang W N, et al.Purification and partial characterization of Mn superoxide dismutase from muscle tissue of the shrimpMacrobrachiumnipponense[J]. Aquaculture, 2004, 241(1/4):621-631.
[15] Jiang J W, Xing J,Sheng X Z, et al. Characterization of phenoloxidase from the bay scallopArgopectenirradians[J]. Journal of Shellfish Research, 2011, 30(2):273-277.
[16] 蒋经伟, 邢婧, 战文斌. 菲律宾蛤仔(Ruditapesphilippinarum)漆酶型酚氧化酶的纯化及特性分析[J]. 海洋与湖沼, 2012, 43(2):294-298.
[17] 李晓光, 刘东超, 白海锋, 等. 光棘球海胆与仿刺参混养技术初步探讨[J]. 水产养殖, 2014, 35(9):30-32.
[18] Gonzalez F, Esther F M, Arias J M, et al. Partial purification and biochemical properties of acid and alkaline phosphatases fromMyxococcuscoralloides[J]. Journal of Applied Bacteriology, 1994, 77(5):567-573.
[19] Jing X, Lin T, Zhan W. Variations of enzyme activities in the haemocytes of scallopChlamysfarreriafter infection with the acute virus necrobiotic virus (AVNV) [J]. Fish & Shellfish Immunology, 2008, 25(6):847-852.
[20] Beauchamp C, Fridovich I. Superoxide dismutase:improved assay and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 1971, 44(1):276-287.
[21] Soderhall K. Fungal cell wall β-1,3-glucans induce clotting and phenoloxidase attachment to foreign surfaces of crayfish haemocyte lysate[J]. Developmental and Comparative Immunology, 1981, 5(4):565-573.
[22] Hillegass L M, Griswold D E, Brickson B, et al. Assessment of myeloperoxidase activity in whole rat kidney[J]. Journal of Pharmacological Methods, 1990, 24(4):285-295.
[23] 张学辉, 陈爱华, 宋端阳. 沉积物中重金属的生物有效性研究综述[J]. 河北渔业, 2008(4):9-13.
[24] Looi L J, Aris A Z, Johari W L W, et al. Baseline metals pollution profile of tropical estuaries and coastal waters of the Straits of Malacca[J]. Marine Pollution Bulletin, 2013, 74(1):471-476.
[25] 赵同伟, 张兵, 吕文静, 等. 亚洲玉米螟酚氧化酶原的原核表达和性质分析[J]. 昆虫学报, 2014, 57(7):798-805.
[26] 廖金花, 陈巧, 林丽蓉, 等. 鲍鱼碱性磷酸酶的分离纯化和性质研究[J]. 厦门大学学报:自然科学版, 2005, 44(2):272-275.
[27] 林少琴, 兰瑞芳, 余萍, 等. 贻贝过氧化氢酶的纯化及部分性质[J]. 食品科学, 2000, 21(11):22-24.
[28] 李忠, 梁宏伟, 呼光富, 等. 克氏原螯虾(Procambarusclarkii)应急二价铜离子时超氧化物歧化酶和过氧化氢酶的变化[J]. 武汉大学学报:理学版, 2010, 56(1):115-119.
[29] Liu G X, Yang L L, Fan T J, et al. Purification and characterization of phenoloxidase from crabCharybdisjaponica[J]. Fish & Shellfish Immunology, 2006, 20(1):47-57.
[30] 潘清清, 钱冬, 刘问, 等. 锯缘青蟹血细胞酚氧化酶活力及主要影响因子[J]. 华中农业大学学报, 2008, 26(6):839-843.
EffectsofDivalentMetalIonsonActivitiesofImmune-relatedEnzymesinSeaUrchinStrongylocentrotusnudus
CHENG Yuhui1, JIANG Jingwei2, DONG Ying2, GAO Shan2, CHEN Zhong2, ZHOU Zunchun2
( 1. Dalian Ocean University, Dalian 116023, China; 2. Liaoning Ocean and Fisheries Science Research Institute, Dalian 116023, China )
In order to understand the effects of divalent metal ions on the activities of immune-related enzymes in sea urchinStrongylocentrotusnudus, the coelomic fluid of the sea urchin was incubated with Cu2+, Mn2+, Zn2+, Fe2+, Ca2+, Mg2+, Cd2+and Pb2+at different concentrations, respectively, and then the activities of acid phosphatase (ACP) and alkaline phosphatase (AKP), catalase (CAT), superoxide dismutase (SOD), phenoloxidase (PO) and myeloperoxidase (MPO) in the incubation mixture were determined with biochemical methods. The results showed that Cu2+led to increase the activities of AKP, CAT, SOD and PO; Mn2+enhanced the activities of ACP, AKP, CAT and MPO; Zn2+showed inhibitions on SOD and PO activities; Fe2+inhibited the activities of CAT and SOD; Ca2+inhibited the activities of ACP and MPO; Mg2+showed inhibition on AKP activities; Cd2+inhibited the activities of SOD and PO; Pb2+showed inhibitions on CAT, SOD and PO activities. The results implied that Mn2+and Cu2+promoted the immune-response capacity of the sea urchin at certain concentrations, while Fe2+, Zn2+, Ca2+, Mg2+, Pb2+and Cd2+might be harmful to the innate immune system in the sea urchin.
Strongylocentrotusnudus; coelomic fluid; divalent metal ion; immune-related enzyme
10.16378/j.cnki.1003-1111.2017.01.004
S968.9
A
1003-1111(2017)01-0022-07
2015-12-02;
2016-05-06.
辽宁省科技计划项目(2015103044);辽宁省农业领域青年科技创新人才培养计划项目(2015018);辽宁省海洋与渔业厅项目(201502).
程雨卉(1991-),女,硕士研究生;研究方向:棘皮动物免疫学. E-mail: 1132689854@qq.com. 通讯作者: 周遵春(1967-),男,研究员;研究方向:海洋生物技术.E-mail:zunchunz@hotmail.com.

