3种仿刺参养殖池塘底质特性的研究
刘 冉,吴 雪,王 琛,崔龙波
( 烟台大学 生命科学学院,山东 烟台 264005 )
3种仿刺参养殖池塘底质特性的研究
刘 冉,吴 雪,王 琛,崔龙波
( 烟台大学 生命科学学院,山东 烟台 264005 )
为研究3种仿刺参养殖池塘底质的特点,于2014年4—6月检测了砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥的粒度组成、7项理化指标及8类细菌数量特点。试验结果显示,3种池塘底质分别属于含砾泥质砂质底、粉砂质砂质底和砂质粉砂质底;底泥pH值波动均不大;氧化还原电位的变化范围分别为-336.83~-233.83 mV、-340.77~-310.30 mV和-380.66~-369.77 mV;硫化物含量分别为29.64~386.83 μg/g、47.6~507.50 μg/g和160.16~991.04 μg/g;砂质底池塘总氮、总磷、有机碳含量较少,泥沙质底总氮含量超标严重,泥质底总磷含量超标,且有机碳含量远高于其他两种底质池塘。3种底质池塘底泥中氨化细菌、反硝化细菌的数量均远高于亚硝化细菌的数量,还原性物质大量积累;泥沙质底池塘弧菌和硫还原细菌数量较多。结果表明,3种底质池塘底泥所存在的共性问题是底泥氧化还原电位偏低,硫化物含量较高;其差异性体现在砂质底池塘各指标波动较大,泥沙质底池塘总氮含量超标,有害细菌滋生,泥质底池塘底泥总磷含量超标,有机碳含量较高。
仿刺参;池塘;底质
仿刺参(Apostichopusjaponicus)是一种底栖生物,以摄入底泥中的营养物质为生。而底泥是海水中各种颗粒性物质的沉积地,同时又是水体各种溶解性物质的重要来源,因而底质的好坏对仿刺参的生长有着重要的影响。为此,本实验室曾对某一养殖区的仿刺参养殖池塘的底泥理化指标和细菌数量的变化规律进行了探讨[1]。然而,各地区地理环境的差异导致不同仿刺参养殖池塘的底质各不相同,主要有砂质底、泥沙质底和泥质底等类型。不同的底质类型对仿刺参池塘生态系统的结构和功能会产生重要影响,一方面,不同类型的底质适宜不同微生物的生长,使得不同底质池塘中的细菌组成及数量有着明显的差别,对底泥中营养物质的代谢途径也有所不同;另一方面,不同类型的底质其底泥的吸附能力和缓冲能力也存在差异,进而影响底泥或水体中生物可利用性营养的组成与含量,在一定程度上决定了细菌等生物的群落组成[2]。目前国内外学者主要探讨不同底质类型的湖泊、海洋等其底泥(沉积物)对水质或底质某些理化指标的影响[3,4]。然而,不同底质的仿刺参养殖池塘其底泥各自的特点,它们之间的共同点和差异,以及如何影响仿刺参的生长等问题,是笔者开展此项研究的出发点。笔者对山东省内分布的3种底质类型的仿刺参养殖池塘的底泥理化指标和细菌数量进行比较探讨,以期为科学调控仿刺参养殖环境提供依据,为后期研发适宜于不同底质池塘的改良剂提供方向。
1 材料与方法
1.1 试验池塘
分别对砂质底、泥沙质底和泥质底的仿刺参养殖池塘进行调查,其中砂质底和泥沙质底仿刺参养殖池塘位于山东省莱州市仿刺参养殖区内,砂质底池塘面积为2×104~3×104m2,水深1.8~2.0 m;泥沙质底池塘面积为5000~6000 m2,水深1.8~2.0 m;泥质底仿刺参养殖池塘位于山东省东营市仿刺参养殖区,池塘面积4×104~5×104m2,水深1.0~1.5 m。养殖用水均为海湾海水,池塘底部附着基为岩石、网片和地笼。3种底质的仿刺参养殖池塘均为2~3年塘,定期换水,其中砂质底和泥沙质底池塘定期投喂饵料,而泥质底池塘不投饵。
1.2 样品采集
于2014年4—6月(仿刺参活动旺盛期),每月初采样1次,每种底质调查3个池塘,每个池塘设5个采样点。使用Ekman-Binge/Lenz采泥器(德国HYDRO-BIOS公司)采集距表层0~2 cm的底泥,取适量底泥用于理化指标及细菌数量的测定。
1.3 理化指标的检测
检测底泥粒度组成、pH、氧化还原电位、硫化物、有机碳、总氮、总磷和阳离子交换量。粒度组成采用筛分法和激光粒度分布仪检测[5],底泥pH和氧化还原电位采用美国奥力龙5-star水质分析仪现场检测,硫化物、有机碳、总氮、总磷的检测方法参照海洋监测规范[6]。阳离子交换量采用EDTA-铵盐快速法检测[7]。
1.4 细菌的检测
检测底泥中异养细菌、芽孢杆菌(Bacillus)、弧菌(Vibrio)、氨化细菌、反硝化细菌、亚硝化细菌、硫氧化细菌和硫还原细菌的数量。培养基配方、细菌稀释及检测方法参照水生微生物学试验法[8]。异养细菌、芽孢杆菌及弧菌计数采用平板计数法,氨化细菌、反硝化细菌、亚硝化细菌、硫氧化细菌和硫还原细菌计数采用稀释培养计数法。
1.5 数据处理
运用Excel进行数据统计,采用IBM SPSS Statistics 19软件进行相关性分析。
2 结果与分析
2.1 3种底质仿刺参养殖池塘底泥的粒度组成
采用国际上应用较广的尤登—温德华粒度分级方案,即砾(>2 mm)、砂(2~0.063 mm)、粉砂(0.063~0.0039 mm)和黏土(<0.0039 mm),对从山东莱州和东营采集的3种仿刺参养殖池塘底泥进行粒度分析。经筛分和激光粒度分布仪检测,砂质底仿刺参养殖池塘底泥的粒度组成为:砾石27.28%,砂64.94%,粉砂6.26%,黏土1.49%;泥沙质底仿刺参养殖池塘底泥的粒度组成为:砂69.68%,粉砂23.85%,黏土6.46%;泥质底仿刺参养殖池塘底泥的粒度组成为:砂15.76%,粉砂72.21%,黏土12.02%。采用Fork(福克)沉积物三角粒度图对仿刺参养殖池塘底泥进行系统命名[9],试验所检测的砂质底仿刺参养殖池塘的底质为含砾泥质砂;泥沙质仿刺参养殖池塘的底质为粉砂质砂;泥质底仿刺参养殖池塘的底质为砂质粉砂。
2.2 3种底质仿刺参养殖池塘底泥理化指标的变化
2.2.1 3种底质仿刺参养殖池塘pH和氧化还原电位的变化
砂质底、泥沙质底和泥质底仿刺参养殖池塘pH值在4、5、6月分别为7.51~7.80、7.32~7.57和7.40~7.51,3种底质池塘底泥pH值的波动均不大(图1a);氧化还原电位均为负值,在4、5、6月分别为-336.83~-233.83 mV、-340.77~-310.30 mV和-380.66~-369.77 mV(图1b)。


图1 养殖池塘底泥pH和氧化还原电位的变化
2.2.2 3种底质仿刺参养殖池塘底泥中硫化物含量的变化
砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥中硫化物含量在4、5、6月分别为29.64~386.83 μg/g、47.66~507.50 μg/g和160.16~991.04 μg/g。泥沙质底和泥质底池塘底泥硫化物含量不断上升,说明底泥硫化物不断积累。砂质底池塘底泥硫化物含量相对较低,但波动较大,这可能与砂质底池塘底泥颗粒较大,对硫化物的吸附能力较弱有关。泥质底池塘底泥硫化物含量一直处于较高水平(图2)。
相关性分析发现,泥沙质底池塘底泥中硫化物的含量分别与硫还原细菌、反硝化细菌和亚硝化细菌的数量呈极显著正相关,与底泥中总磷含量和氨化细菌数量呈显著正相关,这与么宗利等[10-11]的研究基本一致;而泥质底池塘底泥中硫化物含量仅与底泥中有机碳含量呈显著正相关;砂质底池塘底泥硫化物含量未与任何其他指标发生显著的相关性。

图2 养殖池塘底泥硫化物的变化
2.2.3 3种底质仿刺参养殖池塘底泥中有机碳、总氮和总磷含量的变化
砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥有机碳含量在4、5、6月分别为0.15%~0.28%、0.29%~0.37%和0.45%~0.53%(图3a);总氮含量分别为0.161~0.249 mg/g、0.483~0.682 mg/g和0.354~0.403 mg/g(图3b);总磷含量分别为0.116~0.407 mg/g、0.178~0.231 mg/g和0.160~0.723 mg/g(图3c)。



图3 养殖池塘底泥有机碳、总氮和总磷的变化
泥沙质底仿刺参养殖池塘底泥总氮含量最高,这可能与养殖户的投饵有关。泥质底仿刺参养殖池塘总磷和有机碳含量均远高于其他两种底质池塘,这可能与泥质底池塘底泥颗粒最小,底泥吸附能力较强有关。另外泥质底池塘所在位置位于黄河入海口附近,黄河水中带来的大量有机物和营养盐,可能也是造成其底泥中有机碳和总磷含量远高于其他两种底质池塘的原因。
2.2.4 3种底质仿刺参养殖池塘底泥阳离子交换量的变化
砂质底、泥沙质底、泥质底仿刺参养殖池塘底泥阳离子交换量在4、5、6月分别为0.30~1.88 cmol/kg、4.69~8.11 cmol/kg、8.57~18.45 cmol/kg(图4)。泥质底池塘底泥阳离子交换量最大,而砂质底池塘底泥阳离子交换量最小,缓冲能力也就最小。这主要是由于底泥阳离子交换量的大小受底泥粒度组成和有机质含量的影响,粒度越细,有机物含量越多底泥阳离子交换量也就越大。

图4 养殖池塘底泥阳离子交换量的变化
2.3 3种底质仿刺参养殖池塘底泥中细菌数量的变化
2.3.1 3种底质仿刺参养殖池塘底泥中异养细菌、弧菌及芽孢杆菌数量的变化
砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥中异养细菌密度在4、5、6月分别为8.92×104~2.27×106cfu/g、6.70×105~1.34×106cfu/g和4.68×104~1.29×105cfu/g;弧菌密度分别为3.32×103~4.43×103cfu/g、4.40×104~8.54×104cfu/g和1.52×102~1.77×103cfu/g;芽孢杆菌密度分别为2.87×103~6.15×104cfu/g、1.40×104~3.00×104cfu/g和2.85×103~1.10×104cfu/g(图5)。
泥沙质底仿刺参养殖池塘中弧菌数量远高于其他两种底质的仿刺参养殖池塘,且弧菌占异养细菌的比例可达8.92%。弧菌是条件致病菌,与仿刺参的多种疾病有关,池塘中弧菌数量越高,仿刺参患病的几率也就越大,因而应加强对泥沙质底池塘的防范。砂质底池塘底泥异养细菌数量在5月份出现骤减,这提示我们池塘环境可能发生了剧烈变化,影响异养细菌生长。



图5 养殖池塘底泥异养细菌、弧菌及芽孢杆菌的数量变化
2.3.2 3种底质仿刺参养殖池塘底泥中氮循环细菌数量的变化
在砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥中,4、5、6月份氨化细菌密度分别为1.00×106~1.01×107cfu/g、1.10×106~3.30×106cfu/g和1.57×106~4.97×106cfu/g;反硝化细菌密度分别为1.63×102~1.95×104cfu/g、1.34×104~1.16×105cfu/g和1.73×103~2.02×104cfu/g;亚硝化细菌密度分别为3.00×101~6.50×101cfu/g、6.90×102~1.70×103cfu/g和2.17×101~4.07×102cfu/g(图6)。3种底质仿刺参养殖池塘氨化细菌和反硝化细菌密度均远大于亚硝化细菌的密度,使得还原性物质大量积累。


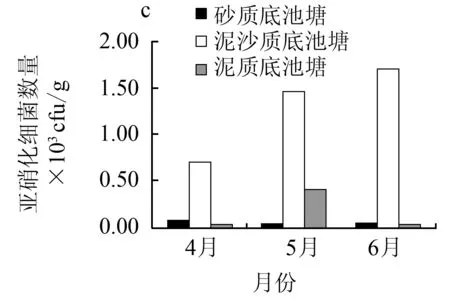
图6 养殖池塘底泥氨化细菌、反硝化细菌及亚硝化细菌数量的变化
2.3.3 3种底质仿刺参养殖池塘底泥中硫循环细菌数量的变化
砂质底、泥沙质底和泥质底仿刺参养殖池塘底泥中硫氧化细菌密度在4、5、6月分别为5.50×102~1.40×104cfu/g、4.00×101~8.50×101cfu/g和1.88×103~3.80×103cfu/g;硫还原细菌密度分别为1.83×103~2.65×104cfu/g、1.50×104~7.22×104cfu/g和1.30×103~4.67×104cfu/g(图7),底泥中硫还原细菌的密度均出现了增长。


图7 养殖池塘底泥硫氧化细菌和硫还原细菌数量的变化
泥沙质底仿刺参养殖池塘中硫氧化细菌的数量远低于其他两种池塘,而硫还原细菌的数量远大于其他两种底质的仿刺参养殖池塘,可以预见该池塘底泥中的硫化物将会大量积累,这与该池塘底泥中硫化物的变化趋势相同。5月份砂质底仿刺参养殖池塘底泥中硫氧化细菌大幅下降,这可能与该池塘底泥硫化物在5月份增高有关,硫化物大量积累,对硫氧化细菌产生抑制作用。
3 讨 论
3.1 3种底质类型养殖池塘底泥物理性质特点
3种底质的仿刺参养殖池塘其底泥粒度组成有所不同,砂质底池塘底泥主要以砂砾为主,泥沙质池塘底泥主要以砂为主,而泥质底池塘底泥主要以粉砂为主。3种底质类型的底泥具有不同的物理性质,砂质底池塘底泥粒度最大,底泥颗粒间的孔隙度最大,底泥的通透性就相对较好,含氧量较高,但底质结构易发生变化;而泥质底池塘底泥粒度最小,底泥颗粒间的孔隙度也最小,气体交换的条件就相对较差,但底质结构相对稳定[12]。
3.2 3种底质仿刺参养殖池塘底泥化学性质特点
3种底质仿刺参养殖池塘底泥化学性质存在许多共同特点,底泥氧化还原电位均随时间呈下降趋势,且均处于高度还原化状态(Chien等[13]指出,当底泥氧化还原电位小于-100 mV时,底质环境即处于高度还原化状态)。底泥长期处于还原化状态会促进还原性细菌的生长,消耗水中大量氧气,使得还原性物质大量积累,从而进一步降低底泥氧化还原电位,形成恶性循环,使养殖池塘底部长期处于缺氧状态,威胁仿刺参的生长。调查期间大部分池塘底泥硫化物的含量均超过海洋沉积物质质量第一类标准(300 μg/g)[14],硫化物污染严重。本研究还发现,3种底质的仿刺参养殖池塘底泥中硫化物的含量均随时间推移呈上升趋势,这与对乳山湾及虾贝养殖池塘的调查结果一致[15-16]。沉积物中的硫化物主要来源于硫还原细菌对硫酸盐的还原作用,随着水温的升高,细菌代谢增强,消耗大量氧气,使得底泥处于缺氧环境,氧化还原电位降低,处于还原状态的底泥促进硫还原细菌的还原作用,而硫化物的产生反过来又进一步降低底泥氧化还原电位[17]。本次调查的3种底质仿刺参养殖池塘的底泥有机碳含量均小于沉积物主要污染物评价标准规定的3%[18],均未超标,且低于王岩等[19]报道的罗非鱼与对虾混养的海水围隔底泥有机碳的含量(0.40%~1.48%),这可能与仿刺参的沉积食性有关,仿刺参对底泥中有机物的扫食可促进底泥有机物的再利用,从而降低底泥有机碳的含量[20]。
3种底质的仿刺参养殖池塘底泥化学性质也存在诸多差异。泥质底仿刺参养殖池塘底泥硫化物含量远高于其他两种底质的池塘,砂质底池塘硫化物含量波动较大。相关性分析发现,泥质底池塘中底泥硫化物的含量仅与底泥有机碳含量呈显著正相关,说明其底泥硫化物的含量主要受底泥中较高含量的有机碳的影响,较多有机质的存在为微生物提供了必要生存条件,在有氧条件下,底泥中的有机物被好氧细菌降解,消耗氧气,降低氧化还原电位,从而产生较多的硫化物;而在缺氧条件下,硫还原细菌等还原性细菌消耗有机物,产生硫化氢等还原性物质,氧化还原电位进一步降低;泥沙质底池塘底泥中硫化物的含量与底泥中多个理化指标表现出显著或极显著的相关性,说明该种底质的底泥中硫化物含量的变化受多种因素的综合影响;而在砂质底池塘由于其底泥粒度较大,底泥缓冲能力较弱,极易受外界因素的干扰,底泥中硫化物的含量也随之出现波动,因而未能与其他指标产生强烈的联系。另外根据沉积物主要污染物评价标准(总氮含量<0.55 mg/g,总磷含量<0.60 mg/g,有机质含量<3%)[18]可以看出,所调查的3种底质的仿刺参养殖池塘中,泥沙质底池塘底泥的总氮含量超标,泥质底池塘底泥的总磷含量超标。泥质底仿刺参养殖池塘底泥总磷、有机碳含量均明显高于其他两种池塘,总氮含量也相对较高,这可能与该池塘底泥颗粒最细,底泥吸附能力较强,对营养盐的释放量较小有关[21-22],随着养殖的进行,其受内源性污染的风险也更大[23]。养殖期间,泥沙质底池塘大量投喂饵料,而泥质底池塘并未投饵,这可能是造成前者底泥虽然不及后者底泥颗粒细,但底泥总氮含量却远高于后者,并出现超标现象的主要原因。
3.3 3种底质仿刺参养殖池塘底泥中细菌数量的特点
熊千龄[24]认为底泥颗粒越小,其中含有的营养物质也就越丰富,能为更多的细菌生长提供能量,因此泥土底质中的细菌数量一般高于沙土底质。然而笔者调查发现,尽管泥沙质池塘底泥中细菌数量较砂质底仿刺参养殖池塘多,但泥质底池塘中异养细菌和弧菌数量却较少,这可能是由于泥质底池塘底泥颗粒太细,氧气不易进入,而异养细菌和弧菌的生长代谢需要氧气,因而异养细菌和弧菌的生长受到抑制。另外,该种底质的池塘在本次调查前夕刚刚对底质进行了改良,在一定程度上也降低了底泥中异养细菌和弧菌的数量。3种池塘中弧菌数量均与芽孢杆菌数量的变化趋势相反,这与李烁寒等[25]的研究相一致。有研究指出,芽孢杆菌能产生多种抗菌物质,能够抑制弧菌的生长[26]。而弧菌是条件致病菌,与仿刺参的发病有关,芽孢杆菌与弧菌的这一拮抗关系,为生态防治池塘中弧菌的增殖提供了一条思路。
4 结 论
3种底质养殖池塘的底质存在共同的问题:池塘底泥氧化还原电位均较低,处于高度还原化状态,硫化物含量较高,还原性细菌大量滋生。与此同时也存在差异:砂质底仿刺参养殖池塘底泥粒径较大,底泥中总氮、总磷及有机碳的含量均较低,硫化物含量波动较大,池塘环境不稳定;泥沙质底仿刺参养殖池塘底泥中总氮含量超标,底泥硫还原细菌及弧菌数量较高;而泥质底仿刺参养殖池塘底泥中较高的有机碳含量是引起其底泥硫化物含量较高的重要原因,同时其底泥中总磷含量超标。不同底质类型的仿刺参养殖池塘具有其特有的性质,可根据其底质特点开发有针对性的底质改良剂,提高养殖效率。
[1] 迟爽,刘海军,刘冉,等.刺参养殖池塘底泥理化指标和细菌数量变化的检测[J].渔业科学进展,2014,35(1):111-117.
[2] 刘华丽,曹秀云,宋春雷,等.水产养殖池塘沉积物有机质富集的环境效应与修复策略[J].水生态学杂志,2011,32(6):130-134.
[3] 王圣瑞,何宗健,赵海超,等.洱海表层沉积物中总氮含量及氨氮的释放特征[J].环境科学研究,2013,26(3):256-261.
[4] Andrieux-Loyer F,Aminot A.Phosphorus forms related to sediment grain size and geochemical characteristics in French coastal areas [J].Estuarine, Coast and Shelf Science,2001,52(5):617-629.
[5] 国家海洋局908专项办公室.海洋底质调查技术规程[M].北京:海洋出版社,2006:5-7.
[6] 中华人民共和国国家质量监督检验检疫总局.GB 17378.5—2007,海洋监测规范[S].北京:中国标准出版社,2007.
[7] 包农建,团良.EDTA-铵盐快速法测定土壤中阳离子方法探讨[J].北方环境,2012,25(3):156-158.
[8] 陈绍铭,郑福寿.水生微生物学实验法[M].北京:海洋出版社,1985:1-252.
[9] 赵东波.常用沉积物粒度分类命名方法探讨[J].海洋地质动态,2009,25(8):41-46.
[10] 么宗利,周凯,罗璋,等.盐碱地养虾池塘养殖期间细菌组成分析[J].华中农业大学学报,2011,30(2):225-228.
[11] 李秋芬,姜娓娓,刘淮德,等.刺参(Apostichopusjaponicus)养殖环境中可培养细菌与理化参数的动态及其相关性分析[J].应用与环境生物学报,2014,20(3):544-550.
[12] 余友茂.滩涂底质与贝类养殖关系的探讨[J].福建水产,1986(3):56-62.
[13] Chien Y H.Study on the sediment chemistry of tiger prawn, kuruma prawn and red tail prawn ponds in I-Lan Hsien [J].Council of Agriculture Fisheries Series,1989(16):257-275.
[14] 中华人民共和国国家质量监督检验检疫总局.GB 18668—2002,海洋沉积物质量[S].北京:中国标准出版社,2002.
[15] 王娟娟,李晓敏,曲克明,等.乳山湾底质中硫化物和氧化—还原电位的分布与变化[J].海洋水产研究,2006,27(6):64-70.
[16] 彭斌.虾贝混养池塘养殖环境中底质硫化物的研究[J].现代农业科技,2008(9):172-174.
[17] 吴金浩,刘桂英,王年斌,等.辽东湾北部海域表层沉积物氧化还原电位及其主要影响因素[J].沉积学报,2012,30(2):333-339.
[18] 辛福言,崔毅,陈聚法,等.乳山湾表层沉积物质量现状及其评价[J].海洋水产研究,2004,25(6):42-46.
[19] 王岩,齐振雄.不同养殖方式对海水实验围隔底泥中氮、磷和有机碳含量的影响[J].海洋科学,1999(4):1-3.
[20] 杨红生,周毅,王健,等.烟台四十里湾栉孔扇贝、海带和刺参负荷力的模拟测定[J].中国水产科学,2001,7(4):27-31.
[21] 吴俊峰,谢飞,陈丽娜,等.太湖重污染湖区底泥沉积物特征[J].水资源保护,2011,27(4):74-78.
[22] 熊林芳,石学法,邓煜,等.南黄海、东海北部陆架区表层沉积物有机质分布特征[J].海洋通报,2013,32(3):281-286.
[23] 李永进.深圳水库泥沙淤积对水质的影响及其对策[J].中国农村水利水电,2002(11):74-76.
[24] 熊千龄.利用PCR-DGGE研究军曹鱼肠道和水环境的细菌群落[D].广州:中山大学,2006.
[25] 李烁寒.不同对虾养殖模式细菌数量动态与环境变化的比较[D].广州:暨南大学,2009.
[26] 苏浩,刘明泰,鲍相渤,等.芽孢杆菌对弧菌的抑制作用及其应用[J].水产科学,2010,29(7):412-415.
CharacteristicsinSeaCucumberApostichopusjaponicusCulturePondswithThreeDifferentSediments
LIU Ran, WU Xue, WANG Chen, CUI Longbo
( College of Life Science, Yantai University, Yantai 264005,China )
In order to study the sedimentary characteristics of sandy, sedimentary and silty substrate culture ponds for sea cucumberApostichopusjaponicus, size class of sediment, 7 physiochemical indices and numbers of 8 classes of bacteria were tested from April to June in 2014. The results showed that sedimentary types of the three different sedimentary ponds were pebbly muddy sand, silty sand and sandy silt, respectively. The pH values of sediments changed, and the variation ranges of redox potential were -336.83—-233.83 mV, -340.77—-310.30 mV and -380.66—-369.77 mV, respectively. The variation ranges of sulfide content were 29.64—386.83 μg/g, 47.6—507.50 μg/g and 160.16—-991.04 μg/g, respectively. The contents of total nitrogen, total phosphorus and organic carbon were the least in sediments of sandy substrate ponds, the total nitrogen content of sediments was overproof greatly in sedimentary substrate ponds, the total phosphorus content of sediments was overproof in sandy substrate ponds, and the organic carbon content was higher than those in the other ponds. The numbers of ammoniated bacteria and denitrifying bacteria in the three types of ponds were much higher than those of bacterial nitrification, which led to an accumulation of reducing substances. The numbers of sulfur-reducing bacteria were much higher than those of sulfur-oxidizing bacteria in sedimentary substrate ponds, indicating that sulfide was accumulated. The findings indicated that the common problems of the three types of ponds were the facts that the redox potential was low and the sulfide content was high. Meanwhile, there were some differences among groups, with great fluctuation in indices in sandy substrate ponds, and the total nitrogen content of sediment was overproof seriously and harmful bacterias bred in sedimentary substrate ponds. The total phosphorus content was overproof and the content organic matter was rather high in sediments of sandy substrate ponds.
Apostichopusjaponicus; pond; sediment
10.16378/j.cnki.1003-1111.2017.01.005
S912
A
1003-1111(2017)01-0029-07
2015-12-10;
2016-03-14.
山东省科技发展计划项目(2014GSF117010);烟台大学研究生科技创新基金资助项目(YJSY201417).
刘冉(1988—),女,硕士研究生;研究方向:海洋动物细胞学. E-mail:734581413@163.com. 通讯作者:崔龙波(1962—),男,教授,博士,硕士生导师;研究方向:海洋动物细胞学. E-mail:lbcui@163.com.
——以加拿大麦凯河油砂储集层为例

