斜带石斑鱼生长激素基因重组蛋白的发酵
吕晴霁,潘忠超,,石和荣,杨慧荣,王树启,赵会宏
( 1.华南农业大学 动物科学学院,广东 广州 510642; 2.汕头大学 广东省海洋生物技术重点实验室,广东 汕头 515063; 3.广东海大畜牧兽医研究院有限公司,广东 广州510630 )
斜带石斑鱼生长激素基因重组蛋白的发酵
吕晴霁1,潘忠超1,3,石和荣3,杨慧荣1,王树启2,赵会宏1
( 1.华南农业大学 动物科学学院,广东 广州 510642; 2.汕头大学 广东省海洋生物技术重点实验室,广东 汕头 515063; 3.广东海大畜牧兽医研究院有限公司,广东 广州510630 )
将含有石斑鱼生长激素基因的毕赤酵母X33进行震荡培养后,装入≥50 L的自控罐中,28~30.5 ℃、pH 5.5~6.0、溶解氧≥30 mg/L条件下发酵84 h,生产石斑鱼生长激素基因重组蛋白。发酵期间,通过甲醇诱导毕赤酵母获得目的蛋白的高效表达,最后通过Western Blot和SDS-PAGE聚丙酰胺凝胶电泳对目的蛋白进行定性定量检测。最终获得目的蛋白表达量约为1.5~2.0 g/L,约占胞外可溶性总蛋白的16.4%。本试验用自控罐发酵生产含有斜带石斑鱼生长激素基因重组蛋白的毕赤酵母生产工艺,为实现工业化生产鱼类生长激素饵料添加剂奠定基础。
斜带石斑鱼;生长激素基因重组蛋白;毕赤酵母;发酵
斜带石斑鱼(Epinepheluscoioides)是我国南部沿海地区以及东南亚地区重要的海水养殖鱼类。硬骨鱼类生长激素是垂体细胞分泌的一种多功能激素,参与代谢、生长、发育、繁殖和渗透压调节等生理过程,可以增加鱼食欲,提高饲料转化率。研究发现,外源生长激素给入鱼体后能明显促进鱼类的生长[1-5]。但是,天然的生长激素难以获得,且分离纯化成本高,不适合在水产养殖中应用。重组的生长激素具有天然生长激素的生物活性,利用基因重组技术生产鱼类生长激素能够解决外源激素的来源问题,为鱼类养殖业的快速发展开辟新途径。
20世纪30年代以来,已克隆了40多种鱼类的生长激素基因及其DNA,鱼类生长激素基因工程研究取得了一系列重要进展。在原核表达方面,Sekine等[6]从脑垂体的cDNA文库中克隆得到了大麻哈鱼(Oncorhynchusketa)生长激素的cDNA,并在大肠杆菌(Escherichiacoli)中表达。Fine等[7]在大肠杆菌中表达了鲤鱼(Cyprinuscarpio)的生长激素,发现在表达过程中形成了包含体。Ben-Atia等[8]在大肠杆菌中表达了金鲷(Sparusaurata)的生长激素,通过口服和腹腔注射的方式处理金鲷,均能显著地促进金鲷的生长。露斯塔野鲮(Labeorohita)[9],点斑蓝子鱼(Siganusguttatus)[10]的生长激素都在大肠杆菌中得到有效的表达。Zang等[3]用集胞藻(Synechocystissp.) PCC6803作为宿主,成功表达了褐牙鲆(Paralichthysolivaceus)的生长激素。真核表达系统与原核表达系统比较,具有很大的优越性,例如能对蛋白进行糖基化,磷酸化的翻译后修饰,正确形成二硫键,帮助蛋白折叠成正确的构象,进行高密度发酵(酵母细胞)等。Piyaviriyakul等[11]将鲇鱼(Silurusasotus)生长激素在酿酒酵母(Saccharomycescerevisiae)胞内重组表达。Acosta等[2]在毕赤酵母(Pichiapastoris)中表达了红罗非鱼(Oreochromisaureus×O.niloticus)和鲤鱼的生长激素,并发现生长激素在酵母中重组表达时C-端缺失46个氨基酸残基同样具有生物学活性,其培养液中的上清液不仅能促生长,还能有效提高罗非鱼的非特异性免疫功能。近些年,美国FDA认为毕赤酵母为安全微生物,为其在食品和医药上的应用铺平了道路[12]。
本文通过振荡和自控罐发酵含有斜带石斑鱼生长激素基因重组蛋白的酵母,获得高效发酵的条件,以期为指导生产实践提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
含斜带石斑鱼生长激素基因的毕赤酵母工程菌,由中山大学水生经济动物研究所构建,本实验室保存。
1.1.2 试剂及仪器
Peptone,Yeast Extract(Oxioid LTR.有限公司);Zeocin[Invitrogen(USA)公司];预染蛋白Marker[MBI Fermentas(USA)公司];二喹啉甲酸蛋白定量试剂盒(北京百泰克公司产品);TEMED和AP[Bio-Rad(USA)公司],2×SDS-PAGE Loading Buffer[威佳科技(广州)有限公司产品];其他试剂均为国产分析纯。
INFORSAGCH-4103控温摇床,Thermo Forma超净台,BECKMAN Avanti J-30I离心机,TOMYSS-325灭菌锅,50 L自动控制发酵罐(中国台湾Biotop Process & Equipment公司的BTF-B型号)。
1.1.3 酵母浸出粉胨葡萄糖琼脂培养基
液体(g/L):酵母粉10,蛋白胨10,葡萄糖20;固体(g/L):酵母粉10,蛋白胨10,葡萄糖20,琼脂粉15。
1.1.4 改良基本盐培养基
成分(按1 L计,百分比为各成分占发酵培养基总量的质量百分比):硫酸铵0.5%,磷酸二氢钾0.5%,七水硫酸镁0.4%,硫酸钾0.4%,二水氯化钙0.02%,消泡剂0.03%,甘油2%。高压后每升加4.35 mL微量元素(PTM1)。
1.1.5 营养盐培养基
成分(按1 L计,百分比为各成分占发酵培养基总量的质量百分比):硫酸铵10%,磷酸二氢钾10%,七水硫酸镁7%。高压灭菌。
1.1.6 PTM1
成分:五水硫酸铜6.0 g/L,碘化钠0.08 g/L,一水硫酸锰3.0 g/L,二水钼酸钠0.2 g/L,硼酸0.02 g/L,氯化钴0.5 g/L,氯化锌20.0 g/L,七水硫酸亚铁65.0 g/L,硫酸5.0 mL。
1.2 方法
1.2.1 菌种的保存与扩大培养
斜带石斑鱼生长激素基因酵母工程菌在酵母浸出粉胨葡萄糖琼脂培养基中(1%酵母膏,2%蛋白胨,2%葡萄糖),于28 ℃,150 r/min振荡培养至菌体质量浓度为5.5 g/L,加15%灭菌甘油,-70 ℃冷冻保存。还可将冷冻保存的菌种在酵母浸出粉胨葡萄糖琼脂培养基固体平板上划线,28 ℃温箱中培养3 d后于4 ℃冰箱中保存3个月。
挑取酵母浸出粉胨葡萄糖琼脂培养基固体平板上的酵母工程菌单个菌落于酵母浸出粉胨葡萄糖琼脂液体培养基中,30 ℃,180 r/min振荡培养至菌体湿质量为5.5 g/L,用作振荡发酵及自控罐发酵的种子。
1.2.2 摇瓶发酵
将2%种子液接种于酵母浸出粉胨葡萄糖琼脂培养液中,28 ℃,180 r/min振荡培养至菌体质量浓度为5.5 g/L。然后每隔24 h向振荡瓶中加入0.5%的甲醇,28 ℃,180 r/min继续培养诱导3 d,离心取上清液。
1.2.3 自控罐发酵
检查自控罐及其相关设备,确保自控罐安全正常工作;然后加入25 L发酵改良培养基,灭菌;灭菌后待培养基冷却到接种温度后,接入种子液1.5 L,设置发酵温度30 ℃,pH 6.0,溶解氧35%,转速200 r/min,开始发酵。在发酵过程中适时补加营养盐培养基、发酵微量元素、甘油,开始诱导时加入甲醇。发酵过程中每隔一段时间记录日期、时间、pH、溶解氧、温度、菌种湿质量及保种、补料情况,并取样品,保存于4 ℃冰柜中。
1.2.4 湿质量检测与测定
取大小相同的4个1.5 mL的离心管,称量质量,然后再取发酵液各1 mL,13 000 r/min,离心5 min,弃上清液,称量沉淀,减去初始质量,取平均值,即为当前时段酵母发酵的湿质量。
用二喹啉甲酸蛋白含量试剂盒测定总蛋白含量。用三氯乙酸法沉淀上清蛋白。用蛋白质印迹法鉴定目的蛋白。
1.2.5 SDS-PAGE电泳
将酵母表达上清加电泳缓冲液后跑12%SDS-PAGE蛋白电泳,低分子量标准蛋白作Maker。染色、脱色后,拍照,然后用Quantity-one软件分析蛋白含量。
2 结果与分析
2.1 自控罐发酵
2.1.1 发酵诱导前后发酵液温度和pH变化
发酵试验结束后,发酵过程中的温度和pH变化见图1。由图1可知,14 h是诱导时间点,甲醇诱导之前,最高温度为30.2 ℃,最低为29.4 ℃,最大pH为6.08,最小为5.88;诱导后直到76 h放罐,最高温度为30.9 ℃,最低为29.1 ℃,最大pH为6.68,最小为5.74。这说明在诱导前后温度及pH变化结果不大,且温度29.1~30.9 ℃,pH 5.74~6.68,有利于发酵正常进行。

图1 诱导前后发酵液温度和pH的变化
2.1.2 诱导前后发酵液溶解氧的变化
诱导前后溶解氧的波动较大,诱导之前溶解氧最大值为92.1 mg/L,最小值为63.2 mg/L;诱导之后溶解氧开始上升,最大值123.6 mg/L,然后逐渐降低,呈S型曲线变化,32 h时降至最低值20.75 mg/L,其余均在27 mg/L以上。这说明前期溶解氧越高越好,到后期菌种变多,溶解氧最好控制在27 mg/L以上,这样能获得更多的目的蛋白,保持菌种的正常生长(图2)。

图2 诱导前后溶解氧的变化
2.1.3 诱导前后菌体湿质量的变化
发酵期间每隔2 h收集菌液,测菌体湿质量,直至发酵结束。整个过程菌体湿质量变化见图3。由图3可知,整个发酵过程湿质量一直升高,14 h达15 g,此时开始诱导,直到最后72 h时达最大值59.75 g,接着开始呈下降趋势,于76 h时放罐。这与微生物的生长曲线一致,先是调整期,接着为快速生长期,最后为稳定期,当开始下降时,说明菌体开始衰老,为节省成本和获得最大的目的蛋白,应及时放罐。
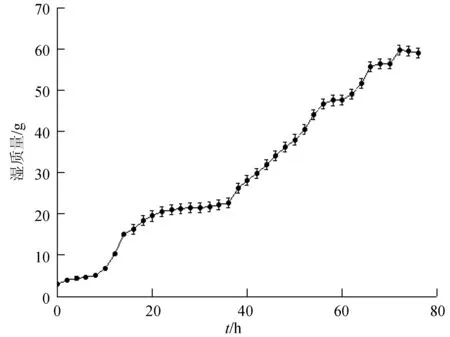
图3 诱导前后菌体湿质量的变化
2.2 重组蛋白的Western Blot鉴定
发酵后上清液的SDS-PAGE电泳见图4。对黑鲷(Acanthopagrusschlegeli)生长激素特异性抗体的Western Blot检测,发现有阳性条带,其大小与SDS-PAGE中的特异性条带相符合,而阴性对照无此条带(图5),表明在检测的发酵上清液中均表达了斜带石斑鱼的重组生长激素,具有免疫活性。

图4 发酵后上清液的SDS-PAGE电泳
1:Marker;2、3:空载酵母发酵上清液;4、5:放罐时的上清液; 6、7:诱导前的发酵上清液.

图5 甲醇诱导表达24 h后上清总蛋白Western Blot 分析
M:蛋白分子量标准;N:空载pPICZαA阴性对照;1:诱导12 h的上清蛋白;2:诱导24 h的上清蛋白.
2.3 蛋白质量浓度的测定以及目的蛋白表达量的估算
采用二喹啉甲酸比色法,测定标准蛋白的吸光度A562,用Excel软件以标准牛血清蛋白质量浓度为横坐标,各质量浓度标准牛血清蛋白在562 nm波长的吸收值为纵坐标绘制标准曲线(图6)。由图6可知,蛋白质量浓度与吸光度A562呈线性关系,说明此标准曲线可信。将蛋白样品稀释10倍和100倍进行反应,根据软件生成的方程计算出样品蛋白的蛋白质量浓度。根据软件GeneTools from SynGene (Bio-Rad,USA)分析SDS-PAGE 图谱的结果和蛋白定量的结果,估算出重组生长激素约占胞内总蛋白的16.4%,表达量约为1.5~2.0 g/L。

图6 二喹啉甲酸比色法测定蛋白质量浓度的标准曲线
2.4 发酵上清液目的蛋白表达量随时间的变化
发酵过程中每隔2 h取一次上清液,放于冰箱-20 ℃保存,最后选取部分上清液进行SDS-PAGE电泳(图7)。由图7可知,随着时间的变化,上清液中的目的蛋白含量越来越高,说明菌体正常生长,表达正常。

图7 发酵上清液目的蛋白表达量随时间的变化
Mark: 5 μL加样量,质量浓度为0.1~0.2 μg/μL;1~9: 10 μL样品,14、18、22、26、30、34、38、42、46 h时上清目的蛋白表达.
3 讨 论
3.1 培养基的选择对发酵的影响
基因工程菌的生长要选择合适且廉价的培养基配方,使菌体的生长、蛋白表达量和生产成本最优化[13]。毕赤酵母含醇氧化酶基因启动子具明显的调控功能,可用于调控外源基因的表达[14]。甲醇作为诱导剂,能够诱导毕赤酵母产生外源蛋白[15]。本试验在振荡培养中选用适合毕赤酵母发酵的酵母浸出粉胨葡萄糖琼脂液体培养基进行复壮、保种等工序,而在50 L自控罐中选用以硫酸铵、磷酸二氢钾等化合物质组成的成本相对较低的改良培养基进行放大培养,以期获得优质且廉价的适合毕赤酵母基因工程菌生长及表达的工业用培养基。
3.2 pH以及发酵温度对发酵的影响
毕赤酵母在pH 3.0~7.0的范围内均可生长, pH低于2.2时则停止生长, pH恒定在5.0时表达量最高[16]。刘彦丽等[17]研究了高密度培养的毕赤酵母基因工程菌对重组人血清白蛋白表达的影响,发现酸性环境不利于蛋白表达,诱导过程中pH 6.0~6.5最佳。章如安等[18]认为,用两步法来诱导外源蛋白的表达,诱导时的起始pH可能是毕赤酵母高效表达重组蛋白的关键之一,改变诱导时的pH,可使表达量提高50%以上。
在高密度发酵过程中,防止蛋白水解酶的水解、提高外源蛋白的稳定性、减少外源蛋白的降解,实际上也是一种提高外源蛋白产量的措施和手段[19]。有时,为减少培养基中蛋白酶的作用,改善外源蛋白的稳定性,pH控制在5.5左右[20]。不同重组蛋白类目标蛋白也具有不同的最佳稳定pH范围[21]。本试验中pH控制在5.5~6.5,基本符合酵母生长的酸性环境。
温度升高酵母易衰老,发酵周期缩短,酶失活加快,影响外源蛋白的表达[22]。本试验的温度控制范围为28~30.5 ℃,是酵母生长、目的蛋白表达的最佳温度范围。
3.3 甲醇体积分数对发酵效果的影响
甲醇体积分数大于3.65%时菌体的发酵受抑制[5]。过高体积分数的甲醇抑制细胞的生长和产物的表达,控制甲醇的流加是提高外源蛋白表达量的关键[21]。本试验补加甲醇时采用过渡流加的方式,即逐渐降低甘油补加速率而逐渐提高甲醇补加速率,并非等到甘油耗尽后并让菌体饥饿一段时间再补加。该方法使细胞逐渐适应甲醇的加入,不会抑制生长,增加能量的供应,增加了生物量外源蛋白的表达。
3.4 最佳发酵时间的确定
发酵时间是影响外源蛋白表达量的重要因素。本试验操作总结所得,最佳发酵时间为76 h。在发酵菌液湿质量达到15.0 g,稳定后开始加入甲醇诱导。发酵至14 h时,发酵菌液湿质量达到15.5 g,适合作为诱导起点;诱导后发酵菌液湿质量在12 h内维持在20.0 g~21.25 g,之后开始稳定上升。发酵至72 h时,发酵菌液湿质量达到59.75 g,之后2 h及4 h后测得湿质量分别是59.5 g及59.0 g。湿质量稳定在59.0 g~59.75 g,因此判断发酵到达终点总发酵时间为76 h。
4 结 论
本试验利用已构建的含有斜带石斑鱼生长激素表达载体的毕赤酵母X33发酵生产石斑鱼生长激素蛋白,确定了工业化大规模发酵此类蛋白的生产工艺,基本参数为温度28~30 ℃,pH 5.5~6.0,发酵时间76 h。利用此工艺可实现石斑鱼养殖生产中大规模应用石斑鱼生长激素重组基因蛋白(多肽)产品,促进石斑鱼的健康生长。整合了外源生长激素基因的酵母菌是绿色、安全、高效的新型微生物制剂,更适合于经济型和环保型水产养殖[22]。开发新型微生物制剂有利于生产更多更好的优质蛋白,保障国家食物安全,促进生态系统水平的水产养殖发展,提升我国渔业科技进步[23]。
[1] Acosta J, Carpio Y, Besada V, et al. Recombinant truncated tilapia growth hormone enhances growth and innate immunity in tilapia fry (Oreochromissp.)[J]. General and Comparative Endocrinology, 2008,157(1):49-57.
[2] Acosta J, Morales R, Morales A, et al.Pichiapastorisexpressing recombinant tilapia growth hormone accelerates the growth of tilapia[J]. Biotechnology Letters, 2007,29(11):1671-1676.
[3] Zang X, Liu B, Liu S, et al. Transformation and expression ofParalichthysolivaceusgrowth hormone cDNA inSynechocystissp. PCC6803[J]. Aquaculture, 2007,266(1/4):63-69.
[4] Li Y, Bai J, Jian Q, et al. Expression of common carp growth hormone in the yeastPichiapastorisand growth stimulation of juvenile tilapia (Oreochromisniloticus)[J]. Aquaculture, 2003,216(1/4):329-341.
[5] 王伟, 孙永华, 汪亚平, 等. 草鱼生长激素在毕赤酵母中的高效分泌表达[J]. 遗传学报, 2003,30(4):301-306.
[6] Sekine S, Mizukami T, Nishi T, et al. Cloning and expression of cDNA for salmon growth hormone inEscherichiacoli[J]. Proc Natl Acad Sci USA, 1985,82(13):4306-4310.
[7] Fine M, Sakal E, Vashdi D, et al. Recombinant carp (Cyprinuscarpio) growth hormone: expression, purification, and determination of biological activityinvitroandinvivo[J]. General and Comparative Endocrinology, 1993,89(1):51-61.
[8] Ben-Atia I, Fine M, Tandler A, et al. Preparation of recombinant gilthead seabream (Sparusaurata) growth hormone and its use for stimulation of larvae growth by oral administration[J]. General and Comparative Endocrinology, 1999(113):155-164.
[9] Venugopal T, Anathy V, Pandian T J, et al. Molecular cloning of growth hormone-encoding cDNA of an Indian major carp,Labeorohita, and its expression inEscherichiacoliand zebrafish[J]. General and Comparative Endocrinology, 2002,125(2):236-247.
[10] Funkenstein B, Dyman A, Lapidot Z, et al. Expression and purification of a biologically active recombinant rabbitfish (Siganusguttatus) growth hormone[J]. Aquaculture, 2005,250(1/2):504-515.
[11] Piyaviriyakul P, Panyim S, Eurwilaichitr L. High intracellular expression of giant catfish growth hormone under the control of PGK promoter inSaccharomycescerevisiae[J]. World Journal of Microbiology & Biotechnology, 2002(18):773-777.
[12] 朱泰承, 李寅. 毕赤酵母表达系统发展概况及趋势[J]. 生物工程学报, 2015,31(6):929-938.
[13] 李晶, 张淑梅, 王佳龙, 等. 鱼重组生长因子酵母的发酵研究[J]. 生物技术, 2002,12(6):30-31.
[14] 王鹏, 范代娣, 王增禄. 重组人生长激素在毕赤酵母中的表达研究[J]. 西安工程大学学报, 2008,22(2):161-165.
[15] 李昆鹏. 重组猪生长激素基因工程菌培养基优化及高密度液体发酵研究[D]. 兰州:兰州理工大学, 2011.
[16] 孙波. 重组人载脂蛋白A-Ⅳ在毕赤酵母中的表达及大规模发酵研究[D].长春:吉林大学, 2010.
[17] 刘彦丽, 刘永东, 王艳辉, 等. 毕赤酵母发酵生产重组人血清白蛋白高密度培养条件的研究[J]. 北京化工大学学报:自然科学版, 2003(4):25-28.
[18] 章如安, 杨晟, 邱荣德, 等. 巴斯德毕赤酵母表达体系研究及进展[J]. 微生物学通报, 2000,27(5):371-373.
[19] 王鹏. 重组毕赤酵母生产人生长激素的发酵条件研究[D]. 西安:西北大学, 2008.
[20] 谢帝芝, 刘臻, 王赏初, 等. 青鱼生长激素在毕赤酵母中的表达[J]. 淡水渔业, 2011,41(6):19-24.
[21] 李洪淼, 王红宁, 许钦坤. 毕赤酵母高密度发酵研究进展[J]. 生物技术通讯, 2005,16(2):210-212.
[22] 谢帝芝. 重组生长激素酵母饲料的研究[D].长沙:湖南农业大学, 2011.
[23] 唐启升, 丁晓明, 刘世禄, 等. 我国水产养殖业绿色可持续发展战略与任务[J]. 中国渔业经济, 2014,32(1):6-14.
FermentationofRecombinantProteinofGrowthHormoneGeneinOrange-spottedGrouper
LÜ Qingji1,PAN Zhongchao1,3,SHI Herong3,YANG Huirong1,WANG Shuqi2,ZHAO Huihong1
( 1.Animal Science College,South China Agricultural University,Guangzhou 510642,China; 2.Guangdong Provincial Key Laboratory of Marine Biotechnology,Shantou 515063,China; 3.Guangdong Haid Institute of Animal Husbandry & Veterinary,Guangzhou 510630,China )
Yeast X33Pichiapastoriswere applied to express recombinant of growth hormone in orange-spotted grouperEpinepheluscoioidescultivated in shaking flask first, and than fermented in 50 liters or bigger auto-control fermentator under conditions of temperature from 28 ℃ to 30.5 ℃,and pH 5.5—6.0 for 76 hours. During the fermentation period, the Yeast X33 were induced to express high amount protein by methanol, and the targets were detected qualitatively and quantitatively by Western Blot and SDS-PAGE. The concentration of target protein was found to be changed from 1.5 g/L to 2.0 g/L, accounting for 16.4% of total soluble protein in vitro. The fementation technology which producted recombinant orange-spotted grouper growth hormone in yeast X33P.pastorisby an automatic control fermentor lays the foundation of industrial production of fish growth hormone feed additives.
Epinepheluscoioides; recombinant growth hormone;Pichiapastoris; fermentation
10.16378/j.cnki.1003-1111.2017.01.015
S965.334
A
1003-1111(2017)01-0088-06
2016-03-01;
2016-05-11.
广东省科技计划项目(2015A020208002);广东省海洋生物技术重点实验室开放基金资助项目(GPKLMB201301);广东省海洋渔业科技推广专项(A201501A03,A201501A09,A201501A10).
吕晴霁(1993-),女,硕士研究生;研究方向:鱼类生理学.E-mail:18819169270@163.com.通讯作者:赵会宏(1975-),男,副教授,博士;研究方向:鱼类生理学.E-mail:zhaohh@scau.edu.cn.

