饲料盐藻水平对卵形鲳鲹体色和生长的影响
杨育凯,陈效儒,林黑着,黄小林,黄 忠,周传朋
( 1.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室, 广东 广州 510300;2.中国水产科学研究院 南海水产研究所深圳试验基地, 广东 深圳 518121;3.通威股份有限公司, 四川 成都 610041 )
饲料盐藻水平对卵形鲳鲹体色和生长的影响
杨育凯1,2,陈效儒3,林黑着1,2,黄小林1,2,黄 忠1,2,周传朋1
( 1.中国水产科学研究院 南海水产研究所,农业部南海渔业资源开发利用重点实验室, 广东 广州 510300;2.中国水产科学研究院 南海水产研究所深圳试验基地, 广东 深圳 518121;3.通威股份有限公司, 四川 成都 610041 )
以初始体质量为(13.88±0.28) g的卵形鲳鲹为试验对象,研究不同盐藻添加量(0.0%、0.1%、0.2%、0.4%、0.8%、1.6%)饲料对其体色和生长的影响。每组设3个平行,每个平行饲养20尾鱼,每日饱食投喂2次(8:00;17:00),试验周期为56 d。结果显示,盐藻添加量为0.1%~1.6%时,随着饲料中盐藻水平的提高,卵形鲳鲹背部和腹部黄色值(b*)呈显著上升趋势(P<0.05),饲料中添加盐藻可明显改善卵形鲳鲹体色;与此同时,卵形鲳鲹质量增加率和特定生长率随饲料盐藻水平的上升呈下降趋势(P>0.05),未添加盐藻的对照组具有最高蛋白质效率和最低饲料系数,且与盐藻添加量为0.4%的试验组差异显著(P<0.05),饲料中添加盐藻对卵形鲳鲹生长性能和饲料利用没有明显的促进作用;此外饲料盐藻水平对卵形鲳鲹体成分也没有显著影响(P>0.05)。
盐藻;卵形鲳鲹;体色;生长
卵形鲳鲹(Trachinotusovatus)广泛分布于印度洋和太平洋的热带、亚热带海域,中国东南沿海均有分布[1]。2010年国内养殖产量超过1.0×105t,2014年华南放苗总量达1.83×108尾,较2013年增加了20%[2]。随着卵形鲳鲹生产规模的扩大,高密度集约化人工养殖的卵形鲳鲹逐渐出现体色变白,品质下降的现象。
体色不仅是鱼类分类的重要特征,亦是其健康状态的衡量标准,同时体色正常与否也直接影响商品鱼的价格。在自然水体中,卵形鲳鲹由于摄食了大量富含类胡萝卜素的藻类和浮游生物,体色较鲜艳;而人工养殖条件下,配合饲料中类胡萝卜素等色素源含量较少且不稳定,加之养殖环境等因素的影响,其体色远不及野生群体。目前有关卵形鲳鲹的育种[3-4]、养殖[5-6]、营养[7-8]、病害[9-10]、资源[11-12]等已有研究,而在改善卵形鲳鲹体色方面则罕有报道。研究表明,盐藻(Dunaliellasalina)能合成较多的β-胡萝卜素,是迄今人类发现的天然β-胡萝卜素含量最高的生物,而β-胡萝卜素是一种优质的鱼类着色剂[13]。基于此,笔者在配合饲料中添加不同质量百分比的盐藻作为着色剂,探讨盐藻对卵形鲳鲹体色、生长的影响,旨在为在实际生产中如何健康、有效地解决卵形鲳鲹体色变浅问题提供基础资料和技术支持。
1 材料与方法
1.1 试验饲料
基础饲料原料包括鱼粉、花生粕、大豆浓缩蛋白、豆粕、次粉、鱿鱼内脏粉、啤酒酵母、鱼油、大豆卵磷脂、矿物质预混料、维生素预混料、氯化胆碱、盐藻。原料混合均匀后经饲料造粒机(宇冠YHKJ-300)挤压成粒径2.5 mm的饲料颗粒,然后放于空调房16 ℃抽干,冰柜中-20 ℃保存。饲料中水分、粗蛋白、粗脂肪和粗灰分含量按国家标准GB/F 435—1986、GB/F 432—1994、GB/F 433—1994和GB/F 438—1992中方法进行测定。饲料配方及生化组成见表1。
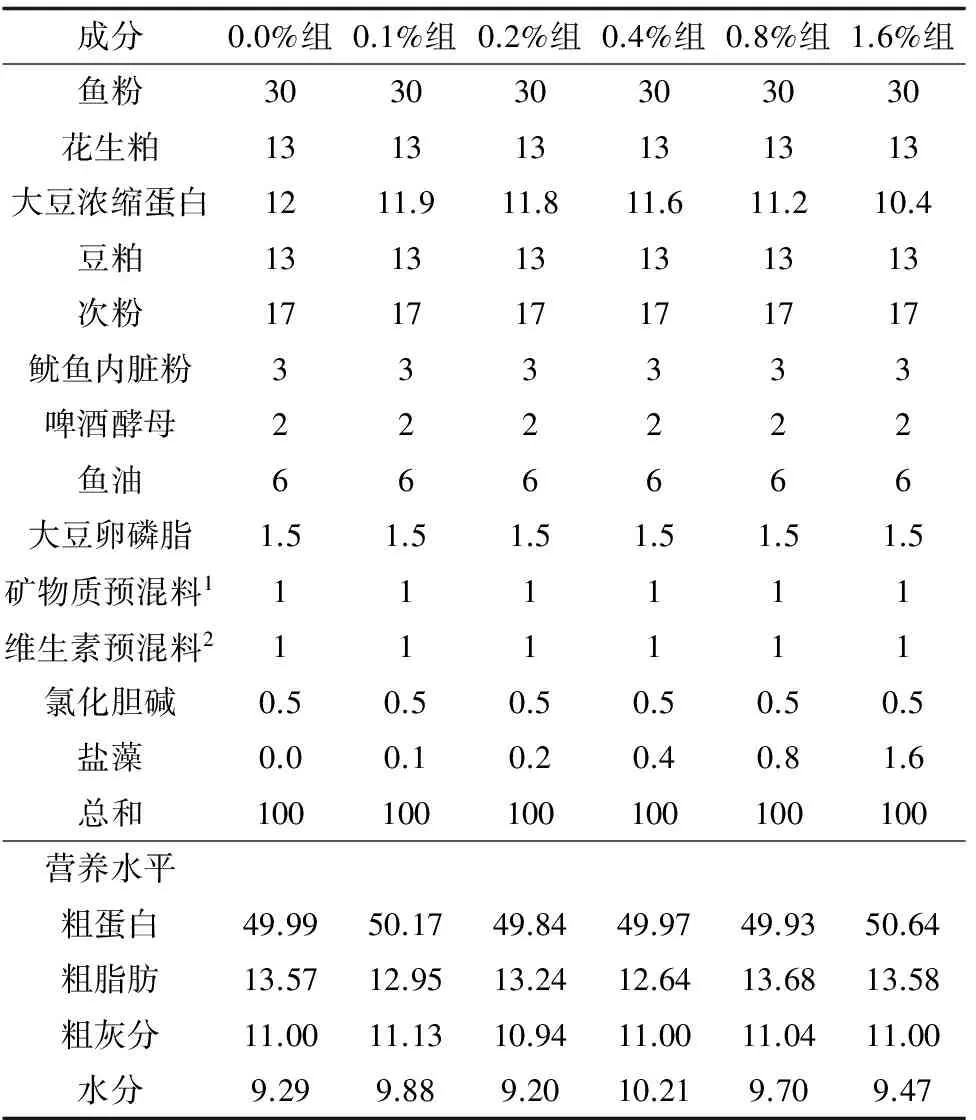
表1 试验饲料组成(干物质基础) %
注:矿物质预混料1(mg/kg):FeSO4·6H2O 800,MgSO4·7H2O 180,NaCl 100,CuSO4·5H2O 10,ZnSO4·H2O 40,CoCl2·6H2O 28,MnSO4·H2O 60,余量为沸石粉;维生素预混料2(mg/kg):维生素A 40,维生素B145,维生素B222,维生素B3168,维生素B5102,维生素B640,维生素B70.4,维生素B8450,维生素B910,维生素B120.04,维生素D30.1,维生素E 80,维生素K315,余量为微晶纤维素.
1.2 饲养管理
养殖试验于2015年9—10月在南海水产研究所深圳试验基地渔排完成。试验用鱼为当年同一批孵化卵形鲳鲹,平均体质量(13.88±0.28) g。暂养1周后将试验鱼分成6个处理组,分别投喂盐藻含量为0.0%、0.1%、0.2%、0.4%、0.8%、1.6%的试验饲料,其中0.0%组设为对照组,每个处理组设3个平行,共计18个网箱(1.0 m×1.0 m×1.5 m),每个网箱20尾试验鱼。养殖试验周期为56 d,试验期间每日2次饱食投喂(7:00,17:00)。试验水温26.0~28.5 ℃,盐度18~20,pH 8.0~8.6,溶解氧≥5 mg/L。每日观察水质变化,记录摄食量和死亡数目。试验结束后取样检测。
1.3 皮肤体色值测定
卵形鲳鲹体色采用国际发光照明委员会规定的L*、a*、b*色空间表示(L*表示亮度值,-b*表示蓝色值,+b*表示黄色值,-a*表示绿色值,+a*表示红色值)。养殖试验结束时使用色彩色差计(GEB-104 Pantone Color-Cue)进行测定,色差计使用前用白板进行校准,每个网箱测定5尾鱼背部和腹部皮肤的体色值,背部测定区域为背鳍前缘下方及侧线上方之间的区域,腹部为卵形鲳鲹腹部的腹鳍到臀鳍之间的区域,测定前先用吸水纸将鱼体表面的水分吸干。选在夜间测定,测定前和测定过程中避免外源灯光对卵形鲳鲹体色的影响,测定结果用数理统计方法进行数据分析。
1.4 生长和饲料利用效果测定
养殖试验结束后,停食24 h采样,用10 mg/L的丁香酚麻醉,称量每组鱼的总质量,并统计鱼的数量。从每个网箱中随机取6尾鱼,称质量后解剖,测定每尾内脏总质量和肝脏质量。生长及饲料利用效果计算公式如下:
成活率/%=n2/n1×100%
质量增加率/%=(m2-m1)/m1×100%
特定生长率/%·d-1=[(lnm2-lnm1)]/t×100%
饲料系数=m3/m4
脏体比/%=m5/m×100%
肝体比/%=m6/m×100%
肥满度=100m/L3
蛋白质效率/%=(m2-m1)/m7×100%
式中,n1为试验开始鱼尾数,n2为试验结束鱼尾数,m1为初始均质量(g),m2为终末均质量(g),t为试验天数(d),m3为饲料投喂量(g),m4为鱼体增加质量(g),m5为内脏质量(g),m6为肝脏质量(g),m为体质量(g),L为鱼体体长(cm),m7为蛋白质摄入量(g)。
1.5 全鱼体成分测定
从每个网箱中随机取3尾卵形鲳鲹进行全鱼体成分分析。用冷冻干燥机烘干测水分(Atlas Copco FX13),凯氏定氮法测定粗蛋白质(FOSS 2300),索氏抽提法测定粗脂肪(以石油醚为抽提剂;SoxtecTM 205,FOSS),马福炉中550 ℃灼烧损失质量法测定灰分(Yatmato FO610C)。
1.6 数据分析
所有数据用Excel软件计算平均值和标准差。采用SPSS 19.0 进行相关性检验,单因素方差分析来进行试验组间显著性检验,若组间差异显著(P<0.05),则作Duncan′s多重比较分析。
2 结 果
2.1 饲料盐藻水平对卵形鲳鲹体色的影响
各试验组背部和腹部皮肤亮度值(L*)和红绿值(a*)变化没有规律性;而黄色值(b*)均出现上升趋势,随着饲料中盐藻添加量的增加,卵形鲳鲹背部皮肤和腹部皮肤黄色值(b*)显著增大,其中1.6%组背部黄色值(b*)最高,0.4%组腹部黄色值(b*)最高,均与对照组存在差异显著(P<0.05)。由此说明饲料中添加盐藻可以使卵形鲳鲹黄色值(b*)增加,使鱼体体色更为金黄(表2、图1、图2)。
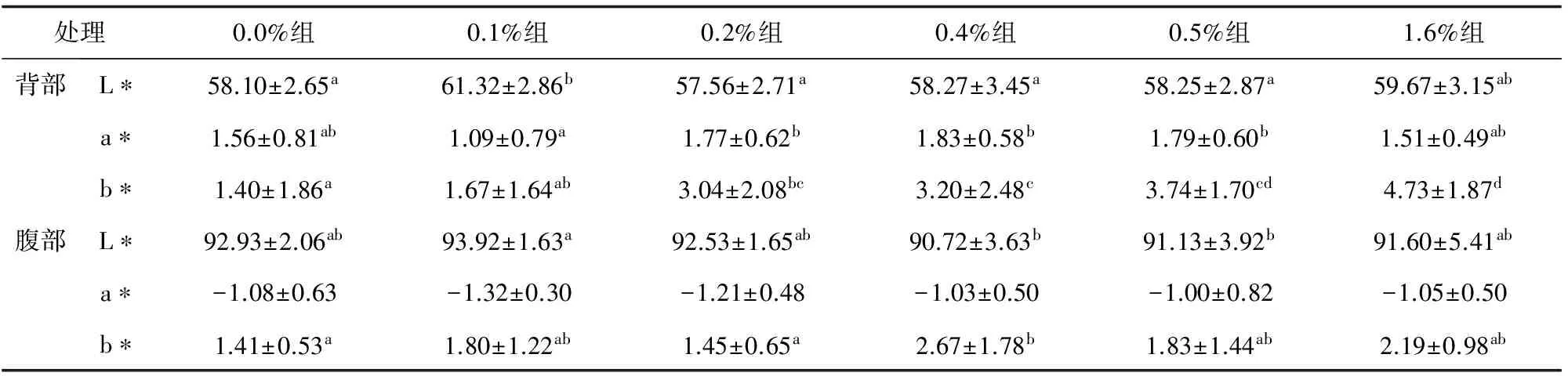
表2 饲料盐藻水平对卵形鲳鲹皮肤体色值(L*、a* 、b*值)的影响
注:同一行不同字母表示组间差异显著(P<0.05).其他表同.

图1 卵形鲳鲹背部皮肤黄色值(b*)
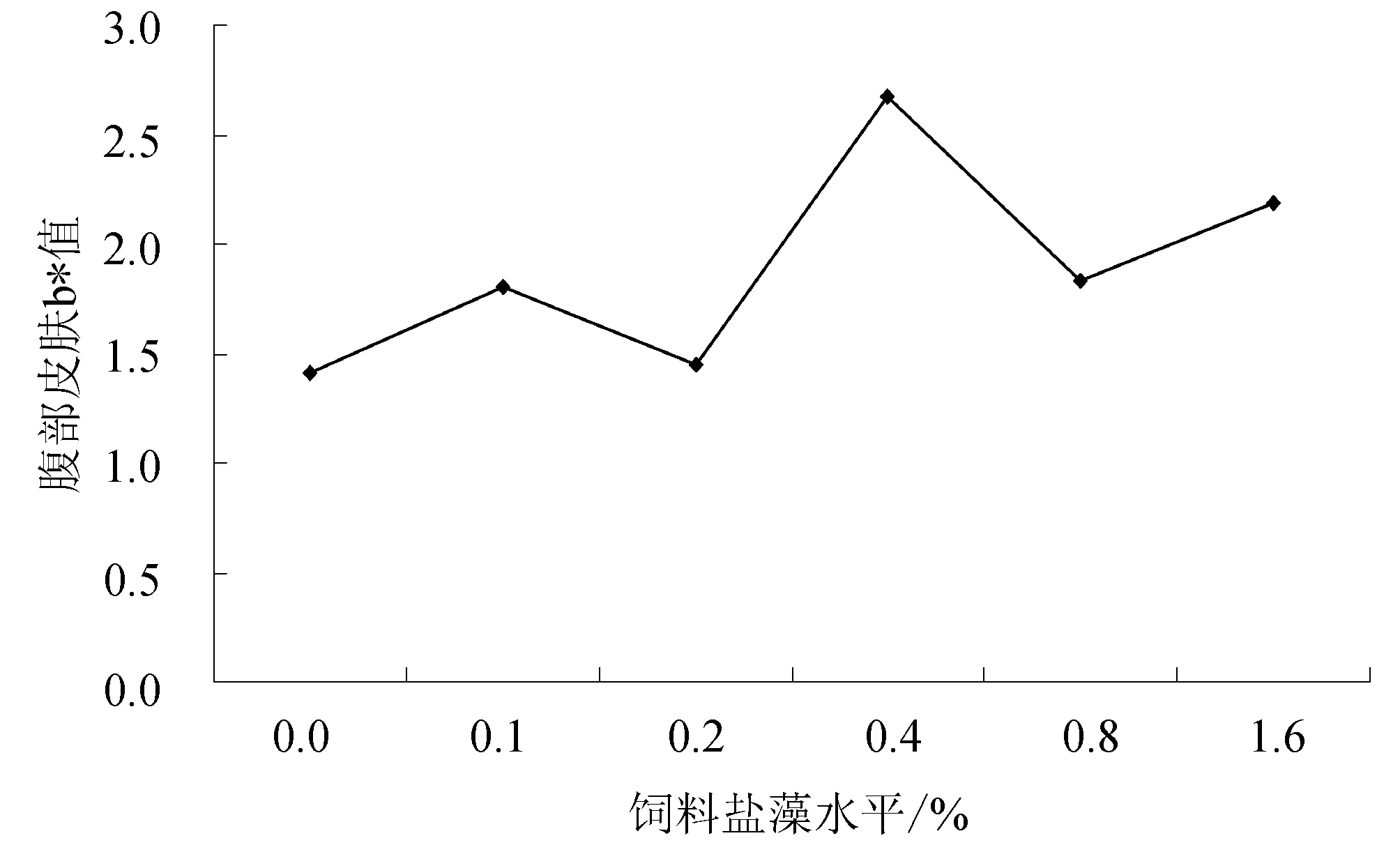
图2 卵形鲳鲹腹部皮肤黄色值(b*)
2.2 饲料盐藻水平对卵形鲳鲹生长性能和饲料利用的影响
投喂不同盐藻添加量的试验饲料56 d后,卵形鲳鲹生长指标和饲料利用效果见表3。由表3可见,各组成活率并不具有规律性,1.6%组成活率最高,0.4%组成活率最低。随着盐藻添加量的增加,卵形鲳鲹质量增加率和特定生长率呈下降趋势,未添加盐藻的对照组具有最高质量增加率和特定生长率,但与其他各组无显著差异(P>0.05)。各组的蛋白质效率和饲料系数具有负相关关系,对照组具有最高蛋白质效率和最低饲料系数,且与0.4%组差异显著(P<0.05)。各组脏体比、肝体比和肥满度均差异不显著(P>0.05),对照组脏体比、肥满度最高,肝体比最低。由此可知,添加盐藻并不能明显改善卵形鲳鲹生长和饲料利用效果。

表3 饲料盐藻水平对卵形鲳鲹的生长性能和饲料利用的影响
2.3 饲料盐藻水平对卵形鲳鲹体成分的影响
经检测,各组卵形鲳鲹全鱼体成分并无显著差异(表4)。0.1%组鱼粗蛋白、粗灰分和水分含量最高,粗脂肪含量最低;对照组粗脂肪含量最高。在本试验范围内,饲料中添加一定量(0.1%~1.6%)的盐藻并不会对卵形鲳鲹鱼体营养成分产生显著影响。

表4 饲料盐藻水平对卵形鲳鲹体成分的影响(干物质基础) %
3 讨 论
3.1 饲料盐藻水平对卵形鲳鲹体色的影响
体色是鱼类逃避敌害、进行信息交流和生理调节的重要手段,同时也是观赏鱼类和一些食用鱼类重要的质量指标[14]。影响鱼类体色的因素主要分为内在因素和外界因素。内在因素包括鱼类本身的遗传因素、大小、年龄、健康状况以及神经内分泌等,从根本上说,鱼的体色是受遗传因素控制的[15]。鱼类体色除与内在因素有关外,还与水质、光照、养殖密度及饲料营养等外界因素有关,其中最直接的影响因素是饲料中色素的种类和水平[16]。改善鱼类体色的方法有很多,如通过光照刺激和药物浸泡等物理方法,但这些方法持续时间较短,且对鱼体伤害也较大[17]。在日粮中添加着色剂被证明是改善养殖鱼类体色最为安全有效的手段之一[18]。观赏鱼饲料中常用的着色剂种类有藻类、虾蟹类壳物、植物提取物、微生物发酵产物和人工合成色素等,这些着色剂的功能物质均属于类胡萝卜素及其衍生物[19]。类胡萝卜素是鱼类着色的关键物质,但鱼类不能自身合成,只能通过饲料添加来实现吸收、沉淀和转化[20]。在经济鱼类中,通过在饲料中添加虾青素和角黄素等类胡萝卜素,可使人工养殖鲑鳟鱼的肌肉达到近似野生鱼的粉红色[21]。
由于着色剂的色素组成及色素的稳定性不同,欲使养殖鱼类达到理想的着色效果,必须根据色素在鱼类体内的代谢途径和沉积能力选用适当的着色剂种类[22]。研究表明,不同着色剂对锦鲤(Cyprinuscarpio)[23]、金鱼(Carassiusauratus)和血鹦鹉鱼(Cichlasomacitrinellus×C.synspilum)[24]的着色效果差异显著(P<0.05)。在对红白锦鲤的体色研究中,添加盐藻的着色效果远远优于添加辣椒粉和使用温度控制的方法,其原因可能与类胡萝卜素种类不同有关,辣椒粉主要含有玉米黄素,而盐藻中含有较多的β-胡萝卜素,推测β-胡萝卜素更易被红白锦鲤吸收和沉积[25]。目前卵形鲳鲹的人工养殖普遍投喂配合饲料,鱼的体内色素积累不足,体色发白,缺少光泽,远不及野生品种金黄鲜亮,分析与饲料营养成分有关。该试验在饲料中添加盐藻投喂卵形鲳鲹,随其添加量的增加鱼体背部和腹部黄色值呈现显著上升趋势(P<0.05),盐藻对卵形鲳鲹体色起到明显改善作用。盐藻中含丰富的β-胡萝卜素,β-胡萝卜素是一种优质的水产动物着色剂,大部分海水鱼类可将其直接吸收而贮存于体内,从而起到改善体色的作用[26]。研究发现盐藻对斑节对虾(Penaeusmonodon)[27]也有显著增色效果,其代谢途径与海水鱼类并不相同。
3.2 饲料盐藻水平对卵形鲳鲹体生长的影响
盐藻是一种营养均衡的单细胞藻类,因此在水产养殖生产中盐藻常被作为生物饵料或饲料添加剂而广泛使用[28]。方珍珍等[25]的研究表明,盐藻对红白锦鲤的生长具有明显促进作用,其适宜添加量为0.04%。在本试验中,饲料中添加0.1%~1.6%的盐藻,卵形鲳鲹的质量增加率和特定生长率均低于未添加盐藻的对照组。说明在本试验条件下,盐藻对卵形鲳鲹生长并没有明显促进作用,这与Chatzifotis等[29]在虹鳟(Oncorhynchusmykiss)中的研究结果类似,可能与色素摄入量及生物种类有关,具体原因有待进一步研究探明。
[1] 成庆泰, 郑葆珊. 中国鱼类系统检索[M]. 北京: 科学出版社, 1987:341-342.
[2] 刘锡强. 2014年华南沿海金鲳鱼养殖回顾和展望[J]. 当代水产, 2015, 40(2):31-33.
[3] 廖经球, 杨小立, 庞强, 等. 卵形鲳鲹繁殖生物学及人工繁育技术研究进展[J]. 红河学院学报, 2014, 12(5):21-25.
[4] 程大川, 郭华阳, 马振华, 等. 3月龄卵形鲳鲹形态性状对体质量的影响分析[J]. 海洋渔业, 2016, 38(1):26-34.
[5] 李样红, 彭树锋, 周全耀, 等. 卵形鲳鲹深水网箱养殖技术研究[J]. 科学养鱼, 2014(5):44-45.
[6] 林壮炳, 赖向生. 河口区池塘卵形鲳鲹生态混养技术研究[J]. 科学养鱼, 2013(7):42-44.
[7] 杨欣怡, 张凤枰, 赵鑫, 等. 网箱海养卵形鲳鲹饲料与肌肉品质评价[J]. 食品科学, 2015, 36(21):243-248.
[8] Lin H, Tan X, Zhou C, et al. Effect of dietary arginine levels on the growth performance, feed utilization, non-specific immune response and disease resistance of juvenile golden pompanoTrachinotusovatus[J]. Aquaculture, 2015, 437(1/2):382-389.
[9] 熊向英, 徐力文, 董兰芳, 等. 网箱养殖卵形鲳鲹鱼体寄生虫初步调查[J]. 广西科学院学报, 2015, 31(4):281-285.
[10] 黄婷, 李莉萍, 王瑞, 等. 卵形鲳鲹感染无乳链球菌与海豚链球菌的研究[J]. 大连海洋大学学报, 2014, 29(2):161-166.
[11] 孙立元, 郭华阳, 朱彩艳, 等. 卵形鲳鲹育种群体遗传多样性分析[J]. 南方水产科学, 2014, 10(2):67-71.
[12] 赵永贞, 陈秀荔, 李咏梅, 等. 南海区卵形鲳鲹遗传多样性的研究[J]. 西南农业学报, 2014, 27(4):1786-1790.
[13] 周丽花, 施翔, 程建峰. 七种常用培养基对盐藻生长和色素含量的影响[J]. 水产科学, 2015, 34(12):750-756.
[14] 张春兰, 赵文, 徐立蒲, 等. 微生态制剂和着色剂对锦鲤体色的影响[J]. 大连海洋大学学报, 2011, 26(4):328-332.
[15] 王旭霞, 邵力. 观赏鱼体色的研究现状[J]. 水利渔业, 2008, 28(2):57-59.
[16] 闫珊珊. 红白锦鲤着色效果的初步研究[D]. 天津:天津农学院, 2010.
[17] 贺国龙, 刘立鹤. 鱼类体色成因及其调控技术研究进展(下)[J]. 水产科技情报, 2010, 37(3):115-120.
[18] 张晓红, 吴锐全, 王海英, 等. 虾青素与螺旋藻对血鹦鹉体色的影响[J]. 大连水产学院学报, 2009, 24(1):79-82.
[19] 方春林, 贺刚, 余智杰, 等. 饲料中3种着色剂对锦鲤体色的影响[J]. 江苏农业科学, 2013, 41(5):226-228.
[20] Goodwin T W. The biochemistry of the carotenoids[M]. London:Chapman and Hall, 1985:64-96.
[21] Smith B, Hardy R, Torrissen O. Synthetic astaxanthin deposition in pan-size coho salmon (Oncorhynchuskisutch)[J]. Aquaculture, 1992, 104(1/2):105-119.
[22] 邝金媚, 吴秀丽, 赵典惠. 着色剂在水产养殖中的研究与应用[J]. 广东饲料, 2010, 19(4):22-25.
[23] 李建光, 胡世然, 刘霆, 等. 四种增色剂对锦鲤的生长、形体、体色和抗氧化能力的影响[J]. 中国饲料, 2009(16):33-36.
[24] 王锐, 费小红. 四种增色剂在观赏鱼中应用的研究[J]. 北京水产, 2005(4):37-38.
[25] 方珍珍, 闫珊珊, 白东清, 等. 盐藻、辣椒粉及温度对红白锦鲤生长及着色的影响[J]. 饲料工业, 2014, 35(18):24-29.
[26] 冷向军, 李小勤. 水产动物着色的研究进展[J]. 水产学报, 2006, 30(1):138-143.
[27] Boonyaratpalin M, Thongrod S, Supamattaya K, et al. Effects of β-carotene source,Dunaliellasalina, and astaxanthin on pigmentation, growth, survival and health ofPenaeusmonodon[J]. Aquaculture Research, 2001, 32(s1):182-190.
[28] 郑秀洁, 刘亚培. 盐藻的开发与应用展望[J]. 盐业与化工, 2015, 44(1):1-4.
[29] Chatzifotis S, Pavlidis M, Jimeno C D, et al. The effect of different carotenoid sources on skin coloration of cultured red porgy (Pagruspagrus)[J]. Aquaculture Research, 2005, 36(15):1517-1525.
EffectsofDietaryGreenAlgaDunaliellasalinaLevelsonBodyPigmentationandGrowthofOvatePompanoTrachinotusovatus
YANG Yukai1,2, CHEN Xiaoru3, LIN Heizhao1,2, HUANG Xiaolin1,2, HUANG Zhong1,2, ZHOU Chuanpeng1
( 1. Key Laboratory of South China Sea Fishery Research Exploitation & Utilization, Ministry of Agriculture; South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. Shenzhen Base of South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shenzhen 518121, China; 3. Tongwei Co., Ltd., Chengdu 610041, China )
A feeding trial was conducted to investigate the effects of dietary green algaDunaliellasalinalevels on body pigmentation and growth of ovate pompanoTrachinotusovatus[initial mean body weight:(13.88±0.28) g]. Six diets containing differentD.salinalevels (0.0%, 0.1%, 0.2%, 0.4%, 0.8%, and 1.6%) were formulated and fed to apparent satietion twice a day (8:00;17:00) to these groups of each 20 fish for 56 days. The results showed that the yellow value(b*) of dorsum and belly skin in ovate pompano was significantly in creased in the range of 0.1% to 1.6% of dietaryD.salinalevels (P<0.05). Addition ofD.salinadiet significantly improved the body color of ovate pompano. Meanwhile, the weight gain (WG) and specific growth rate (SGR) was found to be declined with the increasing dietaryD.salinalevel(P>0.05). The fish in control group fed the diet containing noD.salinahad the maximal protein efficiency ratio (PER) and the minimal feed conversion ratio (FCR), significantly different from group with 0.4%D.salinain its diet (P<0.05). It was found that add supplemetation ofD.salinain diet did not lead to promoting effects in both growth and feed utilization of ovate pompano. There were no significant effects on body nutrient contents in the fish fed differentD.salinalevel diets (P>0.05).
Dunaliellasalina;Trachinotusovatus; body color; growth
10.16378/j.cnki.1003-1111.2017.03.013
S965.328
A
1003-1111(2017)03-0336-05
2016-06-01;
2016-07-29.
公益性行业(农业)科研专项经费资助项目(201403011);深圳市生物产业发展专项资金现代农业生物产业推广扶持计划项目( SWCY20150330010013); 2014年通威合作项目.
杨育凯(1986-),男,实习研究员,硕士;研究方向:水产动物遗传育种科学.E-mail:yangyukai1986@163.com.通讯作者: 林黑着(1965-),男,研究员,博士;研究方向:水产动物营养与饲料科学.E-mail:linheizhao@163.com.
——奇妙的蛋

