温度对大菱鲆幼鱼生长及免疫相关酶活性的影响
李文龙,梁兴明,梁萌青,张天时,孙德强
( 1.中国水产科学研究院 黄海水产研究所,农业部海水鲆鲽鱼类遗传育种中心,山东 青岛 266071;2.山东省海阳市黄海水产有限公司,山东 海阳 265100 )
温度对大菱鲆幼鱼生长及免疫相关酶活性的影响
李文龙1,梁兴明1,梁萌青1,张天时1,孙德强2
( 1.中国水产科学研究院 黄海水产研究所,农业部海水鲆鲽鱼类遗传育种中心,山东 青岛 266071;2.山东省海阳市黄海水产有限公司,山东 海阳 265100 )
将体质量(31.13±1.67) g的大菱鲆幼鱼饲养在容积100 L的水桶中,每个水桶40尾,采用OKE-6710HF微电脑温控仪控制温度为15、18、21、24 ℃和27 ℃,在第0、15、30、45、60 d进行采样分析血清中免疫相关酶活性及幼鱼全长、体质量及存活率。结果显示,在15~27 ℃条件下,大菱鲆幼鱼生长速度随温度升高先升后降;水温为18 ℃时,幼鱼存活率为100%,生长速度最快,为最佳生长水温。大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活力,随温度及饲养时间的变化而呈波动性,但没有表现出显著的规律性;大菱鲆幼鱼血清中超氧化物歧化酶的活力随温度的升高先升后降;刚达到设定温度(即第0 d)时,各温度组之间溶菌酶活力并无显著差异(P>0.05),随着饲养时间的加长及温度的升高,溶菌酶活力不断升高,表明温度对大菱鲆幼鱼生长及存活率具有显著的影响。
大菱鲆幼鱼;温度;生长;酶活性
大菱鲆(Scophthalmusmaximus)原产于欧洲,自然分布于东北大西洋的北海、波罗的海和地中海等海域。大菱鲆生长速度快、肉味鲜美,营养价值高,是世界性养殖鲆鲽鱼类[1]。1992 年引进我国,创建了“温室大棚+深井海水”工厂化养殖模式[2],近5年累计创产值逾70亿元,引领和推动了我国第4次海水养殖产业化浪潮[3]。
大菱鲆为冷温性鱼类,对温度等环境指标要求较严,适宜生长水温12~19 ℃[4],在中国北方夏季,主要通过抽提深井海水来降低大菱鲆养殖水温,但过度抽提深井海水,使地下水位严重下降,给环境带来极大的压力[2]。因此,选育大菱鲆耐高温品种十分必要。Burel等[5]报道,35~140 g法国大菱鲆的最适生长水温为16~20 ℃;20~75 g挪威大菱鲆的最适生长水温为16~19 ℃[6]。Imsland等[7]指出,大菱鲆幼鱼阶段短时间的高温饲养可能会长期影响大菱鲆的生长。高淳仁等[8]研究了不同温度下大菱鲆幼鱼的生长、成活率和体内蛋白酶活性;马爱军等[9]测定了大菱鲆两代家系耐温性能,并分析了各家系的耐温性优势比;曹宝祥等[10]分析了40个大菱鲆家系生长与耐热性状的相关情况;刘宝锁等[11]估计了大菱鲆耐高温性状的遗传参数。这些研究为大菱鲆耐温性状的选育工作提供了理论基础。但目前关于温度对大菱鲆幼鱼血清中免疫相关酶活性影响的研究鲜有报道。本文研究了不同温度梯度对大菱鲆幼鱼生长、存活率以及血清中免疫相关酶活性的影响,以期为大菱鲆的健康养殖及耐高温品种选育提供数据支持。
1 材料与方法
1.1 材料
试验用大菱鲆幼鱼600尾,购自山东省海阳市黄海水产有限公司,平均全长(12.26±0.19) cm、平均体质量(31.13±1.67) g,自同批孵化、同池养殖的鱼群中挑选,生长指标相近;暂养10 d,暂养水温为(18±0.5) ℃,盐度为28~30,pH为7~8,溶解氧为7~7.8 mg/L,每日8:30和16:30饱食投喂配合饲料,投饵后30 min换水50%。
1.2 试验设计
本研究共设置5个温度梯度:15、18、21、24 ℃和27 ℃,每个梯度3个重复。试验用容量为100 L的水桶,每个水桶40尾。温度控制采用OKE-6710HF微电脑温控仪,采用缓慢升降温法,每12 h升高或降低1 ℃,从暂养水温(18±0.5) ℃直至试验设定温度。
试验持续60 d,每日观察大菱鲆幼鱼摄食情况,并及时捞出死亡个体。试验第0、15、30、45、60 d,随机从养殖水桶中取出3尾大菱鲆幼鱼采样,并测量全长、体质量。
1.3 样品采集与分析
用1 mL无菌注射器自大菱鲆幼鱼尾静脉取血,不加抗凝剂。血液置于1.5 mL离心管中,4 ℃静置4 h后,12 000 r/min离心10 min,取上清液分装、冻存于液氮中待用。采用南京建成生物工程研究所试剂盒测定酶活性。测定的免疫指标包括酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和溶菌酶。
1.4 数据处理分析
试验数据用平均值±标准差表示,利用SPSS 18.0统计学软件进行数据处理和分析,进行单因素方差分析,利用最小显著差数法进行多重比较。显著水平为α=0.05。
2 结果与分析
2.1 温度对大菱鲆幼鱼生长和存活率的影响
大菱鲆幼鱼在15~27 ℃饲养60 d全长和体质量的增长情况见图1、图2。由图1和图2可知,在15~27 ℃条件下,大菱鲆幼鱼的生长速度随温度升高先升后降,水温18 ℃时,幼鱼生长速度最快;水温达到24 ℃时,幼鱼生长速度明显低于15、18 ℃和21 ℃,而当水温达到27 ℃时,幼鱼已基本不生长;试验前30 d,15、18 ℃和21 ℃试验组幼鱼生长速度无明显差别,45 d后,21 ℃组幼鱼生长速度明显放缓。

图1 不同温度条件下大菱鲆幼鱼全长的增长
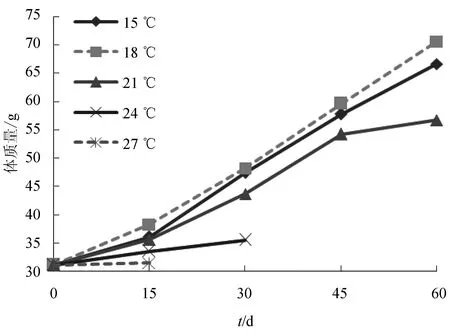
图2 不同温度条件下大菱鲆幼鱼体质量的增长
15 ℃和18 ℃组大菱鲆幼鱼饲养60 d后存活率均为100%;21 ℃和24 ℃组在饲养30 d后,大菱鲆幼鱼存活率开始下降,其中24 ℃组45 d时存活率为0;而当水温达到27 ℃时,大菱鲆幼鱼从第6 d就开始出现死亡个体,30 d时已无存活幼鱼(图3)。

图3 不同温度条件下大菱鲆幼鱼的存活率
2.2 温度对大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活性的影响
在不同温度条件下,大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活力的较大值大多集中在饲养第15 d时,其中,18 ℃组鱼的酸性磷酸酶活力值最大,与27 ℃组差异不显著(P>0.05),而与其他3组存在显著差异(P<0.05),27 ℃组鱼的碱性磷酸酶活力值最大,与其他各温度组差异显著(P<0.05),15 ℃组大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活力随饲养时间的增加变化较为平缓(表1,表2)。
2.3 温度对大菱鲆幼鱼血清中超氧化物歧化酶活性的影响
大菱鲆幼鱼血清中超氧化物歧化酶活力整体变化趋势为:随温度的升高先升后降;随饲养时间加长,15 ℃和18 ℃组超氧化物歧化酶活力变化不显著(P>0.05),而高温度组(21、24 ℃和27 ℃)整体呈降低趋势(表3)。超氧化物歧化酶活力最高组出现在水温21 ℃、0 d时,即水温刚达到设定温度21 ℃时,而后又趋向于平稳。24 ℃和27 ℃组超氧化物歧化酶活力在0 d和15 d均低于21 ℃组。
2.4 温度对大菱鲆幼鱼血清中溶菌酶活力的影响
刚达到设定温度(即第0 d)时,各温度组大菱鲆幼鱼血清中溶菌酶活力无显著差异(P>0.05);随着饲养时间的加长,以及温度的增加,溶菌酶活力不断升高(表4)。

表1 不同温度条件下大菱鲆幼鱼血清中的酸性磷酸酶活力 U/L
注:同列中不同小写字母表示同一温度下不同时间差异显著(P<0.05);同行中不同大写字母表示同一时间不同温度差异显著(P<0.05),下同.

表2 不同温度条件下大菱鲆幼鱼血清中的碱性磷酸酶活力 U/L

表3 不同温度条件下大菱鲆幼鱼血清中的超氧化物歧化酶活力 U/L

表4 不同温度条件下大菱鲆幼鱼血清中的溶菌酶活力 U/L
3 讨 论
3.1 温度对大菱鲆幼鱼生长和存活率的影响
鱼类是变温动物,各种生理机能包括免疫机能,受水温的影响极大。作为影响鱼类生长的主导环境因素之一,水温直接影响着鱼体生化、生理和行为[12],高温会使鱼体产生应激反应以适应外界环境的改变,但若长期处于应激状态,将会导致鱼体免疫防御能力和抗病力下降,死亡率升高[13-14]。大菱鲆是一种冷温性鱼类,温度尤其是高温对其影响至关重要。本研究结果表明,15~27 ℃条件下,大菱鲆幼鱼生长速度随温度升高而先升后降,该结果与高淳仁等[8,15]的研究结果相似。其中,水温为18 ℃时,大菱鲆幼鱼生长速度最快,存活率为100%,是最佳生长水温;水温达到27 ℃时,大菱鲆幼鱼已基本不摄食,从第6 d开始出现死亡个体,30 d时已无幼鱼存活,表明此温度已经超出了大菱鲆幼鱼可以耐受的温度范围;试验前30 d,15、18 ℃和21 ℃三组幼鱼生长速度及存活率均无明显差别,超过45 d后,21 ℃组幼鱼生长速度明显放缓,死亡率也明显提高,说明大菱鲆幼鱼可以耐受21 ℃的水温,但时间不易过长。
3.2 温度对大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活性的影响
外界环境温度不仅影响鱼类的生长,而且对其免疫功能也有着至关重要的影响[16]。有关温度对不同鱼类体内系统免疫、生理代谢等方面影响的研究很多[17-19]。Huang等[20]研究表明,水温低于25 ℃时,大菱鲆酸性磷酸酶活力随着温度增加而升高,之后逐渐降低。本研究结果表明,15 ℃组大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活力随着饲养时间的增加变化较为平缓,酸性磷酸酶和碱性磷酸酶活力的较大值大多集中在饲养第15 d时。虽然大菱鲆幼鱼血清中酸性磷酸酶和碱性磷酸酶活力随着温度及饲养时间的变化有一定的波动性,但是整体而言,两种酶活力均未表现出显著的规律性,推测酸性磷酸酶和碱性磷酸酶并非是大菱鲆幼鱼高温胁迫过程中的敏感指标。
3.3 温度对大菱鲆幼鱼血清中超氧化物歧化酶活性的影响
环境温度的升高可以导致机体耗氧量的增加,促进产生氧自由基[21],升高抗氧化酶活性,长期在此状态下,将导致鱼体免疫防御能力和抗病力下降,超氧化物歧化酶具有消除机体氧自由基的功能,对增强吞噬细胞防御能力和机体免疫功能有重要作用[22]。王伟等[23]研究表明,急性温度胁迫显著影响太平洋鳕(Gadusmacrocephalus)仔稚鱼总超氧化物歧化酶活性。刘松岩[24]的研究表明,中华鲟(Acipensersinensis)血清中超氧化物歧化酶活力与水温具有显著的相关性。在短期内(1~4 h)印度囊鳃鲇(Heteropneustesfossilis)超氧化物歧化酶活力随温度升高而升高,在32~37 ℃时,超氧化物歧化酶活力增加更为显著[25]。军曹鱼(Rachycentroncanadum)幼鱼的超氧化物歧化酶活力也随温度的升高(26~32 ℃)而升高[26]。本研究中,大菱鲆幼鱼血清中超氧化物歧化酶活力随温度的升高先升后降,这一研究结果与Huang等[20]研究结果一致,说明大菱鲆幼鱼随温度的升高有一定的应激反应,为了维持体内氧自由基的平衡,超氧化物歧化酶活力随之增加;超氧化物歧化酶活力最高组出现在水温21 ℃、0 d时,即水温刚达到设定温度21 ℃时,说明在此温度点大菱鲆幼鱼发生了应激性生理生化反应,而后又趋向于平稳;而24 ℃和27 ℃组超氧化物歧化酶活力在0 d和15 d均低于21 ℃组,其原因可能是对超氧化物歧化酶本身活性的影响。
3.4 温度对大菱鲆幼鱼血清中溶菌酶活力的影响
溶菌酶作为鱼类的非特异性免疫物质之一,在机体的炎症过程、修复再生等调节中,发挥重要作用[27]。彭婷等[28]对尼罗罗非鱼(Oreochromisniloticus)的研究表明,温度由20 ℃降至10 ℃,尼罗罗非鱼的溶菌酶活性随温度的下降而降低。Huang等[20]研究结果表明,高温胁迫48 h后,大菱鲆体表黏液中的溶菌酶活力随着温度的增加而不断升高。Langston等[17]也曾报道,温度在生理极限范围内升高时,溶菌酶的活力增加。本研究结果为,刚达到设定温度(即第0 d)时,溶菌酶活力并无显著差异,随着饲养时间的延长,以及温度的升高,溶菌酶活力不断升高,与Huang等[20]有所不同,其原因可能是由于Huang等[20]研究的溶菌酶取自大菱鲆体表黏液,对外界环境的变化更为敏感。
4 结 论
本研究结果表明,大菱鲆幼鱼的生长速度随温度升高先升后降,存活率则随温度升高而降低;大菱鲆幼鱼最佳生长水温约为18 ℃,并可耐受21 ℃的水温,但时间不易太长。不同温度条件下,大菱鲆幼鱼血清中酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶和溶菌酶等免疫酶活性不同,表明高温胁迫导致大菱鲆幼鱼体内自由基代谢紊乱,降低免疫力。因此,大菱鲆的养殖生产中,应尽量避免养殖水体高温。本研究结果可为大菱鲆的健康养殖及耐高温品种选育工作提供数据支持。
[1] 杨正勇,王春晓.全球视野下中国鲆鲽类养殖业的发展[J].中国渔业经济, 2009,27(6):115-121.
[2] 雷霁霖,门强,王印庚,等.大菱鲆“温室大棚+深井海水”工厂化养殖模式[J]. 海洋水产研究,2002,23(4):1-7.
[3] 雷霁霖,刘新富,关长涛.中国大菱鲆养殖20年成就和展望——庆祝大菱鲆引进中国20周年[J].渔业科学进展, 2012,33(4):123-130.
[4] 雷霁霖.海水鱼类养殖理论与技术[M]. 北京:中国农业出版社,2005.
[5] Burel C, Person-Le Ruyet J, Gaumet F, et al.Effects of temperature on growth and metabolism in juvenile turbot[J]. Journal of Fish Biology, 1996,49(4):678-692.
[6] Imsland A K, Sunde I M, Folkvord A, et al. The interaction between temperature and size on growth of juvenile turbot (ScophthalmusmaximusRafinesque)[J]. Journal of Fish Biology, 1996, 49(5):926-940.
[7] Imsland A K, Gunnarsson S, Asgeirsson A, et al.Commercial-scale validation of temperature-step rearing on growth physiology in turbot,Scophthalmusmaximus[J]. Journal of the World Aquaculture Society, 2008, 39(5):684-691.
[8] 高淳仁,王印庚,马爱军,等.温度对大菱鲆幼鱼生长、成活率和体内蛋白酶活性的影响[J]. 海洋水产研究, 2006, 27(6):33-36.
[9] 马爱军,黄智慧,王新安,等.大菱鲆(Scophthalmusmaximus)耐高温品系选育及耐温性能评估[J]. 海洋与湖沼, 2012,43(4):797-804.
[10] 曹宝祥,张天时,刘宝锁,等.大菱鲆家系生长和耐热性状对比分析[J].中国水产科学, 2012,19(6):1001-1007.
[11] 刘宝锁,张天时,孔杰,等.大菱鲆生长和耐高温性状的遗传参数估计[J].水产学报, 2011,35(11): 1601-1606.
[12] Beitinger T L, Bennett W A, McCauley R W. Temperature tolerances of North American freshwater fishes exposed to dynamic changes in temperature[J]. Environ Biol Fishes, 2000, 58(3):237-275.
[13] Dominguez M,Takemura A,Tsuchiya M, et al. Impact of different environmental factors on the circulating immunoglobulin levels in the Nile tilapia,Oreochromisniloticus[J]. Aquaculture, 2004,241(1/4):491-500.
[14] Martinez-Alvarez R M, Morales A E,Sanz A. Antioxidant defenses in fish: biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005,15(1):75-88.
[15] 李勇,孙国祥,柳阳,等.温度对高密度循环海水养殖大菱鲆摄食、生长及消化酶的影响[J].渔业科学进展, 2011,32(6):17-24.
[16] Bly J E, Clem W. Temperature and teleost immune functions[J]. Fish & Shellfish Immunology, 1992,2(3):159-171.
[17] Langston A L, Hoare R, Stefansson M.The effect of temperature on non-specific defence parameters of three strains of juvenile Atlantic halibut (HippoglossushippoglossusL.) [J]. Fish & Shellfish Immunology, 2002, 12(1):61-76.
[18] Tort L, Trtllant J, Liarte C, et al. Effects of temperature decrease on feeding rates, immune indicators and histopathological changes of gilthead seabreamSparusauratafed with an experimental diet[J]. Aquaculture, 2004,229(1/4):55-65.
[19] Kumari J, Sahoo P K, Swain T, et al. Seasonal variation in the innate immune parameters of the Asian catfishClariasbatrachus[J]. Aquaculture, 2006,252(2):121-127.
[20] Huang Z H, Ma A J, Wang X A. The immune response of turbot,Scophthalmusmaximus(L.), skin to high water temperature[J]. Journal of Fish Diseases, 2011,34(8):619-627.
[21] Lushchak V I, Bagnyukova T V. Temperature increase results in oxidative stress in goldfish tissues: 1. indices of oxidative stress[J]. Comp Biochem Physiol, 2006,143(1):30-35.
[22] 黄智慧.高温逆境下大菱鲆体表生理生化特性研究[D].青岛:中国海洋大学, 2010.
[23] 王伟,姜志强,孟凡平,等.急性温度胁迫对太平洋鳕仔稚鱼成活率、生理生化指标的影响[J]. 水产科学, 2012, 31(8):463-466.
[24] 刘松岩.环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响[D]. 武汉:华中农业大学, 2006.
[25] Parihar M S, Javeri T, Hemnani T, et al. Responses of superoxide dismutase, glutathione peroxidase and reduced glutathione antioxidant defense in gills of the freshwater catfish(Heteropneustesfossilis) to short term elevated temperature[J]. J Therm Biol, 1997, 22(2):151-156.
[26] 杨健,陈刚,黄建盛,等.温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J]. 广东海洋大学学报, 2007,27(4):25-29.
[27] 王世若,王兴龙,韩文瑜.现代动物免疫学[M].长春:吉林科学技术出版社, 1996.
[28] 彭婷,胡庭俊,林勇,等. 低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响[J]. 水产科学, 2012, 31(5):259-263.
EffectsofTemperatureonGrowthandEnzymeActivityRelatedtoImmunityinJuvenileTurbotScophthalmusmaximus
LI Wenlong1, LIANG Xingming1, LIANG Mengqing1, ZHANG Tianshi1, SUN Deqiang2
( 1. Marine Flatfish Genetic Breeding Center, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;2. Huanghai Aquaculture Ltd.,Haiyang 265100, China )
The effects of temperature on growth, survival and enzyme activities related to immunity in serum of juvenile turbot (Scophthalmusmaximus) were studied in order to provide the basis for the temperature choice and health breeding of turbot. The total length, body weight, survival and enzyme activities related to immunity were determined in juvenile turbot cultured at water temperature of 15 ℃, 18 ℃, 21 ℃, 24 ℃ and 27 ℃ regulated by a device OKE-6710HF in 0, 15, 30, 45 d and 60 d during the experiment. The results showed that juvenile turbot had best growth and 100% of survival rate at 18 ℃ in 60 days. The growth rate was increased first and then decreased with the rising of the temperature within water temperature of 15—27 ℃. There were no regular changes in acid phosphatase (ACP) and alkaline phosphatase (AKP) activities with increase in the culture temperature and elapse of rearing period. The superoxide dismutase (SOD) activities in serum of juvenile turbot were found to be increased at first and then decreased with the rising of temperature. No significant difference in lysozyme (LSZ) activities was observed (P>0.05) among the groups, with rapid increase with the rising culture temperature and elapse of rearing period. The findings indicate that water temperature has significant effect on growth and survival rate of juvenile turbot, with the optimal growth temperature of some 18 ℃.
juvenile turbot; temperature; growth; enzymatic activity
10.16378/j.cnki.1003-1111.2017.03.009
S965.399
A
1003-1111(2017)03-0311-06
2016-04-24;
2016-07-11.
中国水产科学研究院黄海水产研究所基本科研业务费专项资金资助项目(20603022013034).
李文龙(1987-),男,助理研究员;研究方向:鱼类遗传育种.E-mail:liwl@ysfri.ac.cn.通讯作者: 梁兴明(1961-),男,研究员;研究方向:鱼类遗传育种. E-mail:liangxm@ysfri.ac.cn.

