中链甘油三酯对雏鸭增重及血清甲状腺激素水平的影响
孔 雪,刘为民,张集祥
(佛山科学技术学院动物医学系,广东佛山 528000)
中链甘油三酯对雏鸭增重及血清甲状腺激素水平的影响
孔 雪,刘为民*,张集祥
(佛山科学技术学院动物医学系,广东佛山 528000)
旨在通过饮水中添加中链甘油三酯(MCTs)的方式,探索MCTs对肉雏鸭增重效果及甲状腺激素的影响。试验选用5日龄48只樱桃谷雏鸭称重后,随机分为对照组、低剂量组和高剂量组3个组,每组16只,对照组为普通自来水,低剂量组和高剂量组饮水分别以浓度1 g/L和3 g/L的MCTs添加饮水,试验周期为20 d,期间每5 d称重1次,以及在试验第5、12、20 d时分别对每组雏鸭采血,分离血清用放射性免疫分析法测定每组T3、T4及rT3的含量。结果表明,雏鸭的增重率呈现先上升后下降再上升的变化,这可能与MCTs作用于肝脏影响了T3、T4及rT3活性有关。
雏鸭;中链甘油三酯;增重率;甲状腺激素
中链脂肪酸(medium-chain fatty acids,MCFAs)主要是指含6~12个碳原子的脂肪酸,即己酸、癸酸和月桂酸。MCFAs与甘油发生酯化反应后可生成相应的中链脂肪酸甘油三酯(medium-chain triglycerides,MCTs)。由于其分子量小,MCTs可不经消化直接吸收入小肠上皮细胞内[1],然后经胰脂酶水解成MCFAs及甘油后,MCFAs直接进入门静脉血液,与血浆白蛋白结合后转运至肝脏[2]。进入肝细胞的MCFAs很少被用于合成脂类,几乎都在线粒体内被氧化,且MCFAs可不依赖肉毒碱载体转运而直接进入线粒体。MCFAs在线粒体内进行β-氧化[3]后,进入三羧酸循环供能。整个过程由于MCTs比LCTs在消化[4]、吸收[5]、转运以及被线粒体吸收方面都快的特点,所以MCTs可用于机体的快速供能。
MCFAs所具有的独特的营养代谢过程,为幼小动物能量的补充提供了可能,剂量的制定和饲喂途径是决定其效果的主要因素[6]。MCFAs在猪、家禽等的规模生产上的作用机制和应用研究还比较少,作为初生仔猪的快速补充剂,近年来受到人们的重视。但在雏鸭养殖和生产中应用尚少,MCTs的作用和机制,目前还未见详细的报道。
由于中链脂肪酸在分解、氧化和转运的速度快于长链脂肪酸的特点,使得中链脂肪酸在养猪、家禽方面有了合理的应用,但对雏鸭的应用研究尚少。本试验通过饮水添加MCTs的方式,主要探索MCTs对肉雏鸭增重效果和甲状腺激素水平的影响。为以后探究MCFAs对家禽作用的机制研究提供参考,为MCTs在家禽养殖的应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 1日新出雏樱桃谷鸭,购于佛山市桂柳家禽有限公司三水分公司,人工区分性别,适应性饲养4日。
1.1.2 MCTs制剂 此试验用优速能A杯,含MCTs 500 g/kg、粗蛋白20 g/kg、矿物质60 g/kg、粗纤维50 g/kg、赖氨酸2 g/kg、钙0.1 g/kg~2 g/kg、磷2 g/kg~20 g/kg、氯化钠0.1%~1.0%、铁10 mg/kg~500 mg/kg、硒0.5 mg/kg~5.0 mg/kg、d1-α-生育酚乙酸酯5.0 mg/kg,将其溶于清水中以MCTs 1 g/L和3 g/L含量供雏鸭饮用。
1.1.3 试剂和仪器设备 T3、T4、rT3放射性免疫分析试剂盒:碘[125I]三碘甲腺原氨酸(T3)放射免疫分析药盒(产品批号:RT21701,精密度:批内6.0%;批间9.0%),碘[125I]甲状腺素(T4)放射免疫分析药盒(产品批号:RT31701,精密度:批内7.0%;批间11.2%),碘[125I]反三碘甲腺原氨酸(rT3)放射免疫分析药盒(产品批号:RTB1701,精密度:批内变异系数6.7%;批间变异系数11.2%)。AY220型电子分析天平,SN-695B型智能放免γ测量仪。
1.2 方法
1.2.1 试验动物及分组 将48只雏鸭,随机分为对照组、低剂量组和高剂量组3个组,每组各16只,雌雄比例相同,对各组每只雏鸭分别编号。3个组每天喂食充足的雏鸭配合饲料,对照组饮水不添加任何制剂,试验组分别每1 L饮水中添加1 g或3 g优速能A,则低剂量组和高剂量组中MCTs的浓度分别为1 g/L、3 g/L,并且保证饮水充足。翌日清洗饮具,更换新水,记录饮水量。饮水为城市自来水。
1.2.2 饲养管理及日粮 试验前对鸭笼及周边环境、实验用具进行彻底消毒处理,采用单层笼养,自由采食、饮水,饲养温度30℃左右。基础日粮是雏鸭配合饲料,为广东南海华海饲料厂生产的811快大小鸭配合饲料。
1.2.3 采食量与饮水量 计算平均采食量,饮水量以及耗料增重比。料重比=消耗饲料的重量/增重量
1.2.4 称重 记录试验0、5、10、15、20 d各组每只雏鸭的空腹体重,计算每组雏鸭在0 d~5 d、5 d~10 d、10 d~15 d、15 d~20 d不同时间内的平均增重及平均增重率。增重率=增重/初重×100%;增重=末重-初重。
1.2.5 甲状腺激素含量的测定 试验5、12、20 d非饥饿状态时,对各组雏鸭进行颈静脉采血,血液存入医用采血管,离心后取血清,分装备用。采用放射性免疫分析法测定血清中T3、T4、rT3的含量。
2 结果
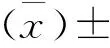
2.1 采食量与饮水量
本试验组添加的MCTs以饮水方式饲喂雏鸭,对照组与试验组的料重比没有显著性差异。试验组的采食量少于对照组的采食量,说明MCTs影响雏鸭的食欲,使雏鸭的食欲变差。试验组料重比小于对照组,说明MCTs会适当减少雏鸭的料重比,这两个方面均与其他人在MCTs对肉仔鸡的试验结果是一致的。
2.2 平均增重
按照增重=末重-初重计算(表2)。在0~5 d内,低剂量的(平均)增重显著高于对照组的(平均)增重(P<0.01);5~10 d内,低剂量组和高剂量组的增重均显著低于对照组(P<0.01);在10 d~15 d内,低剂量组的增重高于对照组,差异极显著(P<0.01);在15 d~20 d内,高剂量组的增重大于对照组,差异显著(P<0.05)。试验组的相对于对照组,虽然增重有显著性变化,但是试验组与对照组的总增重无显著差异,我们推测,雏鸭的生长发育可能存在稳态机制,通过饮水饲喂MCTs在一定时间内,雏鸭的总增重与对照组没有变化。

表1 各组平均采食量与饮水量

表2 在不同试验时间内各组的平均增重(g)
注:同阶段与对照组相比较,*差异显著,P<0.05;**差异极显著,P<0.01。
Note:Compared with control group,values with*and**in the same row mean significant difference at 0.05 and 0.01 level respectively.
2.3 平均增重率
按照增重率=增重/初重×100 %计算,结果见表3。在试验时间0~5 d内,低剂量组和高剂量组的增重率都显著高于对照组(P<0.05);在5 d~10 d内,低剂量组和高剂量组的增重率都显著低于对照组(P<0.05);在10 d~15 d内,低剂量组和高剂量组的增重率都显著高于对照组(P<0.05);但在15 d~20 d内,低剂量组或高剂量组的增重率与对照组相比,差异皆不显著(P>0.05)。图1直观地反映了这些特点。
在0~15 d内,就试验组的增重率与对照组进行比较,在0~5 d、5 d~10 d、10 d~15 d试验组的增重和对照组相比(差异显著)的情况分别是:高、低、高。试验组的增重率在对照组周围呈阶段式上下波动,可见试验组增重率出现先上升后下降再上升的变化趋势。
2.4 甲状腺激素含量的测定
2.4.1 T3含量的测定结果 试验第5 d时,添加MCTs的低剂量和高剂量组的T3含量均显著低于对照组T3的含量,差异极显著(P<0.05) ;试验第12 d和20 d时,高剂量组和低剂量组的T3含量与对照组的差异均不显著(P>0.05)。
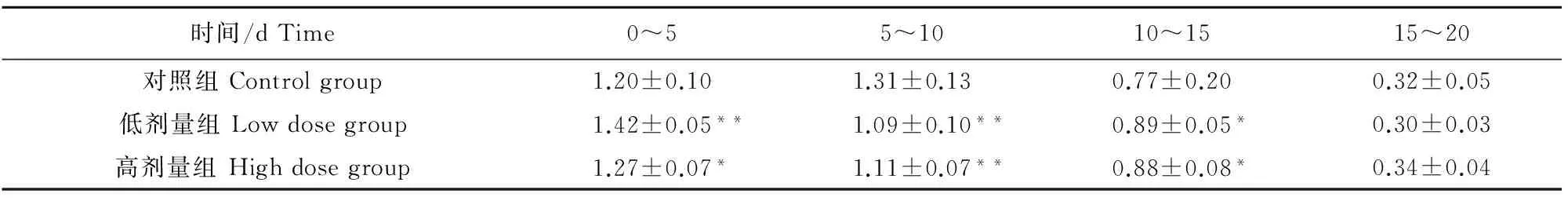
表3 在不同试验时间内各组的增重率(%)
注:*表示与对照组相比,差异显著(P<0.05),**表示差异极显著(P<0.01)。
Note:Compared with control group,values with*and** in the same column mean significant difference at 0.05 and 0.01 level respectively.
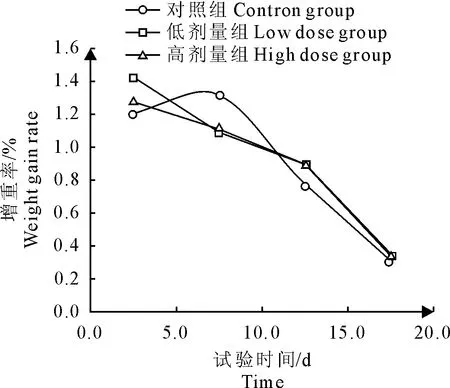
图1 各组增重率的变化

(ng/mL)
注:与对照组相比,*表示差异显著,P<0.05,**表示差异极显著,P<0.01。
Note:Compared with control group,values with*and** in the same row mean significant difference at 0.05 and 0.01 level respectively.

表5 各组的T4含量(μg/dL)
注:与对照组相比,*表示差异显著,P<0.05。
Note:Compared with control group,values with*in the same row mean significant difference at 0.05 level.
2.4.2 T4含量的测定结果 试验5 d和12 d时,高剂量组的T4含量均显著低于对照组,差异显著(P<0.05);第20天时,低剂量组和高剂量组的T4含量与对照组的差异不显著(P>0.05)。
2.4.3 rT3含量的测定结果 试验5 d和12 d,低剂量组和高剂量组的rT3含量均显著低于对照组,差异极显著(P<0.01);第20 d,低剂量组和高剂量组中rT3含量与对照组相比,差异均不显著(P>0.05)。

表6 各组的rT3含量(μg/L)
注:与对照组相比,*表示差异显著,P<0.05,**表示差异极显著,P<0.01。
Note:Compared with control group,values with*and** in the same row mean significant difference at 0.05 and 0.01 level respectively.
3 讨论
3.1 MCTs对雏鸭增重效果的影响
目前,普遍认为,MCFAs主要通过增加能量代谢、促进肝脏脂肪酸的氧化、控制食欲及消耗脂肪组织而降低体脂[7]。马允莉[8]报道在1日龄~57日龄肉鸡饲粮中添加0.4%~10.0% MCFAs,发现MCFAs可以降低肉鸡腹脂的重量。Mabayo R T等[9]比较了在等能日粮中分别添加 MCTs(辛酸甘油酯)和 LCTs(玉米油)对 8日龄~17日龄白色来航公鸡的饲喂效果,结果 MCTs组的日增重和饲料利用率比LCTs组分别高21.4 %和22.9 %,且蛋白质沉积率和利用率也显著提高。MCTs对肉仔鸡生长性能的研究结果并不一致,Furuse M[10]等发现与玉米油相比,MCTs会减少肉鸡采食量和耗料增重比,抑制体增重。Mabayo R T[9]给肉仔鸡饲喂等量等能值的日粮,发现MCTs会减少体增重和耗料增重比。
本试验中,通过饮水中添加MCTs的方式,发现MCTs对肉雏鸭在一定时间内的总增重没有明显影响,但在不同试验时间内的增重率有显著影响。在试验时间0 d~5 d内试验组雏鸭的增重快于对照组,在5 d~10 d内试验组的增重慢于对照组,且在10 d~15 d内试验组的增重又快于试验组,总结发现试验组增重率出现先上升后下降再上升波动性变化,这是试验前没有预料到的,且这个规律变化在其他文献还未见报道。这种增重率的呈上下震荡波动性规律变化,可能是由于肝脏在调节身体增重方面的调节在起作用。以MCTs作为营养因子刺激肝脏,或增加整体的能量供给,都会引起雏鸭增重短期的升高,但随后显著降低,说明多余的营养物并没有引起雏鸭持久的体重增加,特别是MCTs直接向肝脏供应营养时。说明这种局部供应中MCTs打破了雏鸭原有的身体能量平衡,而肝脏可能具有自动回稳机制。到目前还尚无此方面的报道。
3.2 MCTs在肝脏中的代谢与增重和甲状腺激素的关系
通过饮水添加MCFAs的方式,雏鸭增重率呈现先上升后下降再上升变化,可能与体内所含甲状腺激素的动态含量有关。由于T3的生物活性是T4的40倍,所以循环中T3水平的变化会给身体带来更大的影响。T3或T4过多会加速脂肪组织分解、蛋白质分解而引起氮的负平衡和肌肉萎缩以及糖原分解和肠道糖的吸收率增加,将会以消耗更多的能量物质满足身体的代谢水平,对增重呈负面影响。因此,甲亢患者往往身体消瘦,甲低患者趋于肥胖。在家禽中,T3具有相同的作用原理,0日龄肉鸡采食了含有T3的饲料后,雏鸡体重的增加与日粮中T3剂量呈负向相关[11],Jepson M M等[12]认为,T3很可能增加了基础代谢率和总代谢能,随后降低了对营养物质的利用率,结果用于生产的能量少了。因此,饲喂了含有T3能量的鸡在饲料转化率降低的同时体重减轻了。通过对本试验的总结,可以发现在试验时间0 d~5 d内,试验组雏鸭的增重率上升的同时,体内血清的T3含量却显著下降,这与T3的作用特点的不符正是由于MCTs对甲状腺激素的影响造成的。
当采用营养添加或生长发育调控措施时,各种因子的调节节点往往在5D-Ⅲ脱碘酶,其活性发生了变化,5′D-Ⅰ单脱碘酶的活性不变[13-14]。动物体内5′D-Ⅰ单脱碘酶的合成受到许多激素和非激素物质的影响,而甲状腺激素的影响最为突出[15]。理论上分析试验第5 d时,增重率升高可能是由于MCFAs增多导致T4向rT3转化和T3向T2转化所需的5D-Ⅲ单脱碘酶活性降低,而T4向T3转化和T4向rT3转化所需的5′D-Ⅰ脱碘酶的活性不变,所以rT3含量降低,T4含量升高,也使得游离T3的含量升高,因为下丘脑-垂体-甲状腺轴,T3对下丘脑和垂体有负反馈调节作用,T3浓度升高引起垂体分泌TSH量变少,最终导致甲状腺分泌T4也变少,T3含量也随着下降,所以雏鸭的增重率增加。这也与试验第5d时增重率显著上升,T3浓度显著下降的变化相同。但在试验12 d时,试验组的T3、T4和rT3含量均没有显著差异,说明MCTs对雏鸭的影响主要是在生长前期。MCTs对甲状腺激素的调节可能与肝脏的调节有关,也可能与下丘脑-垂体-甲状腺调节周有关,但哪个起主要作用,目前我们尚不能解释其真实的作用机制。
本试验以饮水添加MCTs方式,发现MCTs对雏鸭的增重和甲状腺激素含量有显著影响,探讨了其增重变化和甲状腺激素水平的关系,为以后探究MCFAs对雏鸭的增重和甲状腺激素机制方面的研究打下了基础,并为探讨MCTs对家禽的作用机制提供参考。
[1] 何志谦.人类营养学[M].北京:人民卫生出版社,1988.
[2] Rego Costa A C,Rosado E L,Soaresmota M.Influence of the dietary intake of medium chanin triglycerides on body composition,energy expenditure and satiety:A systematic review[J].Nutrición Hospitalaria,2012,27(1):103-108.
[3] 沈 同,王镜岩.生物化学[M].北京:高等教育出版社,1990.
[4] 何 健.中链甘油三酯在动物体内的代谢及应用研究[J].中国油脂,2004,29(1):14-17.
[5] Chiang S H,Pettigrew J E,Charke S D,et al.Limits of medium-chain and long-chain triacylglycerol utilization by neonatal piglets[J].J Animal Sci,1990,68(6):1632-1638.
[6] 杨金堂,黄克和,王建林.中链脂肪酸在畜牧业上应用的研究进展[J].畜牧与兽医,2009,41(5):100-105.
[7] Ooyama K,Kojima K,Aoyama T,et al.Decrease of food intake in rats after ingestion of medium-chain triacylglycerol[J].J Nutri Sci Vitaminol,2009,55(5):423-427.
[8] 马允莉.中链脂肪酸对鸡的影响[J].饲料研究,1997,3(3):29-30.
[9] Mabayo R T,Furuse M,Kita K,et al.Improvement of dietary protein utilization in chicks by medium-chain triglyceride[J].Bri Poult Sci,1993,34(1):121-130.
[10] Furuse M,Mabayo R T,Kita K,et al.Effect of dietary medium chain triglyceride on protein and energy utilization of growing chicks[J].Bri Poult Sci,1992,33(1):49-57
[11] Chang S C.Lin M J,Croom J,et al.Administration of triiodothyronine and dopamine to broiler chicks increases growth,feed conversion and visceral organ mass[J].Poult Sci,2003,82(2):285-293.
[12] Jepson M M,Bates P C,Millward D J,et al.The role of insulin and thyroid hormones in the regulation of muscle growth and protein turnover in response to diet-ary protein in the rat[J].Bri J Nutri,1988,59(3):397-415.
[13] Darras V M,Rudas P,Visser T J,et al.Endogenous growth hormone controls hi-gh plasma levels of 3,39,5-triiodothyronine (T3) in growing chickens by decreasing the T3-degrading Type III deiodinase activity[J].Domestic Animal Endocrinol,1993,10(1):55-65.
[14] Darras V M,Berghman L R,Vanderpooten A,et al.Growth hormone acutely dec-reases type III iodothyronine deiodinase in chicken liver[J].Febs Lett,1992,310(1):5-8.
[15] Santini F,Chopra I J,Wu S Y,et al.Metabolism of 3,5,3′-triiodothyronine sulf-ate by tissues of the fetal rat:a consideration of the role of desulfation of 3,5,3'-trii-odothyronine sulfate as a source of T3[J].Pediatric Res,1992,31(6):541-544.
EffectsofMedium-chainTriglycerideonWeightGainandLevelsofSerumThyroidHormonesinDucklings
KONG Xue,LIU Wei-min,ZHANG Ji-xiang
(DepartmentofVeterinaryMedicine,FoshanUniversity,Foshan,Guangdong,528000,China)
This experiment was to observe the effects of the medium-chain triglyceride on weight gains and levels of serum thyroid hormones of Cherry Valley ducks in the way of drinking water added medium-chain triglycerides (MCTs).48 five-day old ducklings were randomly divided into three groups,each group 16,respectively in control group(0 g/L drinking water) ,high dose group (3 g/L drinking water) and low dose group (1 g/L drinking water).During the trial period of 20 days,body weights were measured at 5ds intervals and serum samples were taken at 5th,12thand 20thday of the trial period.The levels of the thyroid hormones,including T4,T3 and rT3 were assessed with radioimmunoassay.The results showed that the weight gain rates of ducklings in experiment groups had a trend of accelerating in the first five days and then decreased in 6-10 days,and repeated these waving pattern in 11-20 days compared with the control group.The changes of the levels of thyroid hormones suggested that the liver involved the changing of the thyroid hormones and affected the body weight gains following drinking of MCTs.
duckling; medium-chain triglycerides; weight gain rate; thyroid hormone
2017-03-05
国家自然科学基金项目(31372389)
孔 雪(1991-),女,河北邯郸人,硕士研究生,主要从事基础兽医学研究。*
S852.2
A
1007-5038(2017)11-0076-05