猪链球菌2型感染的A549细胞表达谱研究
刘曼莉,方六荣,肖少波,陈焕春,谭 臣,石丽桥,王开梅,杨自文
(1.湖北省农业科学院生物农药工程研究中心,湖北武汉 430064;2.华中农业大学动物医学院,湖北武汉 430070)
猪链球菌2型感染的A549细胞表达谱研究
刘曼莉1*,方六荣2,肖少波2,陈焕春2,谭 臣2,石丽桥1,王开梅1,杨自文1
(1.湖北省农业科学院生物农药工程研究中心,湖北武汉 430064;2.华中农业大学动物医学院,湖北武汉 430070)
采用人全基因组芯片的方法研究猪链球菌2型感染的A549细胞中各基因的表达变化。结果表明,有130个基因的表达具有显著性差异,其中61个基因表达为上调,69个基因表达下调。通过分析,其中77个差异表达基因可分为32个生物学功能类别,包括了信号转导、细胞凋亡、Toll样受体信号通路、细胞分化等生物学过程。
猪链球菌2型;A549细胞;基因芯片;基因表达
猪链球菌(Streptococcussuis)是一种重要的细菌性传染病病原,33个血清型中猪链球菌2型(Streptococcussuisserotype 2,SS2)具有流行广、致病力强的特点,是一种重要的人兽共患传染病病原,能引起包括人和猪在内的多种动物的多种疾病,造成感染甚至死亡,严重影响养猪业的发展和人类健康[1]。感染猪链球菌2型菌能引起猪的败血症、脑膜炎、肺炎等病变,并造成突然死亡。人通过接触病死猪及其副产品经伤口、消化道感染猪链球菌2型,可引起人链球菌中毒休克综合征(STSS)和链球菌脑膜炎综合征(SMS),导致脑膜炎、败血症、肺炎、心内膜炎、永久性耳聋及突发性死亡等,病死率高[2]。1998年夏季,在我国江苏省部分地区暴发了人感染猪2型链球菌病,造成14人死亡;2005年夏季,猪2型链球菌病在四川省的暴发,造成204人发病,38人死亡[2]。
SS2感染猪和人之后主要导致脑膜炎、肺炎以及败血症等症状和病理变化。目前的研究大多集中在脑膜炎和败血症的形成,为了深入了解链球菌造成的肺炎的致病机制,本试验采用基因芯片的方法研究SS2感染人肺癌上皮细胞A549后,细胞基因表达谱的变化,为进一步研究感染机制和致病机理提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株 猪链球菌2型(Streptococcussuistype 2,S.suis2,SS2)SC19菌株由华中农业大学农业微生物国家重点实验室分离与保存。取冻干保存的猪链球菌2型菌种,划线接种于含100 mL/L血清的TSA培养平皿中,37℃培养过夜。挑取单菌落于含100 mL/L血清的TSB培养基中,37℃振荡培养至对数生长期。12 000 r/min离心沉淀细菌,加入PBS洗2次,12 000 r/min离心后去上清,加入一定量的PBS悬浮细菌,并稀释至约为1×107CFU/mL。
1.1.2 细胞 人肺癌细胞A549(CCL-185),购自中国典型培养物保藏中心(武汉大学保藏中心)。取长满单层的A549细胞,弃去培养液,加入3 mL胰酶-EDTA消化液洗细胞1次,加入2 mL消化液,于37℃培养箱中消化3 min~5 min,弃去消化液加入5 mL含100 mL/L胎牛血清的DMEM生长液轻轻吹打使之完全消化成单个细胞,按1∶3的比例传至3个T75细胞瓶中,于37℃、体积分数为5% CO2培养箱中培养过夜。
1.1.3 基因芯片 Affymetrix GeneChip®系列人类基因组表达谱芯片Human Genome U133 Plus 2.0 array,购自于上海晶泰生物技术有限公司,细胞样品总RNA的提取、与芯片的杂交均由该公司完成。
1.2 方法
1.2.1 猪链球菌2型感染A549细胞 在试验组A549细胞中加入一定量的SS2菌体至细菌和细胞的比例约为1∶1,同时,对照组细胞中加入相同体积的PBS做对照,每组做4个重复。感染3 h后(前期试验结果表明SS2作用细胞3 h,细胞状态正常,但随时间增加细胞存活率急剧下降,结果在此不做赘述)分别收集试验组和对照组的A549细胞,加入一定量的Trizol溶液,用无RNAase的吸管反复吹打以充分裂解细胞,混匀后分装于无RNAase的离心管中于-80℃保存。
1.2.2 实时荧光定量PCR对基因芯片结果进行验证 将与芯片相同的细胞样品提取RNA进行实时荧光定量PCR验证。RNA的提取按Trizol(Invitrogen公司)试剂说明书进行。选取基因表达谱芯片中的3个基因,同时,选取GAPDH为内参(引物序列见表1)。
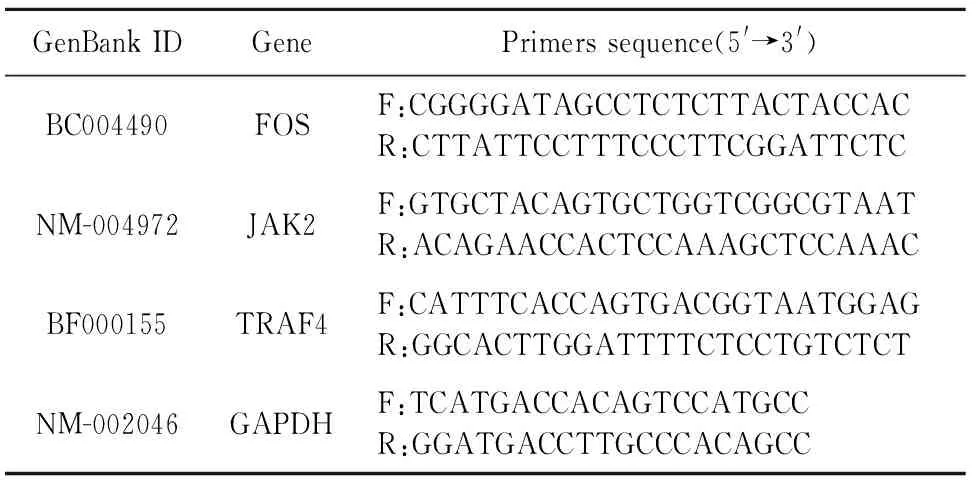
表1 实时荧光定量PCR所用引物序列
使用荧光定量SYBR Green Ⅰ试剂盒(TOYOBO QPK-201)进行实时荧光定量PCR反应,每个样品做3个重复。反应程序为:95℃ 60 s;接着40个循环:95℃ 15 s,60℃ 15 s,72℃ 45 s;在72℃延伸的时候收集荧光信号,整个反应过程包括荧光信号的收集及分析均在ABI Prism 7500实时荧光定量PCR仪中进行。
分析采用ΔΔCt方法:a.计算试验组和对照组中每个基因的ΔCt值。ΔCt(对照组基因)=Ct试验组基因-Ct试验组GAPDH;ΔCt(试验组基因)=Ct对照组基因-Ct对照组GAPDH;b.计算两组中每个基因的ΔΔCt。ΔΔCt=ΔCt(试验组基因)-ΔCt(对照组基因),计算2-ΔΔCt值,得到试验组与对照组所对应基因的表达差异。
2 结果
2.1 筛选差异表达基因
将感染了SS2的试验组A549细胞与表达谱芯片杂交后的信号值,与对照组A549细胞杂交的表达谱芯片的信号值相比较,计算组间的P值,当P≤0.05,且组间的信号值比值Fold Change (FC)≥2的转录本为上调(up-regulated),FC≤0.5的为下调(down-regulated),FC在0.5到2之间为无显著变化。试验结果中,共检测到130个有显著性差异表达变化的基因,其中61个基因的表达上调、69个基因的表达下调。
2.2 实时荧光定量PCR验证
通过实时荧光定量PCR的方法对3个目的基因(FOS、JAK2、TRAF4)进行扩增,获得试验组与对照组基因表达量的比值,结果与基因芯片的结果相比较,3个基因的差异表达变化是一致的(表2),虽然在数值上并不是完全相同,但这可能是因为两种方法的不相同所导致的,试验结果进一步证明了基因芯片的结果是可信的。

表2 实时荧光定量PCR方法验证芯片的结果
2.3 差异表达基因的功能分析
将芯片中找到的差异表达基因,通过DAVID的Gene Ontology分析,发现A549细胞感染SS2后,130个差异表达基因中,89个基因的功能较清晰,其中77个差异表达基因在所属的GO BP分类中涉及32个主要的生物学过程,包括信号转导、细胞凋亡、Toll样受体信号通路、细胞分化等生物学过程。将这89个基因的信息输入STRING进行蛋白分析,找到具有密切联系的23个基因(图1)。
2.4 差异表达基因的KEGG PATHWAY和BIOCARTA代谢通路分析
差异表达基因通过DAVID的分析,获得14个基因涉及BIOCARTA代谢通路,其中较为明确的通路为Regulation of MAP Kinase Pathways Through Dual Specificity Phosphatases,涉及的基因为DUSP1和DUSP6。35个基因涉及KEGG PATHWAY(部分基因见表3),涉及的通路包括有MAPK信号通路、PI3K-Akt信号通路、NOD样受体信号通路、AMPK信号通路、钙信号通路、细胞黏附因子等。
3 讨论
猪链球菌病在全球已经成为影响养猪业的重要细菌性传染病,也是一种重要的人兽共患传染病。研究发现SS2能黏附多种上皮细胞和单核细胞[3],这可能是SS2在上呼吸道定植的原因。溶血素是SS2的一种重要的毒力因子[3-4],对细胞具有一定的毒性作用,是SS2进入血液的过程中重要的因素[5-7]。SS2可被巨噬细胞吞噬,或以细胞外的形式进入血液然后随血液进入其他部位[8-10]。进入血液的SS2造成败血症,而且SS2侵入血脑屏障(BBB)也能造成脑膜炎[2,11]。SS2的毒力因子(如SLY)可以诱导猪、人或鼠的细胞释放大量的促炎细胞因子[12-15]。

图1 23个差异表达基因的关系图
现有的研究大多集中在脑膜炎和败血症的致病机制,对肺炎的研究较少。本试验通过基因芯片技术研究人肺癌细胞A549感染猪链球菌2型后,筛选出130个基因的表达量有显著的变化,通过分析,其中的77个基因分别在98个生物学过程中发挥不同的作用。其中涉及基因数量最多的为regulation of molecular function、response to organic substance和regulation of signaling,都包含了21个基因。基因JAK2、NFKBIB、C3、CTGF、DUSP1、DUSP6、GREM2、NR4A2在这3个类别中均有涉及,主要参与了MAPK信号通路、Toll样受体信号通路、趋化因子信号通路等。
DUSP1也可以称MKP1,是MKP家族中的一员。定位于细胞核的DUSP1在细胞内主要催化已活化的MAPK家族成员,特别是p38 MAPK激酶与JNK激酶中酪氨酸和苏氨酸磷酸基团的水解失活,从而抑制其活性。而DUSP6(MKP-3)定位于细胞质中,负调控ERK2的磷酸化水平,在RAS-MAPK信号通路中发挥重要的生理调节功能[16],可作为一个免疫标记物在肝癌、胰腺癌、乳腺癌、食管鳞癌等疾病中有着重要的诊断价值[17-18]。SS2感染与DUSP1、DUSP6的关系并不明确,而肺炎链球菌的溶血素试验证明可经MAPK途径诱导人脐静脉血管内皮细胞凋亡[19]。同时,有研究表示肺炎链球菌导致中耳炎,主要由于黏蛋白分泌表达过剩造成的,而黏蛋白也能激活MKP-1,负调控ERK相关的炎症反应[20-21]。因此,研究猪链球菌感染时DUSP1和DUSP6的作用及相关的MAPK通路,有助于研制新的抗感染药物。
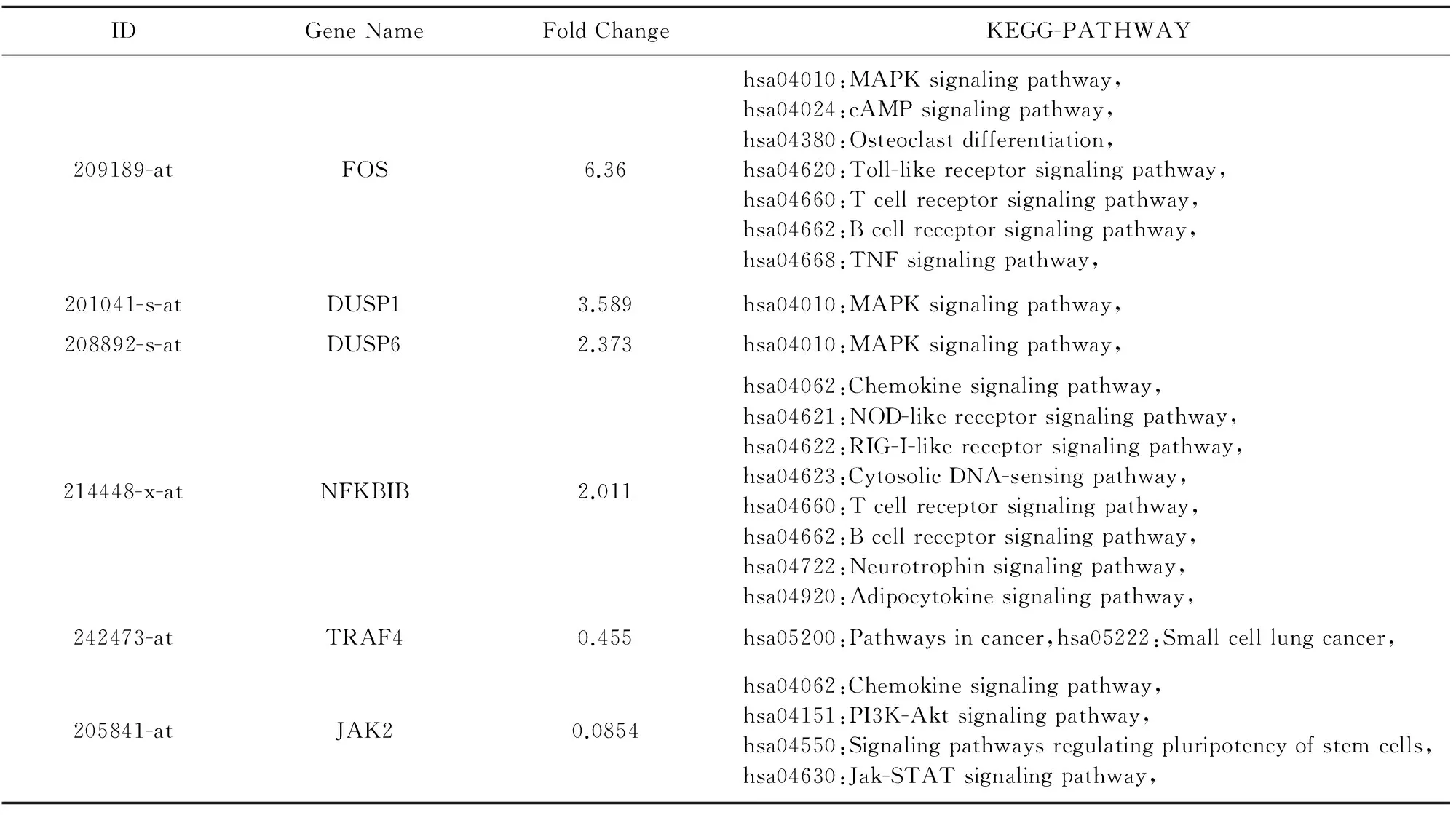
表3 差异表达基因涉及的KEGG PATHWAY
FOS是细胞核内的转录因子,在cAMP信号通路、Toll样受体信号通路、TNF信号通路等发挥作用。当ERKs接受上游的级联反应信号,转位进入细胞核,磷酸化核内的转录因子FOS、c-JUN等。通常,FOS在机体细胞中的表达量极低,但当机体缺血、外伤、癫痫和外周神经刺激时,FOS的表达迅速增加,参与细胞凋亡和神经元修复等作用[22]。猪链球菌感染后FOS的表达上调,也许可以作为标记物在猪链球菌感染的诊断中得到应用。
NFKBIB又称TRIP-9、IKB-β,是NF-κB抑制剂家族中的一个转录因子,通常在细胞质中,阻止NF-κB的转录。NFKBIB的功能不是很明确,通常认为当细胞受到外界因素,如细菌或病毒感染、紫外线照射、电离辐射等刺激后,IKB发生磷酸化并迅速降解,NF-κB被释放、激活并进入细胞核,与特异性DNA位点结合,从而启动一系列基因的转录,发挥其重要的生物学作用,包括调控机体的免疫状态、细胞凋亡等[23-24]。
JAK2在本试验结果中是显著的下调的。JAK2是一种非受体酪氨酸激酶,是JAK家族的一员,是通过诱导胞质信号级联来调控各种不同细胞过程。JAK2主要参与IL-3、GM-CSF、IL-5、血小板生成因子Tpo和IFN-γ的信号通路。缺失JAK2的小鼠由于不能生成红细胞而导致胚胎死亡[25]。JAK2在肺炎球菌EstA诱导的炎症反应中起着重要作用[26]。JAK2能激活NF-κB应对细菌内毒素的反应,而且,由于抑制JAK2的表达能调节巨噬细胞的活化和抑制炎症细胞因子的产生,在败血症的治疗中引起关注[27]。
TRAF4是TNF受体相关因子,TRAFs家族是一类胞内接头蛋白,能直接或间接与多种TNF和IL-1/Toll样受体家族成员结合,介导下游信号通路的信号传导,如NF-κB信号通路、JNK信号通路相关,参与细胞存活、分化、凋亡等[28]。
猪链球菌溶血素(suilysin,SLY)是已知的猪链球菌2型的主要毒力因子之一,SLY能裂解宿主细胞,帮助细菌逃避宿主的免疫系统攻击[29]。研究表明SLY可以激活多种免疫细胞产生前炎症因子TNF-α,并且能通过TLR4介导炎症反应,激活转录因子NF-κB进入细胞核完成TNF-α的转录[20]。SLY 与猪链球菌性脑膜炎致病过程中猪链球菌的黏附、侵袭及相关炎性因子的释放均有密切的关系。纤维蛋白原(fibrinogen)通过与细胞上的CD11b/CD18结合激活NF-κB、MAPK/PI3K参与细胞黏附、迁移、趋化性和吞噬作用等,帮助猪链球菌突破血脑屏障(BBB)[21]。枯草杆菌素样丝氨酸蛋白酶(SspA)能诱导巨噬细胞中IL-1β、IL-6、TNF-α、CXCL8和CCL5的表达[30]。
通过本试验检测到多个与MAPK信号通路、NF-κB信号通路、Toll样受体信号通路等密切相关的基因是之前的报道中没有提及的,它们参与了细胞分化、增殖、凋亡等生物过程,发挥着不同的生物学功能。这些基因及相关通路将为深入研究SS2致病机制以及抗菌药物的研发提供依据。
[1] Gottschalk M,Lebrun A,Wisselink H,et al.Production of virulence-related proteins by Canadian strains ofStreptococcussuiscapsular type 2[J].Can J Vet Res,1998,62:75-79.
[2] Tang J,Wang C,Feng Y,et al.Streptococcal toxic shock syndrome caused byStreptococcussuisserotype 2[J].PLoS Med,2006,3:e151.
[3] Gottschalk M,Segura M.The pathogenesis of the meningitis caused byStreptococcussuis:the unresolved questions[J].Vet Microbiol,2000,76:259-272.
[4] Wisselink H J,Vecht U,Stockhofe-Zurwieden N,et al.Protection of pigs against challenge with virulentStreptococcussuisserotype 2 strains by a muramidase-released protein and extracellular factor vaccine[J].Vet Rec,2001,148:473-477.
[5] Staats J J,Feder I,Okwumabua O,et al.Streptococcussuis:past and present[J].Vet Res Commun,1997,21:381-407.
[6] Staats J J,Plattner B L,Nietfeld J,et al.Use of ribotyping and hemolysin activity to identify highly virulentStreptococcussuistype 2 isolates[J].J Clin Microbiol,1998,36:15-19.
[7] Norton P M,Rolph C,Ward P N,et al.Epithelial invasion and cell lysis by virulent strains ofStreptococcussuisis enhanced by the presence of suilysin[J].FEMS Immunol Med Microbiol,1999,26:25-35.
[8] Williams A E,Blakemore W F.Pathogenesis of meningitis caused byStreptococcussuistype 2[J].J Infect Dis,1990,162:474-481.
[9] Charland N,Harel J,Kobisch M,et al.Streptococcussuisserotype 2 mutants deficient in capsular expression[J].Microbiology,1998,144:325-332.
[10] Smith H E,Damman M,van der Velde J,et al.Identification and characterization of the cps locus ofStreptococcussuisserotype 2:the capsule protects against phagocytosis and is an important virulence factor[J].Infect Immun,1999,67:1750-1756.
[11] Charland N,Nizet V,Rubens C,et al.Streptococcussuisserotype 2 interactions with human brain microvascular endothelial cells[J].Infect Immun,2000,68:637-643.
[12] Segura M,Vadeboncoeur N,Gottschalk M.CD14-dependent and-independent cytokine and chemokine production by human THP-1 monocytesstimulated byStreptococcussuiscapsular type 2[J].Clin Exp Immunol,2002,127(2):243-254.
[13] 刘建涛,张 强,宋娅静,等.猪链球菌2型表面蛋白分支酸合成酶通过p38MAPK和NF-κB通路促进TLR4依赖的炎性反应[J].畜牧兽医学报,2014,45(11):1866-1873.
[14] Graveline R,Segura M,Radzioch D,et al.TLR2-dependent recognition ofStreptococcussuisis modulated by thepresence of capsular polysaccharide which modifies macrophage responsiveness[J].Int Immunol,2007,19(4):375-389.
[15] Bonifait L,Grenier D.The SspA subtilisin-like protease ofStreptococcussuistriggers a pro-inflammatory response in macrophages through a non-proteolytic mechanism[J].BMC Microbiol,2011,11:47.
[16] Denu J M,Dixon J E.A catalytic mechanism for the dual-specific phosphatases[J].Proc Natl Acad Sci USA,1995,92(13):5910-5914.
[17] Bermudez O,Pages G,Gimond C.The dual-specificity MAP kinase phosphatases:critical roles in development and cancer[J].Am J Physiol Cell Physiol,2010,299(2):189-202.
[18] Xu S,Furukawa T,Kanai N,et al.Abrogation of DUSP6 by hypermethylation in human pancreatic cancer[J].J Hum Genet,2005,50(4):159-167.[19] 贺 潇.肺炎链球菌溶血素经MAPK途径诱导人脐静脉内皮细胞凋亡[D].重庆医科大学,2011:237-240.
[20] Bi L,Pian Y,Chen S,et al.Toll-like receptor 4 confers inflammatory response to Suilysin[J].Front Microbiol,2015,6:644.
[21] Ryu J K,Davalos D,Akassoglou K.Fibrinogen signal transduction in the nervous system[J].J Thromb Haemost,2009,1:151-154.
[22] Eisenman L M,Tran M H,Scott Donovan H.Acute ethanol administration produces specific patterns of localization of Fos-immunoreactivity in the cerebellum and inferior olive of two inbred strains of mice[J].Brain Res,2002,952(1):135-141.
[23] McKenna S,Wright C J.Inhibiting IκBβ-NFκB signaling attenuates the expression of select pro-inflammatory genes[J].J Cell Sci,2015,128(11):2143-2155.
[24] Thompson J E,Phillips R J,Erdjument-Bromage H,et al.I kappa B-beta regulates the persistent response in a biphasic activation of NF-kappa B[J].Cell,1995,80(4):573-582.
[25] Neubauer H,Cumano A,Muller M,et al.Jak2 deficiency defines an essential developmental checkpoint in definitive hematopoiesis[J].Cell,1998,93(3):397-409.
[26] Gebru E,Kang E H,Damte D,et al.The role of Janus kinase 2 (JAK2) activation in pneumococcal EstA protein-induced inflammatory response in RAW 264.7 macrophages[J].Microb Pathog,2011,51(4):297-303.
[27] Pena G,Cai B,Deitch E A,et al.JAK2 inhibition prevents innate immune responses and rescues animals from sepsis[J].J Mol Med,2010,88(8):851-859.
[28] Zhang X,Wen Z,Mi X.Expression and anti -apoptotic function of TRAF4 in human breast cancer MCF-7 cells[J].Oncol Let,2014,7(2):411-414.
[29] 贺政新.SLY 蛋白与 2 型猪链球菌感染[D].中国人民解放军军事医学科学院,2009.
[30] Bonifait L,Vaillancourt K,Gottschalk M,et al.Purification and characterization of the subtilisin-like protease ofStreptococcussuisthat contributes to its virulence[J].Vet Microbiol,2011,148:333-340.
StudyonMicroarrayGeneExpressionProfileofA549CellsInfectedwithStreptococcussuisType2
LIU Man-li1,FANG Liu-rong2,XIAO Shao-bo2,CHEN Huan-chun2,TAN Chen2,SHI Li-qiao1,WANG Kai-mei1,YANG Zi-wen1
(1.HubeiBiopesticideEngineeringResearchCentre,HubeiAcademyofAgriculturalSciences,Wuhan,Hubei,430064,China;2.HuangZhongAgriculturalUniversity,Wuhan,Hubei,430070,China)
The microarray was used to study the different expressions of genes in A549 cells after theStreptococcussuistype 2 infection.In the results,130 genes were expressed differentially,including 61 up-regulated genes and 69 down-regulated genes.By Biological process classification,77 major DE genes involved in 32 biological function types,including signal transduction,apoptosis,Toll-like receptor signaling pathway and differentiation.
Streptococcussuistype 2; A549; microarray; gene expression
2017-04-06
国家重点研发计划项目(2017YPD0500202);湖北省农科院青年基金项目(2015NKYJJ18);湖北省农科院创新岗位项目(2016-620-000-001-039)
刘曼莉(1982-),女,广东惠州人,助理研究员,博士,主要从事抗菌药物的研究。*
S852.611
A
1007-5038(2017)11-0006-05