小剂量内毒素预处理对大鼠心肌缺血再灌注损伤的作用及其机制*
何 川 李银萍 姚 兰 廉应涛 徐 松 陆礼萍 余 追,#
小剂量内毒素预处理对大鼠心肌缺血再灌注损伤的作用及其机制*
何 川1李银萍2姚 兰1廉应涛1徐 松1陆礼萍1余 追1,#
目的观察小剂量内毒素(LPS)预处理对心肌缺血再灌注损伤(IRI)大鼠的作用及其机制。方法30只健康雄性SD大鼠,随机分为假手术组(Sham组)、IRI组、内毒素各剂量(0.1mg/kg,0.5mg/kg,1mg/kg)预处理组(LPS组),每组各6只;IRI组采用结扎左冠状动脉前降支(LAD)30min、再灌注4h的方法制备心肌IRI模型;LPS各剂量组分别于术前24h腹腔注射LPS 0.1mg/kg、0.5mg/kg、1mg/kg,其余处理同IRI组;Sham组只穿线不结扎。各组分别于再灌注4h结束后下腔静脉采血并摘取心脏,HE染色观察心肌组织病理学改变,全自动生化分析仪检测血清心肌酶(LDH、AST)含量,ELISA检测血清炎性因子白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)的表达水平。结果与Sham组比较,IRI组大鼠血清LDH、AST、IL-1β和IL-10明显升高(P<0.01),LPS各剂量组血清LDH、AST和IL-1β均较IRI组明显降低(P<0.05或P<0.01),而LPS各剂量组间LDH、AST和IL-1β差异无统计学意义(P>0.05)。IRI组、LPS 0.1mg/kg组、LPS 1mg/kg组IL-10含量无统计学差异(P>0.05),而LPS 0.5mg/kg组IL-10含量较IRI组和LPS 0.1mg/kg组升高(P<0.05或P<0.01)。结论小剂量LPS预处理对心肌IRI有保护作用,其机制与促进抗炎因子IL-10及抑制促炎因子IL-1β的表达有关,且该保护作用不呈剂量依赖性。
内毒素预处理;心肌缺血再灌注损伤;心肌酶;炎症因子;大鼠
冠心病(Coronary Heart Disease ,CHD)是世界范围内引起伤亡的主要原因之一,心梗发生后,及时、有效的心肌灌注是减小心梗面积、提高临床预后的最佳策略。然而,遭受一定时间缺血的心肌组织在恢复血流的过程中,其损伤程度反而会加剧,引起结构破坏和功能障碍的加重,该现象即为心肌缺血再灌注损伤(Ischemia and Reperfusion Injury,IRI)[1, 2],因而,IRI可能是当前治疗心梗心肌保护措施的一个盲点,故探讨IRI的发生机制并寻找预防和治疗IRI的疗法将是此后研究的重点。
研究表明,对心肌IRI给予不同剂量的内毒素(LPS)(0.1-1 mg/kg)预处理可以改善心肌功能,减小心肌梗死面积,从而能对IRI心肌产生保护作用[3-8]。本研究拟参考上述剂量,建立大鼠IRI模型,观察小剂量LPS预处理对IRI大鼠心肌酶及炎性因子的影响,探讨小剂量LPS预处理对IRI的作用及其机制。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠30只,体重200-250g,由武汉大学人民医院动物实验中心提供,随机分为假手术组(Sham组)、IRI组、不同剂量LPS(0.1mg/kg、0.5mg/kg、1mg/kg)预处理组,每组6只。
1.2 实验药品、仪器及试剂
LPS(Escherichia coli 0111:B4;L4130)购于Sigma Aldrich(3050 Spruce Street, Saint Louis, MO 63103, 美国);全自动生化分析仪(Siemens;Advia2400)及公司原装配套测定试剂盒(批号:LDH,401338;AST,401294);白细胞介素-10(IL-10)ELISA检测试剂盒(R&D公司生产,批号:P135337),白细胞介素-1β(IL-1β)ELISA检测试剂盒(eBioscience生产,批号:145535023)。实验前将100mg LPS溶于10ml PBS中,浓度为10mg/ml,分装至10只玻璃瓶,-20℃保存,用时取出稀释至所需浓度,每只大鼠按1kg/ml给药。
1.3 动物模型制备及各组动物处理
大鼠经腹腔注射2.5%戊巴比妥钠(45mg/kg)麻醉,仰卧位固定四肢,分别将针型电极置于四肢皮下,并连接Powerlab心电图记录系统记录II导联心电图。按照Yao等[4]方法建立大鼠IPI模型:颈部切开行气管插管,于胸骨左侧断肋开胸暴露心脏,剪开心包,以在乳胶管凹槽内打结结扎左冠前降支(LAD),以结扎点以下心室肌变白、心电图出现ST段抬高或与高耸T波融合为结扎成功的标志。实验过程中观察动物心电图变化、呼吸情况。缺血30min后剪开线结行再灌注,建立IRI模型,关胸缝合,待呼吸稳定后拔除气管插管并缝合颈部皮肤。其中Sham组于术前24h腹腔注射相应量生理盐水,仅穿线不结扎LAD;IRI组于术前24h腹腔注射相应量生理盐水,LPS各剂量组分别于术前24h腹腔注射LPS 0.1mg/kg,0.5mg/kg,1mg/kg, 并按前述方法结扎LAD 30min后行再灌注4h。
1.4 标本采集及检测指标和方法
各组再灌注4h后经下腔静脉采血,3 000r/min离心15min分离血清,-80℃冻存备用,全自动生化分析仪检测血清LDH、AST含量,ELISA检测血清IL-10、IL-1β含量,操作按仪器和试剂说明书进行。采血后开胸取出心脏,冲洗表面血迹及心肌组织间血迹,取结扎点以下发白心室肌置于4%甲醛溶液中,4℃固定24-48h,常规HE染色后光学显微镜下观察其病理改变。
1.5 统计学处理
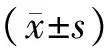
t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠血清LDH、AST水平变化
各组大鼠血清LDH、AST水平差异均有统计学意义(P<0.01)。与Sham组比较,IRI组LDH、AST浓度明显升高(t=3.53、7.37,P<0.01);LPS各剂量组LDH、AST相较于IRI组明显降低,但仍高于Sham组(t均>2.89,P<0.05或P<0.01),而LPS各剂量组间LDH、AST水平比较差异无统计学意义(t均<1.04,P>0.05)。见表1。

表1 各组大鼠血清LDH、AST含量比较均=6)
注:与Sham组比较,1)P<0.05,2)P<0.01;与IRI组比较,3)P<0.01
2.2 各组大鼠心肌组织病理学的变化
各组心肌组织经HE染色后可见:Sham组心肌纤维排列整齐、紧密,胞质、胞核染色均匀,仅有少量出血,水肿程度较轻,无坏死、凋亡、炎性细胞浸润等;IRI组心肌纤维断裂,排列疏松、间隔明显,出血、水肿加重,可见细胞坏死,炎性细胞浸润严重等;LPS 0.1mg/kg组心肌纤维间隔明显,有少量出血、水肿,坏死、炎性细胞浸润仍较重;LPS 0.5mg/kg组心肌纤维间隔仍然存在,出血、水肿较重,炎性细胞浸润减轻,可见坏死;LPS 1mg/kg组心肌纤维排列较为整齐,间隔明显减轻,水肿、坏死明显减轻,但出血仍较重,无明显炎性细胞浸润。见图1。
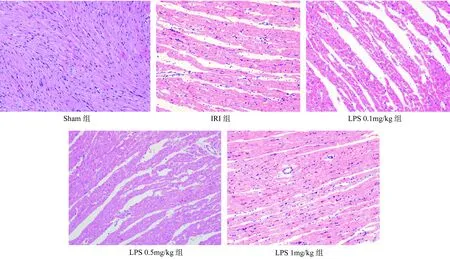
图1 各组大鼠心肌组织病理学变化(HE,×200)
2.3 各组大鼠血清IL-1β、IL-10含量的变化
各组大鼠血清IL-1β、IL-10含量差异均有统计学意义(P<0.01)。与Sham组比较,IRI组IL-1β、IL-10明显升高(t=3.01、2.64,P<0.01);LPS各剂量组IL-1β相较于IRI组降低,差异有统计学意义(t=3.79、3.56、2.22,P<0.05或P<0.01),且与Sham组差异无统计学意义(t均<1.56,P>0.05)。LPS 0.1mg/kg组、LPS 1mg/kg组及IRI组IL-10含量差异无统计学意义(t均<1.98,P>0.05);LPS 0.5mg/kg组IL-10含量高于LPS 0.1mg/kg组和LPS 1mg/kg组,差异有统计学意义(t均>2.36,P<0.05)。见表2。
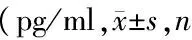
表2 各组大鼠血清IL-1β、IL-10含量的比较均=6)
注:与Sham组比较,1)P<0.01; 与IRI组比较,2)P<0.05;3)P<0.01; 与LPS 0.1mg/kg组和LPS 1mg/kg组比较,4)P<0.05
3 讨论
急性心梗可致心肌细胞坏死,造成细胞内心肌酶急剧释放,随后当梗死心肌表面血管再通时,心肌酶可由梗死心肌大量进入血液中,导致血液中心肌酶浓度显著升高[9],因此,血液中心肌酶的浓度可反映心肌细胞的损伤程度。本实验结果表明,IRI发生后,大鼠血清LDH、AST水平显著升高,同时病理学检查显示心肌纤维断裂,排列疏松、间隔明显,出血、水肿加重,可见细胞坏死,炎性细胞浸润严重等,说明心肌发生严重损伤。而在给予小剂量LPS预处理后,血清LDH、AST水平均降低,且心肌纤维排列趋于整齐,出血、水肿、坏死、炎性细胞浸润等病理改变在各剂量组均有改善,即小剂量LPS预处理对IRI心肌有保护作用,但各剂量组之间保护作用并无差别,即小剂量LPS预处理对IRI心肌的保护作用并不存在剂量依赖性。该结果的出现可能与动物个体差异有关,或样本量少不足以反映整体情况,也可能是由于药物发挥作用的内在机制所致。
心肌IRI的发生机制与氧化应激、钙超载、pH异常、炎症反应、能量代谢障碍等有关[1],其中炎症反应是心肌细胞与多种细胞及介质相互作用的过程[10]。IL-10在心肌IRI中发挥着重要的抗炎作用,有研究在犬心肌IRI模型中发现,在缺血再灌注心肌中IL-10 mRNA及其蛋白表达上调,且IL-10主要由CD5+淋巴细胞和一小部分巨噬细胞产生[11],而这部分内源性的IL-10可通过抑制肿瘤坏死因子-α(TNF-a)、一氧化氮(NO)的产生来抑制中性粒细胞聚集,并减小心肌梗死面积,减轻心肌细胞坏死[12]。IL-1β是一种促炎因子,具有调节免疫反应的作用,可诱导机体产生前列腺素E2、IL-2等炎性介质,更重要的是,在合并有再灌注损伤和心肌肥厚的各类心血管疾病中,IL-1β可介导心肌早期纤维化和非梗死区域代偿性心肌肥厚[13]。
LPS可参与IL-10、IL-1β水平的调节,在内毒素耐受的分子机制中,LPS首先被免疫细胞表面的Toll样受体4(TLR4)识别,在TLR4信号下游有两个信号分子:髓样分化因子88(MyD88)和β干扰素TIR结构域转接蛋白(TRIF)。MyD88通路可以激活下游的核因子-κB(NF-κB)分子,进而促进促炎因子的表达,如TNF-a,IL-1β,IL-6等;TRIF通路可以激活下游的干扰素调节因子3(IRF3)及信号转导和转录激活因子I(STATl),引起干扰素β(IFN-β)及干扰素诱导分子的释放。另据报道,由TRAF3和I型干扰素介导的TRIF通路激活还可以产生如IL-10升高等内毒素耐受的其它表现[14]。Hiasa等[15]发现,LPS预处理对心肌IRI的保护作用部分是通过阻断NF-κB的激活,从而减轻炎性因子的表达而产生的。此外,在反复给予人单核细胞白血病(THP-1)细胞E.coli LPS刺激后,与给予单次刺激相比,TNF-a、IL-1β的分泌显著降低,而IL-10水平升高[16]。心肌发生IRI后引起一系列的炎症损伤,负反馈机制激活了抗炎反应,IL-10作为一种保护因素被激活,致血清IL-10水平升高;给予小剂量LPS预处理的各组,IL-10水平继续升高,且0.5mg/kg组较IRI组升高明显(P<0.05),但同时IL-1β明显下降,提示小剂量LPS预处理可进一步激活IL-10的表达,增强抗炎作用。该项结果与前述心肌酶的变化以及心肌病理组织学检查结果也是一致的,说明小剂量LPS预处理可通过抗炎作用对抗心肌IRI,且各剂量LPS组该种保护作用无明显差异。
综上所述,给予小剂量LPS预处理可通过抗炎作用发挥对心肌缺血再灌注损伤的保护作用,而该保护作用是否呈剂量依赖性还需要进行更稳定的、大样本的深入研究。
◀
本文第一作者简介:
何川(1989-),女,汉族,硕士研究生,研究方向为脓毒症性器官功能损害
1 Yellon DM, Hausenloy DJ. Myocardial reperfusion injury[J]. N Engl J Med, 2007, 357(11): 1 121-1 135.
2 Hausenloy DJ, Yellon DM. Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J]. J Clin Invest, 2013, 123(1): 92-100.
3 Ha T, Hua F, Liu X, et al. Lipopolysaccharide-induced myocardial protection against ischaemia/reperfusion injury is mediated through a PI3K/Akt-dependent mechanism[J]. Cardiovasc Res, 2008, 78(3): 546-553.
4 Yao YW, Zhang GH, Zhang YY, et al. Lipopolysaccharide pretreatment protects against ischemia/reperfusion injury via increase of HSP70 and inhibition of NF-κB[J]. Cell Stress Chaperones,2011,16(3): 287-296.
5 Brown JM, Grosso MA, Terada LS, et al. Endotoxin pretreatment increases endogenous myocardial catalase activity and decreases ischemia-reperfusion injury of isolated rat hearts[J]. Proc Natl Acad Sci USA,1989,86(7): 2 516-2 520.
6 Yamashita N, Hoshida S, Otsu K, Taniguchi N, Kuzuya T, Hori M. Monophosphoryl lipid A provides biphasic cardioprotection against ischaemia-reperfusion injury in rat hearts[J]. Br J Pharmacol,1999,128(2): 412-418.
7 Zacharowski K, Otto M, Hafner G, et al. Endotoxin induces a second window of protection in the rat heart as determined by using p-nitro-blue tetrazolium staining, cardiac troponin T release, and histology[J]. Arterioscler Thromb Vasc Biol, 1999, 19(9): 2 276-2 280.
8 Fan MH, Wong KL, Wu S, et al. Preconditioning with Porphyromonas gingivalis lipopolysaccharide may confer cardioprotection and improve recovery of the electrically induced intracellular calcium transient during ischemia and reperfusion[J]. J Periodontal Res,2010,45(1): 100-108.
9 Li X, Shao D, Wang G, et al. Effects of different LAD-blocked sites on the development of acute myocardial infarction and malignant arrhythmia in a swine model[J]. J Thorac Dis,2014,6(9): 1 271-1 277.
10 Rohrbach S, Troidl C, Hamm C, et al. Ischemia and reperfusion related myocardial inflammation: A network of cells and mediators targeting the cardiomyocyte[J]. IUBMB Life, 2015, 67(2): 110-119.
11 Frangogiannis NG, Mendoza LH, Lindsey ML, et al. IL-10 is induced in the reperfused myocardium and may modulate the reaction to injury[J]. J Immunol,2000, 165(5): 2 798-2 808.
12 Yang Z, Zingarelli B, Szabó C. Crucial role of endogenous interleukin-10 production in myocardial ischemia/reperfusion injury[J]. Circulation, 2000, 101(9): 1 019-1 026.
13 Deten A, Volz HC, Briest W, et al. Cardiac cytokine expression is upregulated in the acute phase after myocardial infarction. Experimental studies in rats[J]. Cardiovasc Res, 2002,55(2): 329-340.
14 Biswas SK, Lopez-Collazo E. Endotoxin tolerance: new mechanisms, molecules and clinical significance[J]. Trends Immunol, 2009, 30(10): 475-487.
15 Hiasa G, Hamada M, Ikeda S, et al. Ischemic preconditioning and lipopolysaccharide attenuate nuclear factor-kappaB activation and gene expression of inflammatory cytokines in the ischemia-reperfused rat heart[J]. Jpn Circ J,2001, 65(11): 984-990.
16 Sun Y, Li H, Sun MJ, et al. Endotoxin tolerance induced by lipopolysaccharides derived from Porphyromonas gingivalis and Escherichia coli: alternations in Toll-like receptor 2 and 4 signaling pathway[J]. Inflammation, 2014, 37(1): 268-276.
EffectandMechanismofLow-doseEndotoxinPretreatmentonMyocardialIschemiaRererfusionInjuryinRats
HE Chuan1,LI Yin-ping2,YAO Lan1,LIAN Ying-tao1,XU Song1,LU Li-ping1,YU Zhui1,#
1Department of Critical Care Medicine,Renmin Hospital of Wuhan University,Wuhan 430060,China;2Department of pathology and pathophysiology,School of Basic Medical Sciences,Wuhan University,Wuhan 430071,China.#Corresponding author
Objective: To investigate the effect and mechanism of low-dose LPS pretreatment on myocardial ischemia reperfusion injury in rats.MethodThirty male Sprague-Dawley rats were randomly divided into the following groups:sham group, ischemia-reperfusion injury group(IRI), lipopolysaccharide (LPS) pretreatment groups: 0.1mg/kg, 0.5mg/kg and 1mg/kg,6 in each group.The rats in the IRI groups were subjected to LAD occlusion for 30min follwed by reperfusion for 4h. LPS preconditioning groups were injected intraperitoneally with LPS 0.1mg / kg, 0.5 mg/kg, or 1 mg/ kg 24h before the surgery,and the rest operation was the same as the IRI group.While the animals in the sham group underwent surgical manipulation without ligature of the LAD.At the end of 4h reperfusion, to observe myocardial pathological changes by HE staining,the contents of myocardial enzymes(LDH,AST)
were detected by automatic biochemical analyzer,and the levels of interleukin-10 (IL-10) and interleukin-1β (IL-1β) were measured by enzyme linked immunosorbent assays.Results: Compared with sham group, the serum levels of LDH,AST,IL-1B and IL-10 in IRI group were significantly higher (P<0.01). After pretreated with LPS, the expression levels of LDH,AST and IL-1β in each dose group were remarkably decreased than those in IRI group (P<0.01 orP<0.05) without substantive difference discovered between these groups(P>0.05). In LPS pretreatment groups, as for the IL-10 expression levels, significant differences merely existed between the pretreatment group at the dose of 0.5 mg/kg and the IRI group(P<0.05).Conclusion: Low dose of LPS pretreatment before myocardium suffering ischemia reperfusion injury can induce cardioprotection by promoting the expression of anti-inflammatory factor IL-10 and inhibiting the activation of inflammatory parameter IL-1β,and the protective effect does not work in a dose-dependent manner.
LPS pretreatment; Myocardial ischemia-reperfusion injury; Myocardial enzymes;Inflammatory factors; Rat
10.3969/j.issn.1005-1740.2017.04.006
R541.4
A
1005-1740(2017)04-0029-05
武汉市科技局课题(2015060101010045)
1武汉大学人民医院重症医学科,武汉430060;2武汉大学基础医学院病理学与病理生理学系,武汉430071;#
,E-mail:yuzhui@whu.edu.cn
本文2017-09-16收到,2017-10-30修回

