津力达颗粒预处理对高糖诱导小鼠胰岛微血管内皮细胞和人脐静脉内皮细胞增殖及凋亡的影响*
董 靖 乐 岭,# 向光大 向 林 刘 敏 倪 静 王 永 叶丽姿
津力达颗粒预处理对高糖诱导小鼠胰岛微血管内皮细胞和人脐静脉内皮细胞增殖及凋亡的影响*
董 靖1乐 岭1,#向光大1向 林1刘 敏1倪 静2王 永2叶丽姿2
目的观察中药津力达颗粒预处理对高糖诱导的小鼠胰岛微血管内皮细胞(MS-1)及人脐静脉内皮细胞(HUVEC)增殖及凋亡的影响。方法体外培养MS-1及HUVEC株,均随机分为正常浓度葡萄糖(5.5mmol/L)培养组(正常对照组)、高浓度葡萄糖(33mmol/L)培养组(高糖组)、不同浓度津力达颗粒(12.5μg/ml、25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml)预处理24h后再高糖培养组(津力达组),各组平行培养48h后收集细胞,MTT法检测细胞增殖水平,流式细胞术检测细胞凋亡,包括总凋亡指数(TAI)和早期凋亡指数(EAI)。结果与正常对照组比较,高糖组MS-1及HUVEC增殖水平(OD值)下降(P<0.01),TAI和EAI升高(P<0.01)。与高糖组比较,津力达组MS-1及HUVEC增殖水平随药物浓度增加而升高(P<0.01),至津力达浓度800μg/ml时与正常对照组差异无统计学意义(P>0.05)。津力达组MS-1和HUVEC的TAI及EAI则随药物浓度增加而降低(P<0.01),但尚不能回复至正常对照组水平。结论中药津力达颗粒升高MS-1及HUVEC增殖水平,降低MS-1及HUVEC的TAI和EAI,从而可能对胰岛功能及血管内皮功能具有一定保护作用。
津力达颗粒;胰岛微血管内皮细胞;人脐静脉内皮细胞;小鼠
我国糖尿病患病人数居全球首位,成为全球面临的重大公共卫生问题。控制好血糖是临床治疗的前提[1];保护好胰岛β细胞功能是关乎糖尿病进展的重要因素[2]。而胰岛微循环异常不仅直接危害胰岛功能,也可能介导周围血管并发症的发生。因此,如何保护胰岛微血管内皮细胞、早期改善胰岛功能及防治血管并发症是重要临床课题。
中药津力达颗粒常用于治疗2型糖尿病(T2DM)。近年来的临床及基础研究均表明津力达颗粒能有效控制血糖、调节脂质代谢、改善胰岛素抵抗、保护胰岛β细胞功能,多角度干预糖尿病及其并发症[3-6];但其对高糖诱导的胰岛微血管内皮细胞(MS-1)及人脐静脉内皮细胞(HUVEC)增殖和凋亡的改善作用的报道较少。故本研究利用高糖诱导小鼠MS-1及HUVEC损伤,观察津力达颗粒预处理对MS-1及HUVEC增殖和凋亡的影响,为其保护胰岛功能和防治T2DM血管并发症提供实验依据。
1 材料与方法
1.1 主要材料、试剂和仪器
MS-1株(编号: CL-0162) 和HUVEC株(编号: CL-0122)均购自武汉普诺赛生命科技有限公司(液氮保存)。津力达颗粒由石家庄以岭药业股份有限公司提供(国药准字Z20050845)。D-葡萄糖分析纯购自国药集团化学试剂有限公司(批号:WHC20060621);低糖(5.5mmol/L)DMEM培养基购自美国Hyclone公司(货号:JM-SH30021.01B);高糖培养基自配,即称取D-葡萄糖溶于DMEM培养基,配制成终浓度33mmol/L葡萄糖溶液,0.22 μm微孔滤膜除菌分装,4℃保存。0.25% 胰酶购自美国 Gibco 公司(货号: 15050065); 10%胎牛血清购自美国 Corning 公司(货号:35-076-CV);细胞增殖检测试剂盒(MTT)购自美国Sigma公司(货号:KA1334);Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物公司(货号:KGA108)。流式细胞仪购自美国BD 公司(型号:BD FACSCalibur);倒置显微镜购自日本OLYMPUS株式会社(型号:IX51);低速离心机购自德国Eppendorf公司(型号:5702R);细胞培养皿、细胞培养瓶购自美国Corning公司。
1.2 细胞扩增培养
将MS-1及HUVEC分别从液氮中取出,快速放入37°C水浴锅中,轻摇冻存管快速溶解;室温1 000rpm离心5min,弃上清;用含10%胎牛血清的完全培养基悬浮细胞, 接种到含100μg/ml青霉素、100μg/ml链霉素和10% 胎牛血清的5ml DMEM培养基中,轻轻吹打混匀后, 置于37℃ 5% CO2饱和湿度培养箱中,每2天换液一次,当生长至80%融合时,用0.25%胰酶消化;收集细胞,离心去上清,在原瓶中以1∶2或1∶3传代培养。
1.3 细胞分组培养
取对数生长期、生长良好的MS-1及HUVEC,用DMEM培养基调整细胞密度为3×104/ml,接种96孔板,每孔200μl,同时在细胞孔周围孔内加入100μl无菌PBS设为空白组,37℃培养过夜后分组,进行条件培养:正常对照组(采用5.5mmol/L 葡萄糖培养)、高糖组(采用33mmol/L 葡萄糖培养)、津力达组(分别采用12.5、25、50、100、200、400、800μg/ml津力达先行培养MS-1及HUVEC 24h,再加入高糖与其它组平行培养)。48h后收集各组细胞检测以下指标。
1.4 MTT法检测细胞增殖
条件培养MS-1及HUVEC,每组3孔,每孔加入20μl MTT,37℃培养4h;吸出培养基,加入150μl二甲基亚砜震荡10min;于酶标仪568nm波长处测定各孔吸光度(OD值),OD值与细胞增殖水平成正比。
1.5 流式细胞术检测细胞凋亡
先用PBS对各组条件培养MS-1和HUVEC润洗2次,胰酶消化,1 500rpm离心5min后弃上清,加入500μl Binding Buffer,重悬细胞;再先后加入5μl AnnexinV-FITC和5μl PI,分别混匀,室温避光反应5-15min。同时设阴性对照(不加Annexin和PI)、阳性对照1(以凋亡效果最明显的溶剂组作为阳性对照,只加5μl AnnexinV单标)、阳性对照2(以凋亡效果最明显的溶剂组作为阳性对照,只加5μl PI单标),上流式细胞仪检测,用CELL Quest软件对结果散点图进行分析,获得由四个象限组成的细胞直方图(cytogram),每个象限的细胞数目是检测细胞总数所在点的组分。左上象限(FITC-/PI+)为机械损伤细胞,左下象限(FITC+/PI-)为正常活细胞,右上象限(FITC+/PI+)为晚期凋亡或死亡细胞,右下象限(FITC+/PI-)为早期凋亡细胞。每组细胞检测各重复3次,取平均值。计算总凋亡指数(TAI)和早期凋亡指数(EAI),均为凋亡细胞数/(凋亡细胞数+非凋亡细胞数),即TAI=(左下象限+右下象限)AI,EAI=右下象限 AI。
1.6 统计学处理
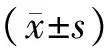
2 结果
2.1 各组MS-1和HUVEC增殖水平比较
各组MS-1和HUVEC增殖水平(OD值)差异均有统计学意义(P<0.01)。高糖组MS-1和HUVEC的OD值明显低于正常对照组(t=135.47和t=94.28,P<0.01)。津力达各浓度组MS-1和HUVEC的OD值均显著高于高糖组(t=34.26和t=295.23,P<0.01),且浓度越大,升高越显著(r=0.627,P<0.01),至800μg/ml时其OD值与正常对照组差异无统计学意义(P>0.05)。见表1。
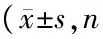
表1 各组MS-1和HUVEC增殖水平(OD值)比较均=3)
注:与正常对照组比较,1)P<0.01;与高糖组比较,2)P<0.05;3)P<0.01
2.2 各组MS-1和HUVEC凋亡指数比较
各组MS-1和HUVEC的TAI及EAI差异均有统计学意义(P<0.01)。高糖组MS-1和HUVEC的TAI及EAI较正常对照组显著升高(t均≥59.91,P<0.01),津力达各浓度组MS-1和HUVEC的TAI及EAI较高糖组明显降低(t均≥8.33,P<0.01),且浓度越大,降低越明显(r=-0.547,P<0.01),但各仍然明显高于正常对照组(t均≥8.2865,P<0.01)。见表2、图1、图2。
3 讨论
糖尿病最主要的临床特点是高血糖,血管内皮细胞,包括胰岛微血管内皮细胞都可能成为高血糖直接攻击的靶细胞。研究显示,内皮细胞的正常增殖受抑和凋亡增加首先引起内皮功能失调,进而导致动脉粥样硬化等糖尿病性心血管疾病的发生、发展[7]。因此,研究糖尿病MS-1和胰岛外血管内皮细胞代谢异常及其改善和拮抗策略,对保护胰岛功能、防治糖尿病血管并发症具有重要临床意义。
胰岛微血管是胰岛功能和结构的基础,其内皮细胞(MS-1)衬托于微血管内壁,成为机体与胰岛β细胞对话的“桥梁”,亦能为胰岛提供营养物质,调节胰岛分泌各种激素,维持机体代谢平衡[8]。各种病理因素,包括高糖所致MS-1损伤均有可能导致胰岛微血管功能和结构异常,以及胰岛功能损害。本研究采用高糖体外培养小鼠MS-1和HUVES,观察其增殖及凋亡情况,结果发现高糖不仅能抑制MS-1增殖,促进MS-1凋亡,而且对胰岛外HUVEC亦可使其增殖受抑、凋亡增加,表明高浓度葡萄糖不论对胰岛微血管还是外周血管均能造成严重损害。与有关报道[9,10]相一致。

表2 各组MS-1和HUVEC TAI及EAI比较均=3)
注:与正常对照组比较,1)P<0.01;与高糖组比较,2)P<0.01

注:1.正常对照组;2.高糖组;3.津力达12.5μg/ml组;4.津力达25μg/ml组;5.津力达50μg/ml组;6.津力达100μg/ml组;7.津力达200μg/ml组;8.津力达400μg/ml组;9.津力达800μg/ml组
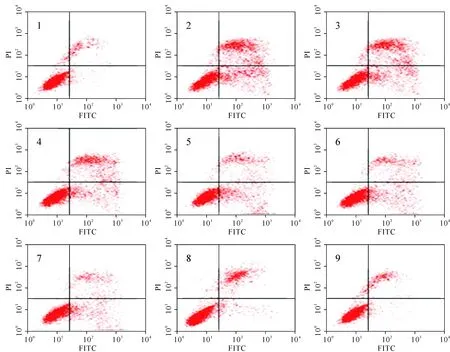
注:1.正常对照组;2.高糖组;3.津力达12.5μg/ml组;4.津力达25μg/ml组;5.津力达50μg/ml组;6.津力达100μg/ml组;7.津力达200μg/ml组;8.津力达400μg/ml组;9.津力达800μg/ml组
津力达颗粒由人参、黄精、苍术、苦参、麦冬、生地、何首乌等17味中药组成,以健脾助运、益气养阴为主要治疗原则,旨在通过恢复脾转输水谷津液正常功能,纠正饮食水谷津液在输布利用及代谢过程中的不平衡状态,达到标本兼治的目的。很多临床和基础研究[3-6,11-13]业已证实,津力达颗粒可以降低血糖,治疗糖尿病及其血管并发症,其主要通过改善胰岛功能,拮抗胰岛素抵抗,保护胰岛β细胞及胰岛信号通路来实现其干预效益。本文采用津力达颗粒预处理MS-1和HUVEC,从细胞层面观察到由高糖诱导的MS-1和HUVEC增殖水平降低和细胞凋亡(包括TAI和EAI)增加,在津力达颗粒作用后明显改善,细胞增殖水平升高,AI降低,且与药物浓度呈现良好的量效关系,再次验证津力达颗粒对胰岛微血管和外周血管的保护作用,但这种药物保护的具体机制尚需进一步研究。
综上所述,津力达颗粒能够明显改善高糖诱导的MS-1和HUVEC的增殖及凋亡,因此可对胰岛微血管和胰岛功能及其它血管内皮功能起到保护作用。但本研究仅为细胞层面,存在一定局限性,尚需从分子水平,并结合临床认证其效果。
◀
本文第一作者简介:
董靖(1986-),女,汉族,硕士,住院医师,主要研究方向为糖尿病血管内皮病变
1 Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults [J] . JAMA, 2013, 310(9): 948-959.
2 Guillausseau PJ, Meas T, Virally M, et al. Abnormalities in insulin secretion in type 2 diabetes mellitus [J]. Diabetes & Metabolism, 2008, 34(1): S43-S48.
3 赵林双, 陈利锋. 津力达颗粒联合降糖药治疗2型糖尿病患者的临床研究[J]. 华南国防医学杂志, 2014, 28(8): 764-766.
4 王少蓉. 津力达颗粒治疗糖尿病及对胰岛功能的作用观察[J]. 陕西中医, 2015, 36(8): 1009-1011.
5 郭 强, 朱玉霞, 赵 欢, 等. 津力达颗粒联合西医降糖药物对2型糖尿病胰岛素抵抗影响的系统评价[J]. 中成药, 2015, 37(7): 1 440-1 446.
6 郑全理, 申姗姗, 杨飞丹. 二甲双胍联合津力达颗粒治疗初诊2型糖尿病的疗效及对胰岛功能的影响[J]. 临床合理用药, 2016, 9(16): 77-78.
7 Winn RK, Harlan JM. The role of endothelial cell apoptosis in inflammatory and immune diseases[J]. Journal of Thrombosis and Haemostasis, 2005, 3(8): 1815-1824.
8 Putz Z, Kempler P’Jermendy G. Diabetes-specific complications in prediabetes[J]. Orv Hrtil, 2009, 150(47): 2 139-2 145.
9 Xiang GD, Wang YL. Regular aerobic exercise training improves endothelium-dependent artery dilation in patients with impaired fasting glucose[J]. Diabetes Care, 2004, 27(3): 801-802.
10 Xiang GD, Sun HL, Zhao LS. Changes of osteoprotegerin before and after insulin therapy in type 1 diabetic patients [J]. Diabet Res Clin Pract, 2007, 76(2): 199-206.
11 史婧丽, 吴 莹, 宋玉萍, 等. 津力达颗粒对糖尿病大鼠胰岛β细胞的保护作用[J]. 第二军医大学学报, 2012, 33(4): 385-389.
12 沈山梅, 金 玺, 房其军, 等. 津力达中药颗粒对胰岛素抵抗大鼠肝脏氧化应激及胰岛素信号通路的影响[J]. 中国糖尿病杂志, 2014, 6(8): 584-588.
13 李 婷, 柳 洁. 津力达颗粒改善2型糖尿病胰岛素抵抗及血管并发症的临床研究[J]. 世界中医药. 2015, 10(12): 1 883-1 886.
EffectofJinLidaGranaonProliferationandApoptosisofIsletMicrovascularCellsandHumanUmbilicalVeinEndothelialCellsCulturedWithHighGlucose
DONG Jing1,YUE Ling1,#,XIANG Guang-da1,XIANG Lin1,Liu Min1,Ni Jing2,WANG Yong2,YE Li-zi2
1Department of Endocrinology, Wuhan General Hospital of the Chinese People's Liberation Army, Wuluo Road 627, Wuhan 430070, China;2Hubei University of Chinese Medicine,Wuhan 430070, China;#Corresponding author
Objective: The purpose of study is to investigate the effect of Jin Lida grana on proliferation and apoptosis of mice islet microvascular cells (MS-1)and human umbilical vein endothelial cells (HUVECs) induced by high glucose in vitro.MethodThe cultured MS-1 and HUVECs were treated with normal glucose group (5.5 mmol/L glucose),high glucose group (33mmol/L glucose) and Jin Lida groups(12.5μg/ml,25μg/ml,50μg/ml,100μg/ml,200μg/ml,400μg/ml,800μg/ml pretreat for 24h)for 48h, respectively. cell viability was measured by MTT, cell apoptosis were assessed by flow cytometry.ResultsCompared with normal glucose group, the viability of MS-1 and HUVECs was decreased(P<0.01), the apoptosis of MS-1 and HUVECs was dramatically increased in high glucose group (P<0.01). Compared with high glucose group, the viability of MS-1 and HUVECs in Jin Lida group was increased with concentration of Jin Lida(P<0.01), there was no statistically difference between 800μg/ml Jin Lida group and normal glucose group(P>0.05).The apoptosis of MS-1 and HUVECs in Jin Lida group were
本文2017-02-16收到,2017-07-30修回
significantly decreased which was negatively related to the drug concentration(P<0.01), but still higher than that in control group.Conclusion: Jin Lida maybe improve islet function and endothelial function by promoting proliferation and inhibiting apoptosis of cells induced by high glucose.
Jin lida grana; Islet microvascular cells; Human umbilical vein endothelial cells;Mice
10.3969/j.issn.1005-1740.2017.04.002
R587.1
A
1005-1740(2017)04-0006-06
国家自然科学基金(81570730)
1中国人民解放军武汉总医院内分泌科,武汉 430070;2湖北中医药大学,武汉 430070;#
,电话:027-50772192;E-mail: yuelingwh@163.com

