血管内皮靶向微泡对兔心肌缺血再灌注损伤的超声分子显像*
邓 倾 王益佳 周 青 陈金玲 曹 省 胡 波 姜 楠
血管内皮靶向微泡对兔心肌缺血再灌注损伤的超声分子显像*
邓 倾 王益佳 周 青#陈金玲 曹 省 胡 波 姜 楠
目的构建针对血管内皮细胞损伤的靶向微泡,实现对兔心肌缺血再灌注损伤的靶向显像。方法构建血管内皮细胞间黏附分子-1(ICAM-1)靶向阳离子微泡(TCMB)和非靶向普通阳离子微泡(CMB),肿瘤坏死因子α(TNF-α)活化培养至70%融合的原代人脐静脉内皮细胞(HUVEC)/脐静脉,CMB和TCMB分别以2.0 dynes/cm2的剪切应力通过平行板流动腔连接的细胞培养皿/脐静脉,比较CMB和TCMB对HUVEC/脐静脉的靶向粘附能力。20只新西兰大耳兔随机分为CMB组和TCMB组,每组各10只,参照相关文献方法制备心肌缺血再灌注损伤模型,耳缘静脉注射1ml浓度均为2×108个/ml的CMB(CMB组)和FITC二抗标记的TCMB(TCMB组),比较CMB和TCMB对兔心肌缺血再灌注损伤的靶向显像能力。结果CMB与TCMB的粒径差异无统计学意义(2.90±1.90μm vs 3.10±2.10μm,P>0.05),CMB表面电位高于TCMB(+31.30±3.90mV vs +22.00±2.40mV,P<0.01)。与活化血管内皮细胞粘附的TCMB数量是CMB的19.4倍,与脐静脉粘附的TCMB声强度是CMB的3倍,差异均有统计学意义(P<0.01)。TCMB可在兔心肌缺血再灌注损伤区域的冠脉内定向聚集,实现靶向超声分子显像,而CMB无明显靶向显像功能;TCMB组兔损伤区域心肌声强比是CMB组的1.86倍,差异有统计学意义(P<0.01)。结论ICAM-1靶向微泡能与损伤的血管内皮细胞特异性粘附,实现对心肌缺血再灌注损伤的靶向超声分子显像。
心肌缺血再灌注损伤;细胞间粘附分子-1;靶向微泡;超声;分子显像;兔
及时的血运重建,特别是经皮冠状动脉介入治疗(PCI)的广泛开展,显著降低了急性心肌梗死(AMI)患者的死亡率,已成为治疗AMI的首选方法。然而,急诊PCI术后出现的心肌缺血再灌注损伤,是AMI病死率不能进一步降低的重要原因。目前临床上缺乏早期诊断心肌缺血再灌注损伤的有效手段[1]。研究表明,心肌缺血再灌注损伤时冠脉内皮细胞功能障碍,内皮细胞激活使黏附分子表达上调,血管内皮细胞间黏附分子-1(Intercellular Adhesion Molecule-1, ICAM-1)大量释放,使炎性细胞浸润,血小板激活,加重心肌损伤和微循环障碍[2]。ICAM-1的大量释放是血管内皮细胞损伤的标志,可依此作为超声分子显像的靶点,从而对血管内皮损伤进行早期直观检测[3]。介于此,本研究拟在微泡表面连接ICAM-1抗体,构建针对损伤血管内皮细胞的靶向微泡,为实现对心肌缺血再灌注损伤的靶向显像提供实验依据。
1 材料与方法
1.1 动物、试剂与设备
20只成年雄性新西兰大耳兔,体重2.0-2.5kg(武汉生物制品研究所),本院刚娩出的胎儿脐带一根。二硬酯酰磷脂酸胆碱 (DSPC,Sigma-Aldrich公司,德国),聚乙二醇二硬脂酰磷脂酰乙胺 (DSPE-PEG 2000,Avanti Polar Lipids公司,美国),DSPE-PEG 2000 生物素 (Avanti Polar Lipids公司,美国),磷脂酰磷脂酸(DPPA,Sanofi Genzyme公司,瑞士),3β-[N-(N’,N’-二甲基胺乙基)胺基甲酰基]胆固醇 (DC-Chol,Avanti Polar Lipids公司,美国),生物素标记的ICAM-1抗体(博奥森公司,北京),FITC-标记的IgG二抗(Abcam公司,美国),亲和素(Sigma-Aldrich公司,德国),倒置荧光显微镜 (Olympus公司,日本),Zetasizer Nano S颗粒粒度及电位检测仪(Malvern公司,英国),Philips iE33超声显像仪(Philips公司,美国)。本实验经武汉大学人民医院伦理委员会批准。
1.2 靶向微泡的制备及鉴定
将DSPC、DSPE-PEG 2000、DPPA、DC-Chol按照摩尔比(39%∶1%∶40%∶20%)混合,辅料为甘油和PBS,50℃水浴45min,4℃冰箱冷却,再置于50℃水浴45min,以全氟丙烷置换瓶中空气,振荡1 min,构建普通阳离子微泡(Cationic Microbubble, CMB)。用生物素-亲和素桥接法构建ICAM-1靶向微泡(Targeted Cationic Microbubbles, TCMB),大致方法同CMB制作。以DSPE-PEG 2000生物素替换DSPE-PEG 2000(其它条件与构建CMB相同),构建生物素化的阳离子微泡,添加足量的亲合素(30μg/ml)使微泡过度亲和素化后添加生物素标记的ICAM-1抗体,混匀,4℃静置30min,PBS洗涤3次去除未结合的抗体,构建ICAM-1靶向微泡。采用Zetasizer Nano S颗粒粒度及电位检测仪检测微泡的粒径及表面电位,倒置荧光显微镜观察微泡形态。为了验证ICAM-1抗体成功与微泡连接,将FITC-标记的IgG二抗与靶向微泡孵育(1∶100,4℃,30 min),洗涤3次去除未结合游离抗体,取悬浮微泡,稀释后荧光显微镜下观察微泡与抗体连接情况。
1.3 靶向微泡与人脐静脉血管内皮细胞(HUVEC)的体外粘附实验
1.4 靶向微泡对人脐静脉内皮的靶向粘附
采用人脐静脉模拟血管,构建血管内皮损伤模型。具体方法:取刚娩出的胎儿脐带一根,截取无产钳损伤的部分,切成两段(约10cm),用肝素冲洗,去除脐静脉内血块,用产钳夹住脐带一端,在另一端注入含TNF-α(浓度为50ng/ml)的内皮细胞培养基,37℃孵育4h,使脐静脉血管内皮细胞活化,大量表达ICAM-1,模拟血管内皮损伤时细胞的状态[4]。随后将脐静脉两端用支架固定在水槽中,微量输液泵分别将2ml CMB和TCMB均以2.0dynes/cm2的剪切应力通过脐静脉[5],微泡混悬液注射完毕后替换为PBS溶液,以相同剪切应力通过脐静脉,5 min后用Philips iE33超声显像仪连接10MHz的高频探头置于水槽中贴附于脐静脉血管表面,观察微泡与脐静脉的粘附情况。Qlab 6.0分析软件(Philips公司,美国)检测与脐静脉内皮粘附微泡的声强度。
1.5 靶向微泡对兔心肌缺血再灌注损伤的靶向显像
1.5.1兔心肌缺血再灌注损伤模型的建立:参照既往文献报道[6],构建兔心肌缺血再灌注损伤的动物模型:20只大耳兔随机分为CMB组和TCMB组,每组各10只通过耳缘静脉注射戊巴比妥钠(30mg/kg)进行麻醉,连接心电图。开胸,暴露心脏,结扎左冠脉前降支,在结扎处垫一小PE管,打活接。结扎成功后,兔心肌逐渐变苍白,心肌运动明显减弱,心电图ST段抬高大于2mm。持续1h后松开结扎线,恢复冠脉血供,以心电图ST段回落大于50%为灌注恢复的标志。
1.5.2靶向微泡对兔心肌缺血再灌注损伤的靶向显像:待冠脉恢复血供1h后通过兔耳缘静脉注射1ml浓度均为2×108个/ml的CMB(CMB组)和FITC二抗标记的TCMB (TCMB组),S5-1心脏探头观察微泡在心腔及心肌内充盈情况,待心腔内微泡完全消退后1min,采集梗死区心肌图像,存储动态图像,Qlab 6.0定量分析软件分析梗死区微泡的声强,采用声强比来表示心肌缺血再灌注区域内的微泡聚集量,声强比=前壁再灌注区声强度/下壁正常区声强度。
1.5.3心脏组织冰冻切片检测图像采集完毕,注射致死剂量戊巴比妥钠处死家兔,心脏停跳后瞬时“Flash”击碎微泡,使微泡表面的荧光染料瞬间释放至冠脉内皮,快速冰冻切片,荧光显微镜下观察缺血再灌注区域内冠脉内皮的荧光情况,以未梗死区正常心肌组织作对照。
1.6 统计学处理
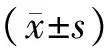
2 结果
2.1 靶向微泡的理化性质及鉴定
CMB与TCMB的粒径差异无统计学意义(2.90±1.90μm vs 3.10±2.10μm,n均=8,t=0.107,P>0.05),CMB表面电位高于TCMB(+31.30±3.90mV vs +22.00±2.40mV,n均=8,t=6.321,P<0.01)。光镜下,CMB和TCMB均为边缘光滑的圆形气泡,荧光显微镜下,CMB表面无荧光,TCMB周围可见明亮的绿色荧光(图1),表明FITC标记的IgG二抗与靶向微泡表面的ICAM-1抗体特异性结合,证实ICAM-1靶向微泡构建成功。
2.2 靶向微泡与HUVEC的体外粘附
平行板流动腔试验显示静息状态下,CMB和TCMB与HUVEC均无明显粘附。当TNF-α激活HUVEC后,CMB与HUVEC有少量粘附,而TCMB则大量粘附于HUVEC表面(图2)。微泡计数显示TNF-α激活后每高倍镜视野中粘附在HUVEC表面的TCMB 和CMB的数量分别为155±14个和 8±3个(t=31.950,P<0.01),前者是后者的19.4倍。
2.3 靶向微泡对人脐静脉内皮的靶向粘附
由于CMB和TCMB有相同的粒径,在超声场中有相同的显像效果。在流动环境中,TCMB大量粘附在TNF-α激活的脐静脉内皮表面,致脐静脉内壁声强明显增强,而CMB则无明显粘附(图3)。TCMB组脐静脉内壁声强是CMB组的3倍(分别为25.60±7.30dB和 8.20±2.60dB,t=21.334,P<0.01)。

图1 TCMB的形态学鉴定(荧光显微镜,×400)

图2 CMB和TCMB与HUVEC的体外粘附 (倒置显微镜,×400)

注:红色虚线标记为脐静脉内壁
2.4 靶向微泡对兔心肌缺血再灌注损伤的靶向显像
CMB在心肌梗死再灌注区域内无明显聚集,而TCMB在心肌梗死再灌注区域(左室前壁)可见较多聚集。TCMB组左室前壁声强度明显高于CMB组(图4)。TCMB组的心肌声强比是CMB组的1.86倍(2.08±0.29 vs 1.12±0.22,t=12.943,P<0.01)。
2.5 兔心肌组织冰冻切片
冰冻切片显示TCMB组再灌注区域的冠脉内皮可见明亮的绿色荧光,而正常心肌组织的冠脉内皮无明显荧光(图5)。

注:红色箭头示兔心脏左室前壁缺血再灌注损伤靶区

图5 靶向微泡对损伤冠脉内皮的靶向粘附(荧光显微镜,×100)
3 讨论
超声分子影像是近年来兴起的一项新技术。该技术通过在超声造影剂表面连接特异性的配体,构建靶向超声造影剂,靶向超声造影剂通过血液循环积聚到特定的目标组织上并在靶区滞留,从而使目标组织在超声场中的图像得到特异性的标记增强[7,8]。本研究构建针对损伤血管内皮的靶向微泡,使靶向微泡通过血液循环在心肌缺血再灌注损伤区域的冠脉内积聚,从而实现对心肌缺血再灌注损伤的超声分子显像。
研究表明心肌缺血再灌注损伤时,缺血和损伤的细胞释放大量的促炎介质,如白细胞介素(IL),TNF等,使冠脉内皮细胞激活,激活的冠脉内皮细胞表面表达大量炎性黏附分子,介导白细胞的粘附反应和血小板的活化,从而加重心肌微循环障碍[9,10]。在所有炎性黏附分子中,ICAM-1是最主要的一种。心肌缺血再灌注2h后,冠脉内皮细胞表面的ICAM-1表达即明显增加,再灌注24h后达到峰值,并持续较长时间[11]。ICAM-1在心肌缺血再灌注损伤过程中的这种表达特点决定其可作为超声分子显像的有效靶点。
本研究通过生物素-亲和素桥接法成功构建ICAM-1靶向微泡。生物素和亲合素具有高度的亲和力,在生理情况下能够牢固结合,荧光显微镜下可见ICAM-1抗体与微泡有效结合,较均匀地分布在微泡表面。平行板流动腔试验显示,TCMB大量粘附在TNF-α激活的HUVEC周围, CMB仅有极少量非特异性粘附,而在未经TNF-α激活的HUVEC周围,无论是TCMB还是CMB均无明显粘附,表明TCMB能与活化的血管内皮细胞特异性结合,具有良好的靶向性。随后采用TNF-α刺激人脐静脉构建血管内皮损伤模型,发现TCMB能与人脐静脉内皮靶向粘附,实现血管内皮损伤的超声靶向显像,定量分析显示,与脐静脉内皮粘附的TCMB声强度是CMB的3倍,靶向显像效果良好。
人脐静脉虽然能在一定程度模拟血管功能,但模型中的剪切应力低于生理情况下冠脉血流剪切应力,TCMB在体内的靶向粘附能力如何还有待活体试验进一步验证。本实验中,通过构建兔心肌缺血再灌注损伤模型,分别经耳缘静脉注射CMB和TCMB,结果显示TCMB大量聚集在心脏左室前壁(心肌缺血再灌注损伤区域),而CMB无明显聚集。
当心腔内微泡完全消失后,TCMB仍大量滞留在左室前壁,使左室前壁的超声强度明显高于其它部位并被肉眼所观察到,从而实现心肌的靶向显像。冰冻切片显示,Flash后TCMB上的ICAM-1抗体靶向释放在心肌缺血再灌注损伤区域的冠脉内,而正常心肌则无明显分布,进一步证实了TCMB对损伤血管内皮的靶向粘附性。
本研究通过构建针对血管内皮的ICAM-1靶向阳离子微泡,实现对心肌缺血再灌注损伤的靶向显像,既能确定心肌缺血再灌注损伤的范围,还能从分子水平评估冠脉内皮细胞的功能和损伤程度。此外,ICAM-1靶向阳离子微泡还能作为心肌缺血再灌注损伤基因靶向治疗的运载工具。电位检测仪显示TCMB的平均表面电位为+22.0±2.40mV,略低于CMB的+31.3±3.90mV,说明连接带负电的ICAM-1抗体后虽然使微泡的表面电位有所降低但并不改变微泡的阳离子属性。相关研究也表明,带正电的TCMB可利用静电吸附法与带负电的治疗基因有效结合,保护基因免遭机体免疫系统的降解和吞噬,并与损伤区域的冠脉内皮细胞特异性粘附,在超声作用下靶向释放基因,实现定向治疗[12]。超声靶向微泡介导的分子显像和基因治疗安全有效,在优化的参数条件下,对机体无明显毒副作用,是一种较理想的靶向显像和治疗技术[7]。
综上,ICAM-1靶向阳离子微泡可以与损伤冠脉内皮细胞特异性粘附,从而实现对心肌缺血再灌注损伤的超声分子显像,同时也有潜力作为基因治疗的靶向运载工具,具有广泛的应用前景。
◀
本文第一作者简介:
邓倾(1986—),男,汉族,博士,主治医师,主要从事超声分子影像和治疗研究
1 Fröhlich GM, Meier P, White SK,et al. Myocardial reperfusion injury: looking beyond primary PCI[J]. Eur Heart J, 2013, 34(23):1 714-1 722.
2 Jin YC, Kim CW, Kim YM, et al. Cryptotanshinone, a lipophilic compound of Salvia miltiorrriza root, inhibits TNF-alpha-induced expression of adhesion molecules in HUVEC and attenuates rat myocardial ischemia/reperfusion injury in vivo[J]. Eur J Pharmacol, 2009, 614(1-3):91-97.
3 Balciūnas M, Bagdonaite L, Samalavicius R, et al. Markers of endothelial dysfunction after cardiac surgery: soluble forms of vascular-1 and intercellular-1 adhesion molecules[J]. Medicina (Kaunas), 2009, 45(6):434-439.
4 Paul A, Binsalamah ZM, Khan AA, et al. A nanobiohybrid complex of recombinant baculovirus and Tat/DNA nanoparticles for delivery of Ang-1 transgene in myocardial infarction therapy[J]. Biomaterials, 2011,32(32): 8 304-8 318.
5 Barreiro O, Aguilar RJ, Tejera E, et al. Specific targeting of human inflamed endothelium and in situ vascular tissue transfection by the use of ultrasound contrast agents[J]. JACC Cardiovasc Imaging, 2009, 2(8):997-1005.
6 李 进, 袁世荧, 丰新民, 等. 舒芬太尼延迟预处理对兔心肌缺血再灌注损伤的影响[J]. 中华麻醉学杂志, 2009, 29(8): 692-
695.
7 王志刚. 超声分子影像学研究进展[J].中国医学影像技术, 2009, 25(6): 921-923.
8 Abou-Elkacem L, Bachawal SV, Willmann JK. Ultrasound molecular imaging: Moving toward clinical translation[J]. Eur J Radiol, 2015, 84(9):1 685-1 693.
9 Rohrbach S, Troidl C, Hamm C, et al. Ischemia and reperfusion related myocardial inflammation: A network of cells and mediators targeting the cardiomyocyte[J]. IUBMB Life, 2015, 67(2):110-119.
10 Moreira DM, da Silva RL, Vieira JL, et al. Inflammation and anti-inflammatory drugs in coronary artery disease[J]. Am J Cardiovasc Drugs, 2015, 15(1):1-11.
11 Yan Y, Liao Y, Yang L, et al. Late-phase detection of recent myocardial ischaemia using ultrasound molecular imaging targeted to intercellular adhesion molecule-1[J]. Cardiovasc Res, 2011, 89(1):175-183.
12 Yan P, Chen KJ, Wu J, et al. The use of MMP2 antibody-conjugated cationic microbubble to target the ischemic myocardium, enhance Timp3 gene transfection and improve cardiac function[J]. Biomaterials, 2014, 35(3): 1 063-1 073.
UltrasoundMolecularImagingofVascnlarEndothelialTargetedMicrobubblesonMyocardialIschemiuRepertusionInjuryinRabbit
DENG Qing, WANG Yi-jia, ZHOU Qing#, CHEN Jin-ling, CAO Sheng, HU Bo, JIANG Nan
Department of Ultrasound, Renmin Hospital of Wuhan University, Wuhan, 430060, China;#Corresponding author
Objective: To construct the vascular endothelium-targeted microbubbles for the target ultrasound imaging of myocardial ischemia reperfusion injury in rabbits.MethodTo construct the vascular endothelium-targeted microbubble (TCMB) by connecting the intercellular adhesion molecule-1 (ICAM-1) antibody to the surface of the cationic microbubble using biotin-streptavidin system. The non-targeted cationic microbubble (CMB) was served as the control. Primary human umbilical vein endothelial cells (HUVECs, 70% confluence) and umbilical vein were activated with 50 ng/ml tumor necrosis factor-α (TNF-α). CMBs and TCMBs were passed across the HUVECs and umbilical vein at a shear stress of 2 dynes/cm2to compare the targeted adhesion ability of the two microbubbles. Twenty rabbits were constructed myocardial ischemia reperfusion injury animal model and randomly divided into two groups: CMB group and TCMB group,n=10 per group. One milliliter of CMBs and FITC-IgG labeled TCMBs were infused through the ear vein to compare the target imaging ability of the two for myocardial ischemia reperfusion injury in rabbits.ResultsThe average diameters of the CMB and TCMB were no statistic difference (2.90±1.90μm vs 3.10±2.10μm,P>0.05) and the zeta potential of the CMB was higher than that of TCMB (+31.30±3.90mV vs +22.00±2.40mV,P<0.01). The amount of TCMB targeted adhesion to vascular endothelial cells and umbilical vein was 19.4-fold and 3-fold to CMB, respectively(P<0.01). TCMB can accumulate in the coronary arteries of myocardial ischemia reperfusion injury area for targeted ultrasound molecular imaging, while CMB has no obvious target imaging function. The acoustic intensity ratio of TCMB in the injury area was 1.86 fold of CMB (P<0.01).ConclusionICAM-1 targeted microbubble can specifically adhere and aggregate with injury vascular endothelial cells, which can be used for targeted ultrasonic molecular imaging of myocardial ischemia reperfusion injury.
Myocardial ischemia reperfusion injury; Intercellular adhesion molecule-1; Targeted microbubble; Ultrasound; Molecular imaging;Rabbit
10.3969/j.issn.1005-1740.2017.04.004
R541.4
A
1005-1740(2017)04-0018-06
国家自然科学基金(81471674,81501495);中央高校基本科研业务费专项资金(2042015kf0097)
武汉大学人民医院超声科,武汉430060;#
,E-mail:qingzhou128@163.com
本文2017-07-10收到,2017-09-30修回

