胃血管球瘤的CT特征
王健 徐军良 柯勤兵
胃血管球瘤的CT特征
王健 徐军良 柯勤兵
目的 探讨胃血管球瘤的CT特征。方法 回顾性分析8例经手术病理学检查确诊的胃血管球瘤患者的CT表现,并与病理学检查结果进行对照分析。结果 7例患者肿瘤单发,胃窦部5例,胃体部2例;肿瘤大小11~37 mm,平均24 mm,呈圆形、类圆形或不规则形,边界清晰;腔内生长4例,腔外生长1例,混合性生长2例;CT平扫肿瘤呈均匀性等高密度,动脉期明显强化,静脉期均进一步强化,术后病理学检查证实单发者均为良性胃血管球瘤。1例患者胃体、胃窦及小肠内见多发病灶;肿瘤CT平扫可见分叶、囊变、溃疡,增强后动脉期不均匀强化,静脉期进一步强化;病理学检查确诊为恶性胃血管球瘤,肾上腺、脾脏及两肺内多发转移灶。结论 胃血管球瘤好发于胃窦部、女性多见,体积偏小,呈圆形、类圆形或不规则形,边缘清晰;增强CT检查示动脉期肿瘤明显强化,静脉期进一步强化;肿瘤多发者提示恶性可能。
血管球瘤 胃肿瘤 体层摄影术,X线计算机
血管球瘤(glomus tumor,GT)是一种间质性肿瘤,由类似于平滑肌细胞的血管周围球体细胞构成,肿瘤通常为良性,好发于四肢末端,也可见于身体的其它部位[1-3]。胃GT极其罕见,约占所有胃间叶源性肿瘤的0.58%~2.2%[3-4],文献中以个案报道为主,相关影像学报道少见,术前极易误诊。本文累积了8例经手术病理学检查确诊的胃GT,回顾性分析其CT特征,旨在进一步了解该病,为提高术前诊断率提供帮助。
1 临床资料
1.1 一般资料 收集2006年1月至2016年1月浙江大学医学院附属邵逸夫医院经手术病理学检查确诊的胃GT患者8例,其中男3例,女5例;年龄42~66岁,平均54.3岁。患者临床症状多无特异性,腹痛、腹部不适5例,咳嗽伴痰中带血3个月、呕血黑便1周1例,体检发现异常2例,临床特征见表1。

表1 8例胃GT患者临床特征
1.2 CT检查方法 应用德国Siemens公司生产的16排螺旋CT机或美国GE公司生产的64排螺旋CT机。患者禁食4h,检查前0.5h喝500~1 000ml水,检查时再喝200~500ml水以充分膨胀胃和十二指肠。本组患者均使用非离子型对比剂碘海醇注射液(欧乃派克,300mg I/ml),给药方式是从肘前静脉以2.5~3.0ml/s的速度注射,剂量2ml/kg。患者均在屏气下进行平扫,30、70s扫描获取动脉期、门静脉期对比增强图像。扫描参数:管电压120kV,管电流200mA,层厚3mm,连续无间断扫描。
1.4 结果 本组8例患者胃GT的CT特征见表2、3。
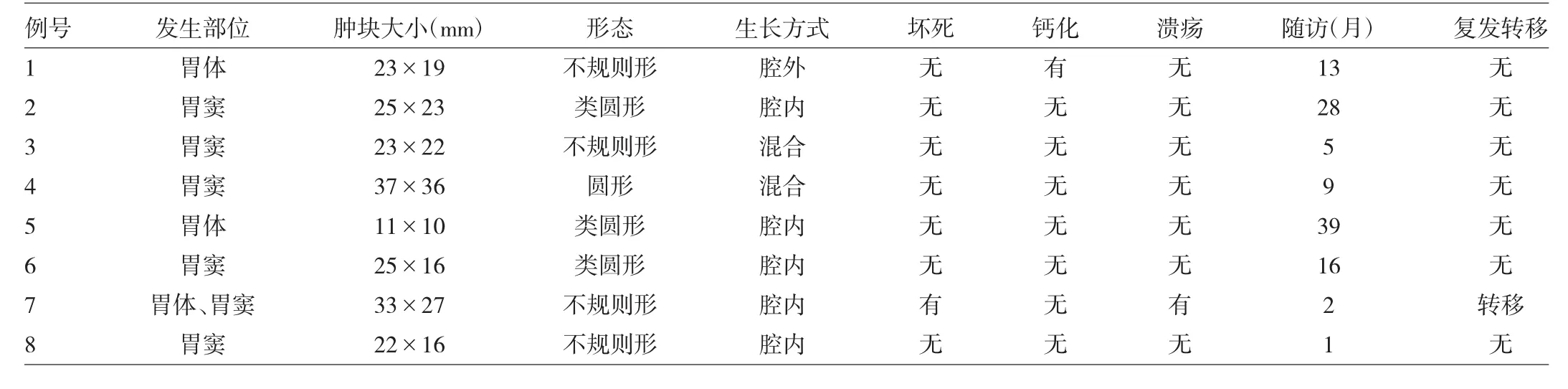
表2 8例患者胃GT的CT特征
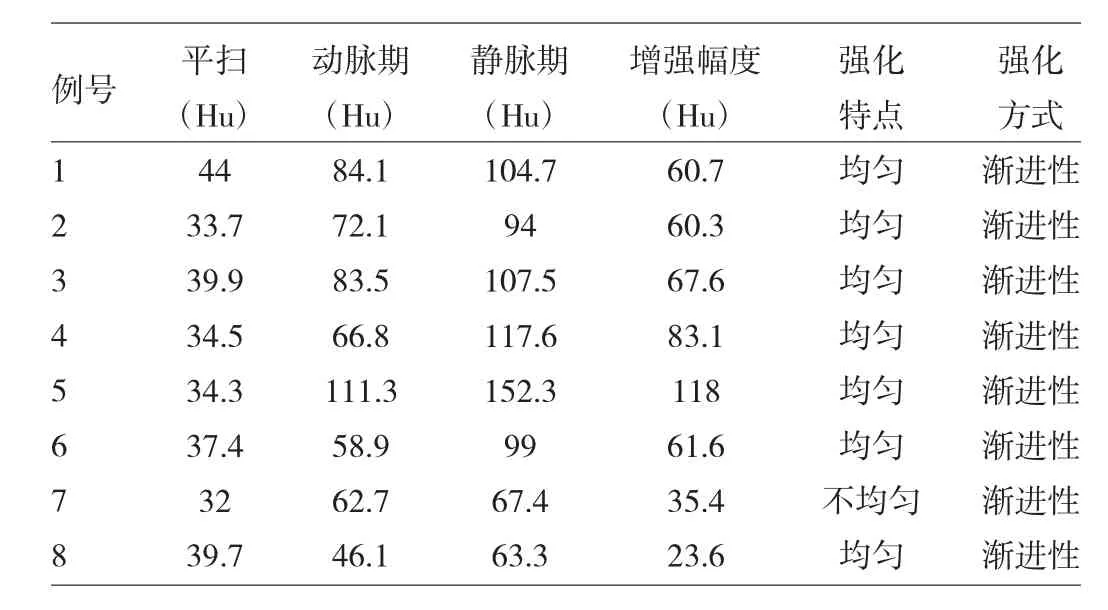
表3 8例患者胃GT增强CT特征
由表2、3可见,7例患者肿瘤单发,胃窦部5例,胃体部2例;肿瘤长径11~37 mm,平均24 mm;呈圆形、类圆形或不规则形,边界清晰;腔内生长4例,腔外生长1例,混合性生长2例;肿瘤内细点状钙化1例(图1),均无囊变、溃疡。CT平扫肿瘤密度均匀,CT值33.7~44.0(37.6±3.8)Hu;动脉期明显强化,CT 值 46.1~113.3(74.7±21.0)Hu;静脉期均进一步强化,CT值63.3~152.3(105.5±26.8)Hu。7例单发者CT增强幅度为23.6~118.0(67.8 ± 28.4)Hu,术后病理学检查证实单发者均为良性胃GT,随访过程中无一例复发转移。1例患者胃体、胃窦及小肠内见多发病灶,较大者位于胃体内,肿瘤长径33 mm,CT平扫肿瘤部分病灶内可见分叶、囊变、溃疡,CT值32.0 Hu;增强后动脉期不均匀强化,CT值62.7 Hu;静脉期进一步强化,CT值67.4 Hu;胃窦部肿块内镜下切除病理学检查证实为恶性胃GT,肾上腺、脾脏及两肺内多发转移灶(图2)。
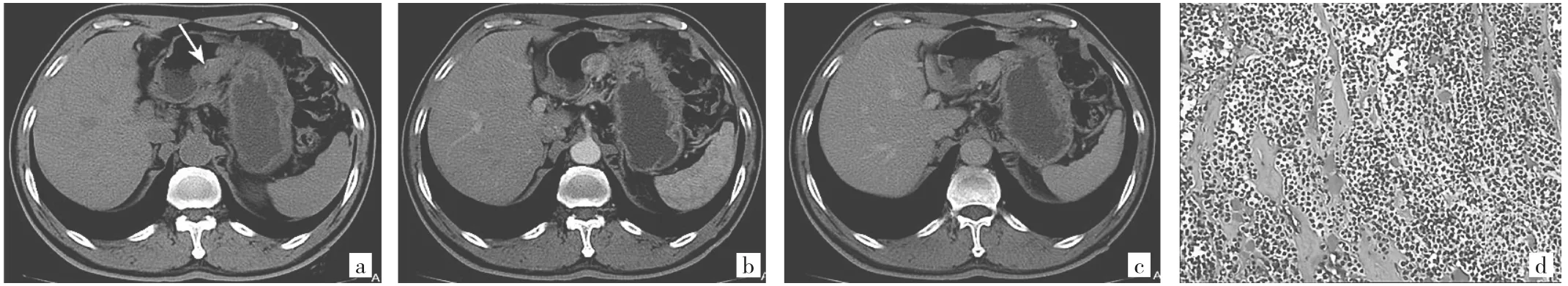
图1 患者男,66岁。腹痛伴呃逆3个月。a:CT平扫示胃体小弯侧见一不规则形软组织肿块,边缘有欠分叶,内见细小点状钙化影(箭头示);b:增强后动脉期明显边缘性强化;c:静脉期呈均匀性强化,强化范围及幅度进一步扩大;d:镜下见肿瘤细胞形态一致,围绕血管生长或成片排列,细胞小多边形,细胞质透亮,核圆形、卵圆形,大小一致,无明显异型(HE染色,×200)
2 讨论
2.1 胃GT临床表现 GT发生率极低,术前明确诊断非常困难,因此,通过临床及CT表现正确诊断仍面临很大挑战。GT多见于女性,本组8例患者中,女5例,占比62.5%,发生率低于 Hu等[5]和 Miettinen等[6]的报道(70%,7/10;71.9%,23/32),高于陶昀璐等[7]的报道(55.8%,24/43)。GT可发生于各个年龄段,通过文献复习发现,其中以 30~70 岁较为多见(93%,66/71)[3-5,7-10]。本组8例患者发病年龄42~66岁,与文献报道较为一致。

图2 患者女,60岁。黑便、呕血1周,2个月后因咳嗽、咯血发现两肺内多发转移灶。a:CT平扫示胃体及胃窦部见多发不规则形软组织肿块(白箭头示),左侧肾上腺见一转移灶(黑箭头示);b:增强后动脉期明显边缘性强化(白箭头示),脾脏内转移灶与胃体内病灶强化特点一致(黑箭头示);c:静脉期胃窦部一病灶强化不均,表面溃疡形成(箭头示);d:小肠内病灶强化均匀(白箭头示),肠腔内可见积血(黑箭头示);e、f、g:两肺内见多发转移灶(箭头示);h:增强后转移灶强化明显(箭头示)
胃GT临床表现各异,多无特异性,部分患者体检发现,临床表现以腹痛和腹部不适最为常见,偶有呕血、黑便者,出血原因可能与肿块表面溃疡形成有关[5,11]。本组患者多以腹痛、腹部不适为主(62.5%,5/8),其中,1例黑便者肿瘤表面有溃疡形成。
2.2 胃GT病理与免疫组化表现 胃GT病理学检查结果显示,良性者肿瘤细胞大小、形态一致,细胞质透亮,核圆形、卵圆形,无明显异型;恶性者肿瘤细胞大小不一,呈胖梭形,核大,异性明显,核分裂相对易见。免疫组化表现:SMA为阳性,偶有CD34阳性,CD117、DOG1为阴性,Ki-67多<5%。本组8例患者SMA均为阳性,2例CD34阳性,这与Wang等[4]的文献报道相符,Ki-67出现的概率以往文献中未有报道,仅在个案报道中出现过[12-13],本组6例患者Ki-67阳性(75%),5例患者Ki-67<5%均为良性,1例恶性者Ki-67为60%以上,Zaidi等[14]报道的1例恶性者Ki-67为15%,这意味着恶性肿瘤细胞增殖活跃较明显。
2.3 胃GT CT表现 (1)肿瘤多为单发,多发者较为罕见;本组1例多发者,术后病理学检查证实为恶性,且脾脏、肾上腺及肺部均有转移,以往文献中鲜有转移的报道,转移部位为肝、肺、脑、淋巴结[6,15-17],脾脏及肾上腺转移以往文献中未曾有相关报道;多发者极其罕见,1篇相关病例报道亦为恶性[18],由此可见,多发者生物学行为具有侵袭性,有恶变可能。(2)肿瘤体积偏小,直径多<4cm,这可能与肿瘤生物学行为偏良性、生长缓慢或胃窦部肿块稍大时易引起临床症状而被发现有关。本组8例患者肿瘤直径均<4cm,平均2.4cm,与Kang等[3]报道相似(直径 1.0~3.6cm,平均 2.0cm)。(3)肿瘤多呈圆形或类圆形,部分形态不规则有分叶,本组4例形态不规则有分叶,分叶出现的原因可能与肿瘤内细胞的增殖程度不一有关。(4)肿瘤好发于胃窦部,据文献资料[3-5,7-13],胃窦部多见(87.2%,82/94),偶发于胃体部(12.8%,12/94),无一例发生于胃底及贲门部,由此可见,位置有助于GT与其它上皮性或间质性胃肿瘤鉴别。本组患者肿瘤位于胃窦部5例,胃体部1例,1例多发者胃窦及胃体部均有病灶。(5)肿瘤生长方式分为腔内生长、腔外生长和混合性生长。本组肿瘤腔内生长5例(62.5%,5/8),腔外生长1例,混合性生长2例,以腔内生长为主,发生率与文献报道相似:腔内生长(57.9%,11/19),混合性生长(26.3%,5/19),腔外生长(15.8%,3/19)[2,5,9,19]。(6)肿瘤内钙化多呈小点状,囊变及溃疡罕见。本组肿瘤点状钙化1例,囊变、溃疡1例,溃疡的发生率与Kang等[3]报道相似(10%,1/10),而钙化的发生率远低于 Kang等[3]和 Hu 等[5]报道(30%,3/10;30%,3/10)。(7)CT平扫肿瘤密度略低于软组织,增强后动脉期明显强化,静脉期进一步强化,即呈渐进性强化的特征。
2.4 鉴别诊断 (1)胃间质瘤(gastric stromal tumor,GST):胃GT最易误诊为GST,原因为GST为最常见的胃间叶源性肿瘤。临床上GST以中老年人多见,性别上无明显差异,而胃GT可见于任何年龄段,平均发病年龄低于GST患者,且以女性多见。GST可见于胃的任何部位,以胃体部多见,而胃GT多见于胃窦部。GST最重要的CT特征是肿瘤易囊变坏死(58%,51/83)[20],增强后多强化不均,这与胃GT均匀性渐进性强化方式不同。此外,由于胃GT的富血供特征使其强化程度多明显高于GST。(2)胃神经鞘瘤:多见于胃体部,以腔外生长或混合性生长为主,而胃GT多见于胃窦部,以腔内生长为主;胃神经鞘瘤相比胃GT胃周或腹膜后淋巴结肿大更常见,两者强化方式相同均呈渐进性强化,但前者静脉期CT值均在85 Hu以下[21-22],明显低于胃GT。(3)胃平滑肌瘤:好发于胃贲门部,与胃GT胃窦部多见明显不同,两者的相似之处均为肿瘤直径偏小、女性多见。(4)胃血管瘤:GT与胃血管瘤在CT影像上较难鉴别,两者均为富血供,强化明显,但后者发病年龄较小,多见于幼儿,肿瘤具有侵袭性,患者多伴有出血、腹痛和梗阻症状,偶有伴发皮肤血管瘤或毛细血管扩张症者,多发者可伴发蓝色橡皮疱痣综合征、马凡综合征等[23-24]。
2.5 本研究的局限性 (1)本研究为回顾性分析,定量资料数值的获取具有一定局限性和偏差。(2)本组胃GT病例数偏少,CT表现具有一定的片面性。(3)本研究未对CT影像上与胃GT鉴别困难的胃疾病进行比对分析。
综上所述,GT好发于30~70岁中老年女性,胃窦部多见,呈圆形、类圆形或不规则形,边界清晰,以腔内生长为主;CT平扫密度略低于软组织,增强后动脉期明显强化,静脉期进一步强化,呈渐进性强化的特征;此外,当肿瘤多发时提示恶性可能。
[1]Tsuneyoshi M,Enjoji M.Glomus tumor:a clinicopathologic and electron microscopic study[J].Cancer,1982,50(8):1601-1607.
[2]Kato S,KikuchiK,Chinen K,et al.Diagnostic utility of endoscopic ultrasound-guided fineneedle aspiration biopsy for glomus tumor of the stomach[J].World J Gastroenterol,2015,21(22):7052-7058.
[3]Kang G,Park H J,Kim J Y,et al.Glomus tumor of the stomach:a clinicopathologic analysis of 10 cases and review of the literature[J].Gut Liver,2012,6(1):52-57.
[4]Wang Z B,Yuan J,Shi H Y.Features of gastric glomus tumor:a clinicopathologic,Immunohistochemicaland molecular retrospective study[J].Int J Clin Exp Pathol,2014,7(4):1438-1448.
[5]Hu S D,Hu D M,Huang W,et al.Computed tomography and clinical characteristics of gastric glomus tumors[J].Journal of Digestive Diseases,2014,15(9):477-482.
[6]Miettinen M,Paal E,Lasota J,et al.Gastrointestinal glomus tumors:a clinicopathologic,immunohistochemical,and molecular genetic study of 32 cases[J].Am J Surg Pathol,2002,26(3):301-311.
[7]陶昀璐,王振军,韩加刚,等.胃血管球瘤43例诊治分析[J].现代肿瘤医学,2013,21(5):1097-1010.
[8]吴若实,王丽丽,韩安家.胃血管球瘤3例临床病理特征[J].临床与实验病理学杂志,2014,30(11):1289-1290.
[9]朱文丰,叶继章,龙丽华.胃血管球瘤的CT影像学表现[J].医学影像学杂志,2015,25(2):266-268.
[10]杨丽丽,许晓燕,赵峰.胃血管球瘤6例临床病理分析[J].重庆医科大学学报,2012,37(8):742-745.
[11]Handa Y,Kano M,Kaneko M,et al.Gastric Glomus Tumor:A Rare Cause of Upper Gastrointestinal Bleeding[J].Case Rep Surg,2015,2015:193684.
[12]Chen K B,Chen L.Glomus tumor in the stomach:A case report and reviewofthe literature[J].Oncology Letters,2014,7(6):1790-1792.
[13]Sahni T,Lipi L,Mishra P,et al.Gastric Glomus Tumour:A Rare Cause of Gastrointestinal Bleeding[J].Images in Medicine,2015,9(10):1.
[14]Zaidi S,Arafah M.Malignant Gastric Glomus Tumor:A Case Report and Literature Review of a Rare Entity[J].Oman Med J,2016,31(1):60-64.
[15]Porter P L,Bigler S A,McNutt M,et al."The immunophenotype of hemangiopericytomas and glomus tumors,with special reference to muscle protein expression:an Immunohistochemical study and review of the literature"[J].Modern Pathology,1991,4(1):46-52.
[16]De Chiara A,Apice G,Mori S,et al.Malignant glomus tumour:a case report and review of the literature[J].Sarcoma,2003,7(2):87-91.
[17]Bray A P,Wong N A,Narayan S."Cutaneous metastasis from gastric glomus tumour"[J].Clinical and Experimental Dermatology,2009,34(8):e719-e721.
[18]Hayashi M,Kitagawa Y,Kim Y,et al.Malignant glomus tumor arising among multiple glomus tumors[J].J Orthop Sci,2008,13(5):472-475.
[19]Tang M,Hou J,Wu D,et al.Glomus tumor in the stomach:Computed tomography and endoscopic ultrasound findings[J].World J Gastroenterol,2013,19(8):1327-1329.
[20]徐宏伟,刘庆猛,朱秀益,等.胃肠道间质瘤的CT表现与免疫组化分型的关系[J].中华肿瘤杂志,2014,36(6):440-445.
[21]潘卫星,马玲飞,王官良.多层螺旋CT对胃神经鞘瘤的诊断价值[J].医学影像学杂志,2012,22(3):409-412.
[22]王健,胡红杰.胃神经鞘瘤的CT表现[J].临床放射学杂志,2015,34(10):63-67.
[23]Fishman S J,Burrows P E,Leichtner A M,et al.Gastrointestinal manifestations of vascular anomalies in childhood:varied etiologies require multiple therapeutic modalities[J].J Pediatr Surg,1998,33(7):1163-1167.
[24]Kang H C,Menias C O,Gaballah A H,et al.Beyond the GIST:Mesenchymal Tumors of the Stomach[J].Radiographics,2013,33(6):1673-1690.
10.12056/j.issn.1006-2785.2017.39.22.2016-1419
310016 杭州,浙江大学医学院附属邵逸夫医院放射科(王健、徐军良现在杭州市江干区人民医院放射科工作)
柯勤兵,E-mail:keqinbing@qq.com
1.3 影像学分析 患者的CT影像均由2位具有消化科工作经验的高级职称医师评定,并对评定结果达成一致意见,影像学分析的内容主要包括:(1)发生部位(胃窦、胃体);(2)肿块大小;(3)形态(圆形、类圆形或不规则形);(4)生长方式(腔内、腔外或混合性生长);(5)分叶(有或无);(6)钙化(有或无);(7)囊变(有或无);(8)溃疡(有或无);(9)肿瘤强化特点(均匀或不均匀);(10)强化方式(有或无渐进性强化)。
2017-03-06)
李媚)

