基于超细剪切细胞破壁技术的藻蓝蛋白提取工艺
俞建峰 ,傅 剑 ,马 潇 , 崔政伟 ,饶 丰
(1.江苏省食品先进制造装备技术重点实验室,江南大学,江苏 无锡 214122;2.江南大学 机械工程学院,江南大学,江苏 无锡 214122;3.常州工学院,电气与光电学院,江苏 常州 213022)
基于超细剪切细胞破壁技术的藻蓝蛋白提取工艺
俞建峰1,2,傅 剑1,2,马 潇1,2, 崔政伟1,2,饶 丰3
(1.江苏省食品先进制造装备技术重点实验室,江南大学,江苏 无锡 214122;2.江南大学 机械工程学院,江南大学,江苏 无锡 214122;3.常州工学院,电气与光电学院,江苏 常州 213022)
为解决目前藻蓝蛋白提取工艺效率低下问题,采用超细剪切技术进行螺旋藻细胞破壁,为藻蓝蛋白工业化生产提供理论依据。采用单因素试验方法,研究螺旋藻液料比、硫酸铵饱和度、剪切时间3种工艺参数对藻蓝蛋白得率的影响,并结合响应面试验方法对上述3种工艺参数进行优化。基于超细剪切技术的藻蓝蛋白提取最佳工艺为:液料体积质量比30mL/g,硫酸铵饱和度为50%,剪切时间为15min,在此条件下得到的藻蓝蛋白得率为12%。
螺旋藻;藻蓝蛋白;超细剪切;响应面分析
近年来,从藻细胞中分离出大量的蛋白质类生物活性物质,被广泛应用于食品、医药、化工等领域。藻蓝蛋白为蓝色粉末,无毒,溶于水,不溶于醇和油脂。藻蓝蛋白品质等级分为食品级、反应级和分析级。纯度为0.7左右的食品级藻蓝蛋白可以作为天然食用色素,纯度为3.9左右的反应级藻蓝蛋白具有抗癌、促进血细胞再生等功效,纯度为4.0以上的藻蓝蛋白可作为生物化学探针[1-6]。
藻蓝蛋白的提取方法和螺旋藻原材料的质量是影响藻蓝蛋白纯度和得率的主要因素。不同的方法被用来从藻类中分离、提纯藻蓝蛋白,这些方法包括酶法[7]、超声波[8]、硫酸铵盐析、离子交换色谱分析、凝胶色谱法、膨胀床吸附、膜分离等[9]。上述方法的主要缺点是生产规模无法扩大,耗时长(4~24 h)[10]。现阶段的藻蓝蛋白的提取工艺效率低下,主要原因是细胞破壁技术阻碍了藻蓝蛋白提取工艺的规模化生产。传统的细胞破壁技术有溶胀法、反复冻融法、超声波法、研磨法等方法[11-13],尚未见关于螺旋藻超细剪切细胞破壁的文献报道。作者是基于超细剪切破壁方法,在单因素试验的基础上,通过改变液料体积质量比、硫酸铵饱和度、剪切时间3种工艺参数,利用响应面分析方法探究超细剪切技术在藻蓝蛋白提取过程中应用的可行性和有效性。
1 材料与方法
1.1 材料与仪器
螺旋藻干粉:购于西安禾一生物技术有限公司;TGL-16C台式离心机:上海安亭科学仪器厂产品;UV1800紫外可见分光光度计:日本岛津公司产品;精密电子天平:奥豪斯国际贸易(上海)有限公司产品;食品超细剪切机:南昌赣康宝工贸有限公司产品。
1.2 试验方法
1.2.1 藻蓝蛋白提取工艺 藻蓝蛋白的提取工艺主要包括:螺旋藻破壁和藻蓝蛋白的分离纯化,从螺旋藻破壁方法出发,探究一种基于超细剪切破壁技术的藻蓝蛋白提取方法。作者采用的螺旋藻提取工艺过程如下:
螺旋藻干粉→浸泡溶解→超细剪切破壁→离心取上清液→硫酸铵盐析→离心取沉淀→缓冲液溶解→纯度较高的藻蓝蛋白。
1.2.2 藻蓝蛋白得率 藻蓝蛋白的质量浓度按照Bennett[14]的方法计算:


式中,PC为藻蓝蛋白浓度,mg/mL;Y为藻蓝蛋白的得率,%;A620为样品在波长为620 nm处的吸光度;A652为样品在波长为652 nm处的吸光度;V为溶液体积,mL;n为稀释倍数;DB为螺旋藻粉质量,g。
1.2.3 紫外可见光光谱分析 为了测定藻蓝蛋白的得率,需提取藻蓝蛋白溶液,使用UV-1800紫外分光光度计进行吸收光谱全波长扫描,测得其在不同波长下的藻蓝蛋白的吸光度。
1.3 试验设计
1.3.1 单因素试验设计 超细剪切细胞破壁技术的提取过程中,影响藻蓝蛋白提取得率的主要有液料体积质量比、硫酸铵饱和度和剪切时间。为了探究各因素分别对藻蓝蛋白提取得率的影响,应进行单因素试验:以液料体积质量比(10、15、20、25、30、35 mL/g)、硫酸铵饱和度(0、20%、30%、40%、50%、60%)和剪切时间(5、10、15 min)作为自变量,以藻蓝蛋白的提取得率作为因变量,也就是试验指标。
1.3.2 响应面优化试验设计 基于单因素试验的结果,采取响应面Box-Benhnken试验设计方案。选取了液料体积质量比(X1)、硫酸铵饱和度(X2)、剪切时间(X3)3 个因素为自变量,藻蓝蛋白得率(PC)为响应值。设计了液料比、硫酸铵饱和度、剪切时间3因素3水平的Box-Benhnken分析实验。其中12个水平点为析因实验点,最后5个为中心实验点用以估计误差。实验的因素和水平分析的选取见表1。
藻蓝蛋白的得率计算如下:

表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiment
2 结果与分析
2.1 液料体积质量比与藻蓝蛋白得率的关系
对螺旋藻采用溶胀法进行破壁处理。称取一定质量的螺旋藻, 按 10、15、20、25、30 mL/g 以及 35 mL/g的比例配制螺旋藻溶液。在4℃环境下溶胀24 h,接着进行离心处理(离心时间15 min,转速为15 000 r/min),取离心后的上清液(藻蓝蛋白的粗提取液)。采用UV-1800分光光度计对藻蓝蛋白的离心液进行吸光度检测,测定溶液在波长620 nm及652 nm处的吸光值,计算出藻蓝蛋白溶液的浓度和得率。藻蓝蛋白的得率实验结果见如图1。
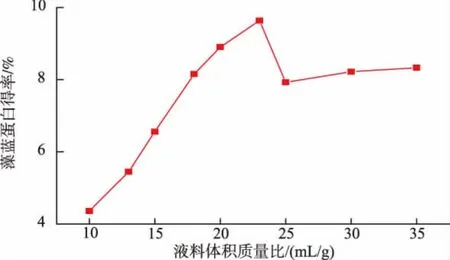
图1 液料体积质量比与藻蓝蛋白得率的关系Fig.1 Relationship between liquid to solid ratio and yield of phycocyanin
由图1可知,随着液料体积质量比的增加,藻蓝蛋白的得率先增加,后逐步减少。在液料体积质量比为10 mL/g时,藻蓝蛋白得率较低,只有4.355%。当液料体积质量比为23 mL/g时,藻蓝蛋白的得率达到最大,达到9.645%。邵明飞等也得到相似的试验结果,藻蓝蛋白的得率是先升后降的趋势,液料体积质量比在20 mL/g时提取效果最佳[8]。从图1中可以分析出,液料体积质量比为25 mL/g和30 mL/g时,藻蓝蛋白的得率在7.9%~8.22%,此时液料比对提取效果的影响不大。从以上分析可以得出,可选取20 mL/g的液料体积质量比作为中间值,选10~30 mL/g的液料体积质量比范围进行后续响应面优化。
2.2 剪切时间与藻蓝蛋白得率的关系
对螺旋藻采用短时间溶胀后进行超细剪切法细胞破壁处理。称取一定质量的螺旋藻,配制液料比为20 mL/g的螺旋藻溶液。将溶胀4 h的螺旋藻溶液分成3份,分别进行5、10、15 min的超细剪切细胞破壁实验。由于实验条件限制,为防止长时间超细剪切产生过热,影响蛋白质活性,超细剪切采用间歇工作法。超细剪切后的螺旋藻溶液进行离心处理,取上清液进行吸光度的检测。由于螺旋藻需要浸泡后才可以进行超细剪切,所以此次选取经过8、12、24 h溶胀时间的螺旋藻溶液进行超细剪切。螺旋藻溶液经超细剪切破壁后,离心液中藻蓝蛋白得率实验结果见图2所示。

图2 剪切时间与藻蓝蛋白得率的关系Fig.2 Relationship between shear time and yield of phycocyanin
由图2可知,在相同的剪切时间下,随着溶胀时间的增加,藻蓝蛋白得率逐步增加。溶胀4 h后进行超细剪切破壁,藻蓝蛋白得率随着剪切时间增加而逐渐提高;溶胀8 h后进行超细剪切破壁,藻蓝蛋白的得率随着剪切时间的增加有明显的增加。溶胀12 h和24 h后,剪切破壁对藻蓝蛋白得率的效果不是很明显,这是因为溶胀 12 h以上,藻蓝蛋白已经基本溶出,后续剪切破壁并不能起到提高藻蓝蛋白溶液的作用。在图2中,溶胀8 h并且剪切15 min条件下藻蓝蛋白得率为8.9%;而溶胀12 h条件下的藻蓝蛋白得率为9.1%,由此可见,超细剪切破壁能够有效提高藻蓝蛋白提取效率。依据以上分析,选取剪切时间10 min为中间值,在5~15 min范围内进行后续响应面优化。
2.3 硫酸铵饱和度与藻蓝蛋白得率的关系
盐析法是一种基本的纯化蛋白质的方法[15],作者采用硫酸铵作为盐析剂。称取一定质量的螺旋藻,配制液料体积质量比为20 mL/g螺旋藻溶液。溶胀8 h后,进行离心处理,取离心后的上清液分成6份。配制饱和度为 0、20%、30%、40%、50%、60%硫酸铵溶液,分别加入离心液中进行盐析。生成沉淀后进行离心操作,取沉淀,溶解沉淀进行吸光度检测,测定溶液在波长620 nm及652 nm处的吸光值,计算出藻蓝蛋白溶液的浓度和得率。藻蓝蛋白的得率实验结果见如图3。
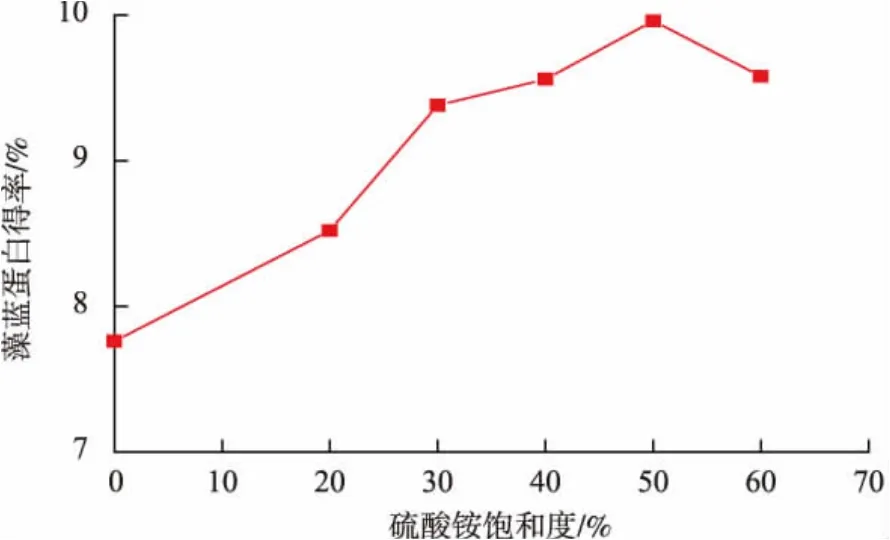
图3 硫酸铵饱和度与藻蓝蛋白得率的关系Fig.3 Relationship between saturation of ammonium sulfate and yield of phycocyanin
由图3可知,使用硫酸铵盐析沉淀藻蓝蛋白,起到了分离和提纯的作用。当硫酸铵溶液的饱和度增加时,藻蓝蛋白的得率呈增加趋势。当硫酸铵饱和度小于50%,随着硫酸铵饱和度的增加,藻蓝蛋白的得率逐渐增加,在硫酸铵饱和度为50%时的得率为9.97%;当硫酸铵饱和度大于50%时,藻蓝蛋白的得率开始降低。上述现象可能是由于添加硫酸盐时,搅拌不均匀引起藻蓝蛋白局部变性,从而导致得率下降。基于以上分析,选取50%作为硫酸铵饱和度的中间值,并选取饱和度40%~60%的区间进行后续响应面优化。
2.4 响应面优化试验
根据Box-Benhnken试验设计原理,在单因素的基础上,以藻蓝蛋白得率为响应值,选取液料体积质量比、硫酸铵饱和度和剪切时间3个因素,设计3因素3水平试验。液料体积质量比的取值分别为10、20、30 mL/g;硫酸铵饱和度的取值分别为40%、50%、60%; 剪切时间的取值分别为 5、10、15 min。采用 Design-Expert.V8.0.6软件对17个试验结果进行分析,实验方案与结果如表2所示。

表2 Box-Behnken响应面实验设计与结果Table 2 Response surface analysis results of Box-Behnken design

序号7891011121314151617
对模型进行了响应面分析,建立了响应值藻蓝蛋白得率(Y)与液料体积质量比(X1)、硫酸铵饱和度(X2)和剪切时间(X3)的多元二次回归模型,模型如下:


表3 藻蓝蛋白得率方差分析Table 3 Analysis of variance for yield of phycocyanin
由表4可以看出,藻蓝蛋白得率的回归模型的P值<0.000 1,表明模型高度显著。失拟项的P值为0.832 6>0.05(不显著),说明模型拟合得很好。相关系数R2=99.55/100.55=0.99,说明回归方程与实际数据点拟合良好,能很好地反映出液料体积质量比、硫酸铵饱和度和剪切时间对藻蓝蛋白得率的影响。
结合表7方差分析的结果,可以得出在二次回归模型中,液料体积质量比一次项(X1)、剪切时间一次项(X2)、液料体积质量比二次项(X12)对藻蓝蛋白得率的影响非常显著,料液体积质量比和剪切时间的交叉项(X1X3)、硫酸铵饱和度二次项(X22)对藻蓝蛋白得率的影响比较显著。所以,试验各因素对响应值的影响并不是简单的线性关系。各因素对藻蓝蛋白得率的影响大小顺序为:液料体积质量比>剪切时间>硫酸铵饱和度。
对回归模型进行分析得出,藻蓝蛋白提取的最佳工艺条件为:液料体积质量比为30 mL/g、硫酸铵饱和度为50%、剪切粉碎时间为15 min。此条件下藻蓝蛋白提取的得率预测为12%。此优化结果与之前实验结果基本一致,进一步验证了模型可信度高、拟合度好。
运用Origin 9.0软件作出各试验因素对响应值交互影响的等高线与响应面图(图4、图5)。可以通过3D曲面图和等高线图分析各个因素之间的交互作用。3D曲面图越对称,等高线图越趋于圆形,则两个因素间的交互作用越弱。
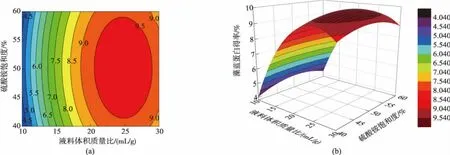
图4 液料体积质量比和硫酸铵饱和度对藻蓝蛋白得率交互作用的响应面图和等高线图Fig.4 Response surface curve (left) and contour plot (right) showing the effects of interactions of the liquid to solid ratio and saturation of ammonium sulfate on yield of phycocyanin

图5 液料体积质量比和剪切时间对藻蓝蛋白得率交互作用的响应面图和等高线图Fig.5 Response surface curve (left) and contour plot (right) showing the effects of interactions of the liquid to solid ratio and shear time on yield of phycocyanin
由图4结合回归模型方差分析可以得出,液料体积质量比和硫酸铵饱和度对藻蓝蛋白得率的交互作用不明显(p=0.789 2)。3D图显示曲面基本呈现较好的对称性,等高线趋近于圆形状,说明这两个因素的交互作用不明显。
由图5结合回归模型方差分析可以得出出,液料体积质量比和剪切时间对得率的交互作用不显著(p=0.006 2)。3D图显示曲面基本呈现出较差的对称形式,等高线趋近于圆形,说明这两个因素的交互作用明显。
结合回归模型方差分析可以得出,硫酸铵饱和度和剪切时间对得率的交互作用不显著(p=0.979 6)。
3 结语
通过单因素试验表明,从螺旋藻中提取藻蓝蛋白时,料液体积质量比为23 mL/g时,可以得到较高的藻蓝蛋白得率;采用超细剪切破壁的方法,相比溶胀法而言,节省了试验的预处理时间,可有效提高传统提取工艺的效率;采用硫酸铵盐析沉淀法处理藻蓝蛋白粗提取液,在硫酸铵溶液饱和度为50%时藻蓝蛋白得率较高。通过响应面优化分析,得到藻蓝蛋白提取的最佳工艺条件为:液料体积质量比为30 mL/g、硫酸铵饱和度为50%、剪切时间为15 min。此条件下藻蓝蛋白提取的得率预测为12%。建立的回归模型可靠,能很好地预测出液料体积质量比、硫酸铵饱和度和剪切时间与藻蓝蛋白得率之间的关系。
[1]CHAIKLAHAN R,CHIRASUWAN N,BUNNAG B.Stability of phycocyanin extracted from Spirulina sp.:influence of temperature,pH and preservatives[J].Process Biochemistry,2012,47:659-664.
[2]XU Changbo,WANG Weijie.Research progress on separation and purification of Phycocyanin from Spirulina[J].Shangdong Chemical Industry,2009,38(1):32-35.(in Chinese)
[3]ZHANG Yifang,YANG Zhilei.The latest trends in research and product development of spirulina[J].Marine Sciences,1998,5:68-30.(in Chinese)
[4]LIANG Kehong.Procegress in studies and application of the algae protein[J].Journal of Food Science and Biotechnology,2015,34(6):569-574.(in Chinese)
[5]SHAO Mingfei,ZHAO Nan,LIU Bing,et al.Progress of production of phycocyanin in large scale[J].Food and Fermentation Industries,2013,39(2):135-139.(in Chinese)
[6]PATIL G, CHETHANA S,SRIDEVI A S,et al.Method to obtain C-phycocyanin of high purity[J].Journal of Chromatography A,2006,1127:76-81.
[7]ZHANG Yifang,LIU Xuchuan,LI Qihua.Study on characteristic and purification of spirulina phycocyanin[J].Journal of Yuannan University(Nature Science Edition),1999,21(3):230-232.(in Chinese)
[8]KUROKAWA M,KING P M,WU X G,et al.Effect ofsonication frequency on the disruption of algae[J].Ultrason Sonochem,2016,31:157-162.
[9]SHAO Mingfei,ZHANG Hongyu,YANG Jinping et al.Optimization of the ultrasonic wave extraction technology of the phycocyanin from Spirulina (Arthrospira) using response surface analysis[J].Journal of Biology,2013,30 (4):93-99.(in Chinese)
[10]DENIZ I,OZEN M O,YESIL-CELIKTAS O.Supercritical fluid extraction of phycocyanin and investigation of cytotoxicity on human lung cancer cells[J].The Journal of Supercritical Fluids,2016,108:13-18.
[11]ZHANG Jing,WEI Yuchun,WANG Guoxiang,et al.Comparison of extraction methods from cyanobacterica blooms water samples in Lake Taihu[J].J Lake Sci,2013,25(2):283-288.(in Chinese)
[12]FU Lili,NA Ri,GUO Jiufeng,JIN Jing.Research progress on the extraction and purification of phycocyanin from spirulina[J].Biotechnology Bulletin,2016,32(1):65-68.(in Chinese)
[13]YANG Guang,MA Yuxiang,ZHANG Chengwu,et al.Isolation and purification of C-phycocyanin from Spirulina subsalsa[J].Journal of Food Science and Biotechnology,2009,28(4):521-524.(in Chinese)
[14]BENNETT A,BOGORAD L.Complementary chromatic adaptation in a filamentous blue green alga[J].J Cell Biol,1973,58:419-435.
[15]YUAN Mengyuan,ZHANG Fayu,SHENG Jingmeng,et al.Influences of different salting-out agents on effect of phycocyanin from blue algae[J].Food Science and Technology,2016,41(5):267-272.(in Chinese)
Separation and Purification of Phycocyanin from Spirulina platensis Based on Ultrafine Cell Breaking Technology
YU Jianfeng1,2,FU Jian1,2,MA Xiao1,2,CUI Zhengwei1,2,RAO Feng3
(1.Jiangsu Key Laboratory of Advanced Food Manufacturing Equipment&Technology,Jiangnan University,Wuxi 214122,China;2.Schhol of Mechanical Engineering,Jiangnan University,Wuxi 214122,China;3.School of Electrical and Photoelectronic Engineering,Changzhou Institute of Technology,Changzhou 213022,China)
To improve the low efficiency of phycocyanin extracted from Spirulina platensis,the ultrafine shearing method was applied to break the cell of Spirulina,which will provide the basis of industrial extractionof phycocyanin.The single-factor experiments were conducted to study the effects of liquid-solid ratio,ammonium sulfate saturation,time length of ultrafine shearing on theyield of phycocyanin.The response surface methodology was applied to optimize the above processing parameters.The optimum extraction processing parameters based on ultrafine shearing technology were:liquid to solid ratio:30 mL/g,ammonium sulfate saturation:50%,time length of ultrafine shearing:15 min.Under the above optimized conditions,the yield of the phycocyanin was 12%.
Spirulina platensis,phycocyanin,ultrafine shearing,response surface analysis
TS 254.1
A
1673—1689(2017)10—1071—06
2015-09-30
江苏省食品先进制造装备技术重点实验室开放课题(FM-2015-09)。
俞建峰(1974—),男,江苏宜兴人,工学博士,副教授,主要从事食品加工装备研究。E-mail:robotmcu@126.com
俞建峰,傅剑,马潇,等.基于超细剪切细胞破壁技术的藻蓝蛋白提取工艺[J].食品与生物技术学报,2017,36(10):1071-1076.

